- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Получение меламина из карбамида презентация
Содержание
- 1. Получение меламина из карбамида
- 2. Меламин Мелами́н (1, 3, 5-триазин-2, 4,
- 3. Применение Меламин широко применяется в промышленном
- 4. Структурная формула меламин-формальдегидной смолы
- 5. Свойства и синтез tпл =364 °C (с
- 6. Свойства и синтез (NH2)2CO → HCNO
- 7. Получение из карбамида Меламин является ценным
- 8. Получение Существует несколько различных технологических схем
- 9. Получение По этой технологии синтез проводится
- 10. Спасибо за внимание!
Слайд 2Меламин
Мелами́н (1, 3, 5-триазин-2, 4, 6-триамин) — бесцветные кристаллы, малорастворимые в воде.
Для обнаружения используется хроматография. Гравиметрически меламин определяют в виде солей с циануровой или пикриновой кислотой, а также фотометрически в слабокислой среде по поглощению при длине волны 236 нм.
Слайд 3Применение
Меламин широко применяется в промышленном органическом синтезе, в том числе ионообменных
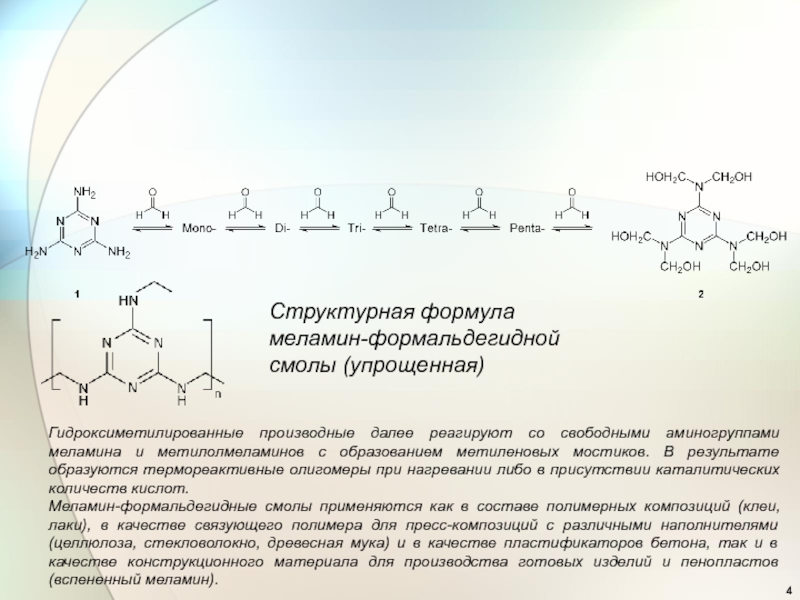
Большая часть производимого меламина используется в производстве меламин-формальдегидных смол, относимых к группе аминопластов, которые получают поликонденсацией меламина с формальдегидом в слабощелочной среде (рН 7,8—8,5), при этом на начальной стадии происходит гидроксиметилирование меламина по аминогруппам, с образованием метилольных производных различной степени замещения (вплоть до гексаметилолмеламина):
Слайд 4
Структурная формула меламин-формальдегидной смолы (упрощенная)
Гидроксиметилированные производные далее реагируют со свободными аминогруппами
Меламин-формальдегидные смолы применяются как в составе полимерных композиций (клеи, лаки), в качестве связующего полимера для пресс-композиций с различными наполнителями (целлюлоза, стекловолокно, древесная мука) и в качестве пластификаторов бетона, так и в качестве конструкционного материала для производства готовых изделий и пенопластов (вспененный меламин).
Слайд 5Свойства и синтез
tпл =364 °C (с разложением); Растворим в воде (0,5 % по
При нагревании до 354 °С и выше меламин отщепляет аммиак с образованием мелема (2,6,10-триамино-сим-гептазина).
Характерным свойством меламина является замещение аминогрупп под действием нуклеофилов. Так, в водных растворах щелочей при повышенных температурах и давлениях меламин гидролизуется, отщепляя аммиак, при этом происходит последовательное замещение аминогрупп на гидроксильные группы с образованием аммелина (2-гидрокси-4,6-диамино-сим-триазина), аммелида (2,4-дигидрокси-6-диамино-сим-триазина) и циануровой кислоты (2,4,6-тригидрокси-сим-триазина). Под действием алкиламинов или их солей аминогруппы меламина замещаются аминоалкильными группами с образованием N-алкилмеламинов, степень замещения (от одного до трех) определяется степенью избытка амина.
Под действием электрофильных агентов происходит замещение атомов водорода аминогрупп меламина: нитрование азотной кислотой в уксусной кислоте ведет к образованию моно- и ди-N-нитромеламинов. Галогенирование ведет к образованию N-галогенмеламинов различной степени замещения, при хлорировании может быть получен гексахлормеламин, являющийся энергичным хлорирующим агентом и применяющийся в составе композиций для дегазации отравляющих веществ.
В лабораторных условиях простейшим методом синтеза меламина является взаимодействие цианурхлорида с аммиаком при 100 °C, другими методами являются синтезы меламина нагреванием гуанидина и тримеризацией цианамида.
В промышленности применяется два основных метода синтеза меламина — пиролиз мочевины и синтез из дициандиамида.
При пиролизе мочевины применяются катализаторы (на онове Al2O3 и др.) при 350—450 °C и давлении 50—200 МПа, при этом на первой стадии мочевина отщепляет аммиак с образованием циановой кислоты:
Слайд 6Свойства и синтез
(NH2)2CO → HCNO + NH3 которая затем с отщеплением
6 HCNO → C3H6N6 + 3 CO2
Другим методом является синтез из дициандиамида (NH2CN)2 в жидком аммиаке или растворе аммиака в этаноле при температуре 180—500 °C и давлении 4—20 МПа (40—200 кг/см²). Исторически первым промышленным методом стало производство меламина из дициандиамида, получаемого, в свою очередь, из карбида кальция, однако по мере роста крупнотоннажного производства мочевины дициандиамидный процесс был вытеснен процессом пиролиза мочевины.
25 мая 2012 года в Невинномысске (Ставропольский край) на ОАО «Невинномысский Азот» была запущена первая в России установка по производству меламина и был получен первый отечественный меламин. Годовой объём производства составляет 50 тысяч тонн.
Слайд 7Получение из карбамида
Меламин является ценным химическим соединением, которое применяют для получения
бумаги, в мебельной – для изготовления лаков, клеев, а также для приготовления дубителей, ионообменных смол, дезинфицирующих веществ, медицинских препаратов, негорючих составов и др.
Меламин образуется из карбамида по реакции
6СО(NН2)2 = С3Н6N6 + 6NН3 + 3СО2.
Реакция протекает при ~600 К с образованием в качестве промежуточного продукта циануровой кислоты. Зависимость равновесного выхода меламина от давления и температуры. С возрастанием давления при постоянной температуре выход меламина уменьшается, так как равновесие реакции смещается в сторону образования карбамида. Наоборот, при повышении температуры и постоянном давлении выход меламина увеличивается. В зависимости от условий реакции можно добиться выхода меламина более 95%.
Слайд 8Получение
Существует несколько различных технологических схем процесса получения меламина. Принципиальная технологическая схема
1 – бункер для карбамида; 2 – шнековый питатель; 3 – реактор с наруж-
ным обогревом; 4 – дополнительный реактор; 5, 6 – конденсаторы-сепараторы; 7
– насос; 8 – центрифуга; 9 – сушилка; 10 – дробилка; 11 – скруббер; 12 –
компрессор; 13 – колонна для осушки паров NH3.
Потоки: I-вода; II- NH3; III –меламин; IV- карбамид
Слайд 9Получение
По этой технологии синтез проводится в газовой фазе на катализаторе с
СО(NН2)2 = НNСО + NН3,
6НNСО = С3Н6N6 + 3СО2.
Карбамид из бункера 1 шнеком 2 подается в реактор 3 с внешним подогревом, в котором при ~600 К он разлагается в "кипящем слое" с образованием циановой кислоты и аммиака. Образовавшаяся смесь паров циановой кислоты и аммиака направляется в реактор 4, в котором происходит образование меламина. Выход меламина составляет 95%. Меламин вследствие быстрого охлаждения выпадает в осадок в конденсаторе 5 и далее через сепаратор 6 и центрифугу 8 направляется на сушку и упаковку.