- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Получение гидроксида никеля (II) презентация
Содержание
- 1. Получение гидроксида никеля (II)
- 2. Цели и задачи работы Цель нашей
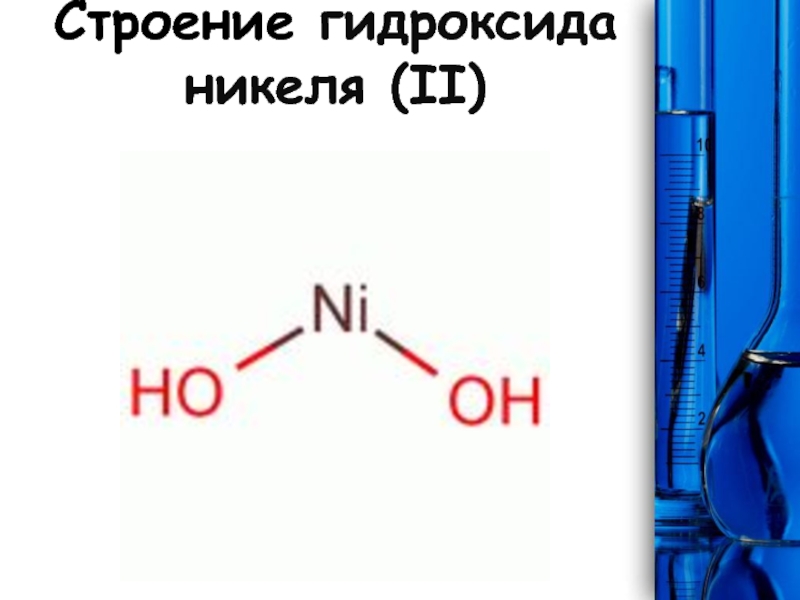
- 3. Строение гидроксида никеля (II)
- 4. Физические свойства Гидроксид никеля(II) образует светло-зелёные кристаллы
- 5. Химические свойства При нагревании разлагается:
- 6. Химические свойства С растворами аммиака образует комплексные
- 7. Применение Никель является компонентом многих сплавов
- 8. Что нам нужно для работы?
- 9. 5 г Ni(NO3)2 ∙6H2O растворяем
- 10. Осадок отстаиваем и декантируем надосадочную жидкость Осадок
- 11. mнавески(CuO) = 50(г.) M(CuO) = 63,55 +
- 12. Качественные реакции Мы провели качественную реакцию, чтобы
- 13. Изучение различных свойств CuI и CuBr CuI
- 15. СПАСИБО ЗА ВНИМАНИЕ
Слайд 1Получение гидроксида никеля (II)
Выполнили:
Черепенникова Т.А. Х-133
Сачкова М.С. Х-133
Руководитель:
Лыгина Л.В.
Слайд 2Цели и задачи работы
Цель нашей работы:
Получить гидроксид никеля (II)
Изучить физические
Рассчитать выход продукта
Провести качественные реакции на наличие в растворе ионов OH
Изучить различные свойства никеля (II) и его соединений. Сравнить способы их получения и устойчивость соединений.
Задачи:
отработать технологию получения гидроксида никеля (II)
идентифицировать гидроксид никеля (II)
Слайд 4Физические свойства
Гидроксид никеля(II) образует светло-зелёные кристаллы тригональной сингонии, пространственная группа P
Из раствора осаждается гидрат Ni(OH)2•n H2O из которого после сушки над серной кислотой выделяется соединение стехиометрического состава 3Ni(OH)2•2H2O.
Не растворяется в воде, р ПР = 13,80.
Слайд 5Химические свойства
При нагревании разлагается:
Реагирует с кислотами:
Медленно реагирует с щелочами с образованием
Слайд 6Химические свойства
С растворами аммиака образует комплексные аммины:
Является слабым восстановителем:
Слайд 7Применение
Никель является компонентом многих сплавов - жаропрочных, сплавов сопротивления (нихром:
Никель используется также для никелирования - создания корозионностойкого покрытия на поверхности другого металла. Еще используют также для производства аккумуляторов, обмотки струн музыкальных инструментов...
Никель относится к числу микроэлементов, необходимых для нормального развития живых организмов. Известно, что он принимает участие в ферментативных реакциях у животных и растений.
Никель может служить причиной аллергии (контактного дерматита) на металлы, контактирующие с кожей (украшения, часы, джинсовые заклепки). В Евросоюзе ограничено содержание никеля в продукции, контактирующей с кожей человека.
Слайд 9
5 г Ni(NO3)2 ∙6H2O растворяем в горячей воде (50мл) Хорошо
Полученный раствор охлаждаем и фильтруем через воронку Бюхнера или бумажный фильтр, для удаления механических примесей
Полученное вещество высушиваем и пересыпаем в колбу
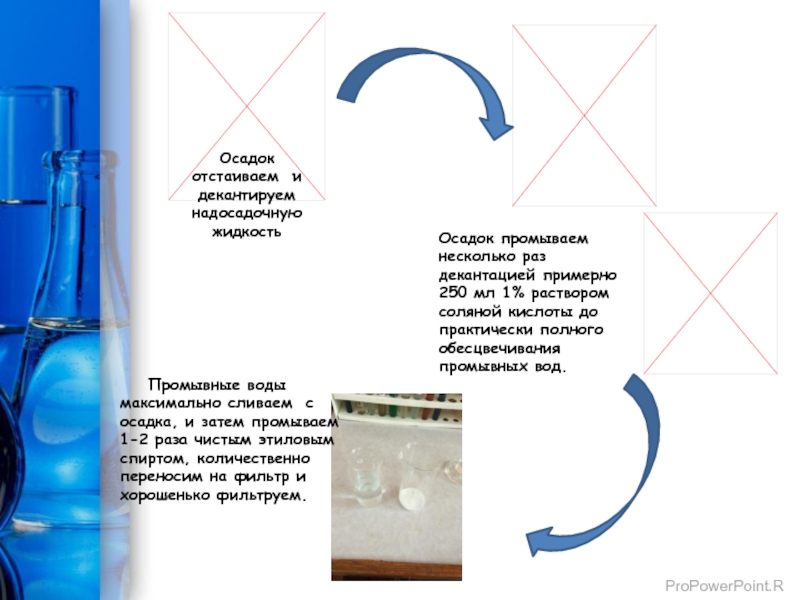
Слайд 10Осадок отстаиваем и декантируем надосадочную жидкость
Осадок промываем несколько раз декантацией примерно
Промывные воды максимально сливаем с осадка, и затем промываем 1-2 раза чистым этиловым спиртом, количественно переносим на фильтр и хорошенько фильтруем.
Слайд 11mнавески(CuO) = 50(г.) M(CuO) = 63,55 + 16 = 79,55(г/моль). M(CuCl2) = 63,55
В ходе проведенного синтеза был получен хлорид меди массой 6,3 г и выходом продукта, составляющим 7,5% от теоретической массы
Слайд 12Качественные реакции
Мы провели качественную реакцию, чтобы доказать наличие в растворе Сl-.
2CuCl
Слайд 13Изучение различных свойств CuI и CuBr
CuI используется в засеве облаков, изменение количества
Структурные свойства CuI позволяют стабилизировать высокую температуру в нейлоне, в коммерческих и жилых отраслях , автомобильных принадлежностях.
CuI используется в качестве источника диетического иода в столовой соли и корме.
CuBr используют в качестве катализатора в органическом синтезе
CuBr используется в известном оборудование, таком как Copper Bromide , который является высокотехнологичным лазером, который позволяет быстро и эффективно решать разнообразные проблемы с состоянием кожи.