- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Подготовка к ОГЭ по химии презентация
Содержание
- 1. Подготовка к ОГЭ по химии
- 2. Т.1 В какой ряду химических элементов усиливаются
- 3. Т.3 Общим для азота и фосфора является:
- 4. Т.5 В каком ряду химических элементов усиливаются
- 5. Т.7 Калий и натрий отличаются: Числом электронов
- 6. Т.9 В молекуле белого фосфора химическая связь:
- 7. Т.11 При прокаливании 1 кг природного известняка
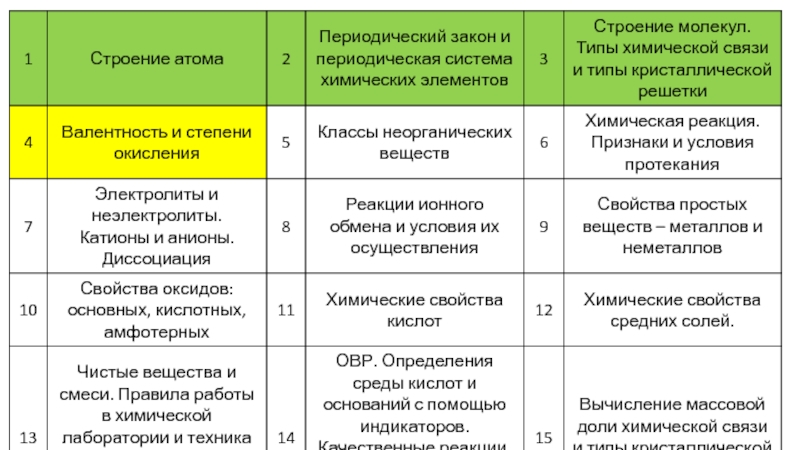
- 10. Валентность – количество связей, которые может образовать
- 11. Валентности некоторых элементов неизменны: H – I,
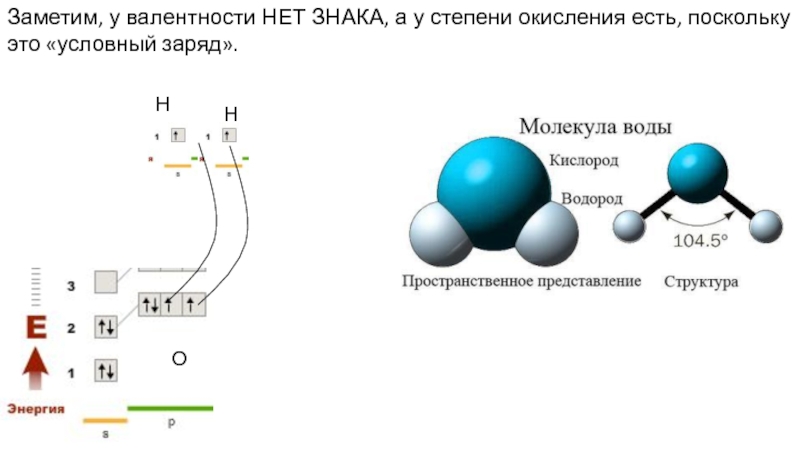
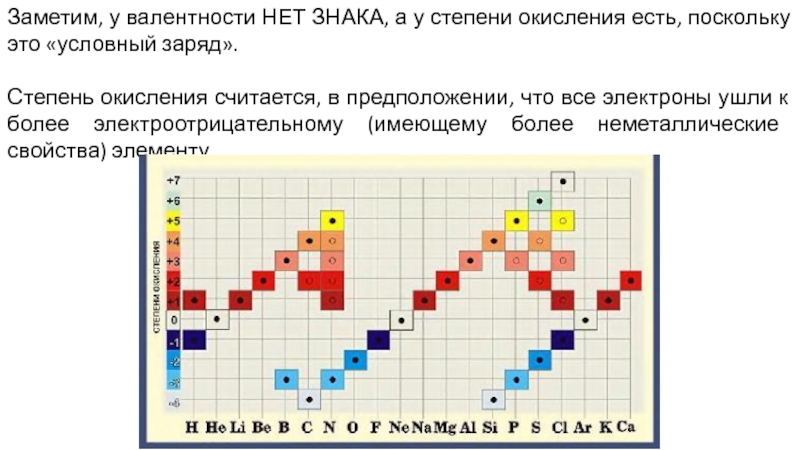
- 12. Заметим, у валентности НЕТ ЗНАКА, а у
- 13. Заметим, у валентности НЕТ ЗНАКА, а у
- 14. Правила вычисления степеней окисления: Сумма
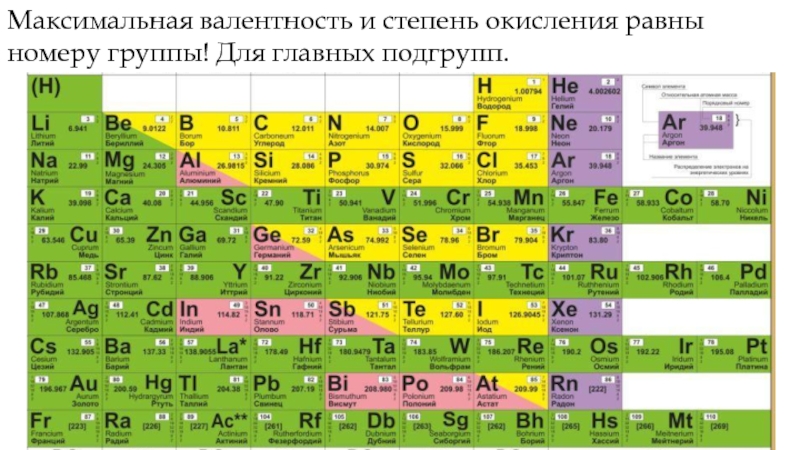
- 15. Максимальная валентность и степень окисления равны номеру группы! Для главных подгрупп.
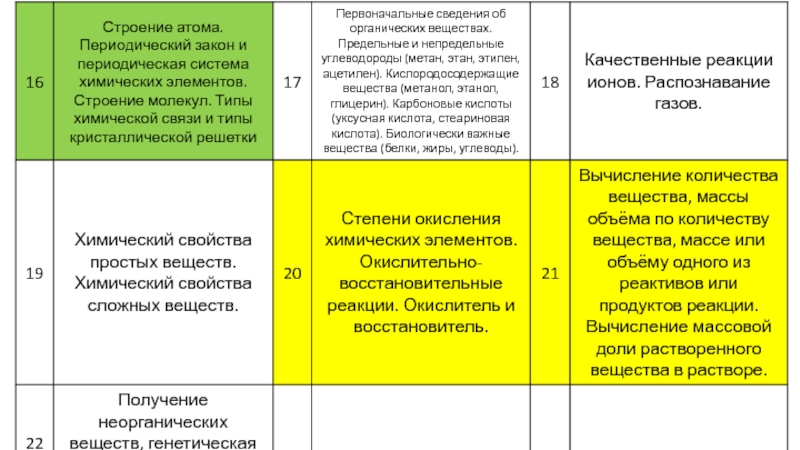
- 16. 3.1 В каком из этих веществ степень
- 17. 3.1 В каком из этих веществ степень
- 18. 3.2 В каком соединении степень окисления серы равна +4: SO3 Na2SO3 Na2SO4 Na2S
- 19. 3.2 В каком соединении степень окисления серы
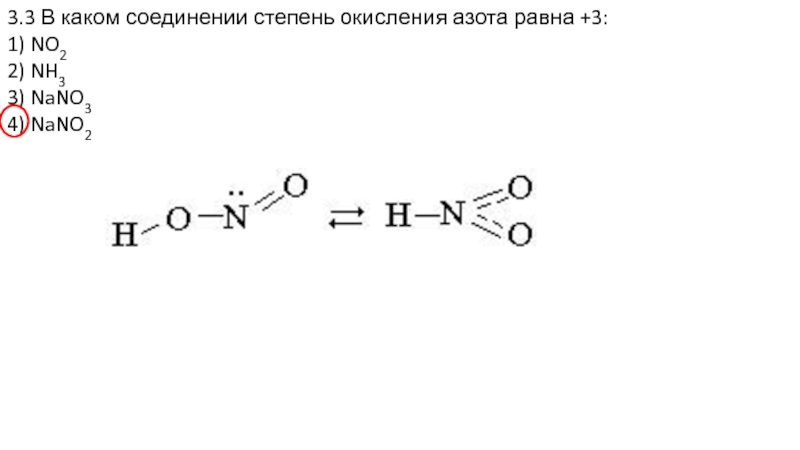
- 20. 3.3 В каком соединении степень окисления азота
- 21. 3.3 В каком соединении степень окисления азота
- 22. 3.4 В каком соединении степень окисления хлора
- 23. 3.4 В каком соединении степень окисления хлора
- 24. 3.4 В каком соединении степень окисления хлора
- 25. 3.5 В веществе, формула которого KNO2, степень окисления азота равна: -3 +3 -5 +5
- 26. 3.5 В веществе, формула которого KNO2, степень окисления азота равна: -3 +3 -5 +5
- 27. 3.6 Одинаковая степень окисления у фосфора в
- 28. 3.6 Одинаковая степень окисления у фосфора в
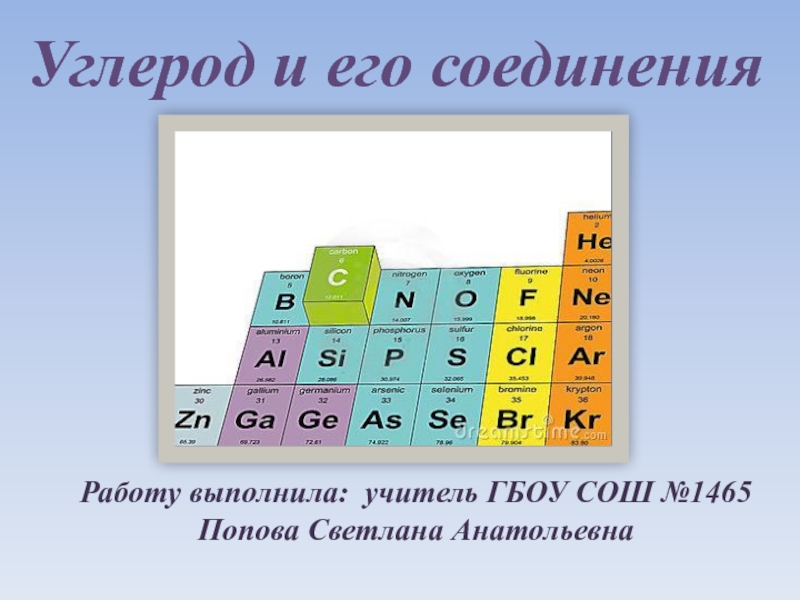
- 29. 3.7 Валентность неметаллов последовательно увеличивается в ряду
- 30. 3.7 Валентность неметаллов последовательно увеличивается в ряду
- 31. 3.8 В веществах, формулы которых: CrO3, CrCl2,
- 32. 3.8 В веществах, формулы которых: CrO3, CrCl2,
- 33. Реакции протекающие с изменением степеней окисления –
- 34. 3.9 Используйте метод электронного баланса, расставьте коэффициенты
- 35. 3.10 Используя метод электронного баланса, расставьте коэффициенты
- 36. Т.1 В каком соединении марганец имеет наибольшую степень окисления? KMnO4 K2MnO4 MnSO4 MnO2
- 37. Т.2 В порядке уменьшения валентности в высших
- 38. Т.3 Атомы серы и углерода имеют одинаковую
- 39. Т.4 Валентность каждого элемента равна II в веществе, формула которого: AlP MgS SiC MgCl2
- 40. Т.5 Валентность хрома равна 6 в вещества, формула которого: Cr(OH)3 CrO H2CrO4 CrO
- 41. Т.6 Отрицательная степень окисления химических элементов численно
- 42. Т.7 В каких соединениях фосфор и азот
- 43. Т.8 Наименьшие значение степени окисления фосфор имеет в веществах: H3PO4 PH3 Na3PO4 Mg3P2 P2O5
- 44. Т.9 Каковы степень окисления и валентность атома
- 45. Т.10 Используя метод электронного баланса, расставьте коэффициенты
Слайд 2Т.1 В какой ряду химических элементов усиливаются металлические свойства соответствующих им
Na, Mg, Al
K, Na, Li
Li, Be, B
Al, Mg, Na
Т.2 В хлориде натрия химическая связь:
Ионная
Ковалентная полярная
Ковалентная неполярная
Металлическая.
Слайд 3Т.3 Общим для азота и фосфора является:
Наличие двух энергетических уровней в
Число электронов на внешнем энергетическом уровне их атомов
Одинаковый радиус их атомов.
Т.4. На схеме изображено электронное строение +Z)2)8 :
Кислорода
Магния
Неона
Аргона
Слайд 4Т.5 В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им
I, Br, Cl
F, Cl, Br
N, C, B
O, S, Se
Т.6 В молекуле сереводорода химическая связь:
Ионная
Ковалентная полярная
Ковалентная неполярная
металлическая
Слайд 5Т.7 Калий и натрий отличаются:
Числом электронов на внешнем энергетическом уровне их
Числом энергетических уровней в атомах этих элементов
Способностью их атомов к отдаче электронов
Агрегатным состоянием простых веществ, образованных этими элементами
Характером их высших гидроксидов
Т.8 В каком ряду химических элементов уменьшаются восстановительные свойства соответствующих им простых веществ:
C, Si, Al
Be, Mg, Ca
C, F, O
Na, Mg, Al
Слайд 6Т.9 В молекуле белого фосфора химическая связь:
Ионная
Ковалентная полярная
Ковалентная неполярная.
Металлическая
Т.10 в ряду
Увеличивается число электронов на внешнем энергетическом уровне в атомах этих элементов
Увеличивается число энергетических уровней в атомах этих элементов
Усиливаются основные свойства оксидов, образованных атомами этих элементов
Усиливаются неметаллические свойства простых веществ, образованных этими элементами
Увеличивается максимальная степень окисления элементов
Слайд 7Т.11 При прокаливании 1 кг природного известняка было получено 201.6 л
CaCO3 ? CO2 + CaO
νCO2=201.6/22.4 = 9 моль
νCO2 = νCaCO3 = 9 моль
mсасо3 =MCaCO3* νCaCO3 = 9*(40+12+16*3) = 900 г
ωпримесей = (1000 -900)/1000 *100% = 10%
Слайд 10Валентность – количество связей, которые может образовать атом. Применяется для атомов,
Валентность атома определяется числом его неспаренных электронов в основном или возбужденном состоянии. Мерой валентности может быть количество химических связей, образуемых атомом данного элемента.
Степень окисления – условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
Слайд 11Валентности некоторых элементов неизменны: H – I, O – II, щелочные
Но большое количество элементов имеет
переменную валентность: C – II,IV; S – II, IV,VI;
Слайд 12Заметим, у валентности НЕТ ЗНАКА, а у степени окисления есть, поскольку
Н
Н
О
Слайд 13Заметим, у валентности НЕТ ЗНАКА, а у степени окисления есть, поскольку
Степень окисления считается, в предположении, что все электроны ушли к более электроотрицательному (имеющему более неметаллические свойства) элементу.
Слайд 14 Правила вычисления степеней окисления:
Сумма степеней окисления атомов в соединении всегда
Степень окисления равна нулю у свободных атомов и у атомов, входящих в состав неполярных молекул. Н02
Если элемент находится в главной подгруппе периодической системы, то высшая положительная степень окисления элемента, как правило, равна номеру группы.
Степень окисления F, как наиболее электроотрицательного элемента, во всех соединениях равна -1.
Степень окисления кислорода обычно равна -2 за исключением OF и пероксидов H2O2.
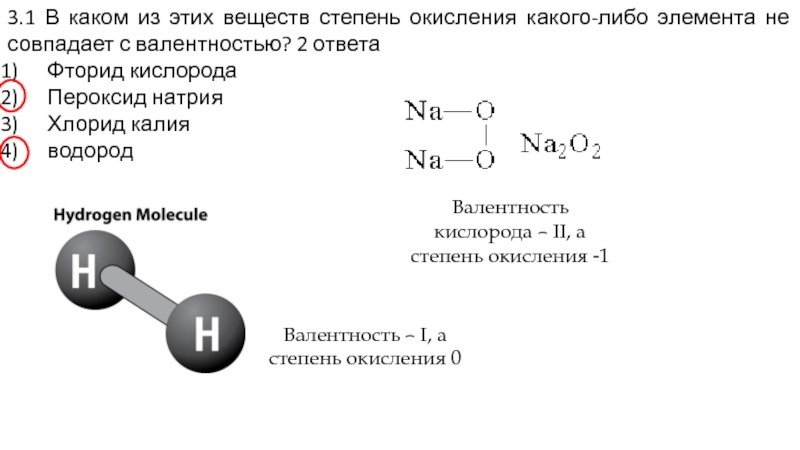
Слайд 163.1 В каком из этих веществ степень окисления какого-либо элемента не
Фторид кислорода
Пероксид натрия
Хлорид калия
водород
Слайд 173.1 В каком из этих веществ степень окисления какого-либо элемента не
Фторид кислорода
Пероксид натрия
Хлорид калия
водород
Валентность кислорода – II, а степень окисления -1
Валентность – I, а степень окисления 0
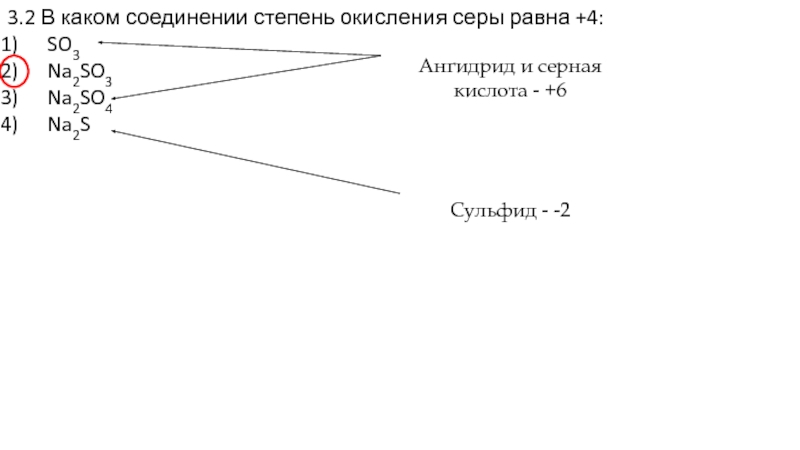
Слайд 193.2 В каком соединении степень окисления серы равна +4:
SO3
Na2SO3
Na2SO4
Na2S
Ангидрид и серная
Сульфид - -2
Слайд 223.4 В каком соединении степень окисления хлора равна +5:
Хлористая кислота
Хлорид натрия
Гипохлорит
Бертолетова соль
Слайд 233.4 В каком соединении степень окисления хлора равна +5:
Хлористая кислота HClO2
Хлорид
Гипохлорит бария Ba(ClO)2
Бертолетова соль KClO3
Слайд 243.4 В каком соединении степень окисления хлора равна +5:
Хлористая кислота HClO2
Хлорид
Гипохлорит бария Ba(ClO)2
Бертолетова соль KClO3
Слайд 273.6 Одинаковая степень окисления у фосфора в фосфате кальция и веществе,
Mg3P2
NaH2PO4
P4O6
HPO3
Слайд 283.6 Одинаковая степень окисления у фосфора в фосфате кальция и веществе,
Mg3P2
NaH2PO2
P4O6
HPO3
Фосфат кальция – Ca3(PO4)2
Слайд 293.7 Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых:
HF
SiH4 – AsH3 –H2S –HCl
HF – H2O – NH3 – CH4
SiH4 – H2S – AsH3 - HCl
Слайд 303.7 Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых:
HF
SiH4 – AsH3 –H2S –HCl
HF – H2O – NH3 – CH4
SiH4 – H2S – AsH3 - HCl
Слайд 313.8 В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени
+6, +2, +3
+6, +3, +2
+3, +2, +3
+3, +2, +6
Слайд 323.8 В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени
+6, +2, +3
+6, +3, +2
+3, +2, +3
+3, +2, +6
Слайд 33Реакции протекающие с изменением степеней окисления – называются окислительно-восстановительными реакциями (ОВР).
2Mg
3S + 2KClO3 ? KCl + 2SO2
Окислитель – химический элемент, принимающие электроны в окислительно-восстановительной реакции.
Восстановитель – химический элемент, отдающий электроны в ОВР
Слайд 343.9 Используйте метод электронного баланса, расставьте коэффициенты в равнении реакции, схема
Слайд 353.10 Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема
Слайд 37Т.2 В порядке уменьшения валентности в высших оксидах элементы расположены в
Сl? S ? P ? Si
Si ? P ? S ? Cl
N ? Si ? C ? B
Na ? K ? Li ? Cs
Слайд 38Т.3 Атомы серы и углерода имеют одинаковую степень окисления в соединениях:
H2S,
H2SO4, CO
SO2, H2CO3
Na2S, Al4C3
Слайд 41Т.6 Отрицательная степень окисления химических элементов численно равна:
Номеру группы в периодической
Числу электронов, недостающих до завершения внешнего электронного слоя
Числу электронных слоёв в атоме
Номеру периода, в котором находится элемент в периодической системе.
Слайд 42Т.7 В каких соединениях фосфор и азот проявляют одинаковые степени окисления?
PH3,
P2O5, HNO3
NO2, H3PO4
N2O, AlPO4
NaNO3, P2O3
Слайд 44Т.9 Каковы степень окисления и валентность атома по отношению друг к
Степень окисления всегда меньше валентности
Степень окисления всегда равна валентности
Степень окисления может быть не равна валентности
Это одно и то же