- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодический закон Д.И. Менделеева (лекция 3) презентация
Содержание
- 1. Периодический закон Д.И. Менделеева (лекция 3)
- 2. Рекомендуемая литература Кужаров А.С. Общая химия
- 3. История открытия. Предшественники Правило триад Дёберейнера
- 4. Спираль Шанкуртуа Александр Эмиль Бегуйе де Шанкуртуа,
- 5. Закон октав Ньюлендса В 1865 г. Ньюлендс опубликовал
- 6. Таблица Мейера 1864 г. Мейер опубликовал таблицу
- 7. Д.И. Менделеев МЕНДЕЛЕЕВ Дмитрий Иванович (1834-1907),
- 8. Первая формулировка Периодического закона 1 марта
- 9. Сущность открытия Д.И. Менделеева Сущность открытия
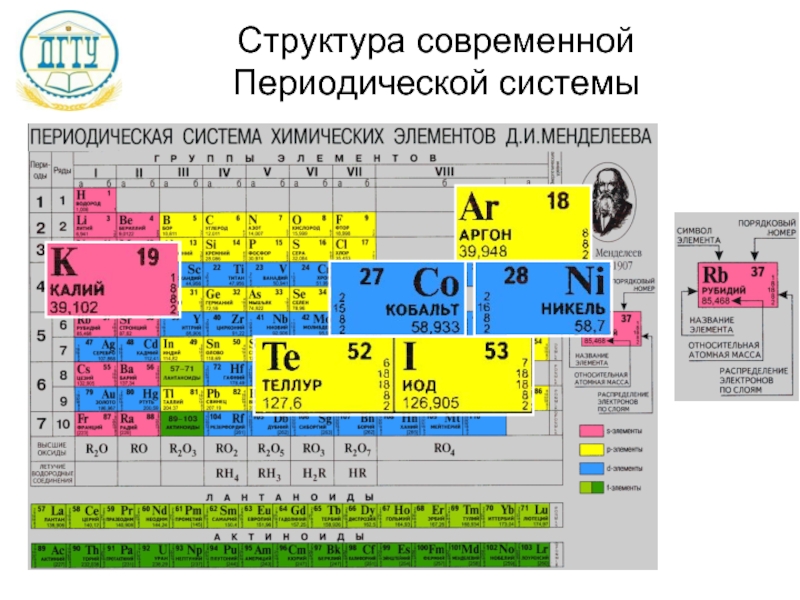
- 10. Структура современной Периодической системы
- 11. Современная формулировка Периодического закона Свойства химических
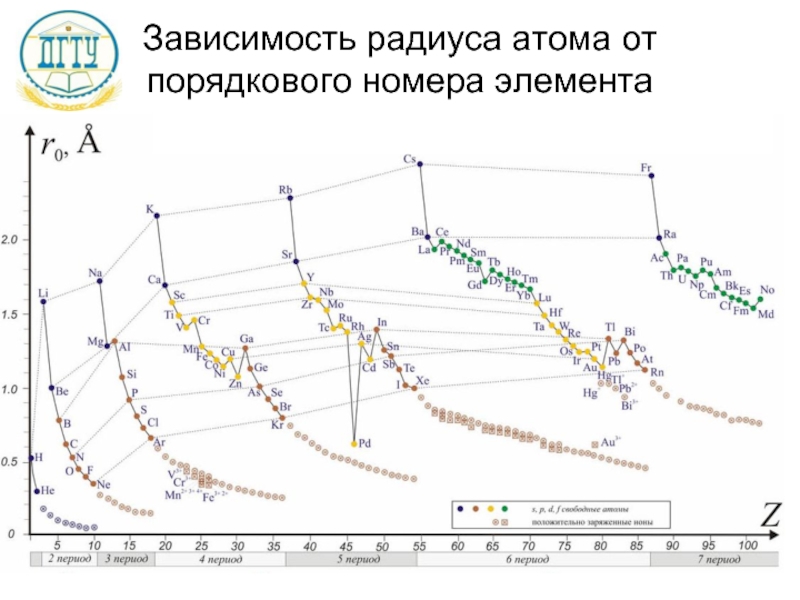
- 12. Зависимость радиуса атома от порядкового номера элемента
- 13. Энергия ионизации Энергией ионизации (потенциалом ионизации) -
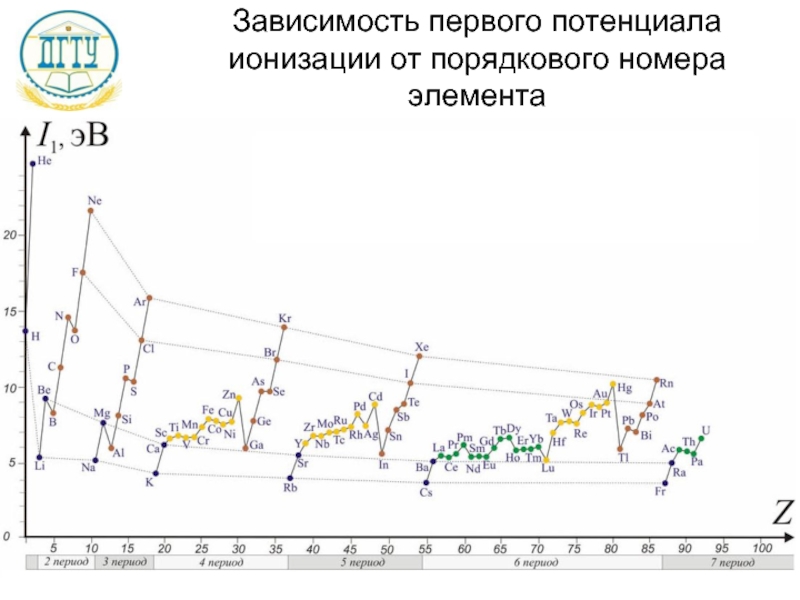
- 14. Зависимость первого потенциала ионизации от порядкового номера элемента
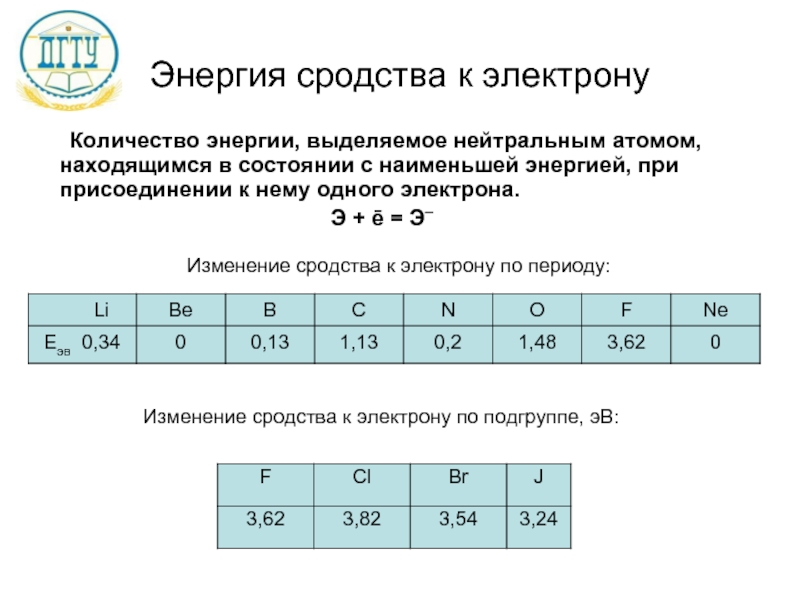
- 15. Энергия сродства к электрону Количество энергии, выделяемое
- 16. Электроотрицательность Мера относительной способности атомов оттягивать на
Слайд 1Лекция 3. Периодический закон
Д.И. Менделеева
Донской государственный технический университет
Факультет нанотехнологии и композиционные материалы
Кафедра «Химия»
Слайд 2Рекомендуемая литература
Кужаров А.С. Общая химия в машиностроительном ВУЗЕ. Конспект лекций для
Ахметов Н.С. Общая и неорганическая химия, М., 2002.
Глинка Н.Л. Общая химия, М., 2008.
Некрасов Б.В. Курс обшей химии, М., 1962 – 2010.
Н.В.Коровин Общая химия, М.: Высшая школа, 1998
М.И.Гельфман, В.П.Юстратов Химия, СПб.: Лань, 2000
www.chemistry.ru
www.chem.msu.su/rus
Слайд 3История открытия. Предшественники
Правило триад Дёберейнера
(1829 г.)
если расположить три сходных по
Литий Li: Ar(Li) = 6,941 а.е.м.
Натрий Na: Ar(Na) = 22,99 а.е.м.
Калий K: Ar(K) = 39,102 а.е.м
Ar(Na) = ½ (Ar(Li) + Ar(K)) ≈ 23,0 а.е.м.
Иоганн Вольфганг Дёберейнер,
1780-1849
Слайд 4Спираль Шанкуртуа
Александр Эмиль Бегуйе де Шанкуртуа,
1820-1886
«Земная спираль» Шанкуртуа
На боковую поверхность цилиндра, разделенную на 16 частей, нанесена линия под углом 45°, на которой отмечены точки, соответствующие атомным весам элементов.
Сходные по свойствам элементы группируются на одной вертикальной линии.
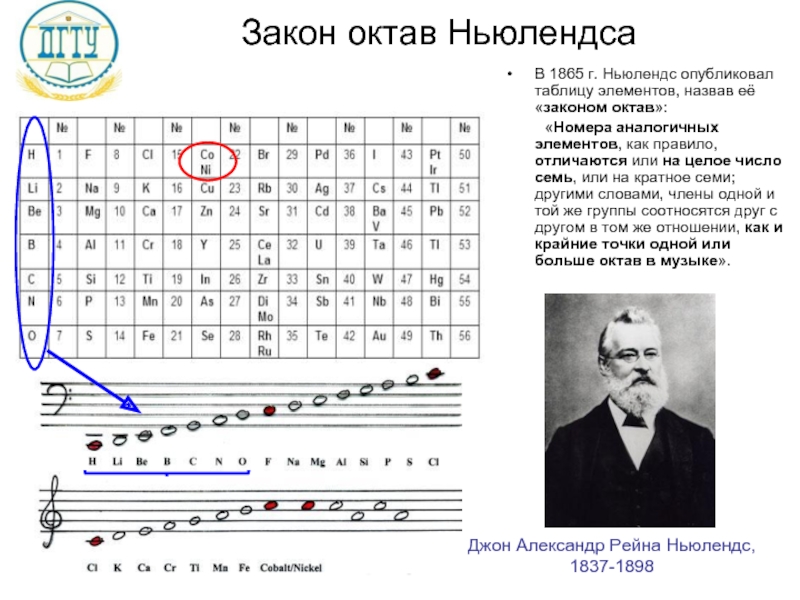
Слайд 5Закон октав Ньюлендса
В 1865 г. Ньюлендс опубликовал таблицу элементов, назвав её «законом
«Номера аналогичных элементов, как правило, отличаются или на целое число семь, или на кратное семи; другими словами, члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
Джон Александр Рейна Ньюлендс, 1837-1898
Слайд 6Таблица Мейера
1864 г. Мейер опубликовал таблицу из 28 элементов, группируя их
Он ограничил число элементов, чтобы подчеркнуть закономерное изменение атомной массы в рядах подобных элементов
Таблица 1870 г. состояла из девяти столбцов
Некоторые ячейки таблицы Мейер оставил незаполненными
Юлиус Лотар Мейер,
1830-1895
Таблица Мейера 1864 г. (фрагмент)
Слайд 7Д.И. Менделеев
МЕНДЕЛЕЕВ Дмитрий Иванович (1834-1907),
российский химик, разносторонний ученый, педагог.
Открыл (1869)
Оставил св. 500 печатных трудов, среди которых классические «Основы химии» (ч. 1-2, 1869-71, 13 изд., 1947) — первое стройное изложение неорганической химии.
Автор фундаментальных исследований по химии, химической технологии, физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, экономике, народному просвещению и др.
Заложил основы теории растворов, предложил промышленный способ фракционного разделения нефти, изобрел вид бездымного пороха, пропагандировал использование минеральных удобрений, орошение засушливых земель.
Один из инициаторов создания Русского химического общества (1868). Профессор Петербургского университета (1865-90), ушел в отставку в знак протеста против притеснения студенчества.
Организатор и первый директор (1893) Главной палаты мер и весов (ныне ВНИИ метрологии им. Менделеева).
Слайд 8Первая формулировка
Периодического закона
1 марта 1869 г. Д.И. Менделеев опубликовал (в
«…Свойства элементов, а потому и свойства образуемых ими простых и сложных тел состоят в периодической зависимости от их атомного веса…»
Слайд 9Сущность открытия
Д.И. Менделеева
Сущность открытия Менделеева: с ростом атомной массы химических
Отличие работы Менделеева от работ предшественников: классификация всех известных к тому времени элементов на основе их атомных масс и химических свойств
Исправил атомные массы некоторых элементов (например, бериллия некоторых элементов (например, бериллия, индия некоторых элементов (например, бериллия, индия, урана некоторых элементов (например, бериллия, индия, урана, тория некоторых элементов (например, бериллия, индия, урана, тория, церия некоторых элементов (например, бериллия, индия, урана, тория, церия, титана некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия)
Разместил несколько элементов в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности),
Оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1875-1866 гг. открыты галлий, где должны были разместиться пока не открытые элементы. В 1875-1866 гг. открыты галлий (экаалюминий), скандий, где должны были разместиться пока не открытые элементы. В 1875-1866 гг. открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций)
Первая периодическая таблица
Слайд 11Современная формулировка Периодического закона
Свойства химических элементов находятся в периодической зависимости от
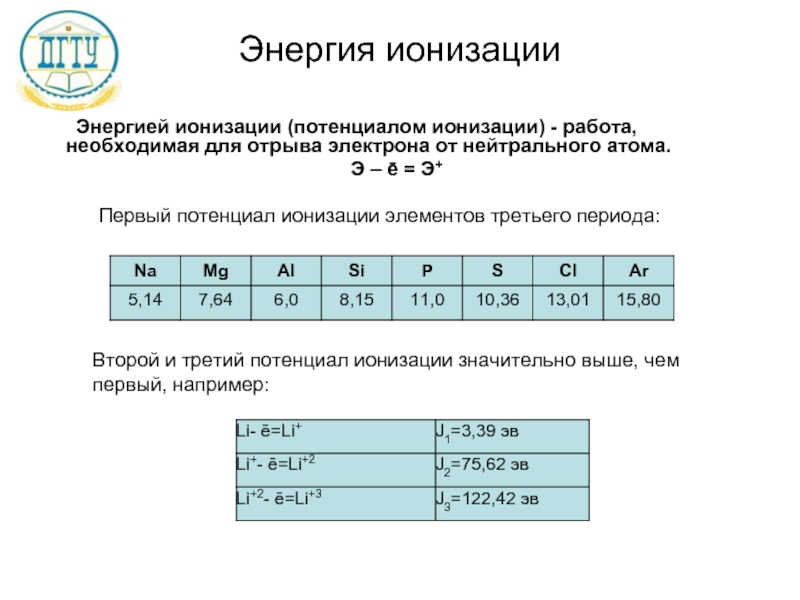
Слайд 13Энергия ионизации
Энергией ионизации (потенциалом ионизации) - работа, необходимая для отрыва электрона
Э – ē = Э+
Первый потенциал ионизации элементов третьего периода:
Второй и третий потенциал ионизации значительно выше, чем первый, например:
Слайд 15Энергия сродства к электрону
Количество энергии, выделяемое нейтральным атомом, находящимся в состоянии
Э + ē = Э–
Изменение сродства к электрону по периоду:
Изменение сродства к электрону по подгруппе, эВ:
Слайд 16Электроотрицательность
Мера относительной способности атомов оттягивать на себя общую электронную пару при
Э.О.=J1+Еср
Таблица электроотрицательности по Полингу