- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодическая система химических элементов Д.И. Менделеева презентация
Содержание
- 1. Периодическая система химических элементов Д.И. Менделеева
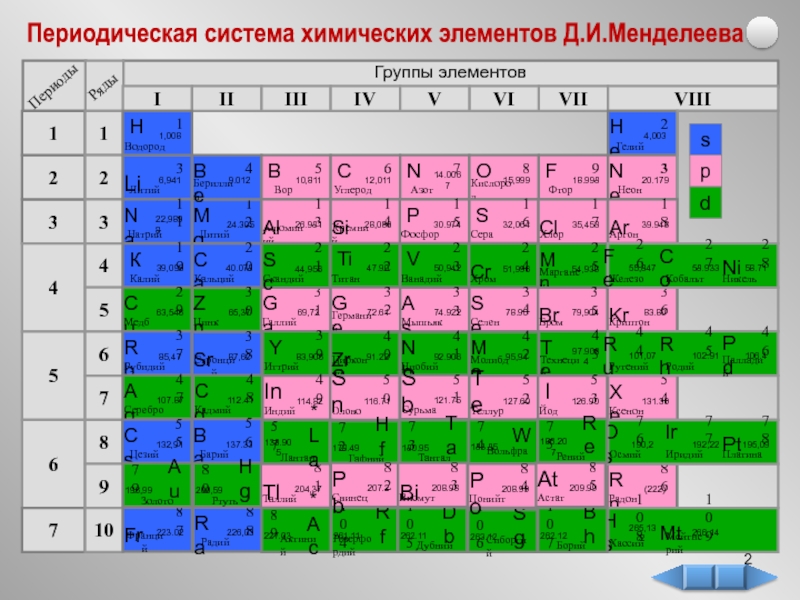
- 2. Периодическая система химических элементов Д.И.Менделеева Группы элементов
- 3. Периодическая система химических элементов Д.И.Менделеева Характеристика
- 4. Алюминий
- 5. Из истории открытия Впервые Al был
- 6. В период открытия алюминия
- 7. Алюминий - элемент III группы, главной
- 8. Электронное строение 27 Аl +13
- 9. Свойства атома 2.1 Степень окисления Al
- 10. Свойства атома 2.2 Восстановительные
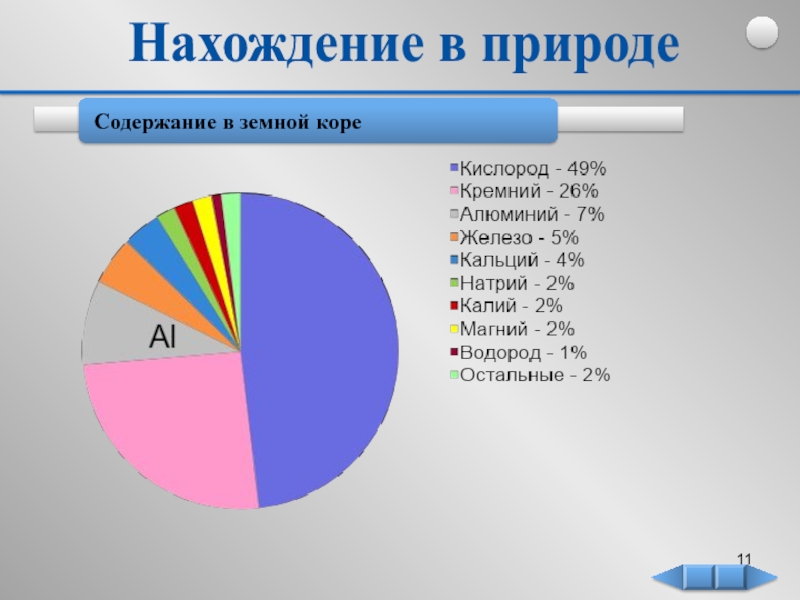
- 11. Содержание в земной коре Нахождение в природе
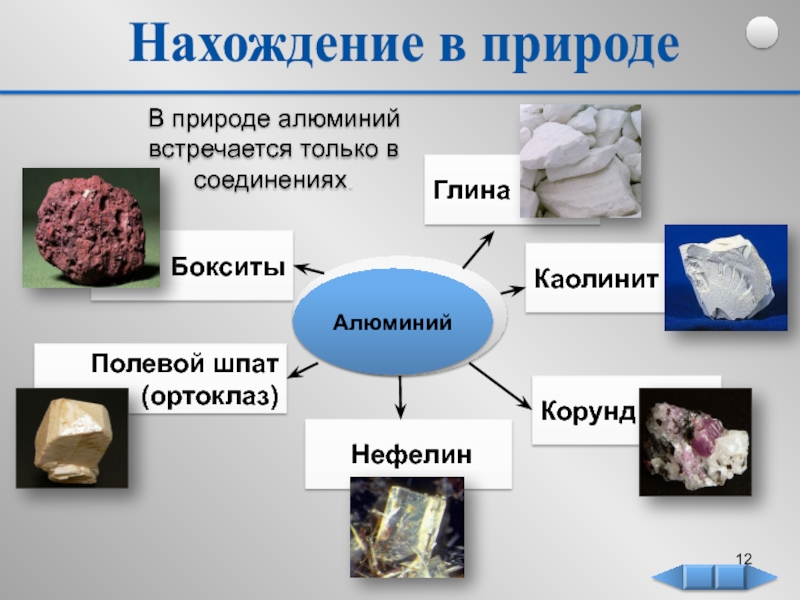
- 12. Нахождение в природе В природе алюминий встречается только в соединениях.
- 13. Бокситы
- 14. Глина Известно
- 15. Каолинит
- 16. Корунд
- 17. Нефелин
- 18. Полевой шпат (ортоклаз)
- 19. Строение простого вещества Металл
- 20. Физические свойства
- 21. Алюминий В
- 22. Взаимодействие с неметаллами Химические свойства
- 23. Взаимодействие с неметаллами Химические свойства
- 24. Взаимодействие с водой Химические свойства
- 25. Взаимодействие с кислотами Химические свойства
- 26. 2Al + Fe2(SO4)3 → Al2(SO4)3 + 2Fe
- 27. Взаимодействие с оксидами металлов Химические свойства
- 28. Амфотерность В расплаве щелочи 2Al +
- 29. Взаимодействие со щелочами Химические свойства
- 30. Получение алюминия
- 31. Получение алюминия
- 32. Применение алюминия
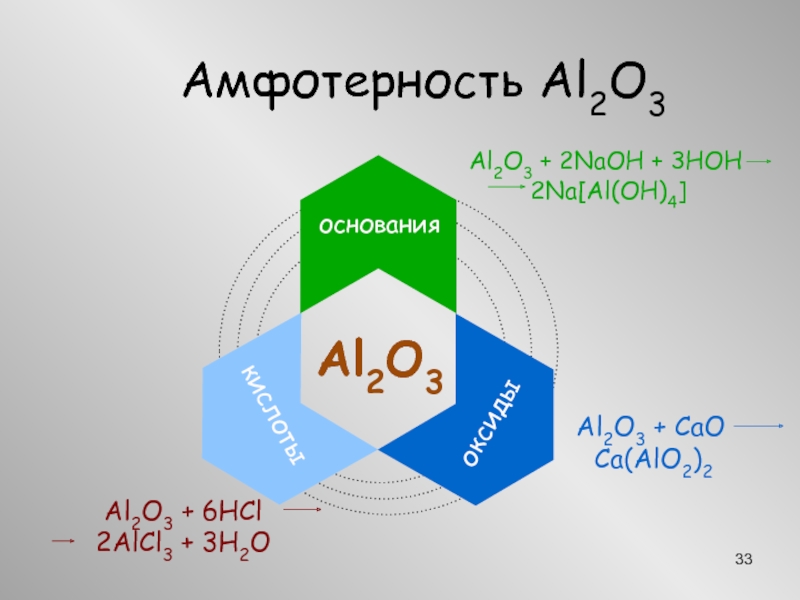
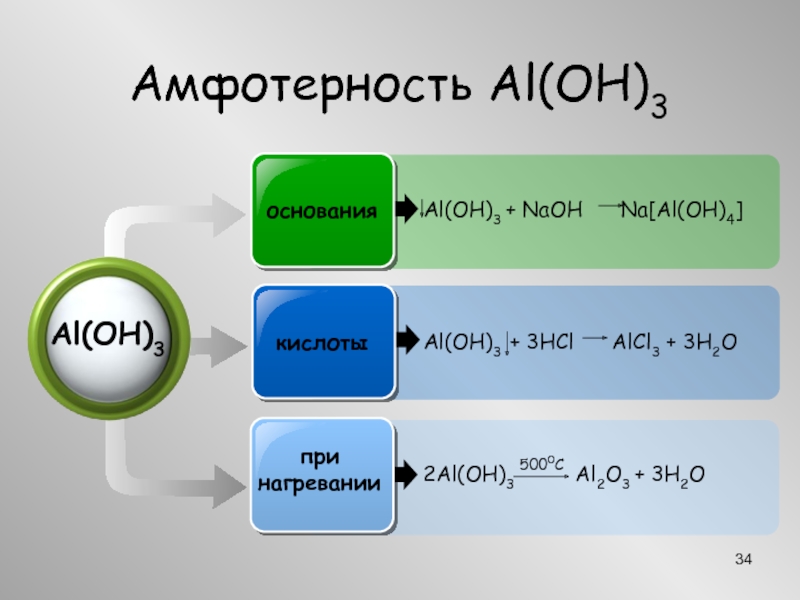
- 33. Амфотерность Al2O3 Al2O3
- 35. Закрепление Al Al2O3 AlCl3 Na[Al(OH)4]
Слайд 5
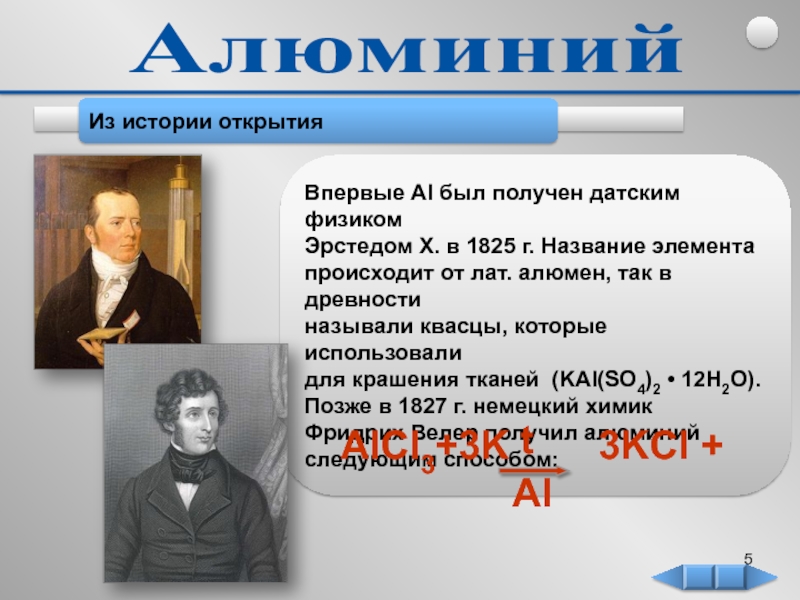
Из истории открытия
Впервые Al был получен датским физиком
Эрстедом Х. в
происходит от лат. алюмен, так в древности
называли квасцы, которые использовали
для крашения тканей (KAl(SO4)2 • 12H2O).
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
Алюминий
Слайд 6 В период открытия алюминия - металл был дороже
Из истории открытия
Алюминий
Слайд 7Алюминий - элемент III группы, главной подгруппы.
Заряд ядра атома алюминия
В ядре атома алюминия 13 протонов.
В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 2е, 8е, 3е.
На внешнем уровне в атоме 3 электронов.
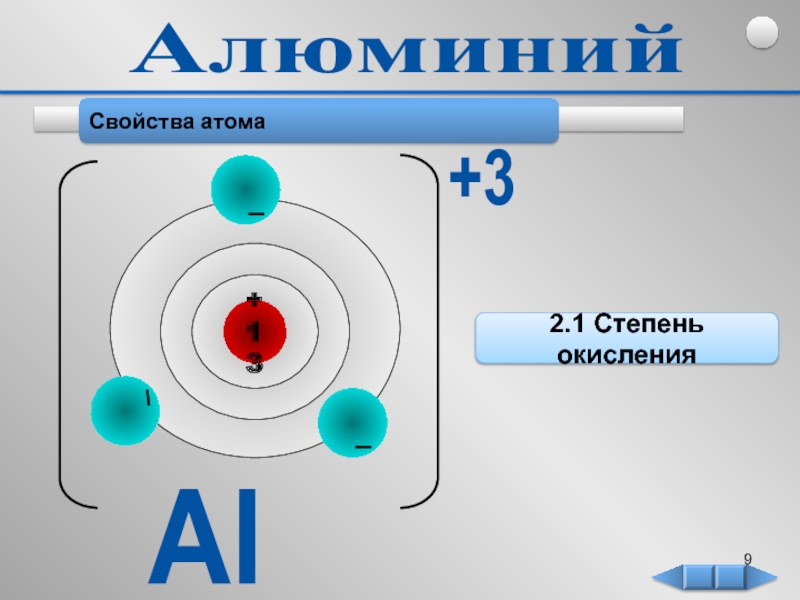
Степень окисления атома в соединениях равна +3 .
Простое вещество алюминий является металлом.
Оксид и гидроксид алюминия имеют амфотерный характер.
Алюминий
Вставьте пропущенные слова
Слайд 8
Электронное строение
27
Аl
+13
0
2e
8e
3e
1s2
2s2
2p6
3s2
3p1
Краткая электронная запись
1s2
2s2
2p6
3s2
3p1
Порядок заполнения
Алюминий
Слайд 10
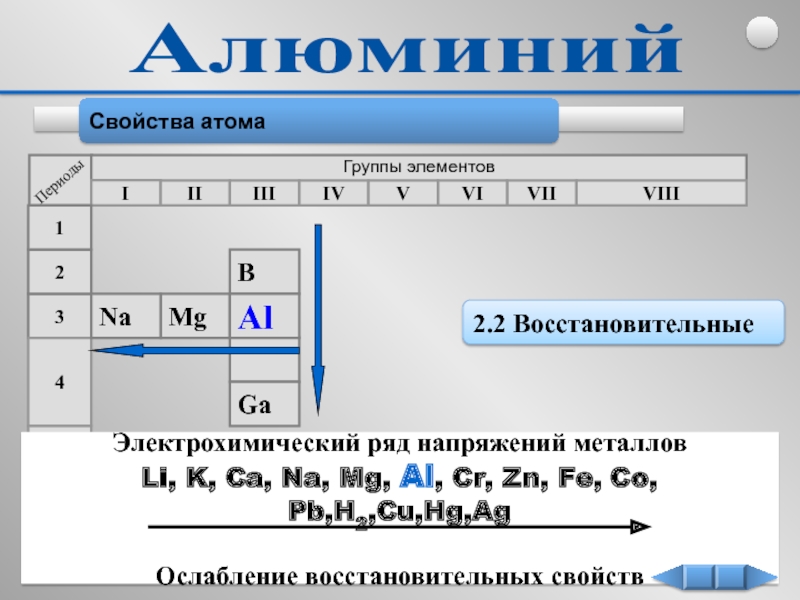
Свойства атома
2.2 Восстановительные
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al,
Ослабление восстановительных свойств
Алюминий
Слайд 13Бокситы
Бокситы (от названия местности Ле-Бо, Lex Baux, на юге Франции,
Слайд 14Глина
Известно более 250 минералов, в состав которых входит алюминий, большинство
Слайд 15Каолинит
Каолинит Al2O3•2SiO2•2H2O – минерал подкласса слоистых силикатов, главная составная
Слайд 16Корунд
Изредка встречается твердый (уступает лишь алмазу) минерал корунд –
Слайд 17Нефелин
Na2O • Al2O3 • 2SiO2
Минералы – серые, красноватые
Слайд 18Полевой шпат (ортоклаз)
К2O • Al2O3 • 6SiO2
Калиевый полевой
Слайд 19
Строение простого вещества
Металл
Связь - металлическая
Кристаллическая
металлическая,
кубическая
гранецентрированная
Алюминий
Слайд 20
Физические свойства
Цвет – серебристо-белый
t пл. = 660°C
t кип. ≈ 2450°C
электропроводный,
теплопроводный
легкий,
плотность ρ = 2,6989 г/см3
мягкий, пластичный
Алюминий
Слайд 21Алюминий
В обычных условиях поверхность алюминия покрыта очень тонкой (10-5мм), но очень
Слайд 22
Взаимодействие с неметаллами
Химические свойства
4Аl +3O2→2Al2O3
Аl + O2 →
Из неметаллов алюминий легче
2Аl +3Br2→2AlBr3
Аl + Br2 →
Слайд 23
Взаимодействие с неметаллами
Химические свойства
C галогенами бромом и йодом реагирует в присутствии
2Аl +3I2→2AlI3
Аl + I2 →
4Al+3C→Al4C3
2Al+3S→Al2S3
Al + S →
Слайд 24
Взаимодействие с водой
Химические свойства
В особых условиях алюминий (очищенный от оксидной пленки
2Al+6H2O → 2Al(OH)3 + 3H2↑
Al + H2O →
Слайд 25
Взаимодействие с кислотами
Химические свойства
Алюминий достаточно легко реагирует с кислотами.
Al +
Al+H2SO4→
Но!
2Al+6HCl → 2AlCl3 + 3H2↑
Al+3H2SO4→ Al2(SO4)3 + 3H2↑
Но! Не реагирует при обычных условиях с очень разбавленной и концентрированной азотной кислотой (пассивируется)
Слайд 262Al + Fe2(SO4)3 → Al2(SO4)3 + 2Fe
2Al + 3CuCl2 → 3Cu
Взаимодействие с солями
Химические свойства
Алюминий может реагировать с водными растворами отдельных солей.
Al + CuCl2 →
Li K Ba Sr Ca Na
Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb
(H2)
Cu Hg Ag Pt Au
Al
Al + Fe2(SO4)3 →
Слайд 27
Взаимодействие с оксидами металлов
Химические свойства
Алюминий – сильный восстановитель.
Его применяют для
2Al0+Fe3+2O3 → Al3+2O3 + 3Fe0
4Al0+3WO2 → 2Al3+2O3 + 3W0
Слайд 28Амфотерность
В расплаве щелочи
2Al + 2NaOH + 6HOН 2Na[Al(OН)4] +
В расплаве
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
Взаимодействует
с расплавами и
растворами щелочей
Слайд 29
Взаимодействие со щелочами
Химические свойства
Алюминий активно взаимодействует со щелочами. Защитная пленка амфотерного
Al+NaOH→
2Al+2NaOH+4H2O→2Na[Al(OH)4]+3H2↑
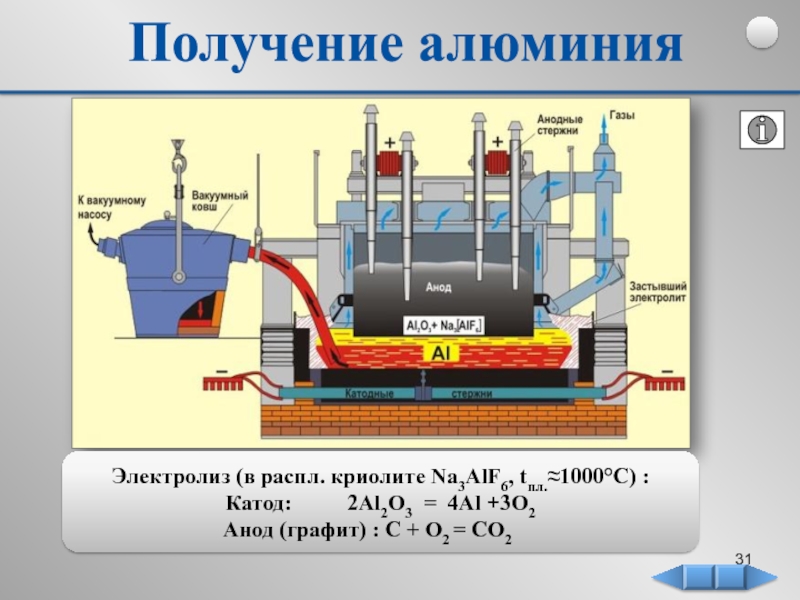
Слайд 30Получение алюминия
При промышленном производстве
бокситы сначала подвергают
химической переработке, удаляя
из них примеси оксидов кремния,
железа и других элементов и
получают чистый оксид алюминия
Al2O3 .
В электролизной ванне сначала расплавляют криолит Na3AlF6, он
понижает температуру плавления
боксита с 2044°C до 950°C.
Далее в этот расплав добавляют
немного Al2О3 (до 10% по массе).
Слайд 31Получение алюминия
Электролиз (в распл. криолите Na3AlF6, tпл.≈1000°С) :
Катод:
Анод (графит) : С + О2 = СО2





















![АмфотерностьВ расплаве щелочи2Al + 2NaOH + 6HOН 2Na[Al(OН)4] + 3H2В расплаве2Al + 2NaOH +](/img/tmb/4/350256/3bcafacf475c8ae4dfb36310ec3e7bb2-800x.jpg)



![ЗакреплениеAlAl2O3AlCl3Na[Al(OH)4]Al(OH)31357248](/img/tmb/4/350256/7b87e7f9b4c829cb7f70f01757cfed51-800x.jpg)





