- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы химической термодинамики и кинетики химических реакций презентация
Содержание
- 1. Основы химической термодинамики и кинетики химических реакций
- 2. Лекция № 1
- 3. Понятие о химической термодинамике Термодинамика –
- 4. Биоэнергетика изучает превращение энергии в биосистемах
- 6. Энергия солнечного излучения
- 7. 40 ккал Еда, 30 мин 30 ккал
- 8. Задача Потребность в энергии у студентов составляет
- 9. Термодинамическая система это тело или группа
- 10. Термодинамические параметры общие Функции состояния основные
- 11. Первый закон термодинамики Подведенное к системе тепло
- 12. Внутренняя энергия Е – сумма всех
- 13. Основной закон термохимии – закон Гесса.
- 14. Энтропия S – мера хаотичности, беспорядка
- 15. Энергия Гиббса G Изобарно-изотермический потенциал
- 16. Критерии самопроизвольности процесса ∆Н< 0 -
- 17. Термодинамическое равновесное состояние – постоянство свойств системы
- 18. Факторы, определяющие ход процесса
- 19. Сопряженные реакции Глюкоза+Фруктоза=Сахароза+Н2О +20,9кДж/моль,
- 20. Кинетика – учение о скоростях и механизмах химических реакций.
- 21. Скорость реакции число элементарных актов реакции, происходящих
- 22. Обратимые реакции протекают одновременно в прямую и
- 23. С уменьшением концентраций исходных веществ
- 24. Скорость химической реакции зависит от -
- 25. Влияние концентрации Закон Гульдберга и Вааге (1867)
- 26. для гетерогенной реакции Горение угля С +
- 27. Влияние давления Р СН
- 28. Влияние температуры. С увеличением Т скорость любой
- 29. Влияние катализатора Катализаторы - вещества, влияющие
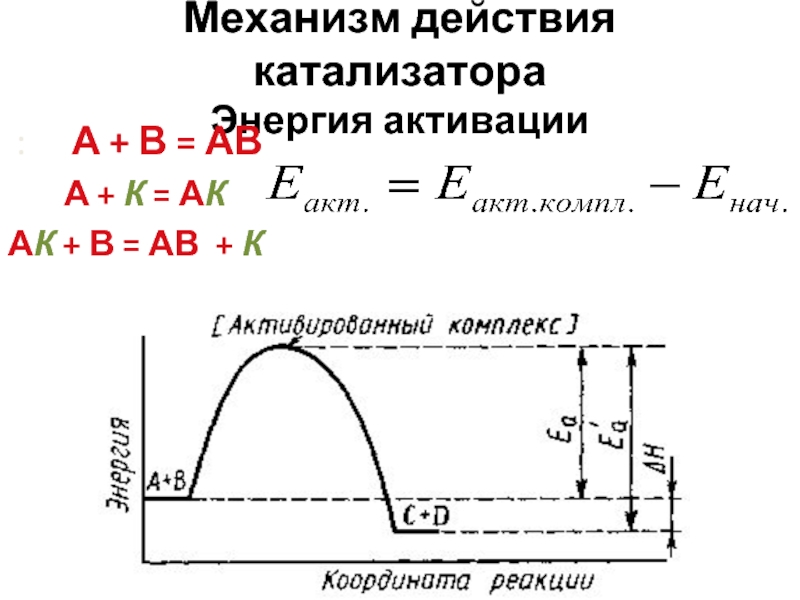
- 30. Механизм действия катализатора Энергия активации :
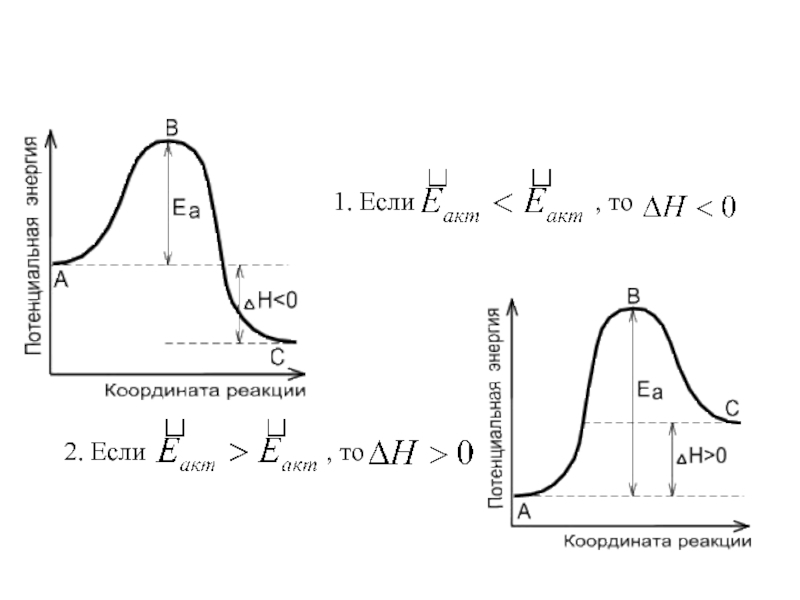
- 31. 1. Если
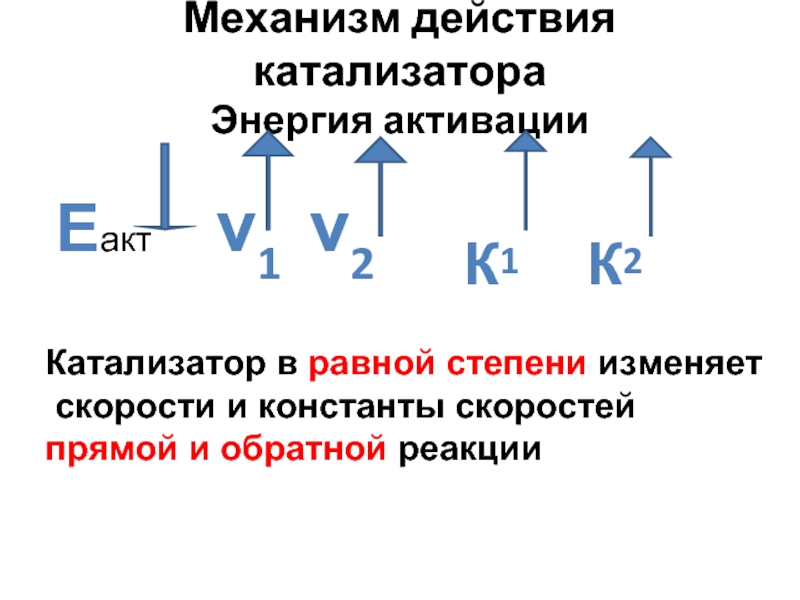
- 32. Механизм действия катализатора Энергия активации
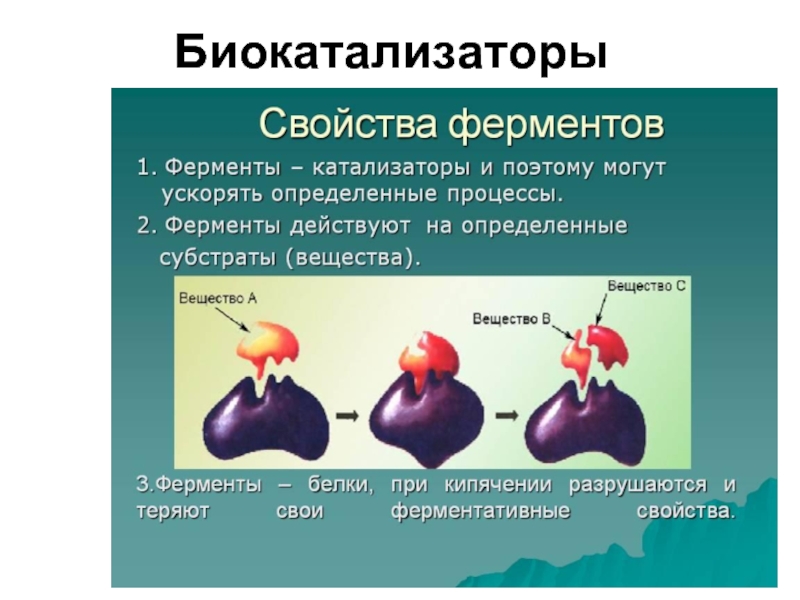
- 33. Биокатализаторы
- 34. Особенности ферментов как биокатализаторов Высокая эффективность действия;
- 36. Кинетические параметры: ν, k, Кравн.
- 37. Уравнение Аррениуса. где: k – константа скорости
- 38. Константа равновесия В условиях
- 39. природа реагирующих веществ; температура;
- 40. Принцип Ле - Шателье
- 41. Термодинамика химического равновесия связь Кравн. со
- 42. СПАСИБО ЗА ВНИМАНИЕ ПОЗДРАВЛЯЮ С ПОСТУПЛЕНИЕМ В ПСПБГМУ
Слайд 1ПСПбГМУ им. акад. И.П.Павлова
кафедра общей и биоорганической химии
дисцисплина
«ХИМИЯ»
12 лекций
Равновесия
Слайд 3Понятие о химической термодинамике
Термодинамика – наука, изучающая взаимные превращения различных
Химическая термодинамика – это раздел физической химии, изучающий превращения различных видов энергии в химических процессах
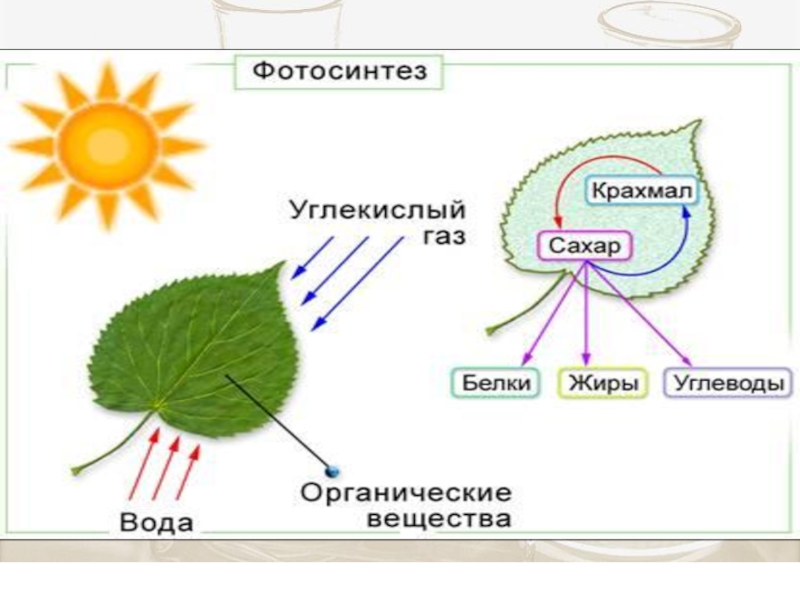
Слайд 4Биоэнергетика изучает превращение энергии в биосистемах
Энергия окисления пищевых продуктов, идет
Переход энергии в биосистеме в теплоту и работу осуществляется через образование промежуточных продуктов.
Калорийность – энергия, выделяемая при полном окислении 1г питательных веществ
Слайд 6
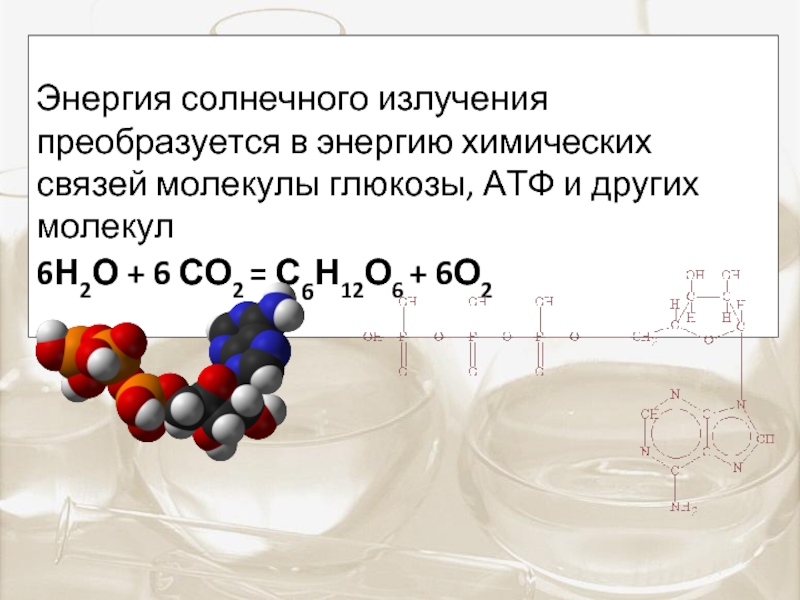
Энергия солнечного излучения преобразуется в энергию химических связей
6Н2О + 6 СО2 = С6Н12О6 + 6О2
Слайд 740 ккал
Еда, 30 мин
30 ккал
Ходьба, 10 мин
110 ккал
Работа, 1 час
70 ккал
Спуск,
180 ккал
Подъем, 10 мин
350 ккал
За рулем 2 ч
580 ккал
Сон, 8 ч
250 ккал
Мытье окон, 1ч
560 ккал
Уборка, 2 ч
270 ккал
Глажение, 1 ч
Слайд 8Задача
Потребность в энергии у студентов составляет 11732 кДж в сутки. Можно
белки – 97 г,
углеводы – 378 г,
жиры – 103 г.
калорийность рациона:
Углеводов = 16,7 кДж/г
Жиров = 37,7 кДж/г
Белков = 16,7 кДж/г
Слайд 9Термодинамическая система
это тело или группа тел, отделенные от окружающей среды
Однородная часть системы с одинаковыми химическими и термодинамическими свойствами, отделенная от других частей видимой поверхностью раздела, называется фазой.
Системы, состоящие только из одной фазы, называются гомогенными (однородными).
Системы, содержащие две или большее количество фаз, называются гетерогенными (неоднородными).
Слайд 10Термодинамические параметры
общие
Функции состояния
основные
давление (Р)
температура (Т)
объем (V)
измеряемые
Измеряются абсолютные значения
энтальпия (Н)
энтропия (S)
свободная энергия Гиббса (G)
неизмеряемые
Измеряются ∆H, ∆E, ∆G, ∆S
Слайд 11Первый закон термодинамики
Подведенное к системе тепло идет на увеличение внутренней энергии
Q = ∆Е + А
В изолированной системе сумма всех видов энергии есть величина постоянная
∆Е = 0 (в изолированной системе)
Слайд 12 Внутренняя энергия Е – сумма всех видов энергии частиц, составляющих
Энтальпия Н – теплосодержание системы.
Q = ∆Е + А
∆Н = ∆E + P∆V
Qр = ∆Н
Слайд 13 Основной закон термохимии – закон Гесса.
Тепловой эффект реакции не зависит
∆Н < 0 - экзотермическая реакция
∆Н> 0 - эндотермическая реакция
Слайд 14Энтропия S – мера хаотичности, беспорядка
Второй закон термодинамики:
В изолированных
∆ S > 0
Sт < Sж < Sгаз
Слайд 15Энергия Гиббса G
Изобарно-изотермический потенциал – максимальная полезная работа, совершаемая системой
∆G = ∆H - T ∆S
Слайд 16Критерии самопроизвольности процесса
∆Н< 0 - энтальпийный фактор
∆S> 0 – энтропийный фактор
∆G
∆G= 0 – термодинамическое равновесие
Слайд 17Термодинамическое равновесное состояние – постоянство свойств системы во времени, потоки вещества
Стационарное состояние - постоянство свойств системы во времени, которое поддерживается обменом веществом, энергией, информацией с окружающей средой (гомеостаз)
Слайд 19Сопряженные реакции
Глюкоза+Фруктоза=Сахароза+Н2О +20,9кДж/моль,
Эндергонический процесс ∆G > 0 ведомая
АTФ + Н2О = AДФ + Н3РО4 -30,4кДж/моль,
Экзергонический процесс ∆G< 0 ведущая реакция
Суммарное уравнение
АТФ + Глюкоза + Фруктоза = Сахароза + AДФ+ Н3РО4
-9,5кДж/моль ∆G< 0
Слайд 21Скорость реакции
число элементарных актов реакции, происходящих в единицу времени в единице
Слайд 22Обратимые реакции
протекают одновременно в прямую и обратную стороны
Необратимые реакции -
протекают
до полного израсходования исходных
продуктов
Слайд 23 С уменьшением концентраций исходных веществ скорость прямой реакции уменьшается,
Кинетическое равновесие: ν1 = ν2
Слайд 24Скорость химической реакции зависит от
- природы реагирующих веществ;
- концентрации;
- температуры;
-
- катализатора;
- площади соприкосновения в гетерогенных реакциях.
Слайд 25Влияние концентрации
Закон Гульдберга и Вааге (1867)
mA+nB=dD
,
где: k – константа скорости реакции;
– скорость реакции , моль/л*с;
С – молярные концентрации исходных веществ А и В (моль/л);
m и n – стехиометрические коэффициенты
Слайд 26для гетерогенной реакции
Горение угля С + О2 = СО2
ν
Константа скорости реакции (k) численно равна скорости реакции, когда концентрации реагирующих веществ равны единице (1 моль/л),
Слайд 28Влияние температуры.
С увеличением Т скорость любой реакции возрастает
Правило Вант – Гоффа
При
скорость реакции увеличивается в 2 – 4 раза
где: и – конечная и начальная температуры;
– температурный коэффициент реакции;
и – скорости реакции при и
Слайд 29Влияние катализатора
Катализаторы - вещества, влияющие на скорость протекания термодинамически возможных
Вещества, увеличивающие скорость протекания процесса, называют положительными катализаторами, а уменьшающие – отрицательными катализаторами (ингибиторами)
Слайд 32Механизм действия катализатора
Энергия активации
Еакт ν1
Катализатор в равной степени изменяет
скорости и константы скоростей
прямой и обратной реакции
Слайд 34Особенности ферментов как биокатализаторов
Высокая эффективность действия;
Избирательность (селективность);
Высокая чувствительность к условиям среды
Сложное строение (белковые структуры).
Слайд 36Кинетические параметры:
ν, k, Кравн.
Константа скорости реакции (k) зависит
природы реагирующих веществ;
температуры;
катализатора (Еакт.)
Слайд 37Уравнение Аррениуса.
где: k – константа скорости реакции;
R
Т – абсолютная температура Кельвина(К);
Еакт – энергия активации (Дж/моль)
А – предэкспоненциальный коэффициент, учитывающий вероятность и число столкновений;
е – основание натурального логарифма.
Слайд 38Константа равновесия
В условиях равновесия для любого обратимого гомогенного
mA + nB pC + qD
Константа равновесия зависит от:
природы реагирующих веществ;
температуры.
Слайд 39
природа реагирующих веществ;
температура;
Кравн.
k
- катализатор;
концентрация;
- давление (для газов);
V
Слайд 40
Принцип Ле - Шателье
Равновесие в системе всегда
На смещение влияют:
температура
концентрация
давление (для газов)
! Принцип Ле-Шателье не говорит об изменении скоростей, констант скоростей и константы равновесия !
Слайд 41Термодинамика химического равновесия
связь Кравн. со свободной энергией Гиббса:
термодинамическое равновесие
реакция не протекает























![для гетерогенной реакцииГорение угля С + О2 = СО2 ν = k[O2] Константа скорости](/img/tmb/1/39370/6ca0278336b2761c7ea89fbd8ec5b950-800x.jpg)