Лектор: Степанова Ирина Петровна
доктор биологических наук,
профессор, зав. кафедрой химии
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы химической термодинамики презентация
Содержание
- 1. Основы химической термодинамики
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ:
- 3. Термодинамика - это наука, изучающая взаимные превращения
- 4. Медико-биологическое значение темы
- 5. Термодинамика - теоретическая основа при
- 6. Медико-биологическое значение темы Термодинамический метод
- 7. Основные понятия и термины
- 8. Основные понятия химической термодинамики Часть объектов природы,
- 9. Открытая
- 10. Основные понятия химической термодинамики
- 11. Основные понятия химической термодинамики В зависимости от
- 12. Основные понятия химической термодинамики
- 13. Основные понятия химической термодинамики
- 14. Основные понятия химической термодинамики
- 15. Основные понятия химической термодинамики
- 16. Основные понятия химической термодинамики
- 17. Функции состояния системы В термодинамике для
- 18. Функции состояния системы К термодинамическим функциям системы
- 19. Функции состояния системы 1. Внутренняя
- 20. Внутренняя энергия (U): Абсолютное
- 21. Знак ΔU: (+)
- 22. Знак ΔU: (+)
- 23. Функции состояния системы ΔU=Q V , где
- 24. Единицы измерения энергии: Джоуль = Дж
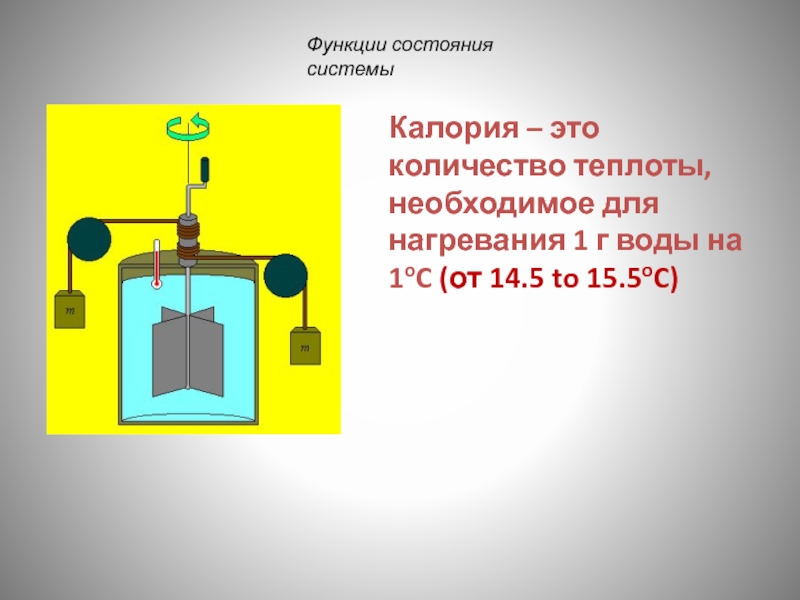
- 25. Калория – это количество теплоты, необходимое для
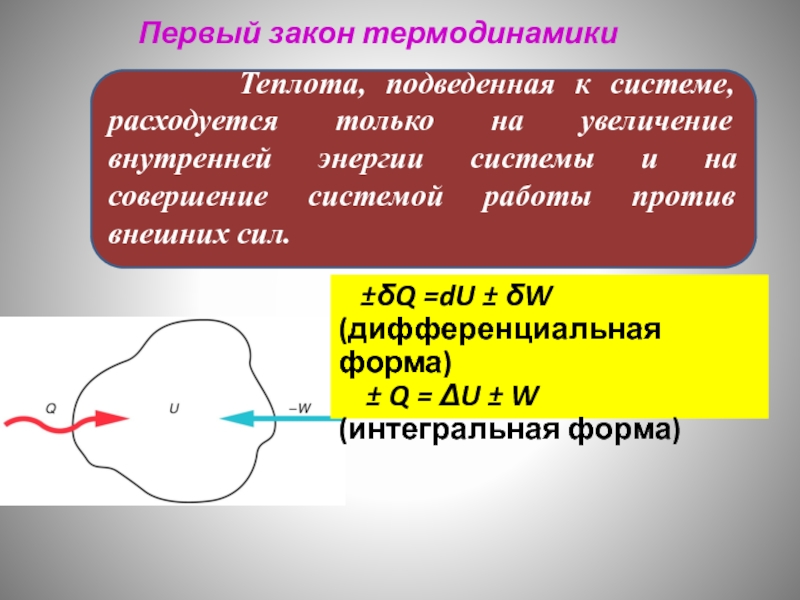
- 26. Первый закон термодинамики Первый закон термодинамики является
- 27. Первый закон термодинамики Химические процессы сопровождаются изменением энергии.
- 28. Первый закон термодинамики Является
- 29. Вечный двигатель первого рода невозможен (работа требует энергии). Первый закон термодинамики
- 30. Система получает теплоту за счет работы
- 31. Q0 Q>0 w
- 32. На что расходуется теплота, подведенная к системе?
- 33. Первый закон термодинамики Пример:
- 34. Первый закон термодинамики
- 35. Первый закон термодинамики
- 36. Первый закон термодинамики
- 37. Первый закон термодинамики
- 38. Первый закон термодинамики
- 39. Первый закон термодинамики
- 40. Первый закон термодинамики
- 41. Первый закон термодинамики
- 42. Первый закон термодинамики
- 43. Теплота и работа: приращение внутренней работы ±
- 44. В биологических системах
- 45. Первый закон термодинамики Теплота (Q)
- 46. Первый закон термодинамики Работа (W)
- 47. Падающий груз поворачивает лопасти
- 48. Пар, идущий из чайника,
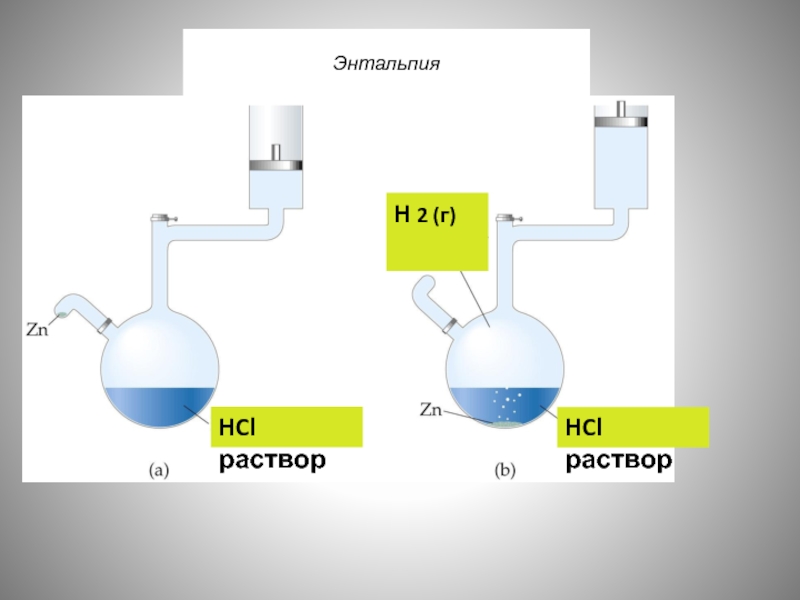
- 50. Энтальпия HCl раствор HCl раствор H 2 (г)
- 51. Функции состояния системы Из первого закона ТД:
- 52. Функции состояния системы Т.к. ΔН=Qр, =>
- 53. Эндотермический процесс, ΔН>0 Экзотермический процесс, ΔН
- 54. Энтальпия (H): Абсолютное значение
- 55. Энтропия (S) характеризует связанную
- 56. Функции состояния системы ΔS=Qmin/T, [Дж · моль-1
- 57. Функции состояния системы Энтропия связана
- 58. Чем выше энтропия, тем больше неупорядоченность системы.
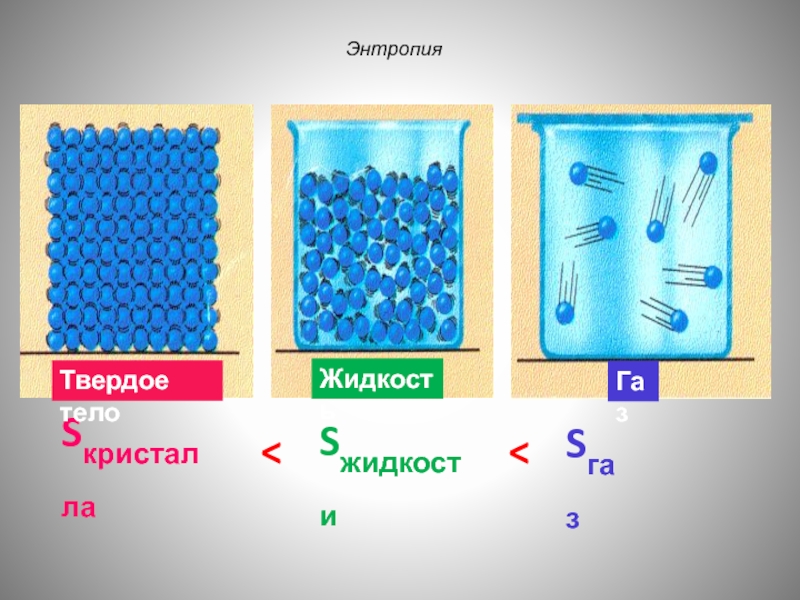
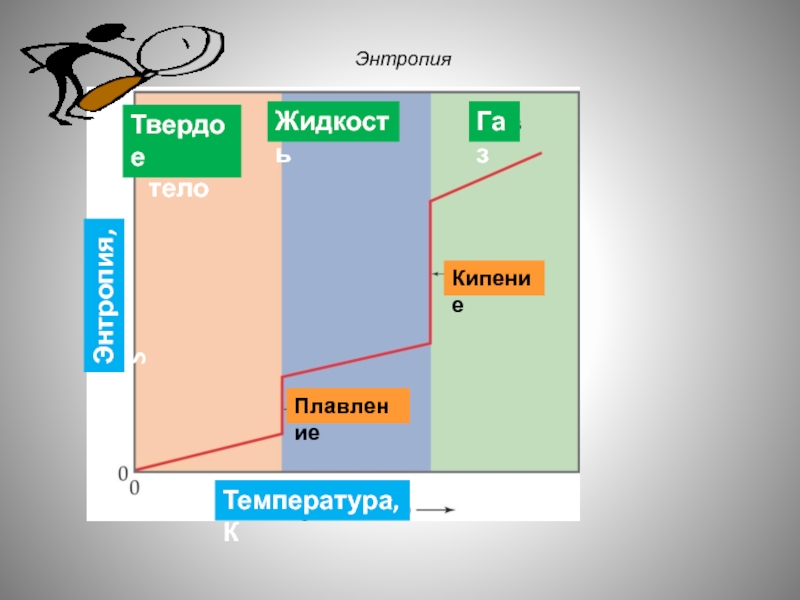
- 59. Энтропия Sкристалла Sжидкости Sгаз
- 60. Энтропия Энтропия, S Твердое тело Жидкость Газ Плавление Кипение Температура, К
- 61. Функции состояния системы Ростом энтропии ΔS>0
- 62. Как бы Вы описали объект, у которого
- 63. “Мама, это не моя вина… Это
- 64. Для изолированных систем
- 65. Приращение энтропии: 1.) Ag+(р-р)+ Cl-(р-р)→AgCl(к) 2.) NH4Cl(к)→
- 66. 4. Свободная энергия Гельмгольца ΔF = ΔU
- 67. Функции состояния системы При протекании
- 68. Функции состояния системы Анализ уравнения:
- 69. Функции состояния системы Величина ΔG
- 70. Влияние температуры на величину ΔG:
- 71. Функции состояния системы μ=G(x)/n(x),
- 72. Функции состояния системы
- 73. Вопросы для самоконтроля Что Вы понимаете
- 74. СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
- 75. Лекция 2 Термохимия. Второй
- 76. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ:
- 77. Раздел ТД, изучающий изменение энергии при
- 78. Основные понятия термохимии
- 79. Основные понятия термохимии Термохимическое уравнение - условное изображение физико-химического процесса.
- 80. Особенности термохимических уравнений: 1.
- 81. 1. Основные понятия термохимии
- 82. Основные понятия термохимии
- 83. Частным выражением 1-го
- 84. Приращение энтальпии (ΔH) ΔH = H2
- 85. Закон Гесса Например: Если С (т)
- 86. Приращение энтальпии (ΔH) В реакции: ΔH
- 87. Энергия выделяется ⇒ Экзотермическая реакция Реагенты Продукты
- 88. Энергия поглощается ⇒ Эндотермическая реакция Продукты Реагенты
- 89. Закон Гесса: Из первого закона термодинамики: ΔUсистема
- 90. Задача: Реакция происходит в присутствии катализатора MnO2:
- 91. Определите знак теплового эффекта процесса: Плавление льда? Кристаллизация воды ? Горение свечи? Взрыв динамита?
- 92. Закон Гесса Расчеты тепловых эффектов
- 93. Калори́метр (от лат. calor - тепло
- 94. Закон Гесса Энтальпия образования вещества (теплота образования)
- 95. Закон Гесса Энтальпия образования, измеренная
- 96. Первое следствие закона Гесса
- 97. CS2(к) + 3O2(г) → CO2(г)
- 98. CS2(к) + 3O2(г) → CO2(г)
- 99. Закон Гесса Для многих органических
- 100. Закон Гесса Энтальпия сгорания (теплота сгорания)
- 101. Закон Гесса Энтальпия сгорания,
- 102. ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж ·
- 103. Закон Гесса
- 104. Закон Гесса Закон Гесса и
- 105. Пищевая калорийность 1000 кал = 1 ккал
- 106. Пищевая калорийность
- 107. Закон Гесса Коэффициенты калорийности основных
- 108. Закон Гесса Для расчета калорийности пищевых
- 109. Закон Гесса
- 110. Закон Гесса На основании данных по калорийности
- 111. Закон Гесса Суточная потребность человека в
- 112. Второй закон термодинамики устанавливает направление
- 113. Второе начало термодинамики Существуют различные равнозначные по
- 114. Второе начало термодинамики
- 115. Второе начало термодинамики
- 116. Второе начало термодинамики
- 117. Второе начало термодинамики
- 118. Второе начало термодинамики
- 119. Второе начало термодинамики
- 120. У. Кельвин (1854): Никакая
- 121. Второе начало термодинамики В. Освальд (1888): Невозможен
- 122. Второе начало термодинамики Паровой двигатель
- 123. Второе начало термодинамики Больцман:
- 124. Второе начало термодинамики Для изолированной системы
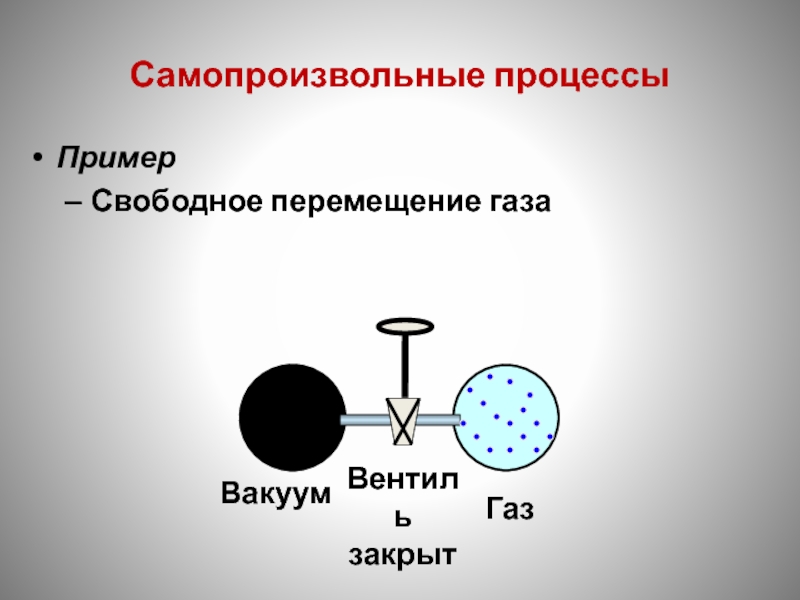
- 125. Самопроизвольные процессы Пример Свободное перемещение газа
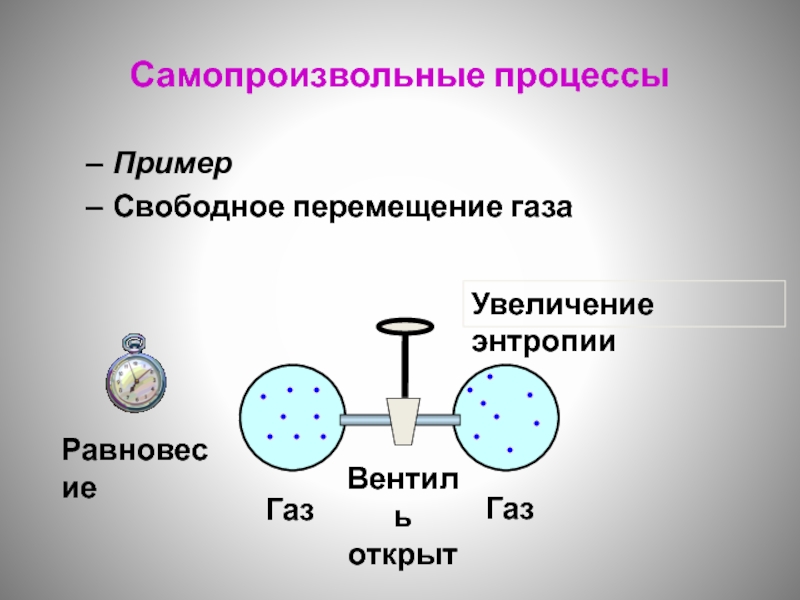
- 126. Самопроизвольные процессы Пример Свободное перемещение газа
- 127. Второе начало термодинамики
- 128. Второе начало термодинамики Для процессов,
- 129. Второе начало термодинамики В условиях постоянной температуры
- 130. Второе начало термодинамики Математическое выражение
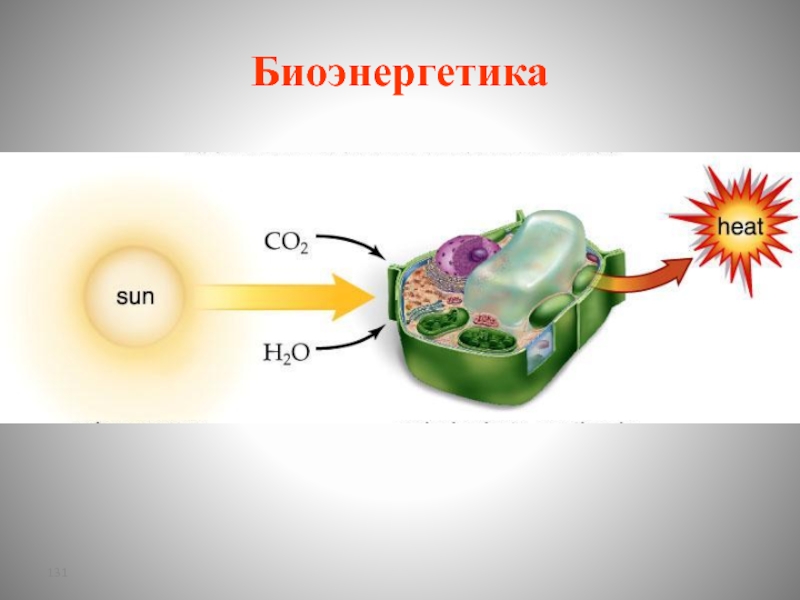
- 131. Биоэнергетика
- 132. Особенности организации живых систем:
- 133. Биоэнергетика Основным источником энергии
- 134. Биоэнергетика Химическая энергия также расходуется на совершение
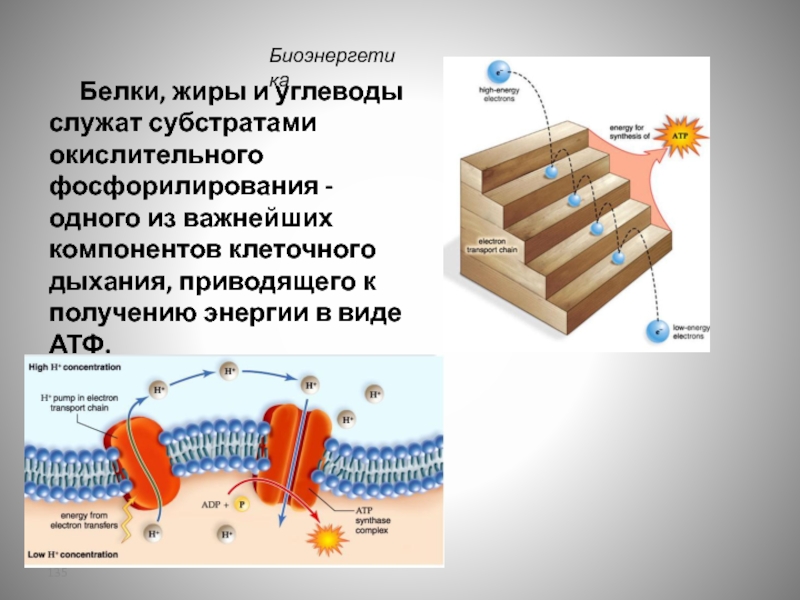
- 135. Белки, жиры и углеводы
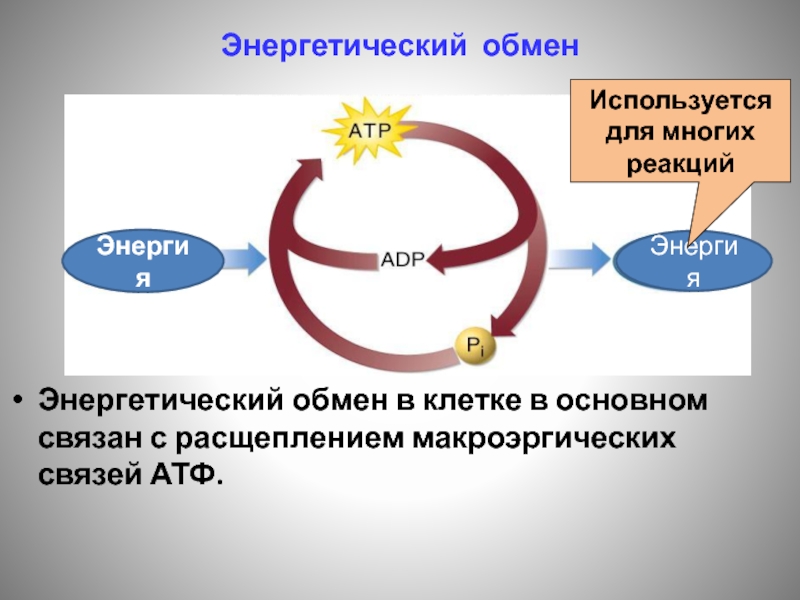
- 136. Энергетический обмен в клетке в основном связан
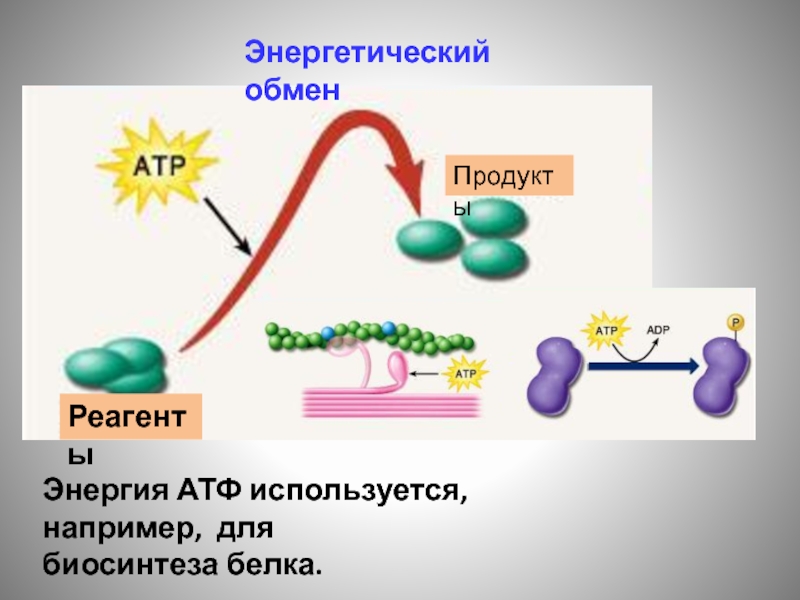
- 137. Энергетический обмен Энергия АТФ используется, например, для биосинтеза белка. Реагенты Продукты
- 138. Биоэнергетика Состояние открытой системы, для которой
- 139. Биоэнергетика В термодинамике открытых систем
- 140. Теорема Пригожина dS/dt = dS орг/dt
- 141. Биоэнергетика Производство энтропии возрастает
- 142. Вопросы для самоконтроля В чем состоят
- 143. СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
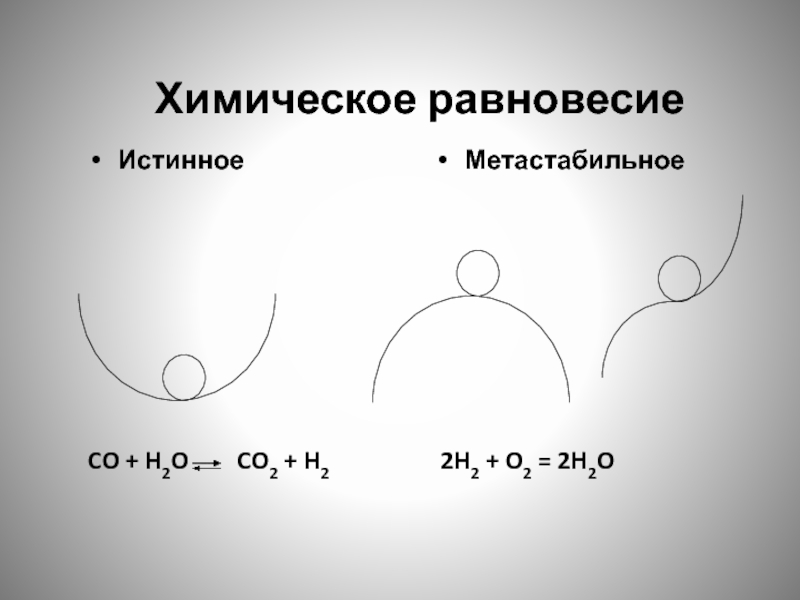
- 144. Химическое равновесие
- 145. Равновесное состояние - такое состояние системы, когда
- 146. Химическое равновесие Истинное
- 147. Термодинамика химического равновесия Состояние химического равновесия характеризуют
- 148. Закон действующих масс (гомогенные системы) aA +
- 149. Термодинамика химического равновесия Константа химического
- 150. Сдвиг химического равновесия Анри Луи Ле Шателье
- 151. Влияние температуры Реакция эндотермическая – Q, ΔH
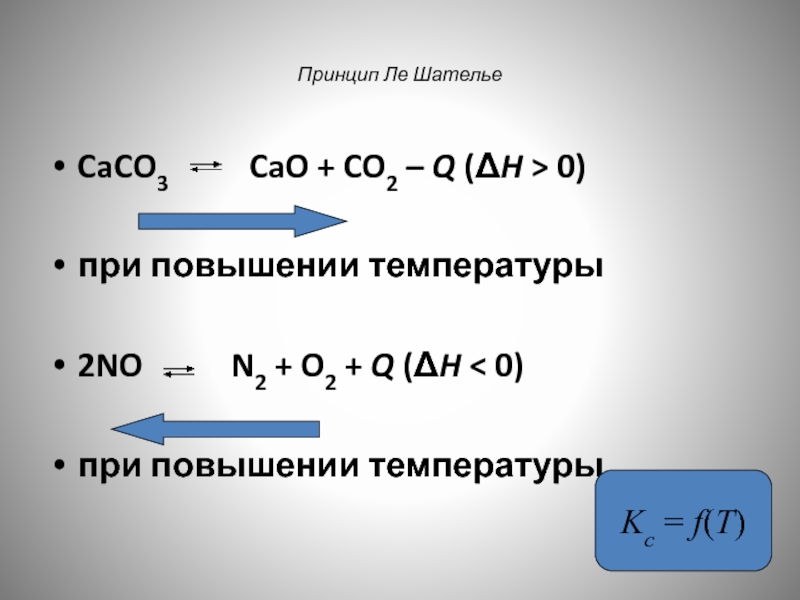
- 152. Принцип Ле Шателье CaCO3
- 153. Влияние концентрации Введение реагента Удаление реагента
- 154. Принцип Ле Шателье 2SO2
- 155. Влияние давления aA + bB
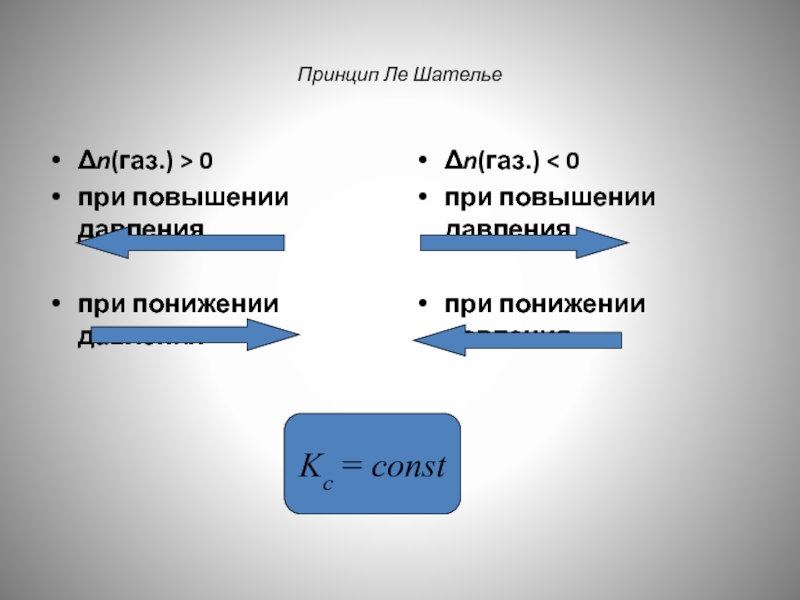
- 156. Принцип Ле Шателье Δn(газ.) > 0 при
- 157. Влияние давления N2 + 3H2
- 158. Принцип Ле Шателье Катализатор не влияет на
- 159. Термодинамика химического равновесия Направление
- 160. Термодинамика химического равновесия Пс
- 161. Термодинамика химического равновесия Анализ
- 162. Спасибо за Ваше внимание!
Слайд 1
Лекция 1
Основы химической термодинамики
Основные понятия химической термодинамики.
Функции состояния системы.
Первый закон термодинамики.
ОМСКАЯ
Слайд 2 ЦЕЛИ ЛЕКЦИИ
ОБУЧАЮЩАЯ: сформировать знания об основах химической
РАЗВИВАЮЩАЯ: расширить кругозор обучающихся на основе интеграции знаний, развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию у обучающихся устойчивого интереса к изучению дисциплины.
Слайд 3Термодинамика - это наука, изучающая взаимные превращения различных видов энергии, связанные
Основные понятия химической термодинамики
Слайд 5 Термодинамика - теоретическая основа при осуществлении химического и биологического
Медико-биологическое значение темы
Слайд 6Медико-биологическое значение темы
Термодинамический метод исследования является одним из наиболее
Превращения энергии, происходящие в живых организмах, являются предметом биоэнергетики.
Слайд 7Основные понятия и термины
Термодинамическая система (ТД система) -
Слайд 8Основные понятия химической термодинамики
Часть объектов природы, не входящих в систему, называется
Важными характеристиками системы являются масса вещества (m) и энергия (Е или U).
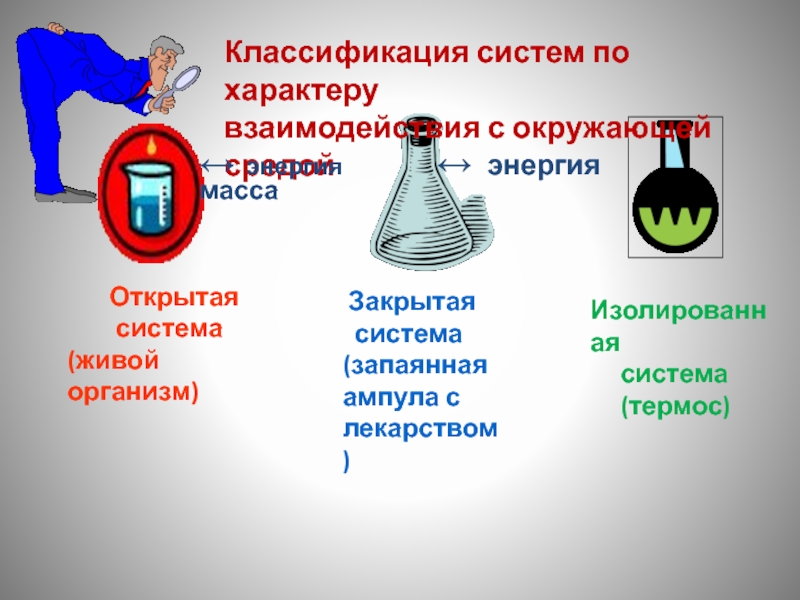
Слайд 9 Открытая
система
(живой организм)
система
(запаянная ампула с лекарством)
Изолированная
система
(термос)
Классификация систем по характеру
взаимодействия с окружающей средой
↔ энергия ↔ энергия масса
Слайд 10Основные понятия химической термодинамики
Фаза - это часть системы
Слайд 11Основные понятия химической термодинамики
В зависимости от фазового состояния различают:
2. Гетерогенные системы. Они состоят из нескольких фаз, отделенных границей раздела. Пример: эритроциты - плазма крови, живой организм.
Слайд 12Основные понятия химической термодинамики
Термодинамическое состояние системы - совокупность
Для термодинамики особое значение имеет равновесное состояние системы - постоянство всех свойств в любой точке системы и отсутствие потоков массы и энергии в системе.
Слайд 14Основные понятия химической термодинамики
Термодинамические параметры называются стандартными, если
К стандартным условиям относят:
t=250С или
Т= (t0С +273) = 298 К
р= 101,3 кПа = 1 атм
С(х) = 1 моль · дм-3
Слайд 15Основные понятия химической термодинамики
Термодинамический процесс - переход системы
одного равновесного состояния в другое,
сопровождающийся изменением хотя бы одного
термодинамического параметра.
Слайд 16Основные понятия химической термодинамики
В зависимости от того, какой
изотермический (Т = const),
изобарный (р = const),
изохорный (V = const),
адиабатический (Q= const).
Слайд 17Функции состояния системы
В термодинамике для определения изменения энергии системы пользуются различными
Слайд 18Функции состояния системы
К термодинамическим функциям системы относятся:
1. Внутренняя энергия
2. Энтальпия (Н).
3. Энтропия (S).
4. Энергия Гельмгольца (F).
5. Энергия Гиббса (свободная энергия) (G).
6. Химический потенциал (μ).
Слайд 19Функции состояния системы
1. Внутренняя энергия (U)
Внутренняя энергия
Слайд 20Внутренняя энергия (U):
Абсолютное значение внутренней энергии измерить
невозможно,
ΔUсистемы = Uкон - Uнач
Бесконечно малое изменение U является полным дифференциалом dU.
Слайд 21Знак ΔU:
(+) значения: система получила энергию;
2H2O(г) → 2H2(г) + O2(г)
2H2(г) + O2(г) → 2H2O(г)
Внутренняя энергия U
ΔU< 0
ΔU>0
H2 (г), O2 (г)
H2O (г)
Слайд 22Знак ΔU:
(+) значения: система получила энергию;
2H2O(г) → 2H2(г) + O2(г)
2H2(г) + O2(г) → 2H2O(г)
+ энергия
(выделяется)
- энергия (поглощается)
Внутренняя энергия U
ΔU< 0
ΔU>0
H2 (г), O2 (г)
H2O (г)
Слайд 23Функции состояния системы
ΔU=Q V , где Q V - теплота изохорного
ΔU - кДж/моль или кДж· моль-1
Внутренняя энергия есть функция состояния системы, приращение которой (ΔU) равно теплоте, поступающей в систему при изохорном процессе (ΔV=const).
Слайд 24Единицы измерения энергии:
Джоуль = Дж
Так как Дж
обычно используют кДж.
калория = кал 1 кал = 4.184 Дж
1 кал
4.184 Дж
Коэффициент пересчета!
Слайд 25Калория – это количество теплоты, необходимое для нагревания 1 г воды
Функции состояния системы
Слайд 26Первый закон термодинамики
Первый закон термодинамики является постулатом: он не может быть
Большая роль в обобщении эмпирического опыта при открытии закона принадлежит Г.К. Гессу, Р. Майеру, Джоулю, Гельмгольцу.
Слайд 28Первый закон термодинамики
Является количественным выражением всеобщего закона природы
Слайд 29Вечный двигатель первого рода невозможен (работа требует энергии).
Первый закон термодинамики
Слайд 30
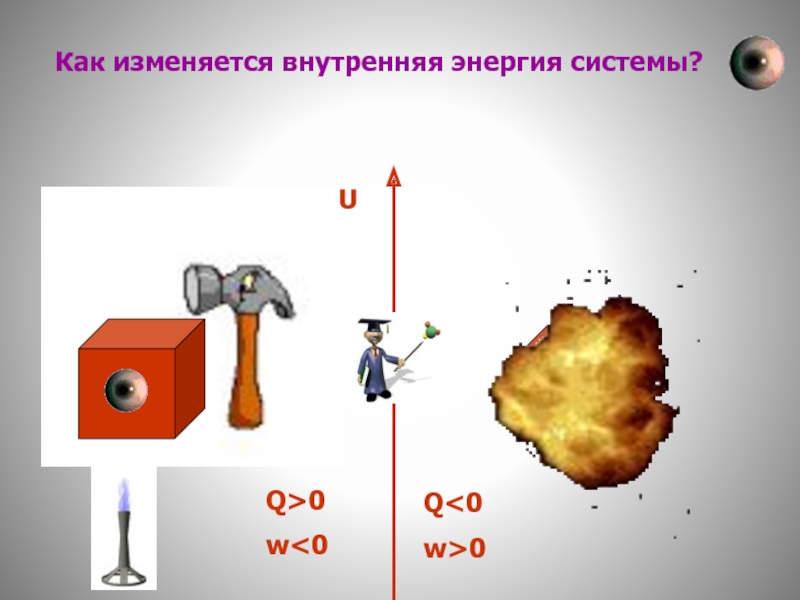
Система получает теплоту за счет работы внешних сил.
Система теряет теплоту за
Q>0
w<0
Q<0
w>0
Первый закон термодинамики
Слайд 33
Первый закон термодинамики
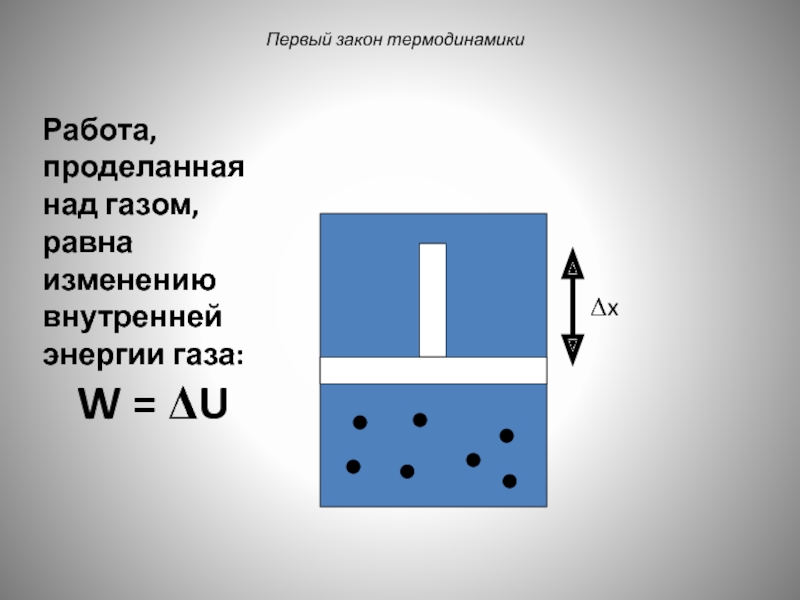
Пример:
Первая ситуация: идеальный газ находится в изолированном цилиндре с
Слайд 35Первый закон термодинамики
Если цилиндр изолирован, температура будет расти, атомы будут двигаться
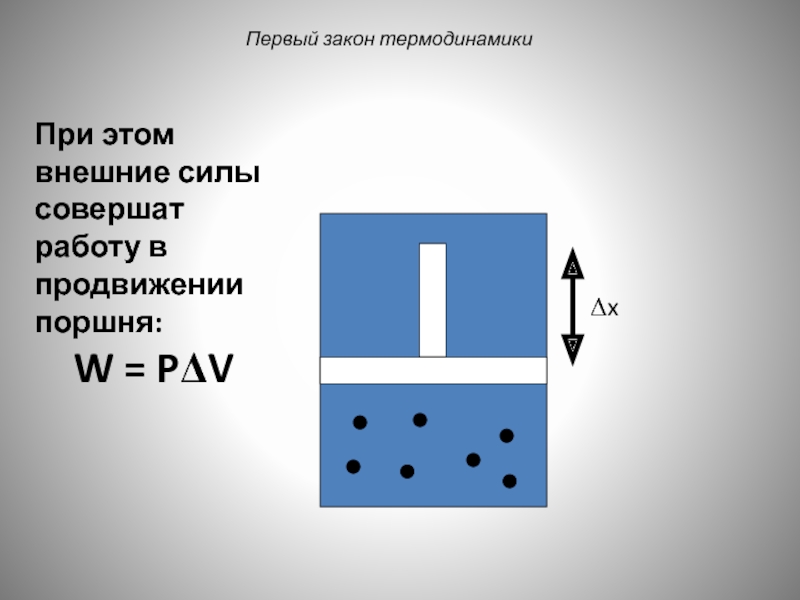
Слайд 36Первый закон термодинамики
Δx
При этом внешние силы совершат работу в продвижении поршня:
Слайд 37
Первый закон термодинамики
Δx
Работа, проделанная над газом, равна изменению внутренней энергии газа:
Слайд 38
Первый закон термодинамики
Вторая ситуация:
цилиндр помещен на горячую плиту.
Что произойдет с газом?
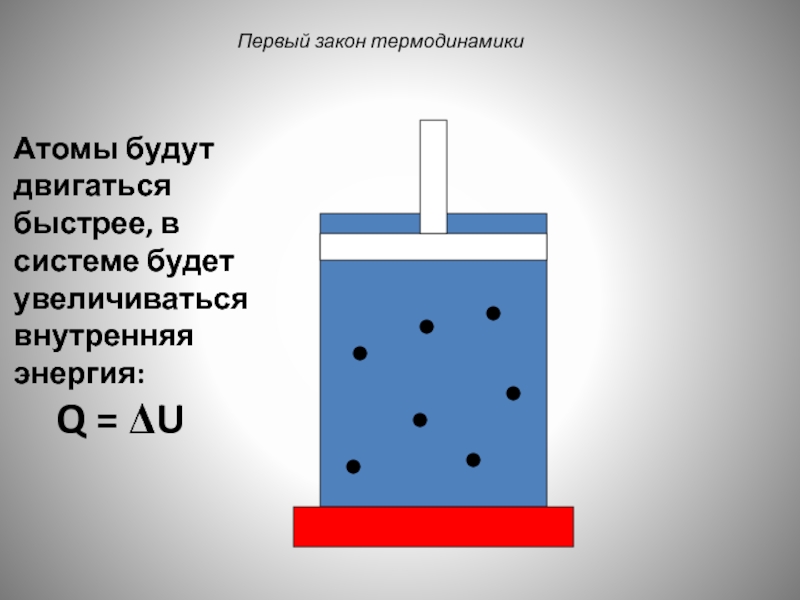
Слайд 39
Первый закон термодинамики
Атомы будут двигаться быстрее, в системе будет увеличиваться внутренняя
Q = ΔU
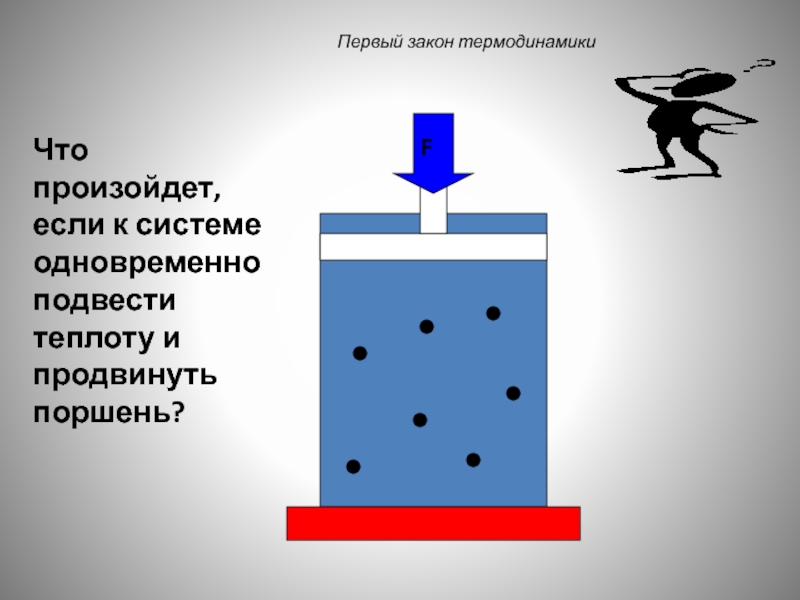
Слайд 40
Первый закон термодинамики
F
Что произойдет, если к системе одновременно подвести теплоту и
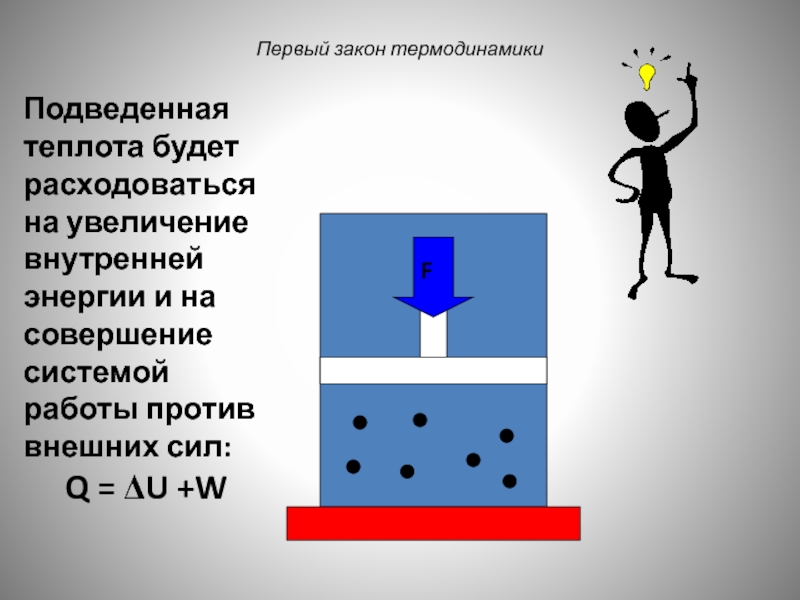
Слайд 41
Первый закон термодинамики
F
Подведенная теплота будет расходоваться на увеличение внутренней энергии и
Q = ΔU +W
Слайд 42Первый закон термодинамики
Теплота, подведенная к системе, расходуется
±δQ =dU ± δW (дифференциальная форма)
± Q = ΔU ± W (интегральная форма)
Слайд 43Теплота и работа: приращение внутренней работы
± Q = ΔU ± W
или (-) над системой.
Теплота получаемая (+)
или отданная (-) системой.
Внутренняя энергия система
Слайд 44 В биологических системах теплота обычно отдается системой
- Q = ΔU - W.
Первый закон термодинамики
Слайд 45Первый закон термодинамики
Теплота (Q) - форма передачи энергии, посредством
Q = С·ΔT [Дж], где
С - молярная теплоемкость [Дж моль/К].
Слайд 46Первый закон термодинамики
Работа (W) - форма передачи энергии от
Простейшей работой является работа расширения идеального газа в цилиндре с поршнем (открытая система): W = р ΔV.
Слайд 47 Падающий груз поворачивает лопасти вертушки в изолированном стакане
Первый закон термодинамики
Слайд 48 Пар, идущий из чайника, заставляет вертушку крутиться в
Первый закон термодинамики
Слайд 49
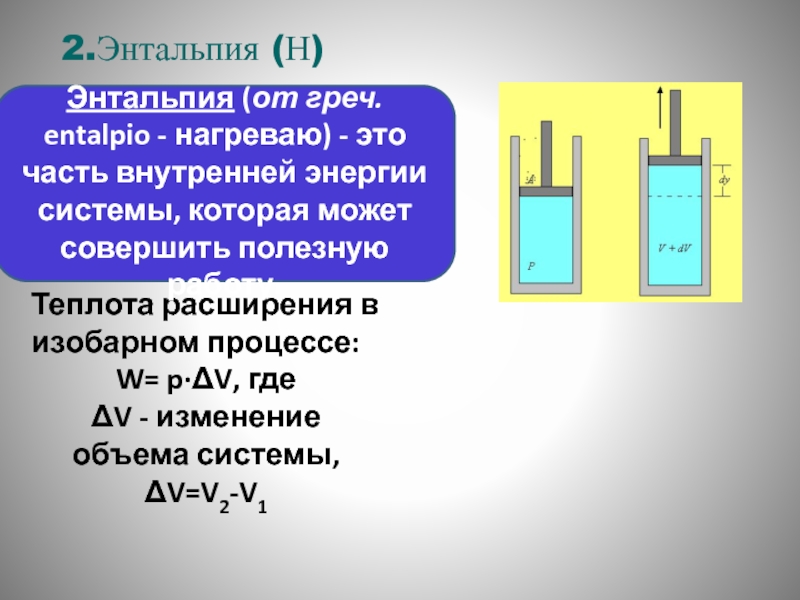
Теплота расширения в изобарном процессе:
W= p·ΔV, где
ΔV - изменение объема
Энтальпия (от греч. entalpio - нагреваю) - это часть внутренней энергии системы, которая может совершить полезную работу.
2.Энтальпия (Н)
Слайд 51Функции состояния системы
Из первого закона ТД:
Q = ΔU + W
Qр =
Qр - теплота изобарного процесса при р=const;
U + р·V = Н, т. е. энтальпия,
=> Qр=Н2-Н1=ΔН, т.е. ΔН=Qр
Слайд 52Функции состояния системы
Т.к. ΔН=Qр, => ΔН = ΔU + р·ΔV
Энтальпию часто называют «тепловой функцией» или «теплосодержанием» системы.
Энтальпия - это функция состояния системы, приращение которой равно теплоте, поступившей в систему в изобарном процессе.
Слайд 54Энтальпия (H):
Абсолютное значение энтальпии измерить
невозможно, поэтому измеряют
ΔHсистемы = Hкон - Hнач
ΔН = Ср ΔТ
Слайд 55 Энтропия (S) характеризует связанную энергию. В реальных необратимых
3. Энтропия (S)
Слайд 56Функции состояния системы
ΔS=Qmin/T, [Дж · моль-1 · К-1].
Энтропия (по Клаузиусу) - функция состояния система, приращение которой (ΔS) равно минимальной теплоте (Qmin), поступившей в систему в обратимом изотермическом процессе, деленной на абсолютную температуру (Т), при которой совершается этот процесс.
Слайд 57Функции состояния системы
Энтропия связана с вероятностью состояния системы уравнением
S=КБ · InW, где
KБ-постоянная Больцмана,
KБ = R/Nа= 1,38· 10-23 Дж· К-1;
W-вероятность состояния системы, т.е. число микросостояний, которым может быть реализовано данное макросостояние.
Опытным путем определяют приращение энтропии: ΔS = S2 – S1.
Слайд 61Функции состояния системы
Ростом энтропии ΔS>0 сопровождаются такие самопроизвольные процессы, как
Снижением энтропии ΔS<0 сопровождаются процессы кристаллизации веществ, реакции полимеризации, поликонденсации, т.е. процессы, которые приводят к увеличению упорядоченности в системе.
Слайд 62Как бы Вы описали объект, у которого S=0?
0 K
Абсолютно твердый кристалл
Чисто теоретически
Невозможно достигнуть абсолютного нуля!
Слайд 63
“Мама, это не моя вина…
Это Вселенная хочет, чтобы моя
комната выглядела
Энтропия Вселенной всегда возрастает!
Слайд 64 Для изолированных систем
является
Самопроизвольный процесс
Обратный процесс
Состояние равновесия
ΔS>0
ΔS<0
ΔS=0
энтропия
критерием
Слайд 65Приращение энтропии:
1.) Ag+(р-р)+ Cl-(р-р)→AgCl(к)
2.) NH4Cl(к)→ NH3(г)+ HCl(г)
3.) H2(г) + Br2(г)→2HBr(г)
1)ΔS
2)ΔS > 0
3)ΔS?
Слайд 664. Свободная энергия Гельмгольца
ΔF = ΔU - TΔS
Свободная энергия Гельмгольца -термодинамический
Слайд 67Функции состояния системы
При протекании изобарно-изотермических процессов:
5. Свободная энергия Гиббса
Энергия Гиббса (G) - это часть потенциальной энергии реагирующих веществ, которая может быть использована для осуществления полезной работы.
ΔG = ΔH - TΔS
Слайд 68Функции состояния системы
Анализ уравнения:
1 Энтальпийный фактор ΔH.
2 Энтропийный фактор TΔS. Определяет стремление системы к хаотичному неупорядоченному состоянию за счет распада сложных частиц на более простые и распределению их по всему объему системы.
Слайд 69Функции состояния системы
Величина ΔG служит критерием возможности самопроизвольного протекания
Процесс протекает самопроизвольно, если ΔG<0.
При ΔG>0, процесс самопроизвольно не протекает.
Если ΔG=0, то в системе установилось состояние равновесия.
Слайд 70
Влияние температуры на величину ΔG:
1. При ΔН>0 , ΔS>0 , процесс
2. При ΔН>0, ΔS<0 , процесс самопроизвольно не протекает ни при каких температурах.
3. При ΔН<0, ΔS>0, процесс самопроизвольно протекает при любых температурах.
4. При ΔН<0, ΔS<0, процесс самопроизвольно протекает только при низких температурах.
Слайд 71Функции состояния системы
μ=G(x)/n(x), отсюда G(х)=n(х)·μ(х).
Если система
6. Химический потенциал(μ)
Химический потенциал какого-либо вещества в системе равен отношению энергии Гиббса (G) к количеству вещества (n).
Слайд 72Функции состояния системы
Для вещества, находящегося в растворе,
Уравнением изотермы:
μ(x) = μ0(x) + R·T ·In C(x), где
μ(x)- химический потенциал [Дж · моль-1];
μ0(x)- стандартный химический потенциал;
С(x) - молярная концентрация вещества x [моль · дм-3].
С увеличением концентрации вещества в системе μ увеличивается, т.е. ∆ μ(х)>0, а с уменьшением -снижается, т.е. ∆ μ(х)<0.
Слайд 73Вопросы для самоконтроля
Что Вы понимаете под термодинамической системой?
Охарактеризуйте термодинамические функции состояния
Сформулируйте первый закон термодинамики.
Слайд 75
Лекция 2
Термохимия. Второй закон термодинамики. Химическое равновесие
Основные понятия.
Закон Гесса
Второй закон термодинамики.
Химическое равновесие.
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ХИМИИ
Лектор: Степанова Ирина Петровна
доктор биологических наук,
профессор, зав. кафедрой химии
Слайд 76 ЦЕЛИ ЛЕКЦИИ
ОБУЧАЮЩАЯ: сформировать знания об основах химической
РАЗВИВАЮЩАЯ: расширить кругозор обучающихся на основе интеграции знаний, развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию у обучающихся устойчивого интереса к изучению дисциплины.
Слайд 77Раздел ТД, изучающий изменение
энергии при протекании химических
процессов, называется химической
Термохимия
Слайд 78 Основные понятия термохимии
Химическая реакция как термодинамический
Для физико-химических процессов действует закон сохранения массы, установленный М.В. Ломоносовым (m1 = m2).
Слайд 79Основные понятия термохимии
Термохимическое уравнение - условное изображение физико-химического процесса.
Слайд 80
Особенности термохимических уравнений:
1. Уравнения записываются с учетом ТД функций состояния
2. Учитывается 1 моль вещества, поэтому возможны дробные коэффициенты.
3. Указываются агрегатные состояния веществ.
4. С ТХ уравнениями могут производиться обычные алгебраические действия.
Пример: ½ N2(г)+ ½ O2(г)= NO(г),ΔH>0.
Слайд 811. Основные понятия термохимии
Тепловой эффект (Q, кДж·моль-1
Если процесс проводится в автоклаве (V=const) тепловой эффект равен приращению внутренней энергии: Qv = ΔU.
Eсли процесс проводится в открытой системе (р = const) тепловой эффект равен приращению энтальпии: Qp = ΔН.
Слайд 82Основные понятия термохимии
Стандартный тепловой эффект - теплота
При этом твердые и жидкие вещества находятся в устойчивой модификации, газы близки к состоянию идеального газа.
Стандартные тепловые эффекты экспериментально определены и приводятся в специальных справочниках.
Слайд 83 Частным выражением 1-го начала термодинамики применительно к
Приращение энтальпии (тепловой эффект) химического процесса в изобарно-изотермических условиях зависит только от природы и состояния реагентов и продуктов реакции и не зависит от пути протекания реакции.
Закон Гесса
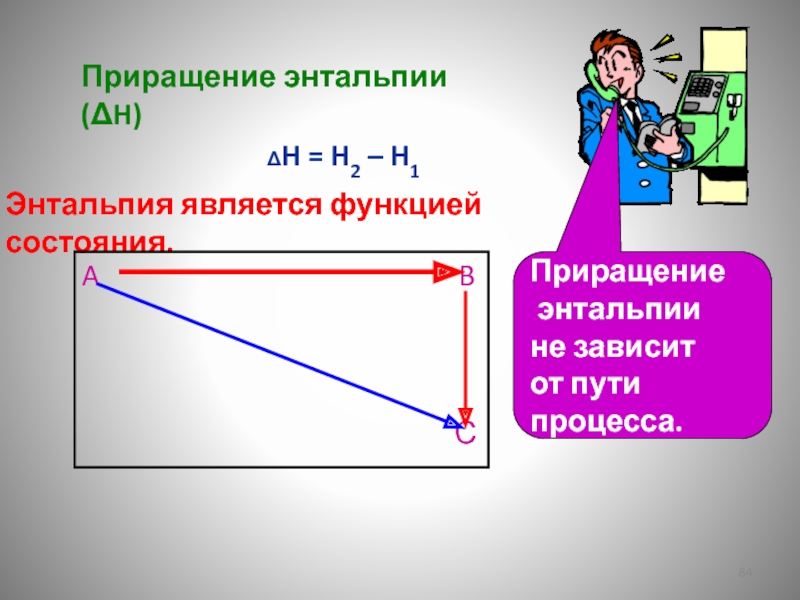
Слайд 84Приращение энтальпии (ΔH)
ΔH = H2 – H1
Энтальпия является функцией состояния.
A B
С
Приращение
энтальпии
не зависит
от пути
процесса.
Слайд 85Закон Гесса
Например: Если
С (т) + О2 (г) = СО2 (г),
или провести процесс по этапам:
С (т) + 1/2О2 (г) = СО (г), ΔН2;
СО (г) + 1/2О2 (г) = СО2 (г), ΔН3,
то
ΔН1 = ΔН2 + ΔН3.
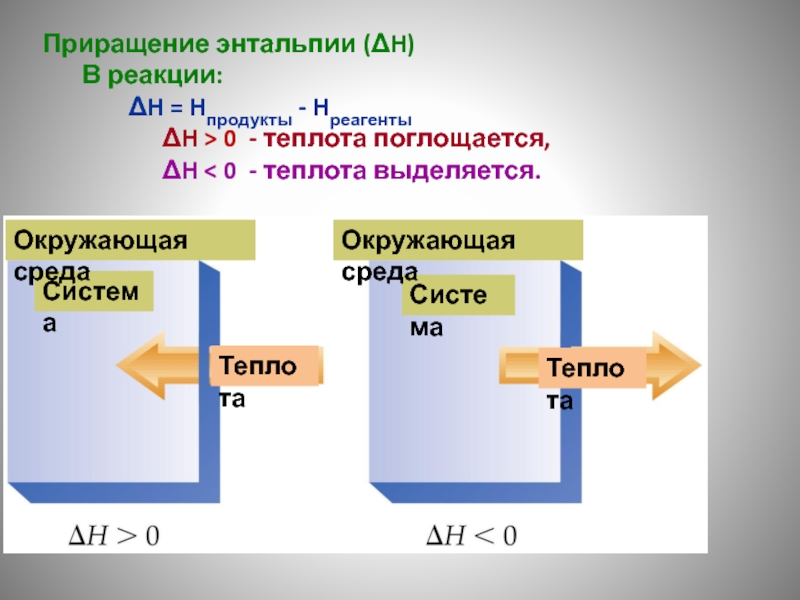
Слайд 86Приращение энтальпии (ΔH)
В реакции:
ΔH = Hпродукты - Hреагенты
ΔH > 0
ΔH < 0 - теплота выделяется.
Система
Система
Окружающая среда
Окружающая среда
Теплота
Теплота
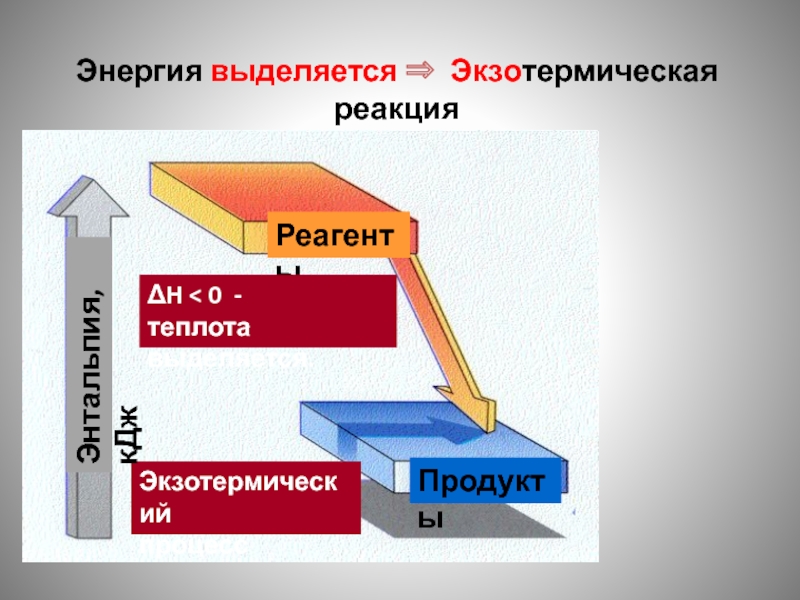
Слайд 87Энергия выделяется ⇒ Экзотермическая реакция
Реагенты
Продукты
Экзотермический
процесс
ΔH < 0 -
теплота выделяется.
Энтальпия,
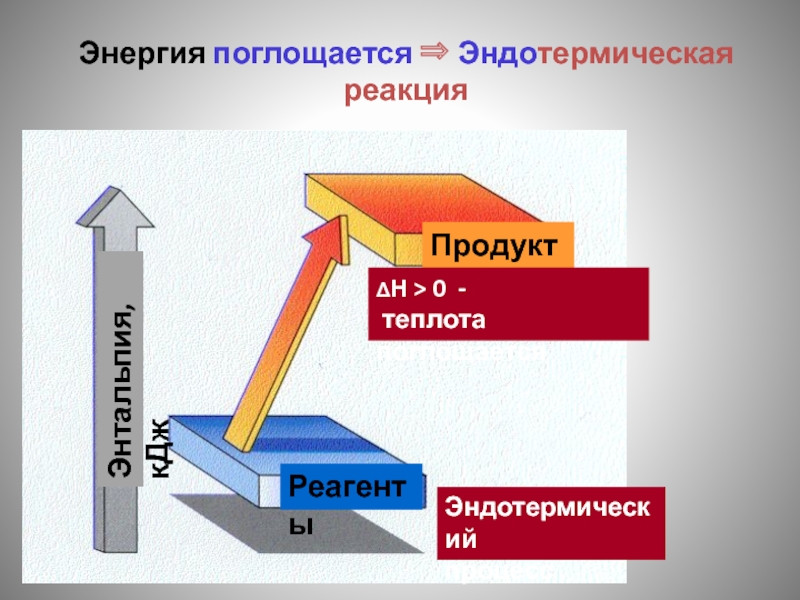
Слайд 88Энергия поглощается ⇒ Эндотермическая реакция
Продукты
Реагенты
Эндотермический
процесс
ΔH > 0 -
теплота поглощается
Энтальпия,
Слайд 89Закон Гесса:
Из первого закона термодинамики:
ΔUсистема = -ΔUсреда
Каждому экзотермическому
соответствует эндотермический процесс.
Слайд 90Задача:
Реакция происходит в присутствии катализатора MnO2:
2KClO3(к) → 2KCl(к) + 3O2(г)
Какой знак имеет ΔH обратной реакции?
+89.7 кД
Слайд 91Определите знак теплового эффекта процесса:
Плавление льда?
Кристаллизация воды ?
Горение свечи?
Взрыв динамита?
Слайд 92Закон Гесса
Расчеты тепловых эффектов реакций (ΔН0х.р.) по термохимическим уравнениям
Слайд 93
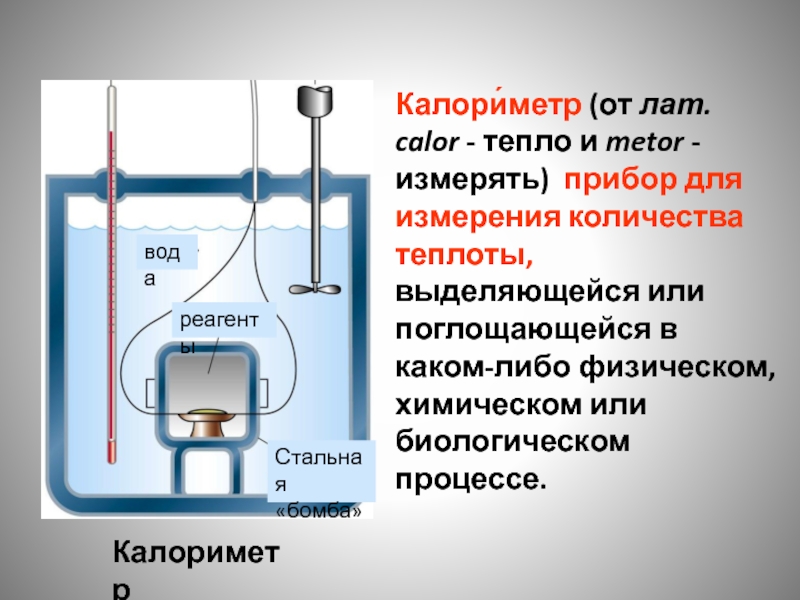
Калори́метр (от лат. calor - тепло и metor - измерять) прибор
Калориметр
вода
реагенты
Стальная
«бомба»
Слайд 94Закон Гесса
Энтальпия образования вещества (теплота образования) – это тепловой эффект реакции
ΔНобр(Х) [кДж · моль-1].
Калориметр
Слайд 95Закон Гесса
Энтальпия образования, измеренная при стандартных условиях, называется стандартной
ΔН0обр(Х) [кДж · моль-1].
Для простых веществ стандартная энтальпия образования = 0.
ΔН0обр(простых веществ) = 0
Слайд 96
Первое следствие закона Гесса
ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реагент),
ΔН0проц.[кДж ·моль-1].
Тепловой эффект
Слайд 97CS2(к) + 3O2(г) → CO2(г) + 2SO2(г)
ΔН0обр:
Каждое значение ΔН0 должно быть
умножено на количество моль
вещества в уравнении.
Слайд 98CS2(к) + 3O2(г) → CO2(г) + 2SO2(г)
ΔН0обр:
ΔН0проц.= ∑nΔН0обр(прод.) - ∑nΔН0обр(реаг.)
ΔН0х.р. = [-393.5 + 2(-296.8)] - [87.9 + 3(0)]
ΔН0х.р. = -1073.4 кДж
Слайд 99Закон Гесса
Для многих органических соединений невозможно одновременно синтезировать сложное
Слайд 100Закон Гесса
Энтальпия сгорания (теплота сгорания) – тепловой эффект реакции сгорания 1
ΔHсгор.(Х) [кДж · моль-1].
Калориметр
Слайд 101Закон Гесса
Энтальпия сгорания, измеренная при стандартных условиях, называется
обозначается ΔН0сгор.(Х) [кДж · моль-1].
Энтальпии сгорания высших оксидов равны 0.
Слайд 102
ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1]
Второе следствие закона Гесса:
Тепловой эффект
Слайд 103Закон Гесса
Задача 2.
реакции спиртового брожения глюкозы, исходя из стандартных энтальпий сгорания:
С6Н12О6 (к) = 2С2Н5ОН(ж) + 2СО2 (г).
ΔН0сгор(С6Н12О6 (к)) = - 2815,78 кДж · моль-1
ΔН0сгор(С2Н5ОН(ж)) = - 1366,9 кДж · моль-1
Решение: по второму следствию закона Гесса:
ΔН0х.р. = ΔН0сгор(С6Н12О6 (к)) - 2ΔН0сгор(С2Н5ОН(ж)) = - 82 кДж · моль-1.
Реакция экзотермическая.
Слайд 104Закон Гесса
Закон Гесса и его следствия применяют в научной
Коэффициентом калорийности называется тепловой эффект реакции сгорания одного грамма вещества, взятый с противоположным знаком.
К= - ΔН0сгор(Х)
Слайд 105Пищевая калорийность
1000 кал = 1 ккал
Так... Пончик с калорийностью в 500
содержит 500.000 кал.
(Съешь два, чтобы был миллион!)
Слайд 107Закон Гесса
Коэффициенты калорийности основных компонентов пищи равны:
К (жиров) = 37,7 – 39,8 кДж · г-1.
Первое значение (16,5 и 37,7) – нижняя граница. Второе значение (17,2 - 39,8) – верхняя граница.
Слайд 108Закон Гесса
Для расчета калорийности пищевых продуктов используют формулы:
По
К = 16,5 m(б) + 16,5 m(у) + 37,7 m(ж) [кДж]
По верхней границе:
К = 17,2 m(б) + 17,2 m(у) + 39,8 m(ж) [кДж]
Слайд 109Закон Гесса
Задача 3.
Решение:
К = 3·[16,5 m(б) + 16,5 m(у) + 37,7 m(ж)] [кДж]
К = 1514 кДж (336 кКал)
Слайд 110Закон Гесса
На основании данных по калорийности пищевых продуктов, составляется научно- обоснованные
Пользуясь этими данными как средними величинами, врач составляет нормы потребления пищевых веществ для каждого пациента в отдельности.
Норма суточного потребления для взрослого организма:
Белков-80-100 г.
Жиров-60-70 г.
Углеводов-370-450 г.
Слайд 111Закон Гесса
Суточная потребность человека в энергии составляет:
1. При
2. При умеренной и напряженной мышечной работе- 12500-15100 кДж (3000-3600 ккал).
3. При тяжелых физических нагрузках-16700-20900 кДж (4000-5000 ккал).
Слайд 112
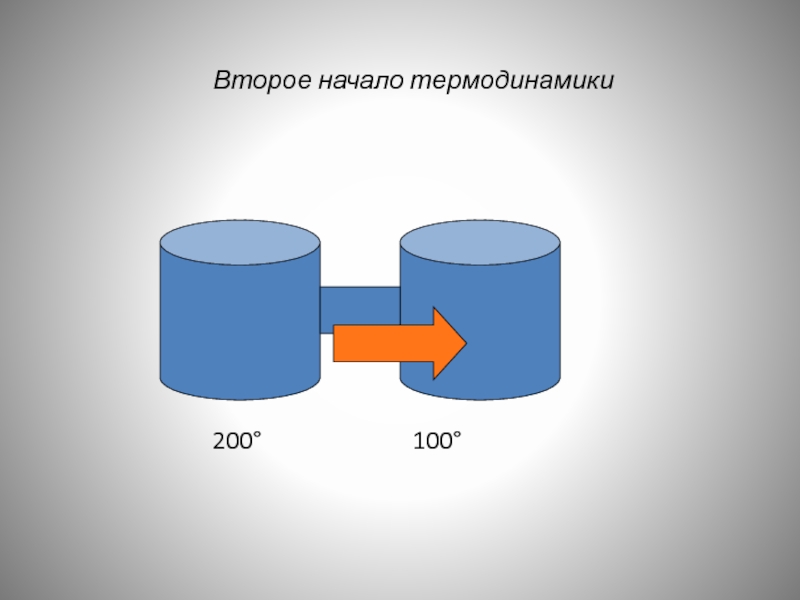
Второй закон термодинамики
устанавливает направление
протекания самопроизвольных
процессов.
Второе начало термодинамики
Слайд 113Второе начало термодинамики
Существуют различные равнозначные по смыслу формулировки 2-го начала термодинамики.
М.В.
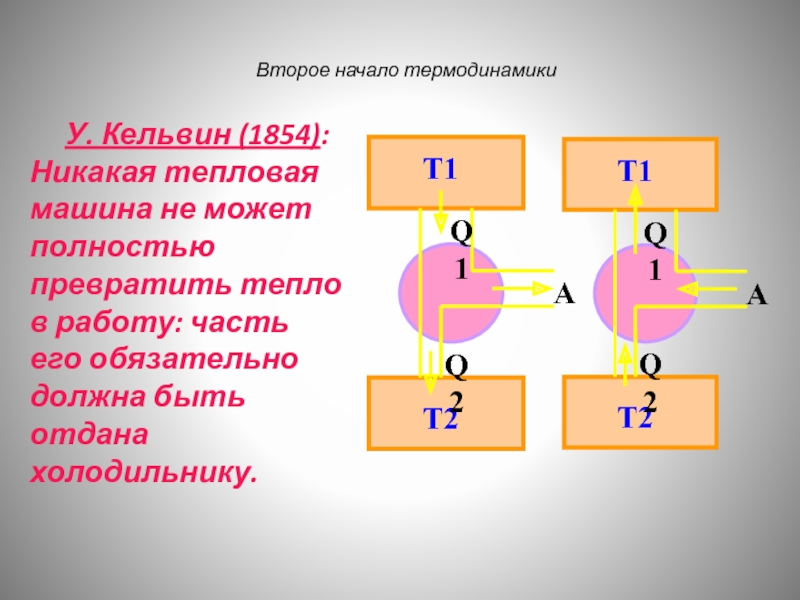
Слайд 120 У. Кельвин (1854): Никакая тепловая машина не может
Второе начало термодинамики
Слайд 121Второе начало термодинамики
В. Освальд (1888): Невозможен вечный двигатель второго рода, т.е.
Слайд 123
Второе начало термодинамики
Больцман: самопроизвольно могут протекать только такие процессы, при которых
Слайд 124Второе начало термодинамики
Для изолированной системы (при Е=const, V= const) критерием
Процесс протекает самопроизвольно, если ΔS > 0.
Протекает обратный процесс, если ΔS < 0
В момент равновесия ΔS = 0.
Слайд 126Самопроизвольные процессы
Пример
Свободное перемещение газа
Вентиль
открыт
Газ
Увеличение энтропии
Равновесие
Газ
Слайд 127Второе начало термодинамики
Современная формулировка: энергия любого вида может
Слайд 128Второе начало термодинамики
Для процессов, протекающих при р=соnst и
Т=соnst,
а в случае процессов, протекающих при V=соnst и Т=соnst – энергия Гельмгольца ΔF (изохорно-изотермический потенциал).
Слайд 129Второе начало термодинамики
В условиях постоянной температуры и давления самопроизвольно могут протекать
Слайд 130Второе начало термодинамики
Математическое выражение 2-го начала термодинамики:
ΔG0пр.
ΔG0пр.= ΔН0 – ТΔS0.
Слайд 132
Особенности организации живых систем:
Биологические системы являются открытыми.
Процессы
Живые системы не находятся в состоянии равновесия.
Все биологические системы гетерогенны.
Слайд 133Биоэнергетика
Основным источником энергии для организма человека является химическая
Слайд 134Биоэнергетика
Химическая энергия также расходуется на совершение внешней работы, связанной с перемещениями
уменьшается
Слайд 135 Белки, жиры и углеводы служат субстратами окислительного фосфорилирования -
Биоэнергетика
Слайд 136Энергетический обмен в клетке в основном связан с расщеплением макроэргических связей
Энергетический обмен
Энергия
Энергия
Используется для многих реакций
Слайд 137Энергетический обмен
Энергия АТФ используется, например, для
биосинтеза белка.
Реагенты
Продукты
Слайд 138Биоэнергетика
Состояние открытой системы, для которой характерно постоянство ее параметров, неизменность во
Слайд 139Биоэнергетика
В термодинамике открытых систем важной величиной является производная энтропии
Cнижении энтропии (негэнтропия) за счет потребления организмом из окружающей среды питательных веществ с низким значением энтропии происходит одновременно с увеличением энтропии за счет выделения в среду продуктов распада, обладающих высокой энтропией.
Слайд 140 Теорема Пригожина
dS/dt = dS орг/dt орг + dS среда/dt среда
dS орг/dt орг – скорость изменения энтропии внутри организма;
dS среда/dt среда – скорость изменения энтропии вследствие обмена организма с окружающей средой и массой и энергией.
Производство энтропии системой, находящейся в стационарном состоянии, стремится к минимуму.
Слайд 141Биоэнергетика
Производство энтропии возрастает в период эмбриогенеза, при процессах
Слайд 142Вопросы для самоконтроля
В чем состоят особенности термохимических уравнений?
Сформулируйте закон Гесса и
Сформулируйте закон Кирхгоффа.
В чем сущность современной формулировки второго закона термодинамики?
Слайд 145Равновесное состояние -
такое состояние системы, когда при постоянных внешних условиях параметры
Динамическое равновесие:
с одинаковой скоростью
Слайд 147Термодинамика химического равновесия
Состояние химического равновесия характеризуют законом действующих масс.
Для обратимой химической
aA + bB ↔ dD + eE
при постоянных внешних условиях отношение произведения концентрации продуктов к произведению концентрации реагентов с учетом стехиометрии есть величина постоянная и называется константой химического равновесия (kc).
Слайд 148Закон действующих масс (гомогенные системы)
aA + bB dD +
c(A) = [A] = const
c(B) = [B] = const
c(D) = [D] = const
c(E) = [E] = const
Вещества в твердой фазе в уравнение не входят.
Слайд 149Термодинамика химического равновесия
Константа химического равновесия зависит от природы реагирующих
Константа равновесия (КС ) может изменяться от 0 до ∞.
Если k = 0, реакция не протекает;
K = ∞, реакция идет до конца;
K> 1, химическое равновесие смещено в сторону образования продуктов;
K< 1, химическое равновесие смещено в сторону образования реагентов.
Слайд 150Сдвиг химического равновесия
Анри Луи Ле Шателье (1884):
Любое воздействие на систему, находящуюся
Слайд 151Влияние температуры
Реакция эндотермическая
– Q, ΔH > 0
при повышении температуры
при понижении температуры
Реакция
+ Q, ΔH < 0
при повышении температуры
при понижении температуры
Слайд 152Принцип Ле Шателье
CaCO3 CaO + CO2 –
при повышении температуры
2NO N2 + O2 + Q (ΔH < 0)
при повышении температуры
Kc = f(T)
Слайд 153Влияние концентрации
Введение реагента
Удаление реагента
Введение продукта
Удаление продукта
Kc = const
При V = const:
Слайд 156Принцип Ле Шателье
Δn(газ.) > 0
при повышении давления
при понижении давления
Δn(газ.) < 0
при
при понижении давления
Kc = const
Слайд 158Принцип Ле Шателье
Катализатор
не влияет на Kc
не является реагентом или продуктом
=> не
ускоряет его достижение
Слайд 159Термодинамика химического равновесия
Направление данной химической реакции общего вида:
aA + bB cC + dD
при заданных концентрациях веществ (A, B, C, D) при постоянной температуре можно представить с помощью уравнения изотермы:
где ΔGр-я –изменение энергии Гиббса реакции,
ΔG 0р-я – изменение стандартной энергии Гиббса
ΔG0р-я = -RТℓnКс.
ΔGр-я = ΔG0р-я + RT ℓn Пс,
Слайд 160Термодинамика химического равновесия
Пс – величина стехиометрического соотношения концентраций
Преобразованное уравнение изотермы:
ΔGр-я = -RT ℓn + RT ℓn =RT (ℓn - ℓn )
ΔGр-я = RT ℓn
Слайд 161Термодинамика химического равновесия
Анализ уравнения изотермы
Если
– протекает обратный процесс.
Если ПС < КС, то
– протекает прямой процесс.
Если ПС = КС, то
- состояние равновесия.






































![Функции состояния системыТ.к. ΔН=Qр, => ΔН = ΔU + р·ΔV [кДж·моль-1]Энтальпию часто называют «тепловой функцией»](/img/tmb/2/188567/e7b7a831a2e18bbd2f67b03e3a05862c-800x.jpg)



![Функции состояния системыΔS=Qmin/T, [Дж · моль-1 · К-1]. Энтропия (по Клаузиусу)](/img/tmb/2/188567/9c23d5709d5f059e8ed698e0ba5778d2-800x.jpg)
































![Первое следствие закона Гесса ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реагент), ΔН0проц.[кДж ·моль-1].Тепловой эффект процесса равен](/img/tmb/2/188567/181c033b6d28d25bfab730d902c21f06-800x.jpg)





![ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1]Второе следствие закона Гесса:Тепловой эффект химического процесса равен алгебраической](/img/tmb/2/188567/1f4a80eb152ae589d8b08627d61efe30-800x.jpg)
































![Закон действующих масс (гомогенные системы)aA + bB dD + eEc(A) = [A] = constc(B)](/img/tmb/2/188567/e68af47f30ae407b5e6144e0974601f1-800x.jpg)