- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы химического равновесия презентация
Содержание
- 1. Основы химического равновесия
- 2. где A,B,M,N – химические символы реагирующих веществ,
- 3. и найти стехиометрические коэффициенты α, β, γ,
- 4. Химические реакции горения и газификации протекают с
- 5. Если энергия, выделяющаяся при образовании новых связей,
- 6. Лекция 5 Согласно 1-му началу термодинамики, изменение
- 7. Лекция 6 Если реакция протекает при постоянном
- 8. Лекция 5 Теплота реакций при р,Т =
- 9. Лекция 5 Теплота реакции равна сумме теплот
- 10. Компоненты горючей смеси могут находиться в одном
- 11. Энтальпия образования сложного вещества есть энтальпия реакции
- 12. Энтальпия сгорания простого и сложного вещества есть
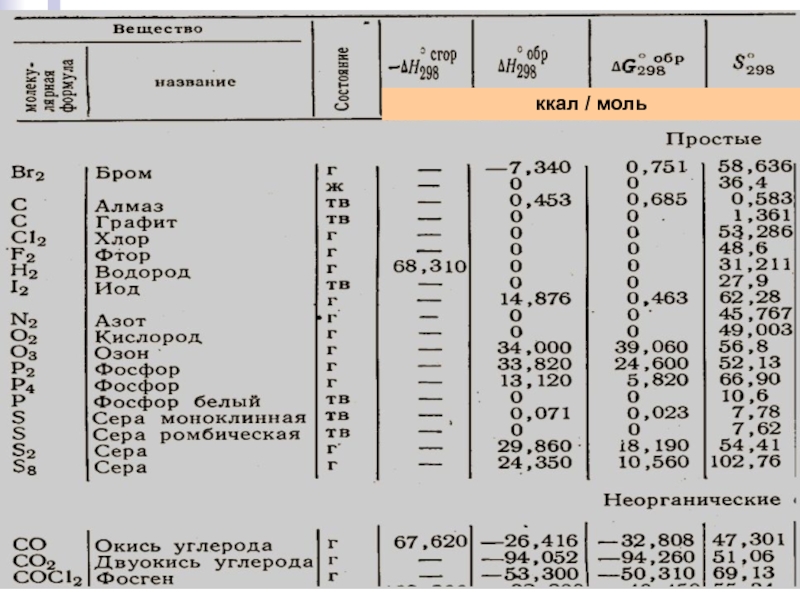
- 13. Лекция 6 ккал / моль
- 14. Лекция 5
- 15. Лекция 6
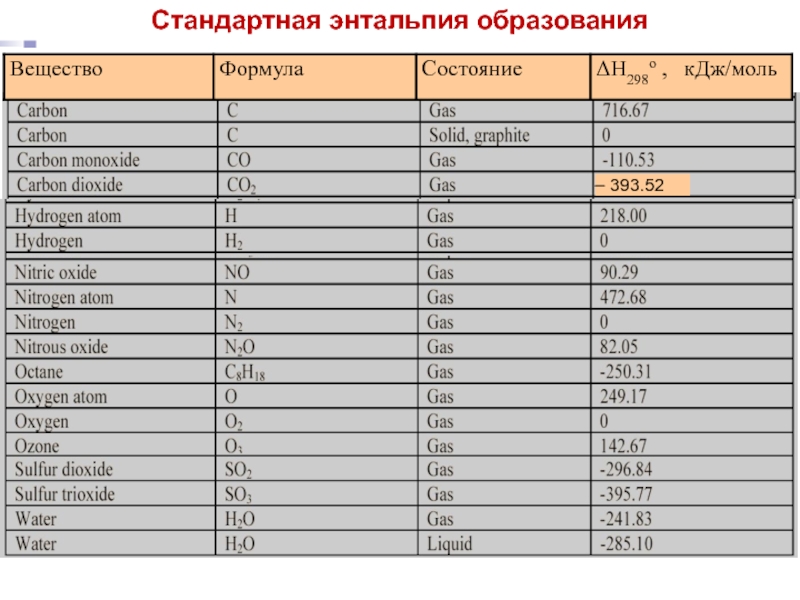
- 16. Лекция 5 – 393.52 Стандартная энтальпия образования
- 17. (11.28 = 3 × (0.79/0.21). Лекция 5
- 18. Лекция 6 Суммарная энтальпия образования продуктов Суммарная
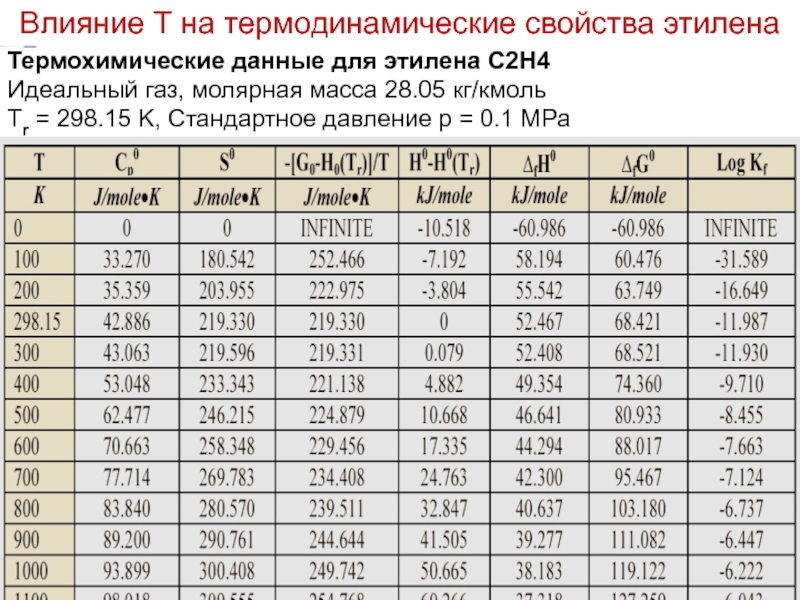
- 19. Лекция 6 Термохимические данные для этилена C2H4
- 20. Лекция 5 Предполгается, что смесь находится в
- 21. Экспериментально установлено, что химические реакции не всегда
- 22. Скорость химической реакции, как будет показано
- 23. В зависимости от условий (Т, р) равновесие
- 24. Скорость протекания химических реакций и
- 25. Лекция 6 Скорость прямой реакции в любой
- 26. Здесь CA ,CB ,CM ,CN – текущие
- 27. Результирующая скорость реакции, равная разности
- 28. Лекция 6 КС – безразмерная величина, называемая
- 29. Так как k1 и k2 при
- 30. Лекция 6 поэтому константу равновесия Кp можно
- 31. Если в газовой смеси может происходить несколько
- 32. Скорости обратных реакций разложения (диссоциации) продуктов
- 33. Строго говоря, область применения закона действующих масс
- 34. Для процессов горения важное значение имеют гетерогенные
- 35. Если на систему в состоянии равновесия воздействовать
- 36. Например, если прямая реакция экзотермична (протекает с
- 37. Лекция 6 Если из системы выводится какой-либо
- 38. Давление воздействует на положение равновесия в
- 39. Принцип Ле Шателье-Брауна указывает только направление смещения
- 40. При очень высоких температурах реакции горения вообще
- 41. Зависимость химического равновесия реакций горения от температуры
- 42. Знак "–" в правой части показывает, что:
- 43. Лекция 5 G0, H0, S0– стандартные значения
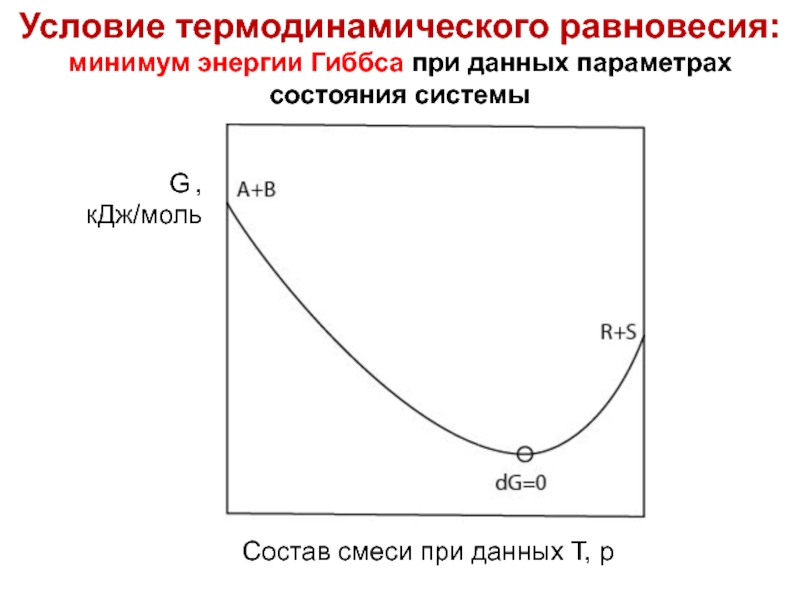
- 44. Лекция 6 Условие термодинамического равновесия: минимум энергии Гиббса при данных параметрах состояния системы
- 45. Лекция 5 Сжигание топлива при высоких температурах
- 46. Лекция 5 Энергия Гиббса для смеси компонентов
Слайд 2где A,B,M,N – химические символы реагирующих веществ,
α, β, γ, δ -
Топливо Лекция 6
Процессы горения/газификации, так же как и другие химические превращения, описываются уравнениями химических реакций, имеющими вид
Уравнение химической реакции
Слайд 3и найти стехиометрические коэффициенты α, β, γ, δ из уравнений баланса
Лекция 6
Предполагая, что элементы, образующие молекулу метана – С и Н, полностью окисляются кислородом и образуют диоксид углерода и пары воды, можно записать уравнение в общем виде
Гомогенная реакция горения метана
Слайд 4 Химические реакции горения и газификации протекают с выделением или поглощением тепла,
Всякая химическая реакция сводится к разрушению (разрыву) химических связей между атомами в молекулах и образованию новых связей. При этом изменяется энтальпия (p=const) или внутренняя энергия (v=const) реагирующих веществ.
Лекция 6
Слайд 5 Если энергия, выделяющаяся при образовании новых связей, больше энергии, затрачиваемой на
Если энергия, выделившаяся при образовании новых связей, меньше энергии разрыва связей, то реакция связана с поглощением теплоты из окружающей среды (эндотермический процесс).
Лекция 6
Слайд 6Лекция 5
Согласно 1-му началу термодинамики, изменение внутренней энергии dU или энтальпии
U, H – функции состояния, и их изменение в результате химической реакции не зависит от пути (механизма), по которому развивается реакция, а определяется лишь начальным и конечным состояниями системы (составами и свойствами реагентов и продуктов).
Теплота реакции в общем случае зависит от пути процесса, но в двух простейших случаях, когда процессы совершаются при V,Т=const и p,Т=const, её значение также определяется только начальным и конечным состояниями системы.
Слайд 7Лекция 6
Если реакция протекает при постоянном объёме (V,Т = const ,
Если реакция протекает при постоянном давлении (p=const, изобарный процесс) и совершается только работа объёмного расширения (типичные условия в устройствах сжигания/газификации), то теплота реакции равна разности энтальпий системы после и до реакции
При ΔН < 0 реакция экзотермическая, при ΔН > 0 – эндотермическая (тепло поглощается из окружающей среды).
Слайд 8Лекция 5
Теплота реакций при р,Т = const или при V,T =
Следствия из закона Гесса
Теплота реакции равна разности между суммой теплот образования (Uобр или Нобр ) конечных продуктов реакции и суммой теплот образования исходных реагентов
Теплота реакции равна разности между суммами теплот сгорания (Uсгор или Нсгор ) исходных реагентов и продуктов реакции
Закон Гесса (следствие I начала т/д)
Слайд 9Лекция 5
Теплота реакции равна сумме теплот сгорания исходных реагентов за вычетом
Теплота реакции образования метана
Слайд 10 Компоненты горючей смеси могут находиться в одном агрегатном состоянии, например,
–
либо в различных состояниях:
– твердое топливо и газообразный окислитель;
– жидкое топливо и газообразный окислитель.
Система , в которой компоненты находятся в одном агрегатном состоянии, называется гомогенной, а в различных – гетерогенной.
От агрегатного состояния реагентов и продуктов зависят их энтальпия образования и, следовательно, – теплота реакции.
Лекция 5
Гомогенное и гетерогенное горение
Слайд 11 Энтальпия образования сложного вещества есть энтальпия реакции его синтеза из простых
Стандартные энтальпии образования веществ приводятся в таблицах при одних и тех же ("стандартных") условиях: р = 1 атм и определённой температуре, обычно 298.15 К = 25 оС.
Обозначение:
Стандартные энтальпии образования простых веществ:
углерода С (графит);
водорода Н2 (газ);
кислорода О2 (газ);
азота N2 (газ) и т.п.
приняты равными 0 (нулю).
Лекция 5
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ
Слайд 12 Энтальпия сгорания простого и сложного вещества есть энтальпия реакции его полного
Стандартные энтальпии сгорания веществ приводятся в таблицах при одних и тех же ("стандартных") условиях: р = 1 атм и определённой температуре, обычно 298.15 К = 25 оС.
Обозначение:
Теплота сгорания указывается в расчёте на 1 моль окисляемого вещества (топлива), кДж/моль.
Лекция 5
ЭНТАЛЬПИЯ СГОРАНИЯ
Слайд 17(11.28 = 3 × (0.79/0.21).
Лекция 5
Предполгается, что смесь находится в стехиометрическом
Теплота реакции горения этилена при C.У.
Слайд 18Лекция 6
Суммарная энтальпия образования продуктов
Суммарная энтальпия образования реагентов
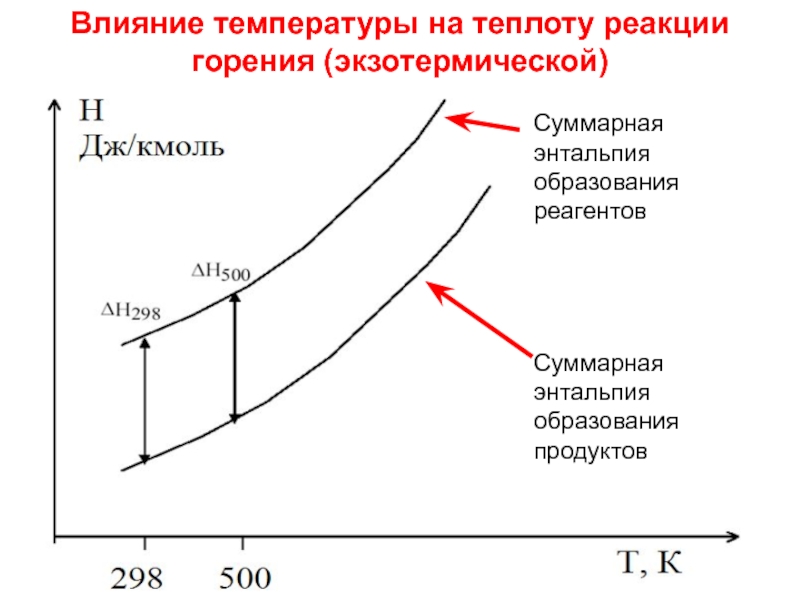
Влияние температуры на теплоту
горения (экзотермической)
Слайд 19Лекция 6
Термохимические данные для этилена C2H4
Идеальный газ, молярная масса 28.05 кг/кмоль
Tr
Влияние Т на термодинамические свойства этилена
Слайд 20Лекция 5
Предполгается, что смесь находится в стехиометрическом соотношении при р =
Сначала пересчитывается предыдущий пример для температуры 298 К, но для воды в состоянии газа.
Затем по таблицам определяются разности энтальпий образования между 500 К и 298 К для всех продуктов (вводятся в теплоту реакции со знаком +) и реагентов (вводятся со знаком –).
Теплота реакции горения этилена при 500оС
Слайд 21 Экспериментально установлено, что химические реакции не всегда протекают до полного превращения
Наряду с продуктами реакции в системе присутствует некоторое количество исходных и промежуточных соединений, что объяснятся одновременным протеканием реакций в двух противоположных направлениях.
Такой ход реакций называется химической обратимостью и отражается в виде:
Лекция 6
Обратимость химических реакций
Слайд 22 Скорость химической реакции, как будет показано далее, пропорциональна концентрациям (количество
По мере протекания реакции из-за уменьшения количества исходных веществ скорость прямой реакции уменьшается, а обратной увеличивается, так как продукты прямой реакции все прибывают.
Когда скорости прямой и обратной реакций уравновешиваются, то состав смеси в системе с течением времени остается неизменным.
Наступает химическое равновесие.
Лекция 6
Слайд 23 В зависимости от условий (Т, р) равновесие может быть, например, сильно
Может казаться, что реакция протекает только в одну сторону.
При других условиях равновесие, напротив, может быть сильно сдвинуто в сторону исходных веществ, реакция как будто бы вовсе не протекает.
Могут быть и любые промежуточные варианты.
Лекция 6
Слайд 24 Скорость протекания химических реакций и положение равновесия зависят от
Наступление химического равновесия данной реакции при постоянных температуре и давлении зависит от концентраций реагирующих веществ C (моль/м3).
Эта зависимость определяется законом действующих масс.
Лекция 6
Слайд 25Лекция 6
Скорость прямой реакции в любой момент времени:
а скорость обратной
Закон действующих масс
В однородной среде при постоянных T и p скорость химической реакции пропорциональна произведению концентраций реагирующих веществ
Слайд 26 Здесь CA ,CB ,CM ,CN – текущие концентрации реагирующих веществ, моль/м3,
k1
Лекция 6
Слайд 27 Результирующая скорость реакции,
равная разности скоростей прямой и обратной реакций,
Лекция 6
Слайд 28Лекция 6
КС – безразмерная величина, называемая константой равновесия (по концентрациям).
Отсюда следует
Слайд 29 Так как k1 и k2 при данной температуре являются постоянными,
Зная значение константы равновесия КС, можно определить состав равновесной смеси при данной температуре.
Лекция 6
Константы равновесия для многих реакций приводятся в термодинамических справочниках.
Слайд 30Лекция 6
поэтому константу равновесия Кp можно выразить через парциальные давления газов
В общем случае при изменении числа молей в реакции
При Т = const парциальные давления газов в смеси пропорциональны их концентрациям (МА – масса реагента А)
Слайд 31 Если в газовой смеси может происходить несколько различных реакций, то закон
В условиях промышленного сжигания топлив обычно состояние равновесия не наступает, так как для этого необходим промежуток времени, в 10-100 раз бóльший, чем среднее время пребывания газов в топочной камере.
Лекция 6
Слайд 32
Скорости обратных реакций разложения (диссоциации) продуктов сгорания при топочных температурах (1600-18000С
Таким образом, в топках котельных агрегатов реакции окисления горючих веществ идут практически только в прямом направлении.
Лекция 6
Слайд 33 Строго говоря, область применения закона действующих масс ограничивается идеальными газами, однако
Лекция 6
Слайд 34Для процессов горения важное значение имеют гетерогенные реакции в системах, в
Однако химические реакции в гетерогенной системе, состоящей из жидкого топлива и газа, протекают в газовой фазе между насыщенным паром топлива и газом.
В результате этого в системе наступает равновесие в газовой фазе, для которого справедливы все законы гомогенных газовых реакций.
Лекция 6
Слайд 35 Если на систему в состоянии равновесия воздействовать извне, изменяя термодинамические параметры
Принцип Ле Шателье справедлив для всех систем, в том числе и в химических реакциях.
Лекция 6
Принцип Ле Шателье – Брауна
Слайд 36Например, если прямая реакция экзотермична (протекает с выделение теплоты), как в
При понижении температуры увеличивается скорость прямой реакции, и равновесие в смещается в сторону продуктов реакции.
При не слишком высоких температурах эти смещения для реакций горения мало заметны.
Лекция 6
Слайд 37Лекция 6
Если из системы выводится какой-либо продукт, то равновесие сдвигается в
ПРИМЕР. Паровая газификация (конверсия, риформинг) углерода с целью получения водорода
эндотермическая конверсия
экзотермическая "шифт-реакция"
Чтобы повысить выход Н2, нужно повышать температуру при проведения 1-ой реакции и понижать – при 2-ой, осуществляя их в отдельных реакторах.
Результирующая реакция
Адсорбция углекислого газа и вывод его из системы в виде твёрдого продукта сдвинет равновесие в сторону увеличения концентрации водорода
Слайд 38 Давление воздействует на положение равновесия в том случае, если реакция
Для реакций с увеличением объема при повышении давления извне равновесие смещается в сторону исходных реагентов, т.е. уменьшения объема, а при понижении давления – в сторону продуктов –увеличения объема.
Лекция 6
Слайд 39Принцип Ле Шателье-Брауна указывает только направление смещения равновесия, но не дает
Соотношения, позволяющие проводить расчеты, можно получить, используя термодинамические методы (равновесные расчеты с использованием констант равновесия).
Лекция 6
Слайд 40При очень высоких температурах реакции горения вообще не протекают. Следовательно, за
В камерах сгорания реактивных двигателей, где температуры достигают 3000-3500 К, даже при высоких давлениях существенна роль обратных реакций.
Лекция 6
Слайд 41Зависимость химического равновесия реакций
горения от температуры
При внешнем изменении температуры равновесие системы
Чтобы определить состав равновесной смеси при различных температурах, необходимо знать зависимость константы равновесия от температуры. Эта зависимость при V = const и p = const выражается уравнениями изохоры реакции
и изобары реакции
Слайд 42Знак "–" в правой части показывает, что:
если Q = ΔrH
если Q = ΔrH > 0, то с возрастанием температуры константа равновесия уменьшается, равновесие сдвигается в сторону образования конечных веществ. Поэтому в эндотермических реакциях высокие температуры благоприятствуют более полному их протеканию.
Лекция 5
Слайд 43Лекция 5
G0, H0, S0– стандартные значения (р=1 атм, Т = 298
Стандартное изменение энергии Гиббса для реакции образования какого-либо вещества
Константа равновесия и энергия Гиббса (свободная энтальпия; изобарно-изотермический потенциал)
Слайд 44Лекция 6
Условие термодинамического равновесия:
минимум энергии Гиббса при данных параметрах состояния
Слайд 45Лекция 5
Сжигание топлива при высоких температурах (Т > 1300 К) сопровождается
Оценим изменение энергии Гиббса для такой реакции, протекающей при температуре Т = 2000 К
ΔG0обр = Δ H0обр(NO) – 0.5 {Δ H0обр(N2) + Δ H0обр(O2)} –
–T {S0(NO) - 0.5 {S0(N2) + S0(O2)} =
(по таблицам) = 65.060 кДж/моль,
что позволяет определить константу
равновесия
Изменение энергии Гиббса при образовании "термического" моноксида азота
Слайд 46Лекция 5
Энергия Гиббса для смеси компонентов
– энергия Гиббса k-го компонента,
Для смесей идеальных газов и идеальных растворов функция Гиббса k-го компонента задается выражением
– энергия Гиббса "чистого" компонента, R – универсальная газовая постоянная, Xk – мольная (объёмная) доля k-го компонента.