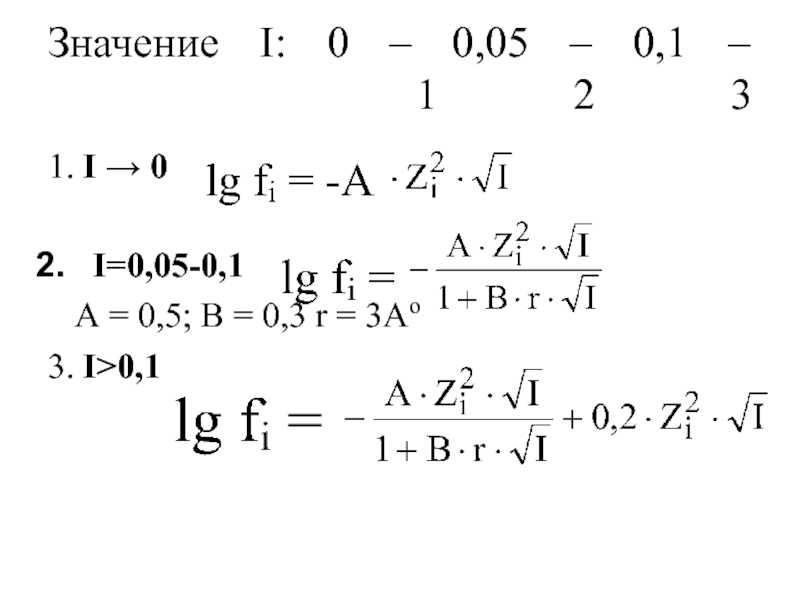- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные законы и теории. Законы стехиометрии. Теория ионных равновесий. (Лекция 3) презентация
Содержание
- 1. Основные законы и теории. Законы стехиометрии. Теория ионных равновесий. (Лекция 3)
- 2. Законы стехиометрии Закон сохранения массы (1748 г.,
- 6. Пруст Жозеф Луи (1754-1828 г.)
- 8. Стехиометрия - это совокупность расчетов, основанных на
- 9. Следствие из правила Для расчета концентрации вещества,
- 16. Cильные электролиты Кислоты: HCl, HBr, HI, HNO3,
- 17. Теория ионных равновесий Теория электролитической диссоциации
- 19. Закон начальной концентрации Концентрация любого вещества в
- 20. Закон сохранения заряда Сумма произведений концентрации каждого
- 21. Теория сильных электролитов (1923 г, Дебай, Хюккель)
- 22. ДЕБАЙ (Debye), Петер Джозеф Уильям 24
- 23. ХЮККЕЛЬ (Hückel), Эрих Арманд Артур Йозеф
- 24. Теория сильных электролитов K+ + m
- 25. Количество ионных пар зависит от: силы
- 26. Ионная сила раствора Является мерой электростатического
- 27. Формула Льюиса-Рендалла (1921 г.)
- 28. Значение I: 0 – 0,05 – 0,1
- 29. Закон Рендалла (закон ионной силы):
- 30. КОЭФФИЦИЕНТЫ АКТИВНОСТИ f
- 31. Зависимость f от I
- 32. Закон действующих масс и его использование в расчетах
- 35. КТ - термодинамическая константа КТ = f
- 36. Кf - функция активности Кf
- 37. fi известны не только для ионов, но
- 38. Применение теории сильных электролитов в аналитических расчетах
- 39. Расчет концентрационной константы CH3COOH
- 40. Константы сильных, слабых, хорошо и малорастворимых электролитов.
Слайд 1Основные законы и теории, лежащие в основе аналитический химии
Законы стехиометрии
Теория ионных
Периодический закон Д.И.Менделеева
Слайд 2Законы стехиометрии
Закон сохранения массы (1748 г., М.В.Ломоносов, 1789 г., Лавуазье).
Закон постоянства
Закон кратных отношений (1803 г., Д.Дальтон).
Закон эквивалентов (1803 г., И.Рихтер).
Закон Авогадро (1810 (11) г.).
Слайд 8Стехиометрия - это совокупность расчетов, основанных на химических формулах и уравнениях
Правило, вытекающее из законов стехиометрии: количества веществ, вступивших в реакцию или образовавшихся в результате реакции, записанных в уравнении справа и слева, относятся друг к другу как их стехиометрические коэффициенты
Слайд 9Следствие из правила
Для расчета концентрации вещества, вступившего или образовавшегося, необходимо и
Эту концентрацию необходимо разделить на коэффициент, стоящий перед данным веществом, и умножить на коэффициент, стоящий перед веществом, концентрацию которого хотим определить.
Слайд 16Cильные электролиты
Кислоты: HCl, HBr, HI, HNO3, H2SO4 (по 1-ой ступени).
Основания:
Соли: все растворимые соли, за исключением HgCl2, [Fe(NCS)3]o.
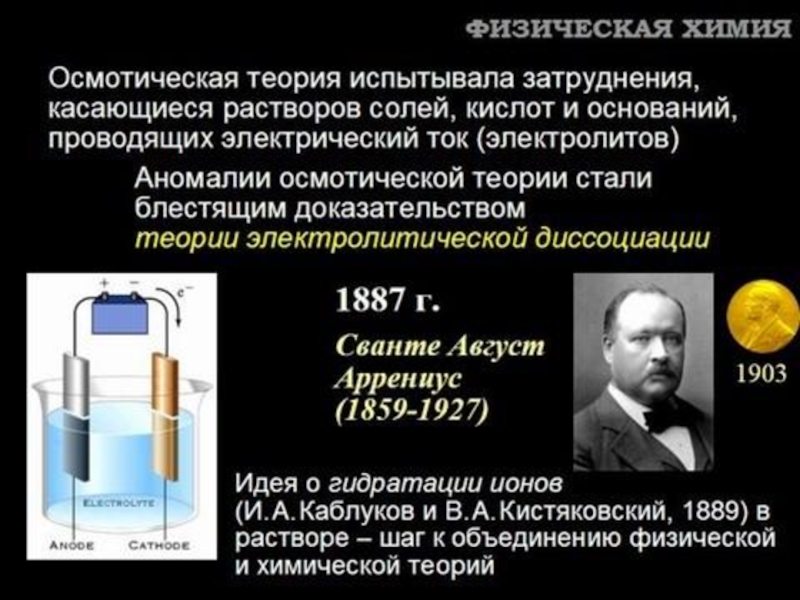
Слайд 17Теория ионных равновесий
Теория электролитической диссоциации С.Аррениуса (1887 г.).
Теория сильных электролитов (П.Дебай,
Закон действующих масс (Н.Н.Бекетов, К.Гульдберг, П.Вааге, 1864-1867 гг.).
Закон сохранения начальной концентрации.
5. Закон сохранения заряда.
Слайд 19Закон начальной концентрации
Концентрация любого вещества в растворе равна сумме равновесных концентраций
Пример: раствор Н2SО4 С=0,1 М
Н2SО4 Н+ + НSО4- Н+ + SО42-
[Н2SО4 ]нач. = [Н+] + [НSО4-] + [SО42-]
Слайд 20Закон сохранения заряда
Сумма произведений концентрации каждого иона на его заряд равна
Пример:
Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
Слайд 21Теория сильных электролитов (1923 г, Дебай, Хюккель)
1. Сильные электролиты в водных
2. В растворах за счет сильного ион-дипольного взаимодействия с молекулами Н2О образуются гидратные оболочки иона.
3. Сильное ион-ионное взаимодействие создает ионные атмосферы (каждый гидратированный ион окружен гидратированными ионами противоположного заряда).
Слайд 22ДЕБАЙ (Debye), Петер Джозеф Уильям
24 марта 1884 г. – 2 ноября
Нобелевская премия по химии, 1936 г.
Слайд 24Теория сильных электролитов
K+ + m H2O → [K(OH2)m]+
катионный гидрат
A– +
анионный гидрат
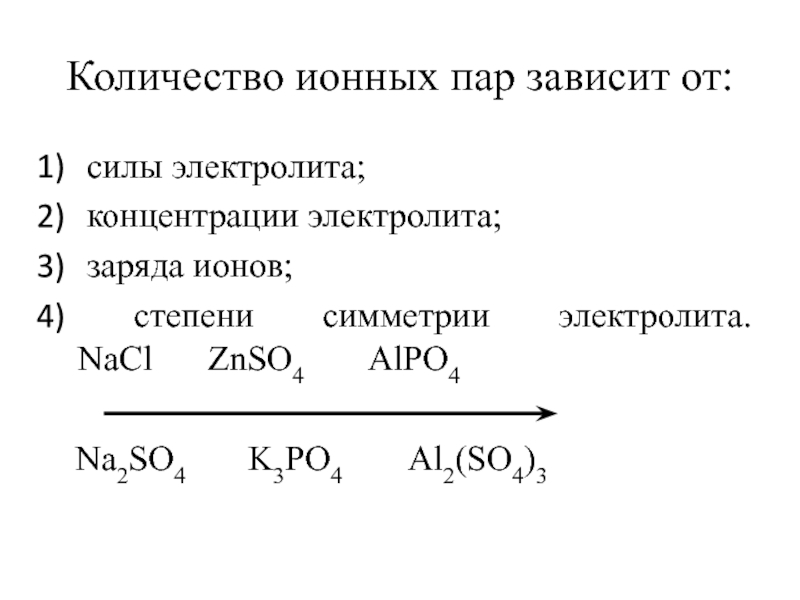
Слайд 25Количество ионных пар зависит от:
силы электролита;
концентрации электролита;
заряда ионов;
Na2SO4 K3PO4 Al2(SO4)3
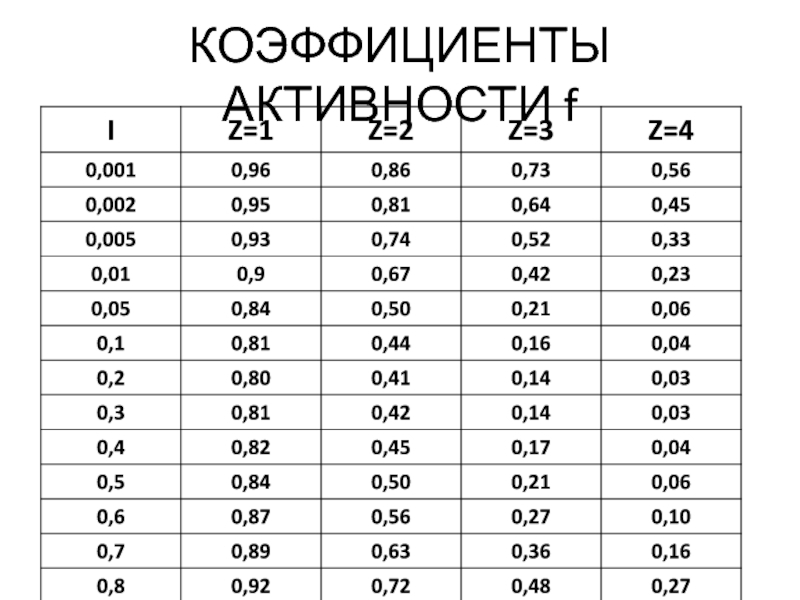
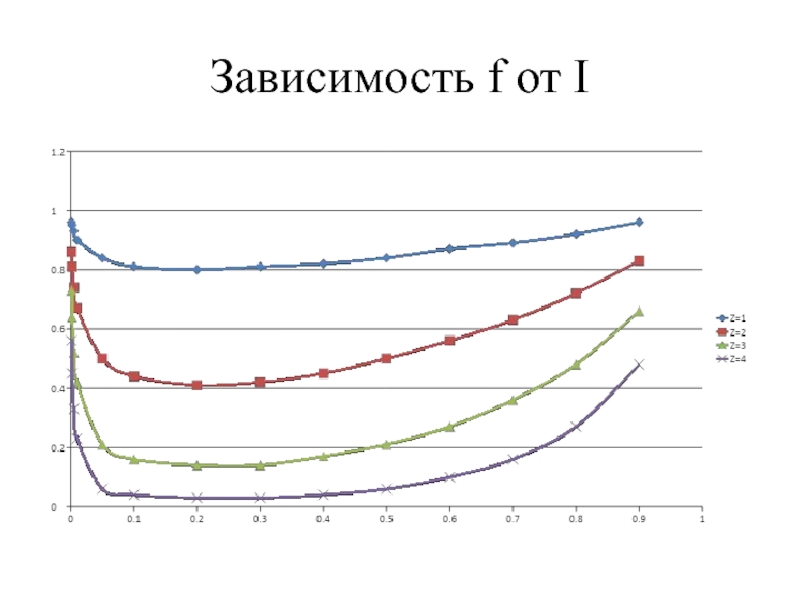
Слайд 26Ионная сила раствора
Является мерой электростатического взаимодействия всех ионов в растворе, обозначается
I = 0 для растворов слабых электролитов.
I ≈ 0 для разбавленных растворов сильных электролитов (С ≤ 10-3 М)
I > 0 для концентрированных растворов сильных электролитов (С > 10-3 М)
Слайд 27Формула Льюиса-Рендалла (1921 г.)
Активность
(действующая концентрация)
ai = Ci ⋅ fi
С –
fi – коэффициент активности
Слайд 29Закон Рендалла
(закон ионной силы):
при значениях ионной силы ≤ 0,05
Слайд 35КТ - термодинамическая константа
КТ = f (природа вещества, природа растворителя, Т,
где е - основание натурального логарифма;
ΔG° - стандартное изменение энергии Гиббса;
R - универсальная газовая постоянная;
Т - абсолютная температура
Слайд 37fi известны не только для ионов, но и для молекул сильных
Слайд 38Применение теории сильных электролитов в аналитических расчетах
Для раствора, содержащего 0,1 М
Решение:
СаСl2 Ca2+ + 2Cl-; KCl K+ + Cl-
0,1 0,2 0,2 0,2
I=1/2(0,1.22+0,2.12+0,4.12)=0,5
f1 = 0,84; f2 = 0,50; a(Ca2+)= 0,1. 0,50 = 0,05
Слайд 39Расчет концентрационной константы
CH3COOH CH3COO- + H+
f1
Kk = KT/f12
Kk = 1,7.10-5/(0,84)2=2,4.10-5
Слайд 40Константы сильных, слабых, хорошо и малорастворимых электролитов. Показатели констант Константы распада электролита






















![Теория сильных электролитов K+ + m H2O → [K(OH2)m]+ катионный гидратA– + n H2O →](/img/tmb/4/373539/ca20132bf98e0ee51d094f3ce3246205-800x.jpg)