- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные реакции презентация
Содержание
- 1. Окислительно-восстановительные реакции
- 2. Классификация реакций Все химические
- 3. Процесс отдачи электронов - окисление,
- 4. Атомы, молекулы или ионы, присоединяющие электроны,
- 5. Окислители это: простые вещества, атомы которых
- 6. Восстановители- это: Элементы I, II, III групп
- 7. Три типа окислительно-восстановительных реакций. - межмолекулярные,
- 8. происходят с изменением степени окисления разных
- 9. Реакции диспропорционирования протекают с одновременным уменьшением
- 10. Влияние среды на характер протекания ОВР
- 11. Рассмотрим несколько примеров. 1. KMnO4 (перманганат
- 12. Окисленная
- 13. Окислительно- восстановительная двойственность пероксида водорода
- 14. Окислительные свойства К2СrО4 и К2Сr2О7 3. Хромат
- 15. К2Сr2О7
- 16. Метод электронно-ионного баланса (метод полуреакций). Реакции,
- 17. Пример 1. КМnO4
- 18. Пример 2.
- 19. Реакции, протекающие в щелочной среде.
- 20. Пример 1. Cr2O3 + KNO3
- 21. Пример 2.
- 22. Реакции, протекающие в нейтральной среде.
- 23. Пример 1. KMnO4 + Na2SO3
- 24. Пример 2. MnSO4 + KMnO4 +
- 25. Теория возникновения равновесных электродных и
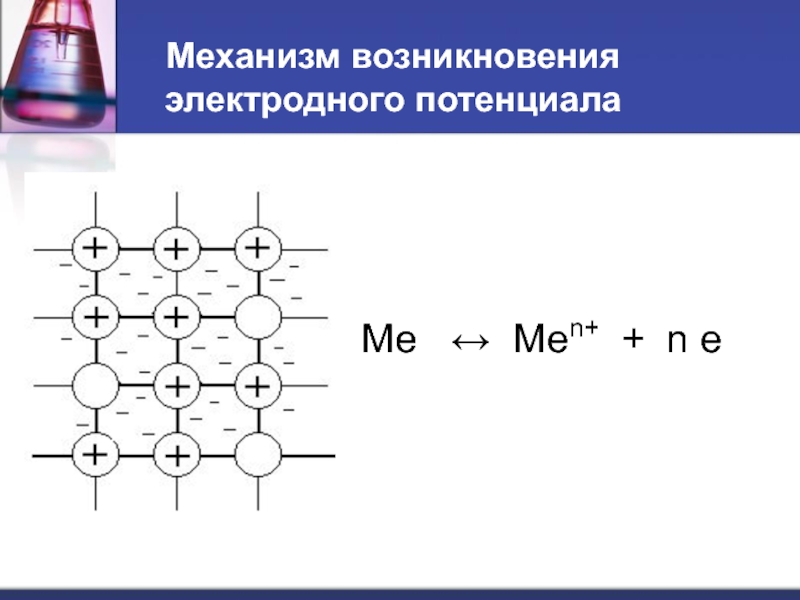
- 26. Механизм возникновения электродного потенциала Ме ↔ Меn+ + n e
- 27. При погружении металла в воду… Ме +
- 28. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
- 29. Если металл погрузить в раствор его соли,
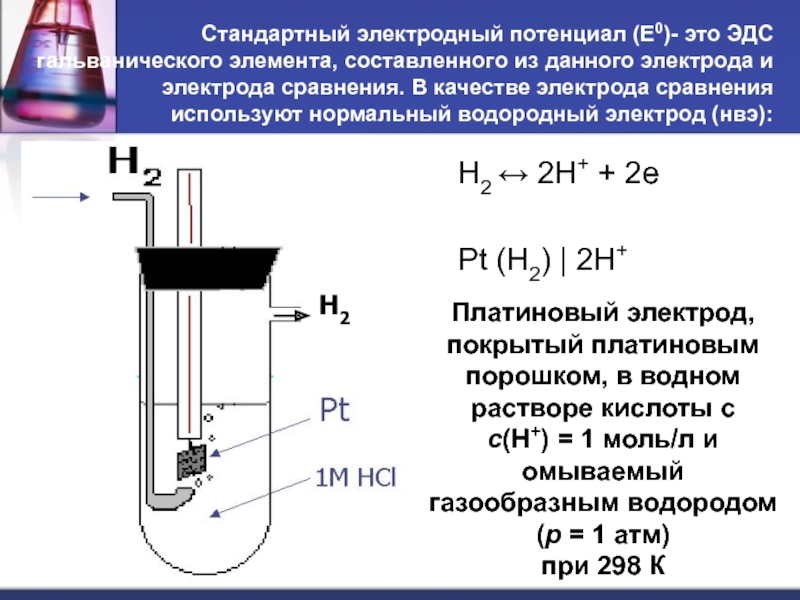
- 30. Стандартный электродный потенциал
- 31. Стандартный электродный потенциал (Е0)- это ЭДС гальванического
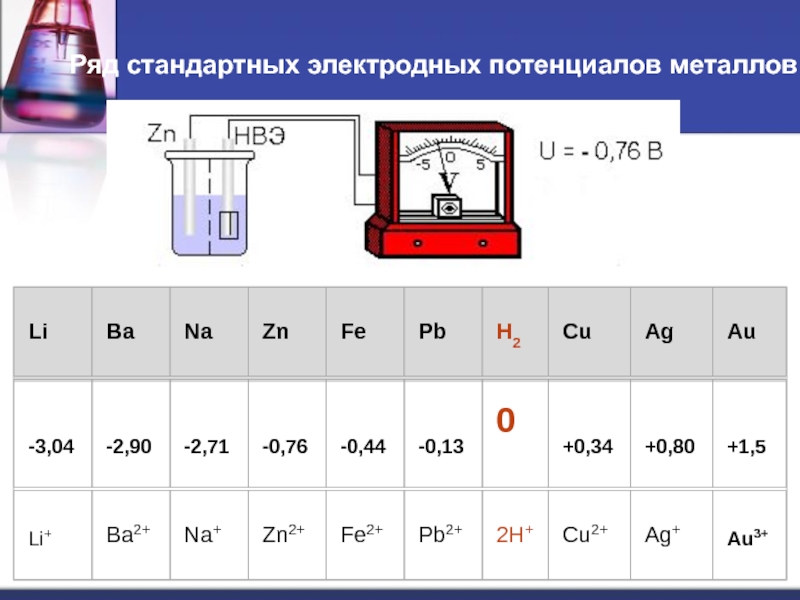
- 32. Ряд стандартных электродных потенциалов металлов
- 33. Величина потенциала в реальных условиях рассчитывается по уравнению Нернста:
- 35. Если известен потенциал водородного электрода, можно рассчитать рН раствора:
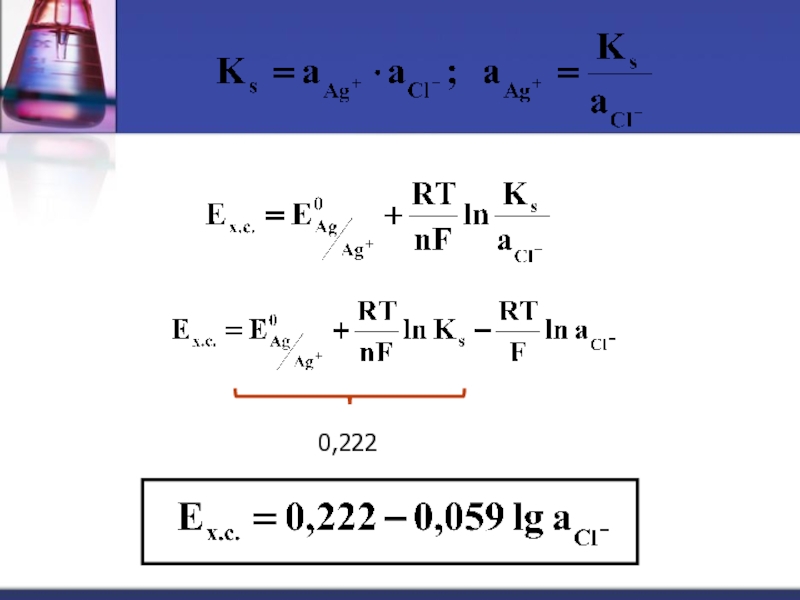
- 36. Хлорсеребряный электрод (ХСЭ) Ag, AgCl |
- 37. Ag ↔ Ag+ + e
- 38. 0,222
- 39. ↑[Cl-] → ↓[Ag+] → ↓E х.с.
- 40. Гальванические элементы Изометаллические Биметаллические
- 41. Гальванический элемент (биметаллический) Анод: Zn -
- 42. Мерой работоспособности ГЭ элемента является ЭДС или разность потенциалов электродов:
- 43. Концентрационный гальванический элемент (изометаллический) Анод: Zn→Zn2+(0,1н)
- 45. Окислительно-восстановительные потенциалы Fe 2+(р-р)↔ Fe 3+(р-р)+е (
- 46. Вальтер Фридрих Герман Нернст (1864-1941)
- 47. ОВ потенциал зависит от:
- 48. Стандартный ОВ потенциал ЭДС ГЭ, составленного из
- 49. Если составить
- 50. В реальных условиях расчет ОВ потенциала системы MnO4-/Mn2+ производится по уравнению Нернста:
- 51. Чем больше стандартный ОВ потенциал системы, тем
- 52. Критерии самопроизвольного протекания ОВ реакций
- 53. Пример:
- 54. Глубина протекания ОВ реакций
- 55. Окислительно-восстановительные ГЭ
- 56. 2KI + 2FeCl3 → I2 + 2FeCl2+2КCl
- 57. Ионоселективные электроды
- 58. Стеклянный электрод R(Na+, Li+) + H+↔ R(H+)
- 59. Определение рН в лабораторном практикуме
- 60. БЛАГОДАРЮ ЗА ВНИМАНИЕ !
Слайд 1Окислительно-восстановительные реакции
Лекция для студентов 1 курса фармацевтического факультета
ГБОУ ВПО ТюмГМА
Слайд 2Классификация реакций
Все химические реакции можно разделить на 2
Слайд 3
Процесс отдачи электронов - окисление, сопровождается увеличением положительной степени окисления или
Слайд 4
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Атомы, молекулы или
Окисление всегда сопровождается восстановлением. Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления.
Слайд 5Окислители это:
простые вещества, атомы которых обладают большой величиной электроотрицательности. Это элементы
сложные вещества, катионы которых находятся в высшей степени окисления.
Например: SnCl4, FeCl3, CuSO4.
сложные вещества, в анионах которых атом металла или неметалла находятся в высшей степени окисления
Например: К2Сr2O7, КМnO4, КNO3, H2SO4.
Слайд 6Восстановители- это:
Элементы I, II, III групп главных подгрупп. Например: Na, Zn,
Сложные вещества, катионы которых находятся в низшей степени окисления. Например: SnCl2, FeCl2 .
Сложные вещества, у которых анионы достигают предельной отрицательной степени окисления. Например: KI, H2S, NH3 .
Вещества, ионы которых находятся в промежуточных степенях окисления могут быть как окислителем, так и восстановителем Например: Na2SO3 .
Мерой восстановительных свойств служит величина энергии ионизации (это энергия, необходимая для последовательного отделения электронов от атома.)
Слайд 7Три типа окислительно-восстановительных реакций.
- межмолекулярные,
- внутримолекулярные,
- диспропорционирования
- В межмолекулярных ОВР
SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2
2 Fe 3+ + e = Fe 2+ - восстановление
1 Sn 2+ - 2е = Sn 4+ - окисление
Слайд 8 происходят с изменением степени окисления разных атомов в одной и
2 КClO3 → 2KCl + 3O2
2 Cl5+ + 6e = Cl - - восстановление
3 2О2- - 4е- = О2 - окисление
Внутримолекулярные
реакции
Слайд 9 Реакции диспропорционирования
протекают с одновременным уменьшением и увеличением степени окисления атомов
3HNO2 → HNO3 + 2NO + H2O
2 N 3+ + e = N 2+ - восстановление
1 N 3+ - 2е = N 5+ - окисление
Слайд 10Влияние среды на характер протекания ОВР
-
ОВР
В зависимости от среды может меняться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степени окисления атомов.
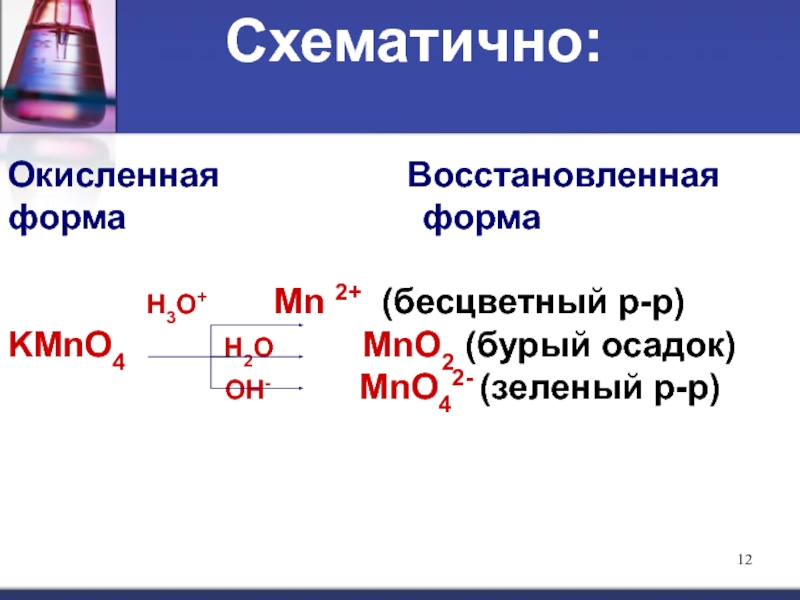
Слайд 11Рассмотрим несколько примеров.
1. KMnO4 (перманганат калия) является сильным окислителем, в сильнокислой
Слайд 12Окисленная Восстановленная
Н3О+ Мn 2+ (бесцветный р-р) KMnO4 Н2О MnO2 (бурый осадок)
ОН- МnО42- (зеленый р-р)
Схематично:
Слайд 13
Окислительно- восстановительная двойственность пероксида водорода
Пероксид водорода как окислитель.
Н –
| +
Н – O ОН- 2ОН- Н2О2 + 2е = 2ОН-
Пероксид водорода как восстановитель.
Н – О Н + O2 + 2Н3О+ ; Н2О2 - 2е + 2Н2О = O2 + 2Н3О+
| +
Н – O ОН- O2 + 2Н2О; Н2О2 + 2ОН- - 2е = O2 + 2Н2О
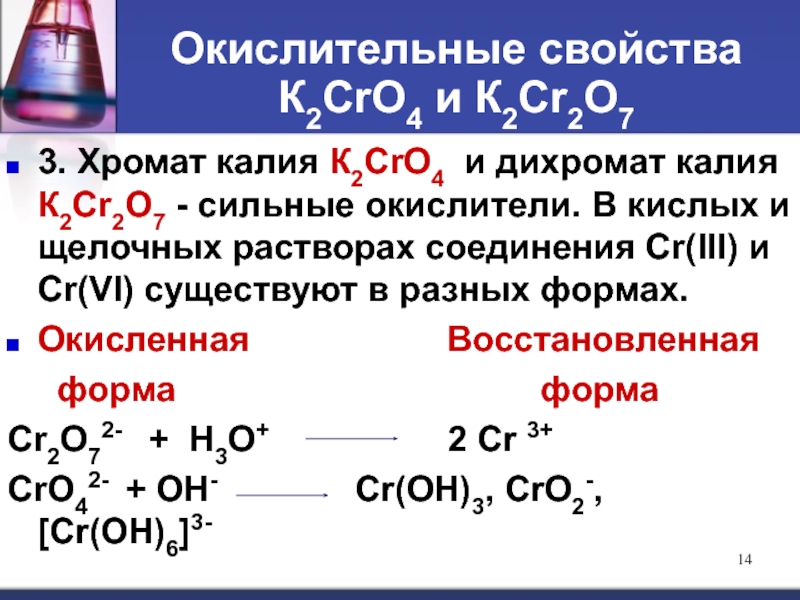
Слайд 14Окислительные свойства К2СrО4 и К2Сr2О7
3. Хромат калия К2СrО4 и дихромат калия
Окисленная Восстановленная
форма форма
Cr2O72- + H3O+ 2 Cr 3+
CrO42- + OH- Cr(OH)3, CrO2-, [Cr(OH)6]3-
Слайд 16Метод электронно-ионного баланса (метод полуреакций).
Реакции, протекающие в кислой среде.
Правило: если реакция
Слайд 17Пример 1.
КМnO4 + Na2SO3 + H2SO4 = MnSO4
ок вос среда
Решение
2 MnO4- + 8H+ + 5e = Mn2+ + 4H2O
5 SО32- + Н2О – 2е = SО42- + 2Н+
2MnО4- +16H++5SО32-+5Н2О=2Mn2++8H2O+5SO42- +10H+
2КMnО4 + 5Nа2SО3 + 3Н2SО4 = 2MnSO4 + К2SO4 +5Na2SO4 + 3H2O
КMnО4 –окислитель, вос-ся; Nа2SО3 –восстановитель, окис-ся
Слайд 18Пример 2.
Na2Cr2O7 +
ок. вос. среда
Решение.
1| Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O
3| 2Br- - 2e = Br2
Cr2O72- + 14H+ + 6Br- = 2Cr3+ + 7H2O + 3Br2
Na2Cr2O7 + 6KBr + 7 H2SO4 = Cr2(SO4)3 + 3Br2 +
3 К2SO4 + Na2SO4 + 7H2O
Na2Cr2O7 - окислитель, восстанавливается;
KBr - восстановитель, окисляется.
Слайд 19Реакции, протекающие в щелочной среде.
Правило: если реакция протекает в щелочной среде,
Слайд 20Пример 1.
Cr2O3 + KNO3 + KOH = K2CrO4 + KNO2
вос. ок. среда
Решение.
3 | NO3- + H2O + 2e = NO2- + 2OH-
1 | Cr2O3 + 10 OH- -6e = 2CrO4 2- + 5H2O
3NO3-+3H2O+Cr2O3+10OH-=3NO2-+6OH-+ 2CrO42- + 5 H2O
Cr2O3 + 3KNO3 + 4 KOH = 2 K2CrO4 + 3 KNO2 + 2 H2O
Cr2O3 - восстановитель, окисляется;
KNO3 - окислитель, восстанавливается.
Слайд 21Пример 2.
КMnО4 +Na2SO3 + KOH
ок. вос. среда
Решение.
2 | MnO4- + 1e = MnO4 2-
1 | SO32- + 2OH- - 2e = SO4 2- + H2O
2MnO4- + SO3 2- + 2 OH- = 2 MnO4 2- + SO4 2- + H2O
2 KМnO4 + Na2SO3 + 2 KOH = K2MnO4 + Na2SO4 + H2О
Слайд 22 Реакции, протекающие в нейтральной
среде.
Правило: если реакция протекает в нейтральной
Слайд 23Пример 1.
KMnO4 + Na2SO3 + H2O = MnO2 + Na2SO4
ок. вос.
Решение.
2 | MnO4- + 2H2O +3e = MnO2 + 4 OH-
3 | SO32- + H2O -2e = SO42- + 2 H+
2 MnO4-+4H2O+3SO32-+3H2O=2MnO2 +8OH- + 6H++ 3SO42-
2KMnO4 +3Na2SO3 + H2O = 2 MnO2 + 3 Na2SO4 + 2 KOH
КMnО4–окислитель, вос-ся; Nа2SО3–восстановитель, окис-ся
Слайд 24Пример 2.
MnSO4 + KMnO4 + H2O = MnO2 + K2SO4 +
вос. ок. среда
Решение.
2 | MnO4- + 2 H2O + 3e = MnO2 + 4 OH-
3 | Mn2+ + 2 H2O - 2e = MnO2 + 4 H+
2MnO4- +4H2O+3Mn2++6H2O=2MnO2+8OH-+3MnO2+12H+
3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4
MnSO4 - восстановитель, окисляется;
KMnO4 – окислитель, восстанавливается.
Слайд 25
Теория возникновения равновесных электродных и окислительно-восстановительных потенциалов
Определение направления окислительно-восстановительного
Слайд 27При погружении металла в воду…
Ме + m Н2О → Меn+(Н2О)m+n e
Ме
Меn+(Н2О)m+ne → Ме + m Н2О
Слайд 28
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Слайд 29Если металл погрузить в раствор его соли, то процессы протекающие на
Для сравнения электродных потенциалов различных металлов выбирают стандартные условия: температура - 250 С, давление - 101,3 кПа, активность одноименного иона - 1 моль/л. Разность потенциалов, возникающая между металлом и раствором в таких условиях называется стандартным электродным потенциалом.
Слайд 31Стандартный электродный потенциал (Е0)- это ЭДС гальванического элемента, составленного из данного
H2 ↔ 2H+ + 2e
Pt (H2) | 2H+
Платиновый электрод, покрытый платиновым
порошком, в водном растворе кислоты с
с(Н+) = 1 моль/л и омываемый
газообразным водородом (р = 1 атм)
при 298 К
Слайд 36Хлорсеребряный электрод (ХСЭ)
Ag, AgCl | KCl
Электрод второго рода
При погружении
Слайд 37Ag ↔ Ag+ + e (1)
AgCl
KCl → K+ + Cl- (3)
Чем больше концентрация KCl, тем больше концентрация Cl- , тем меньше растворимость AgCl и меньше концентрация Ag+. [Ag+] в этих условиях очень мала и практически неопределяема. Потенциал, возникающий на границе Ag|Ag+ определяется уравнением Нернста:
Ks
Слайд 39↑[Cl-] → ↓[Ag+] → ↓E х.с.
Значение потенциала хлорсеребряного электрода при
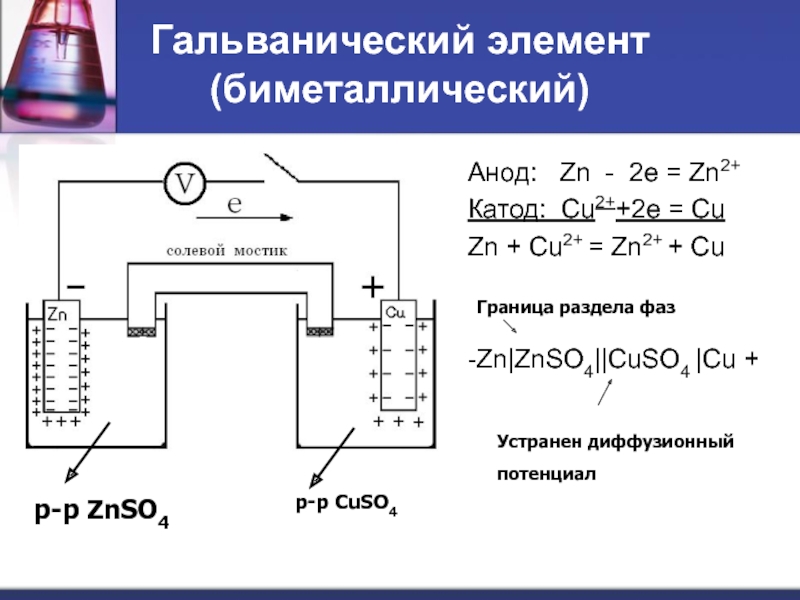
Слайд 41Гальванический элемент (биметаллический)
Анод: Zn - 2e = Zn2+
Катод: Cu2++2e =
Zn + Cu2+ = Zn2+ + Cu
-Zn|ZnSO4||CuSO4 |Cu +
р-р ZnSO4
р-р CuSO4
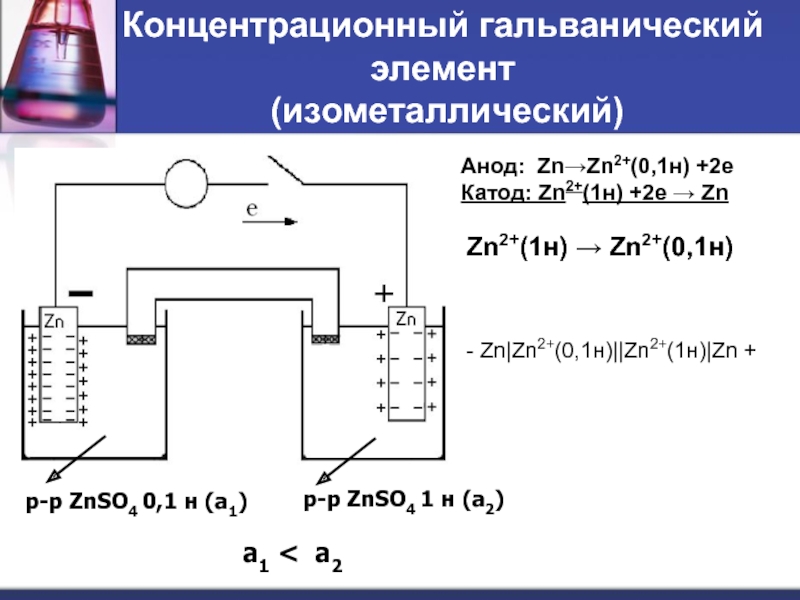
Слайд 43Концентрационный гальванический элемент
(изометаллический)
Анод: Zn→Zn2+(0,1н) +2e
Катод: Zn2+(1н) +2e → Zn
Zn2+(1н)
- Zn|Zn2+(0,1н)||Zn2+(1н)|Zn +
p-p ZnSO4 0,1 н (a1)
p-p ZnSO4 1 н (a2)
a1 < a2
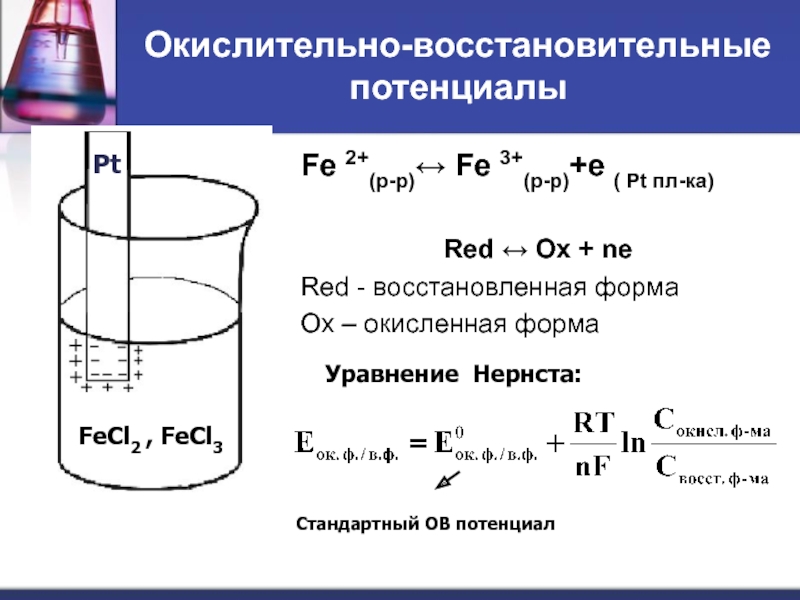
Слайд 45Окислительно-восстановительные потенциалы
Fe 2+(р-р)↔ Fe 3+(р-р)+е ( Pt пл-ка)
Red ↔ Ox +
Red - восстановленная форма
Ox – окисленная форма
Уравнение Нернста:
Стандартный ОВ потенциал
Слайд 47ОВ потенциал зависит от:
температуры
природы окислителя и восстановителя
концентрации окисленной
рН среды
Слайд 48Стандартный ОВ потенциал
ЭДС ГЭ, составленного из окислительно-восстановительной системы, содержащей окисленную и
Слайд 49
Если составить ГЭ из MnO4-/Mn2+ и (Pt),H2|2H+,
MnO4- + 8H+ +5e →Mn2+ + 4H2O
a(MnO4-)= a(Mn2+)=1 моль/л
а(H+)= 1 моль/л
Слайд 50В реальных условиях расчет ОВ потенциала системы MnO4-/Mn2+ производится по уравнению
Слайд 51Чем больше стандартный ОВ потенциал системы, тем в большей степени выражены
MnO4-/Mn2+ E0= 1,51 B
Fe3+/Fe2+ E0= 0,77 B
Sn4+/Sn2+ E0= 0,15 B
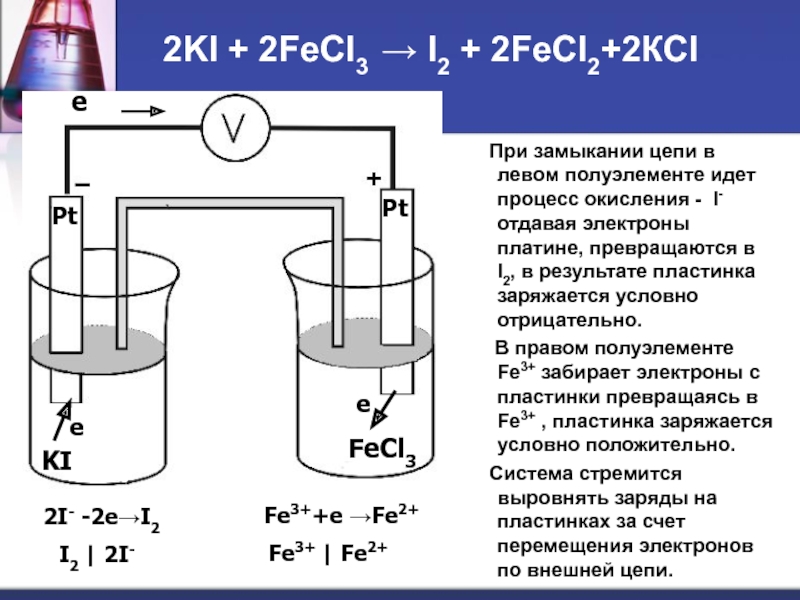
Слайд 562KI + 2FeCl3 → I2 + 2FeCl2+2КCl
При замыкании цепи
В правом полуэлементе Fe3+ забирает электроны с пластинки превращаясь в Fe3+ , пластинка заряжается условно положительно.
Система стремится выровнять заряды на пластинках за счет перемещения электронов по внешней цепи.
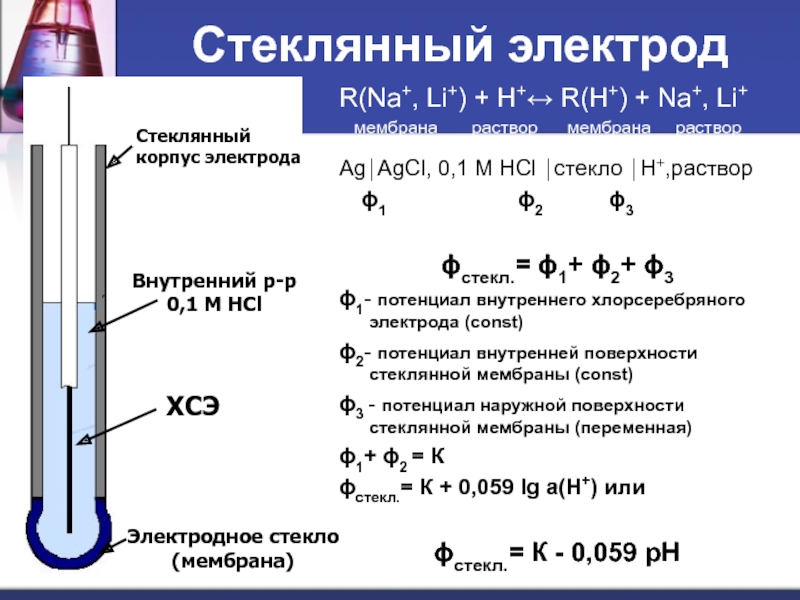
Слайд 58Стеклянный электрод
R(Na+, Li+) + H+↔ R(H+) + Na+, Li+
мембрана
Ag⏐AgCl, 0,1 M HCl ⏐стекло ⏐H+,раствор
ϕ1 ϕ2 ϕ3
ϕстекл.= ϕ1+ ϕ2+ ϕ3
ϕ1- потенциал внутреннего хлорсеребряного электрода (const)
ϕ2- потенциал внутренней поверхности стеклянной мембраны (const)
ϕ3 - потенциал наружной поверхности стеклянной мембраны (переменная)
ϕ1+ ϕ2 = К
ϕстекл.= К + 0,059 lg a(H+) или
ϕстекл.= К - 0,059 рН
Слайд 59Определение рН в лабораторном практикуме
ЭДС представленной цепи Ецепи:
Ецепи= Е х.с. – К + 0,059рН
































![↑[Cl-] → ↓[Ag+] → ↓E х.с. Значение потенциала хлорсеребряного электрода при разных концентрациях водного раствора](/img/tmb/5/405371/28067768f4991545733a0ff92188644b-800x.jpg)