- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные процессы презентация
Содержание
- 1. Окислительно-восстановительные процессы
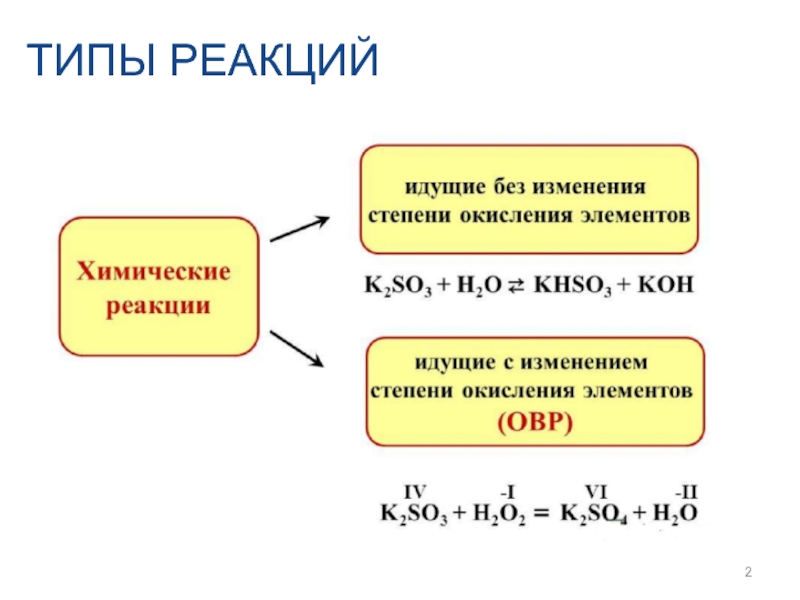
- 2. ТИПЫ РЕАКЦИЙ
- 3. 1. Окислительно-восстановительные реакции – это реакции, сопровождающиеся
- 4. Степень окисления
- 5. Окисление и восстановление
- 6. Окисление и восстановление Число электронов, отдаваемых атомами
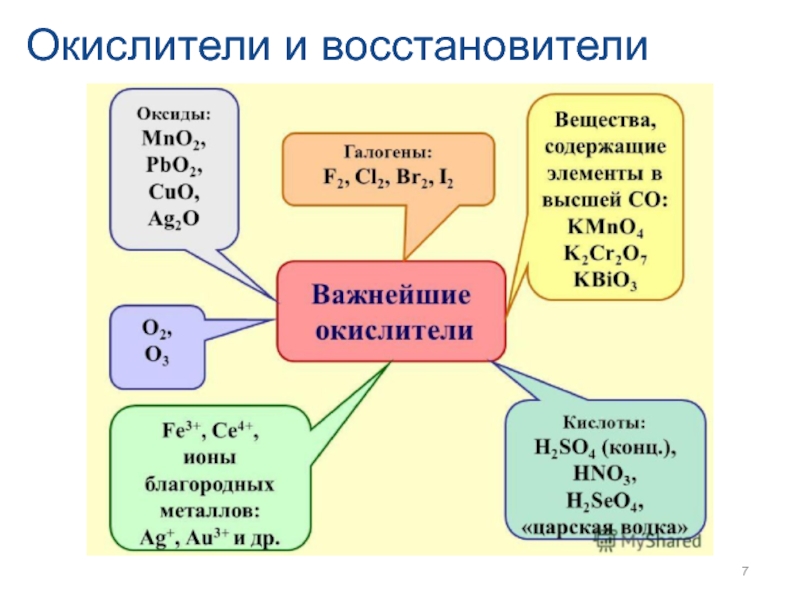
- 7. Окислители и восстановители
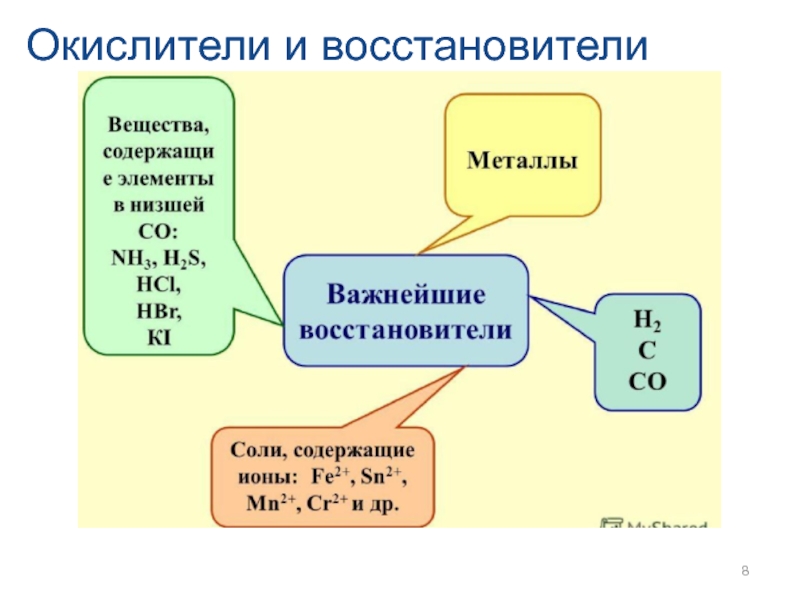
- 8. Окислители и восстановители
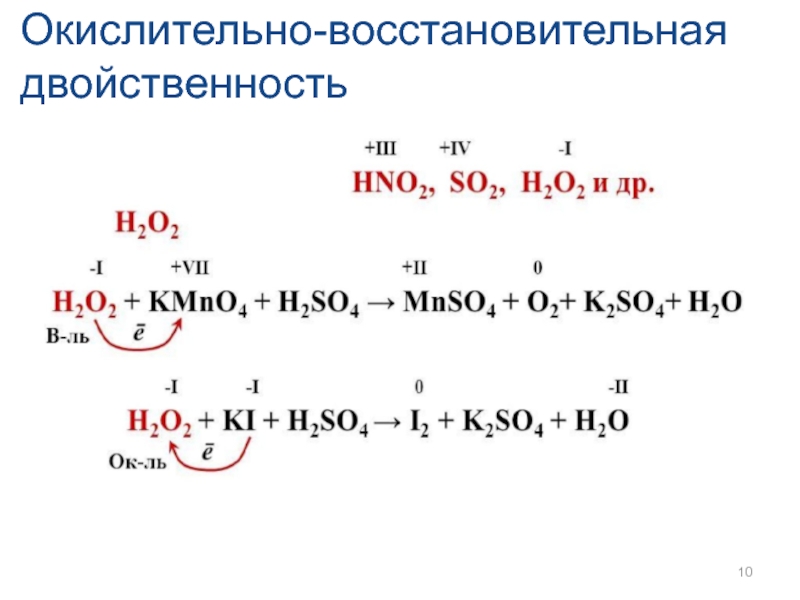
- 9. Окислительно-восстановительная двойственность степень окисления азота в соединениях изменяется в пределах от (– 3) до (+5)
- 10. Окислительно-восстановительная двойственность
- 11. Метод электронного баланса
- 12. Ионно-электронный метод (полуреакций)
- 13. Ионно-электронный метод (полуреакций)
- 14. Ионно-электронный метод (полуреакций)
- 15. Ионно-электронный метод (полуреакций)
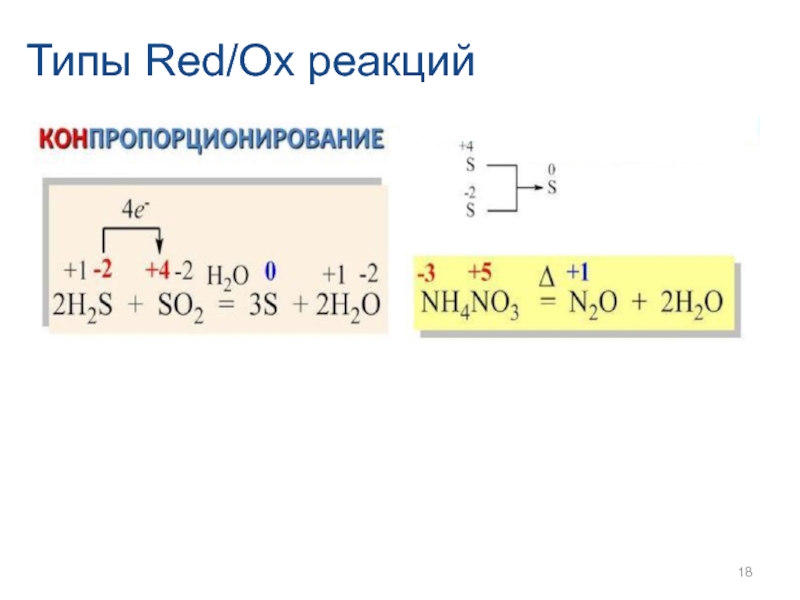
- 16. Типы Red/Ox реакций
- 17. Типы Red/Ox реакций
- 18. Типы Red/Ox реакций
- 19. Типы Red/Ox реакций 4. Окислительно-восстановительные реакции
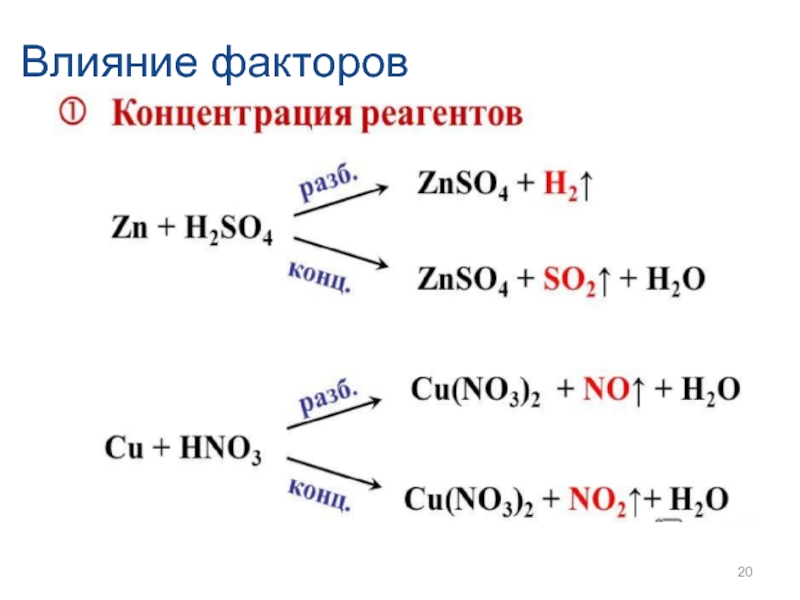
- 20. Влияние факторов
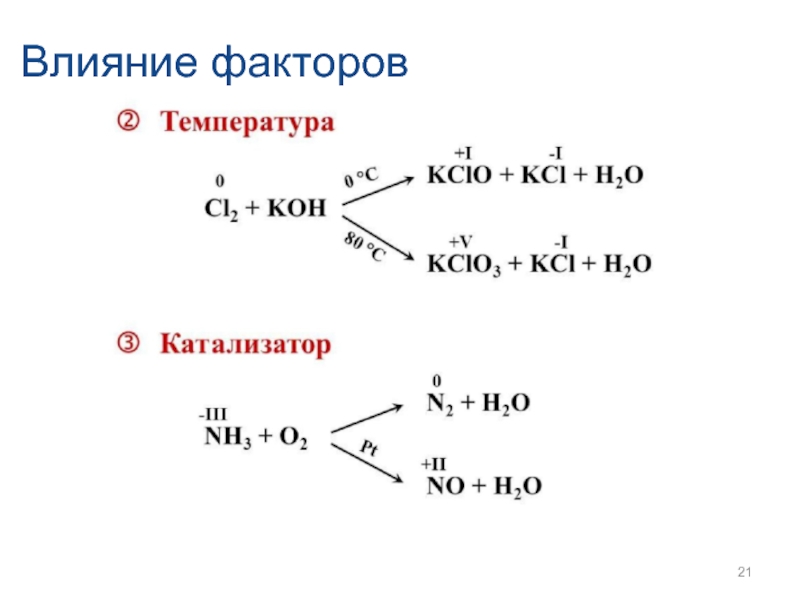
- 21. Влияние факторов
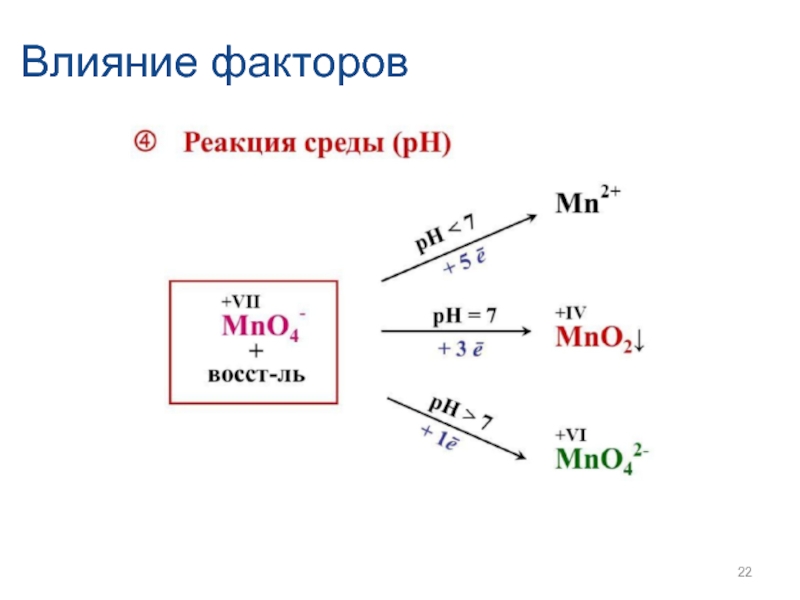
- 22. Влияние факторов
- 23. Энергетикa Red/Ox процессов Итак, если условием
- 24. Энергетикa Red/Ox процессов
- 25. Энергетикa Red/Ox процессов Кс = 10127
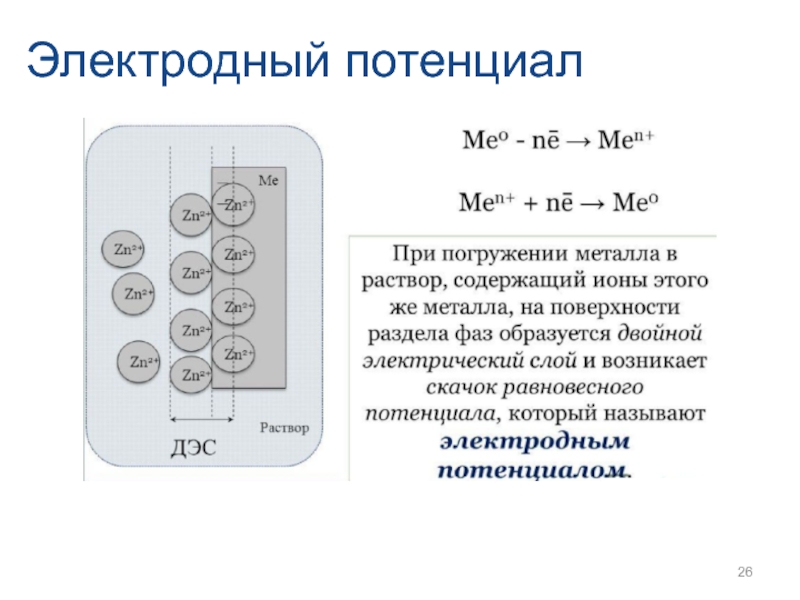
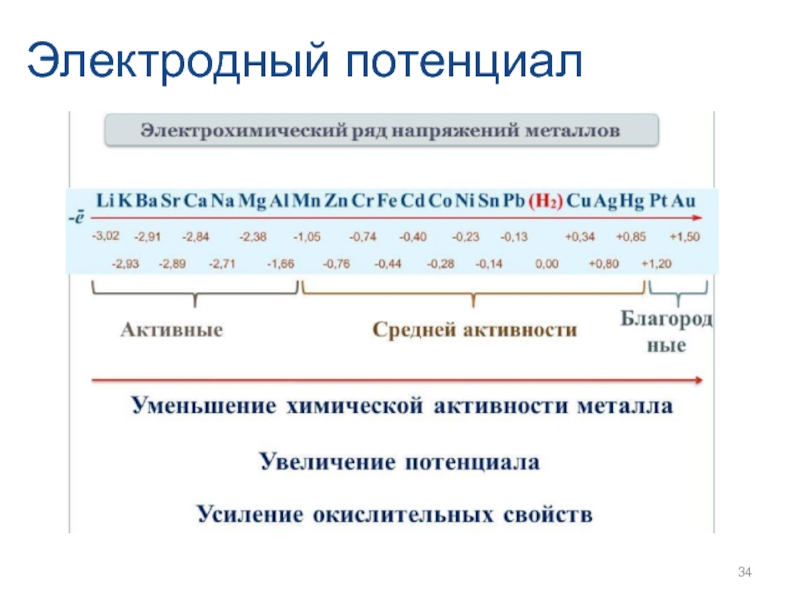
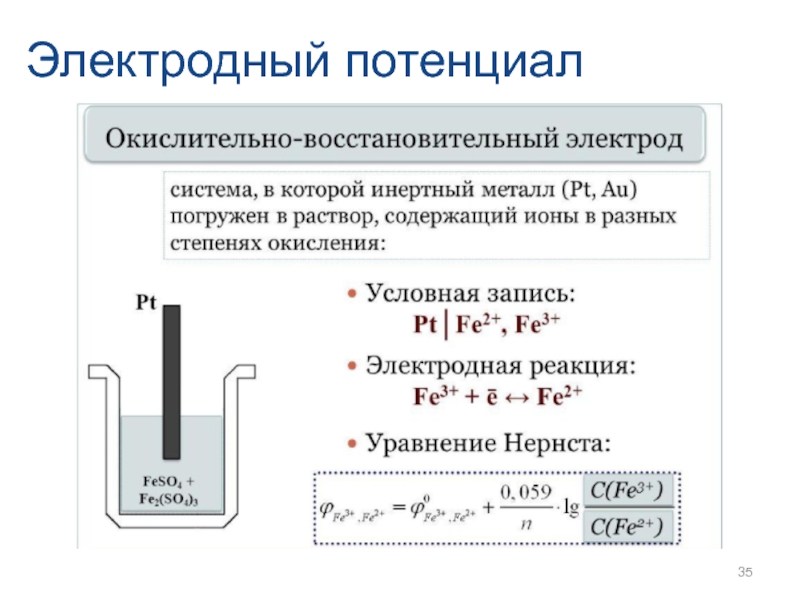
- 26. Электродный потенциал
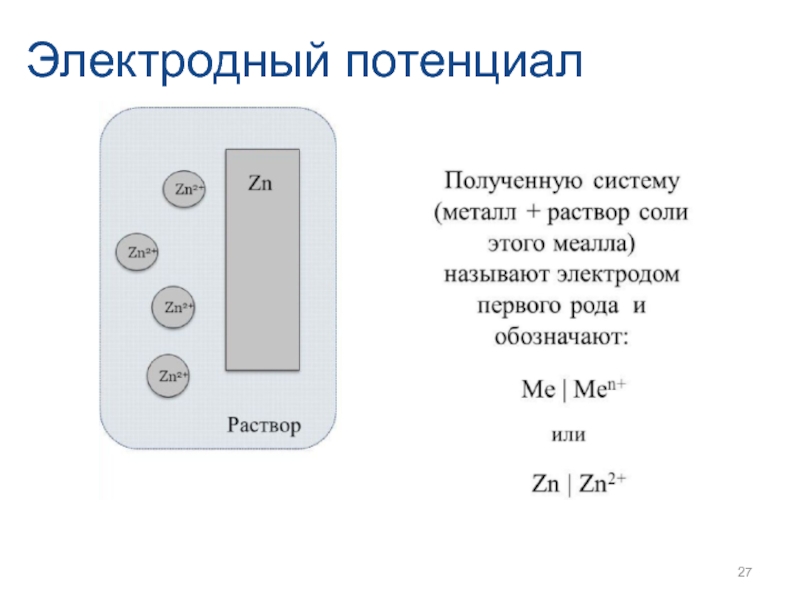
- 27. Электродный потенциал
- 28. Электродный потенциал
- 29. Электродный потенциал
- 30. Электродный потенциал
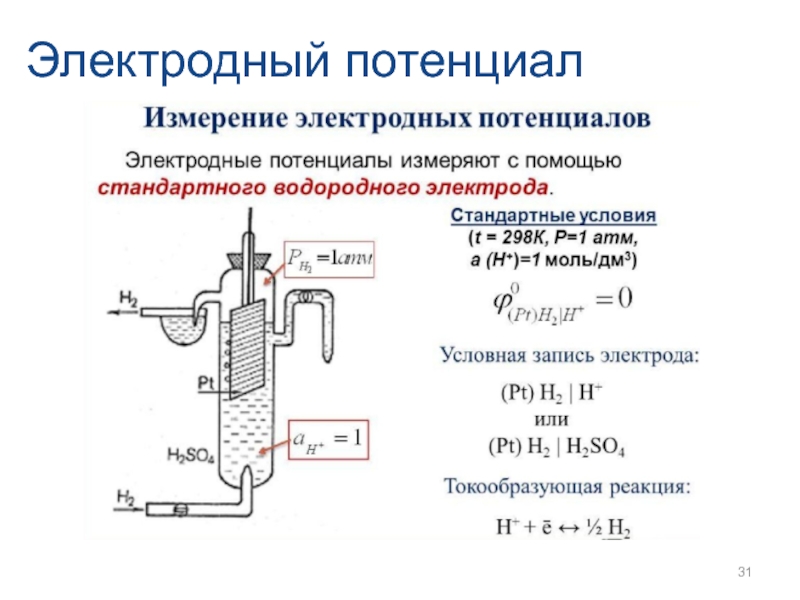
- 31. Электродный потенциал
- 32. Электродный потенциал
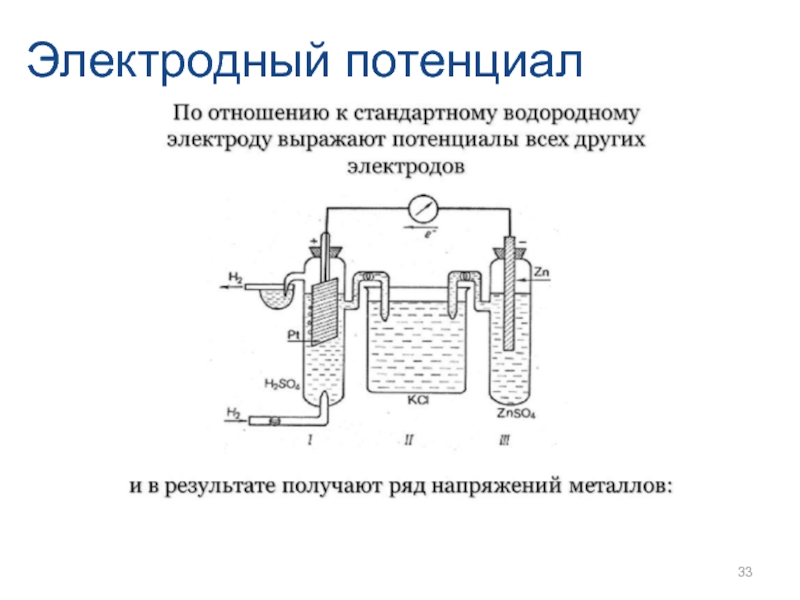
- 33. Электродный потенциал
- 34. Электродный потенциал
- 35. Электродный потенциал
- 36. Гальванические элементы Е0Zn / Zn2+ = -0,76
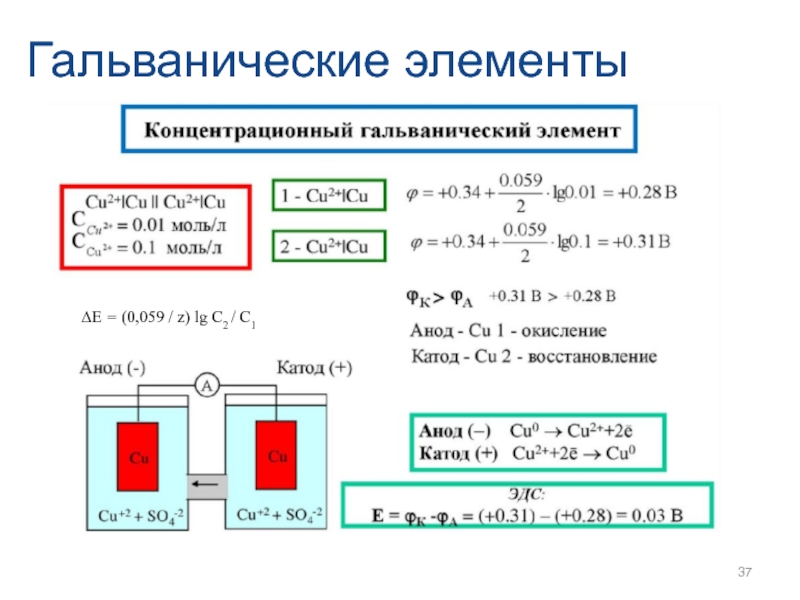
- 37. Гальванические элементы ∆Е = (0,059 / z) lg C2 / C1
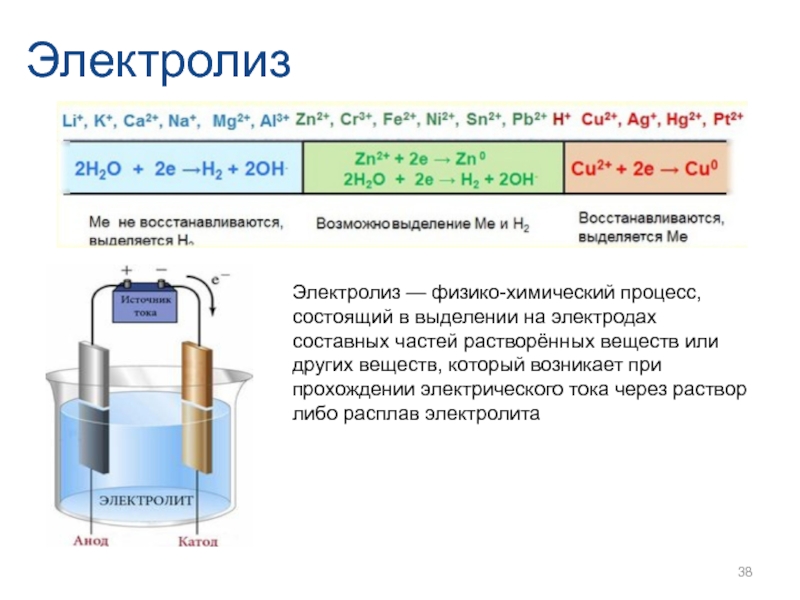
- 38. Электролиз Электролиз — физико-химический процесс, состоящий в
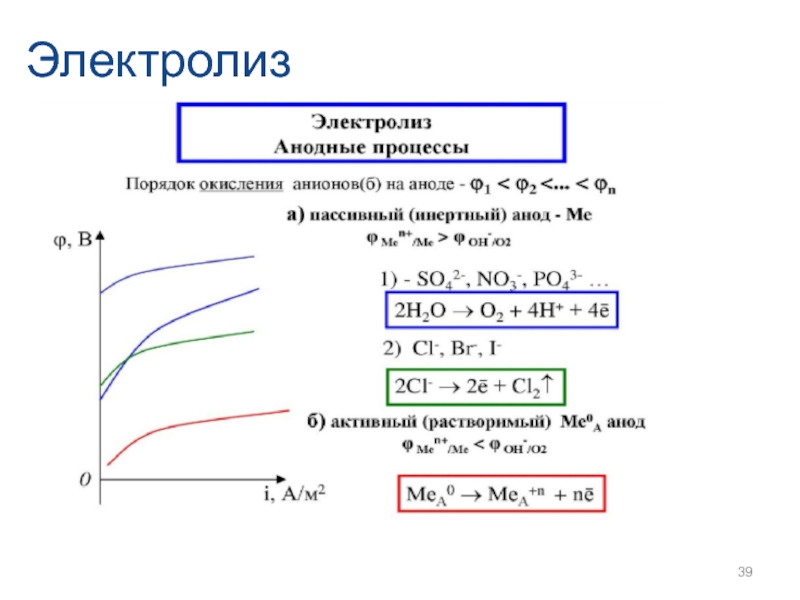
- 39. Электролиз
- 40. Электролиз 1. Электролиз водного раствора соли, образованной
- 41. Электролиз 3. Электролиз водного раствора соли, образованной
- 42. Электролиз 5. Электролиз водного раствора щелочи и кислоты
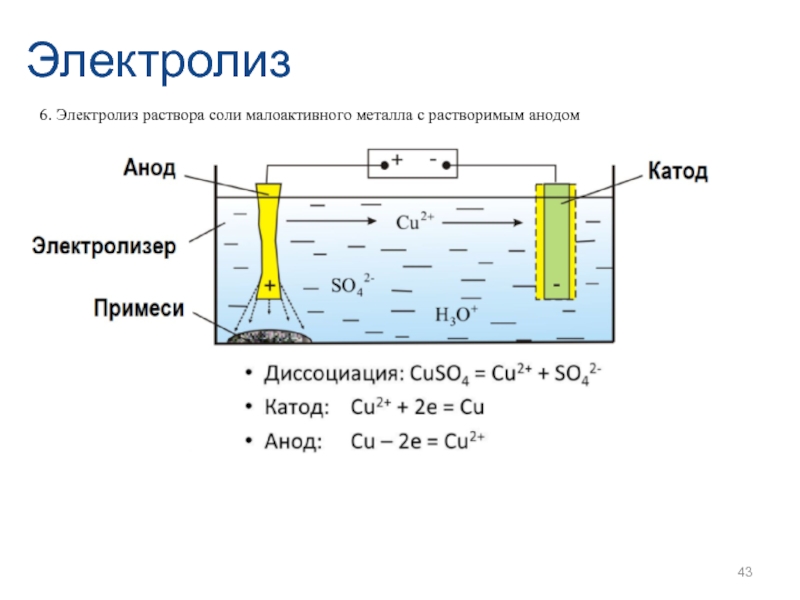
- 43. Электролиз 6. Электролиз раствора соли малоактивного металла с растворимым анодом
- 44. Электролиз 7. Соль образована металлом, стоящем в
- 45. Законы электролиза для выделения одного эквивалента вещества
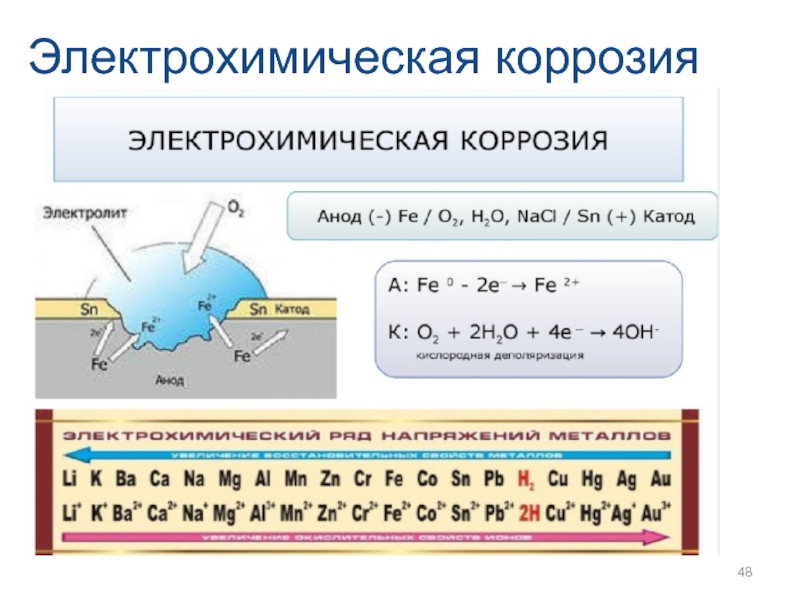
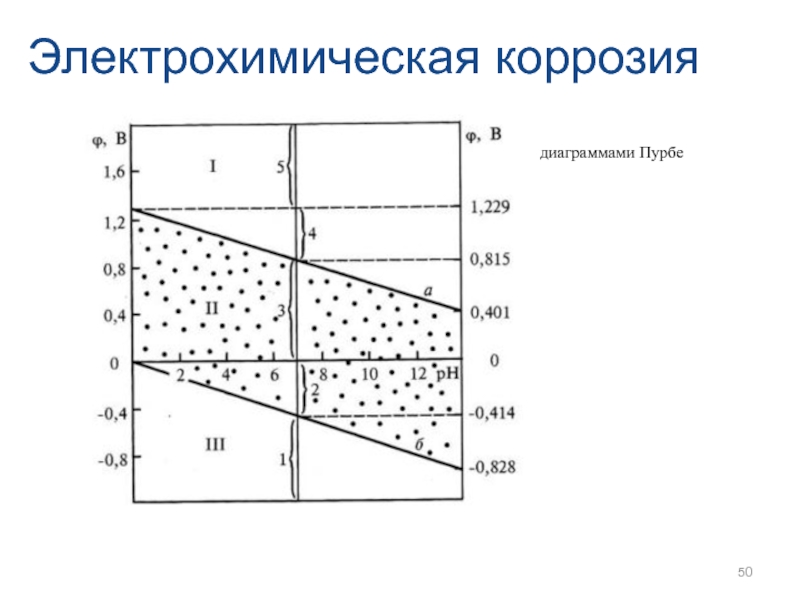
- 46. Электрохимическая коррозия
- 47. Электрохимическая коррозия
- 48. Электрохимическая коррозия
- 49. Электрохимическая коррозия
- 50. Электрохимическая коррозия диаграммами Пурбе
Слайд 1Лекция № 6
Окислительно-восстановительные процессы
1. Понятие степени окисления.
2. Способы выражения
3. Коллигативные свойства растворов.
4. Основные положения теории электролитической диссоциации. 5. Количественные характеристики процесса диссоциации.
6. Степень электролитической диссоциации. Классификация растворов по величине α.
7. Закон разбавления Оствальда.
8. Ионное произведение воды. Водородный и гидроксильный показатель.
9. Гидролиз, сущность процесса.
10. Произведение растворимости.
Слайд 31. Окислительно-восстановительные реакции – это реакции, сопровождающиеся переходом электронов от одних
2. Степень окисления – это заряд атома элемента в соединении, вычисленный из условного предположения, что все связи в молекуле являются ионными.
3. Правила определения степеней окисления
Степень окисления
Слайд 6Окисление и восстановление
Число электронов, отдаваемых атомами восстановителя (калия), равно числу электронов,
Слайд 9Окислительно-восстановительная двойственность
степень окисления азота в соединениях изменяется в пределах от (–
Слайд 19Типы Red/Ox реакций
4. Окислительно-восстановительные реакции с участием
более двух элементов
FeS2 + HNO3 = Fe2(SO4)3 + NO + …
2FeS2+10НNО3 = Fe2(SO4)3 + 10NО + Н2SO4 + 4H2O
Слайд 23Энергетикa Red/Ox процессов
Итак, если условием самопроизвольного протекания процесса является неравенство
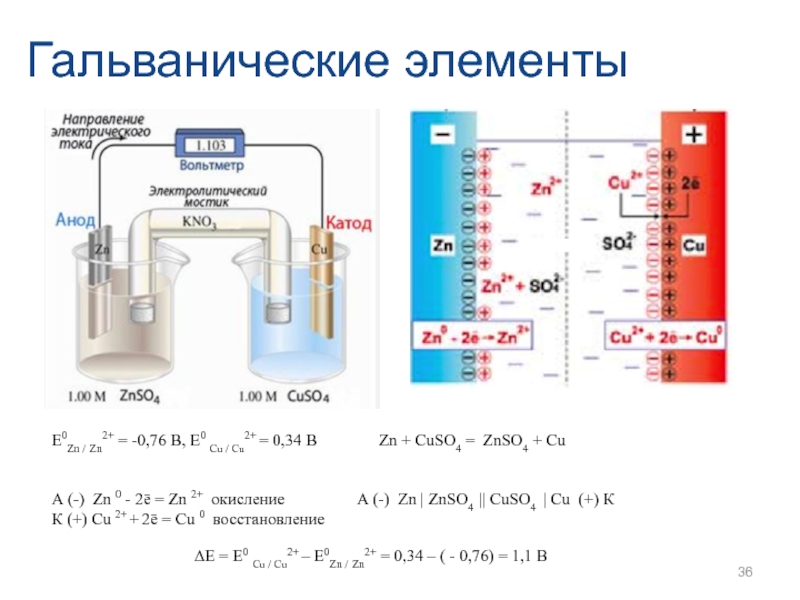
Слайд 36Гальванические элементы
Е0Zn / Zn2+ = -0,76 В, Е0 Cu / Cu2+
А (-) Zn 0 - 2ē = Zn 2+ окисление
К (+) Сu 2+ + 2ē = Сu 0 восстановление
Zn + СuSО4 = ZnSО4 + Сu
А (-) Zn | ZnSО4 || СuSО4 | Cu (+) К
∆Е = Е0 Cu / Cu2+ – Е0Zn / Zn2+ = 0,34 – ( - 0,76) = 1,1 В
Слайд 38Электролиз
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей
Слайд 40Электролиз
1. Электролиз водного раствора соли, образованной активным металлом и бескислородной кислотой,
2. Электролиз водного раствора соли образованной активным металлом и кислородосодержащей кислотой
Слайд 41Электролиз
3. Электролиз водного раствора соли, образованной малоактивным металлом и кослородосодержащей кислотой
4.
Слайд 44Электролиз
7. Соль образована металлом, стоящем в раду напряжений после алюминия до
Законы электролиза
m=kQ (1)
где: m – масса образовавшегося или подвергшегося превращениям вещества, г; Q - количество электричества, Кл; А-ч. Так как Q=I*t, то m=kIt, где I - сила тока, А;
t – время электролиза, с, ч;