- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обзор разных типов химических связей презентация
Содержание
- 1. Обзор разных типов химических связей
- 2. Дихромат калия K2Cr2O7 Дихромат калия K2Cr2O7 Оксид
- 3. Химическая связь - взаимодействие между атомами, приводящее
- 4. Термодинамика процесса образования химической связи Процесс
- 5. Изменение потенциальной энергии в системе из двух
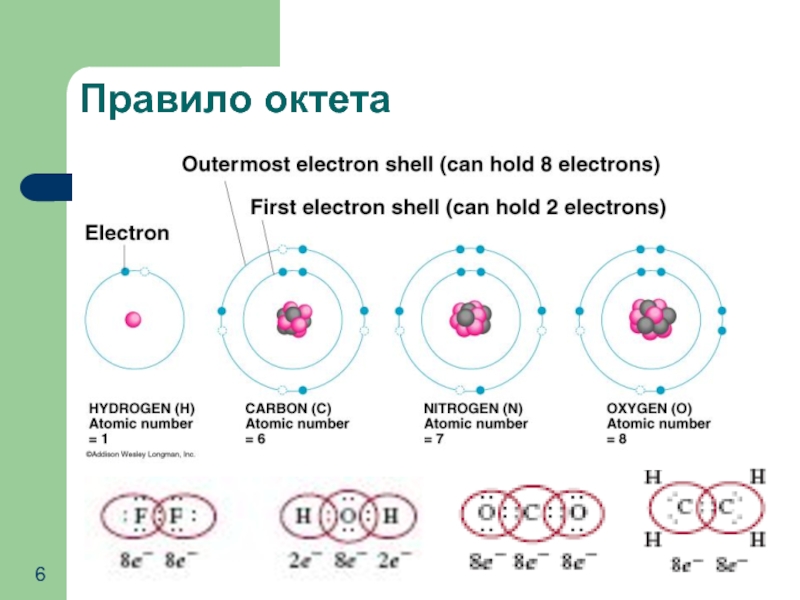
- 6. Правило октета
- 7. Образование химической связи разных типов: модели Передача
- 8. Ионная связь: Энергия кристаллической решетки Энергия
- 9. Hard, rigid solids at room temperature High
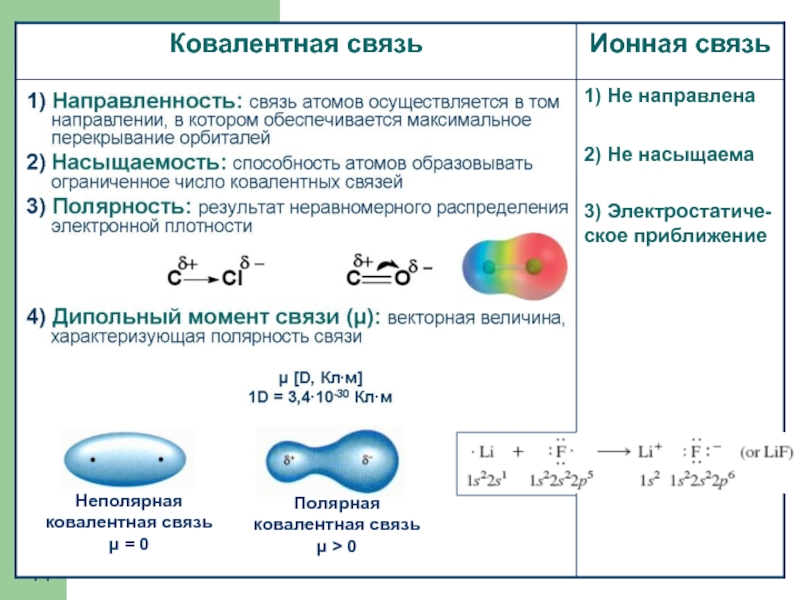
- 10. Ковалентная связь Атомы, образующие ковалентную связь, обобществляют
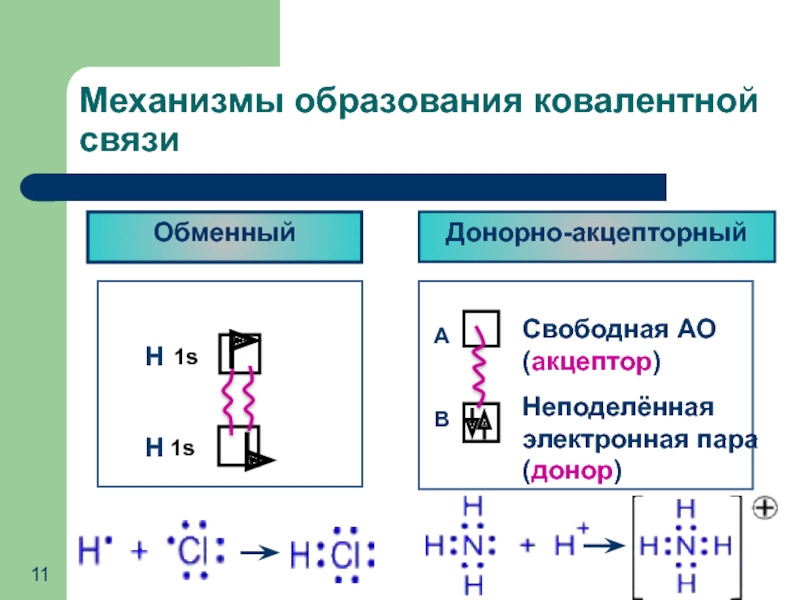
- 11. Механизмы образования ковалентной связи Обменный Донорно-акцепторный
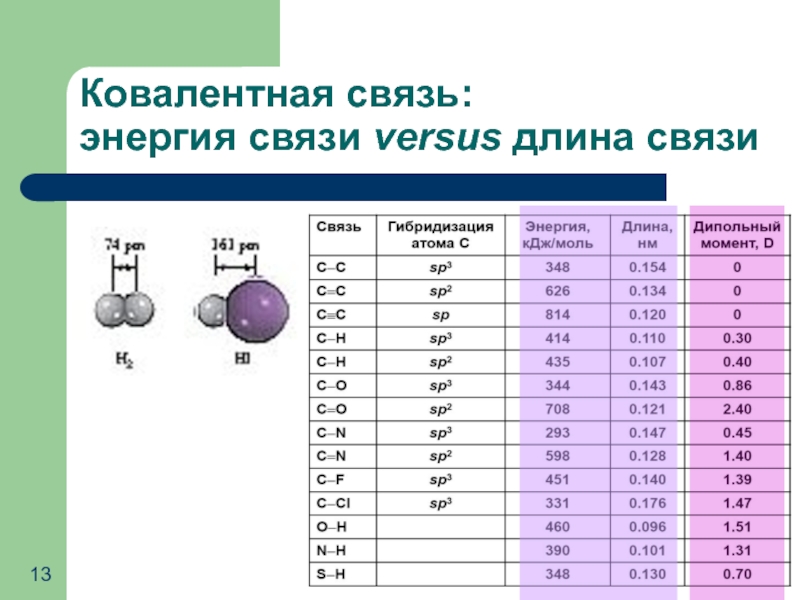
- 12. Характеристики ковалентной связи 1) Длина связи –
- 13. Ковалентная связь: энергия связи versus длина связи
- 14. 1) Не направлена 2) Не насыщаема 3) Электростатиче-ское приближение
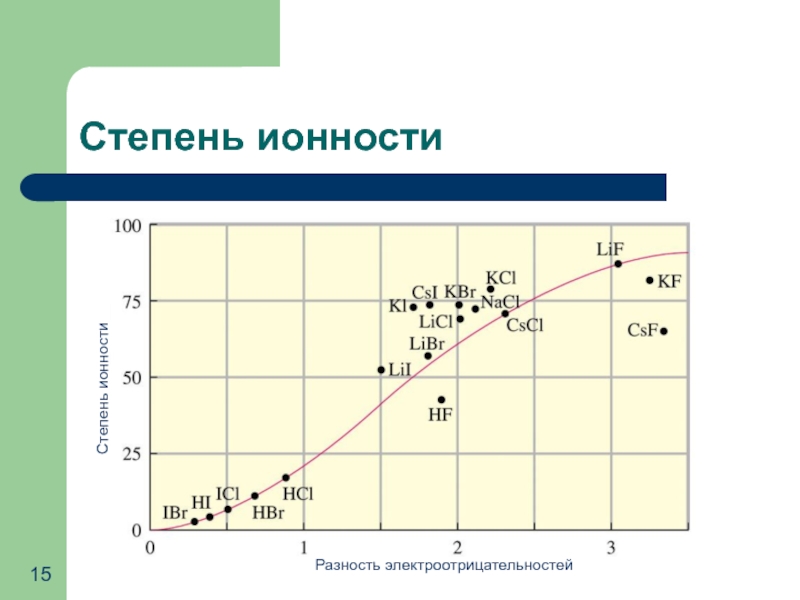
- 15. Степень ионности Разность электроотрицательностей Степень ионности
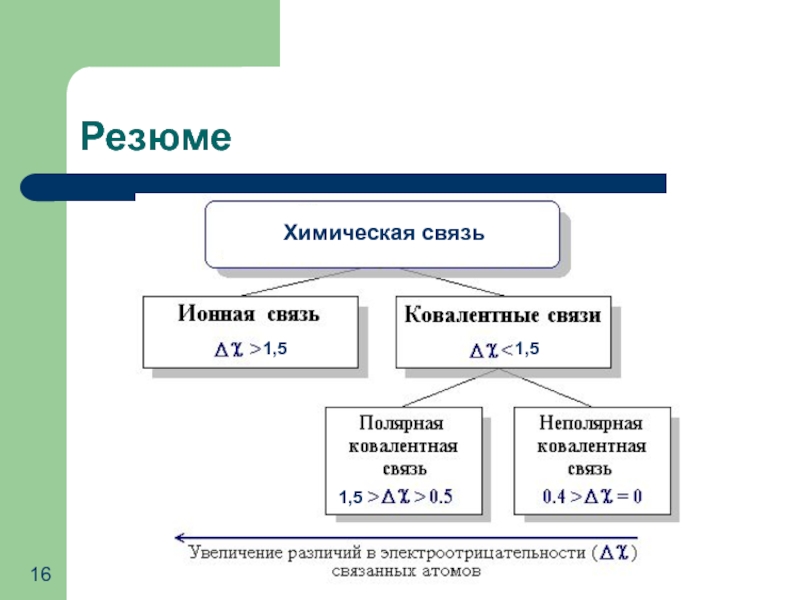
- 16. Резюме
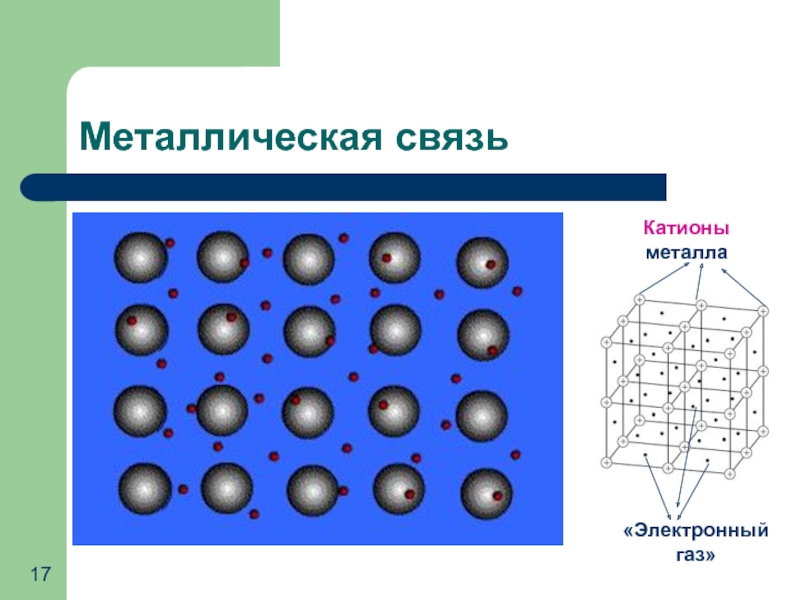
- 17. Металлическая связь Катионы металла «Электронный газ»
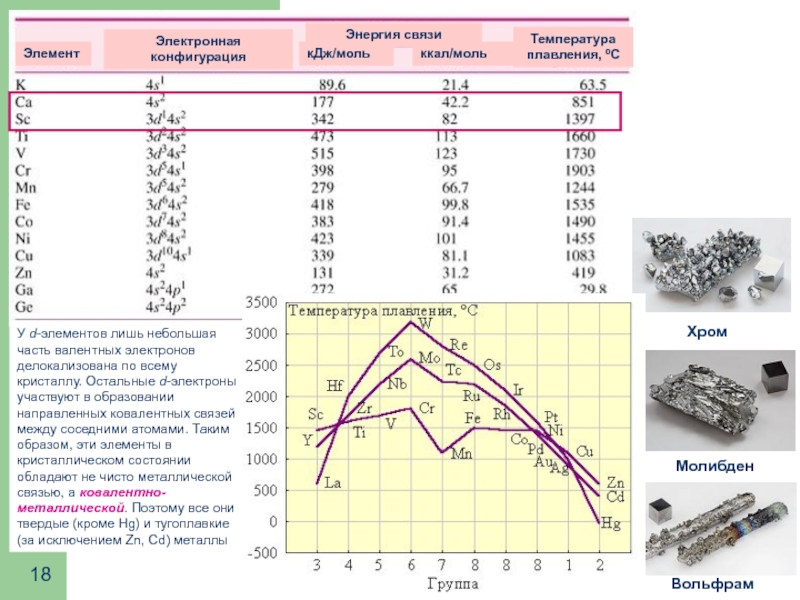
- 18. У d-элементов лишь небольшая часть валентных электронов
- 19. Межмолекулярные взаимодействия Водородная связь Слабые межмолекулярные взаимодействия (силы Ван-дер-Ваальса) Диполь-дипольные Ион-дипольные Дисперсионные
- 20. Водородная связь: механизм образования - электростатический
- 21. Ассоциация молекул (повышение Ткип, объемные эффекты)
- 22. Водородная связь: влияние на свойства воды Лед/вода
- 23. Ориентационные силы, диполь-дипольное притяжение Осуществляется между молекулами,
- 24. Слабые межмолекулярные взаимодействия: влияние на свойства соединений
Слайд 2Дихромат калия K2Cr2O7
Дихромат калия K2Cr2O7
Оксид никеля (II) NiO
Оксид магния
MgO
Магний
Золото
Медь
Сера
Br2
Сахароза
C12H22O11
Слайд 3 Химическая связь - взаимодействие между атомами, приводящее к образованию устойчивой системы
Л. Полинг
1901 - 1994
Химическая связь
Слайд 4Термодинамика процесса образования химической связи
Процесс самопроизвольный, т.е. ∆ G
Т∆S < 0, а это не способствует образованию ХС
Основной причиной образования химических связей между атомами с образованием молекулы является понижение полной энергии системы при переходе от свободных атомов к молекуле
∆ G < 0 только если ∆Н < 0
S2
S1
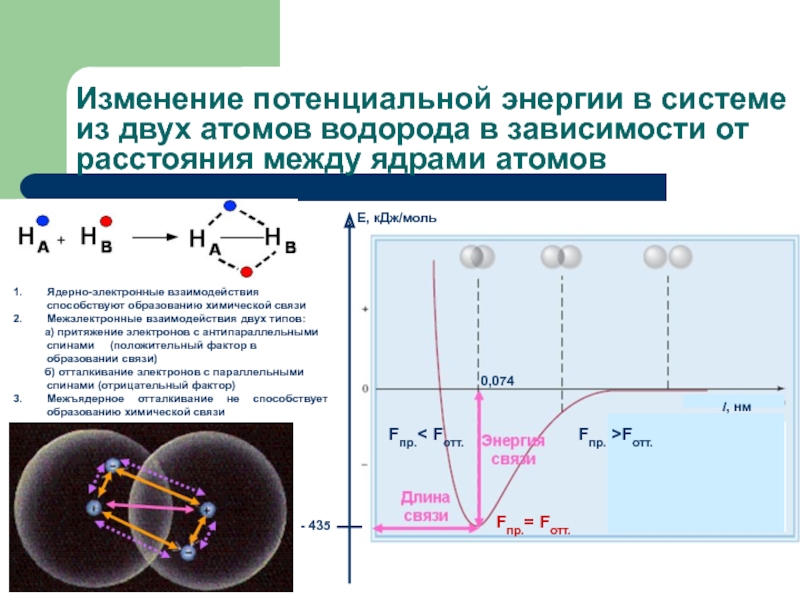
Слайд 5Изменение потенциальной энергии в системе из двух атомов водорода в зависимости
Ядерно-электронные взаимодействия способствуют образованию химической связи
Межэлектронные взаимодействия двух типов:
а) притяжение электронов с антипараллельными спинами (положительный фактор в образовании связи)
б) отталкивание электронов с параллельными спинами (отрицательный фактор)
Межъядерное отталкивание не способствует образованию химической связи
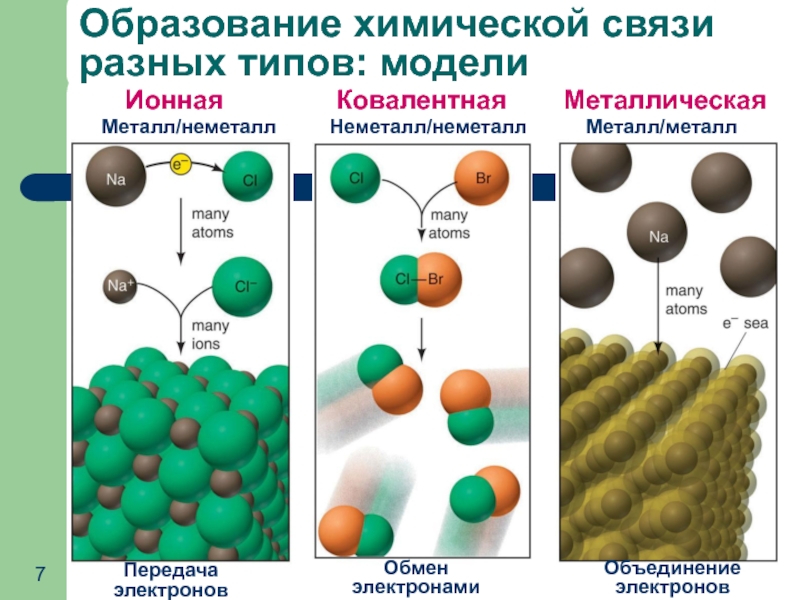
Слайд 7Образование химической связи разных типов: модели
Передача электронов
Обмен
электронами
Объединение электронов
Ионная
Ковалентная
Металлическая
Металл/неметалл
Неметалл/неметалл
Металл/металл
Слайд 8Ионная связь:
Энергия кристаллической решетки
Энергия кристаллической решетки – энергия, необходимая для
Слайд 9Hard, rigid solids at room temperature
High melting point
Dissolve in polar solvents
(if soluble)
Solutions conduct electricity
Melts conduct electricity
Closely packed dense structures
Properties of ionic compounds
Слайд 10Ковалентная связь
Атомы, образующие ковалентную связь, обобществляют электроны
Каждая ковалентная связь образуется 2
В образовании связей участвуют только валентные электроны
Copyright © Cengage Learning. All rights reserved
Структуры Льюиса
Слайд 12Характеристики ковалентной связи
1) Длина связи – расстояние между центрами связанных атомов
2)
3) Энергия связи – энергия, выделяющаяся при образовании химической связи и характеризующая ее прочность
(200-1000 кДж/моль)
4) Энергия диссоциации – энергия, необходимая для гомолитического расщепления отдельной связи в молекуле (для двухатомных молекул равна энергии связи)
BF3
CH4
BeH2
Слайд 18У d-элементов лишь небольшая часть валентных электронов делокализована по всему кристаллу.
Слайд 19Межмолекулярные взаимодействия
Водородная связь
Слабые межмолекулярные взаимодействия (силы Ван-дер-Ваальса)
Диполь-дипольные
Ион-дипольные
Дисперсионные
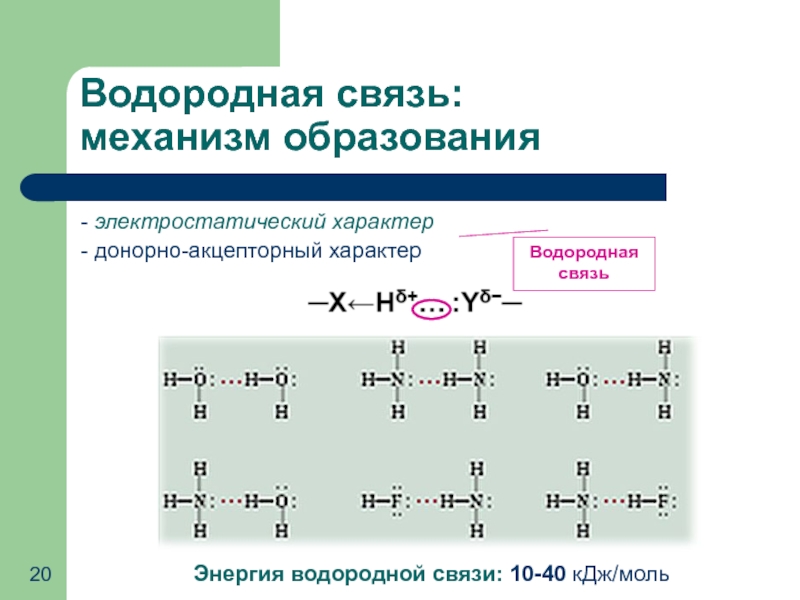
Слайд 20Водородная связь:
механизм образования
- электростатический характер
- донорно-акцепторный характер
Энергия водородной связи: 10-40
Водородная связь
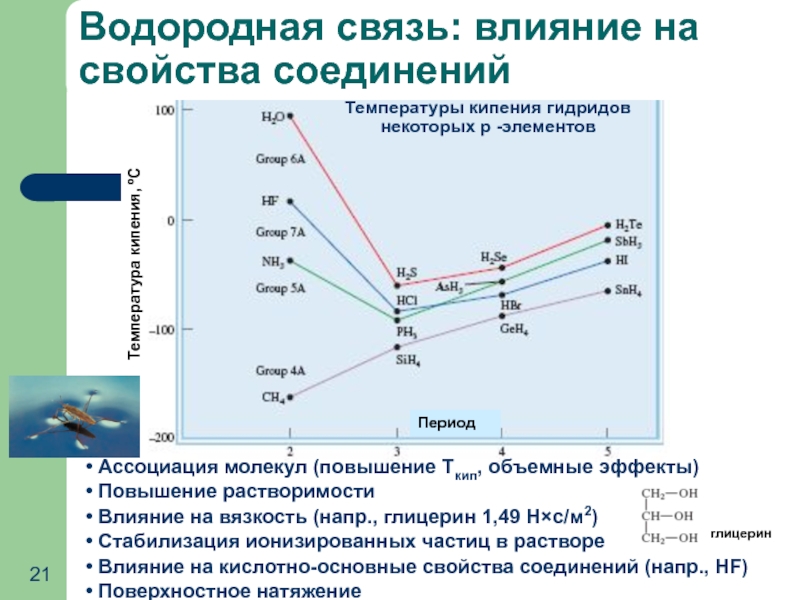
Слайд 21 Ассоциация молекул (повышение Ткип, объемные эффекты)
Повышение растворимости
Влияние на
Стабилизация ионизированных частиц в растворе
Влияние на кислотно-основные свойства соединений (напр., HF)
Поверхностное натяжение
Водородная связь: влияние на свойства соединений
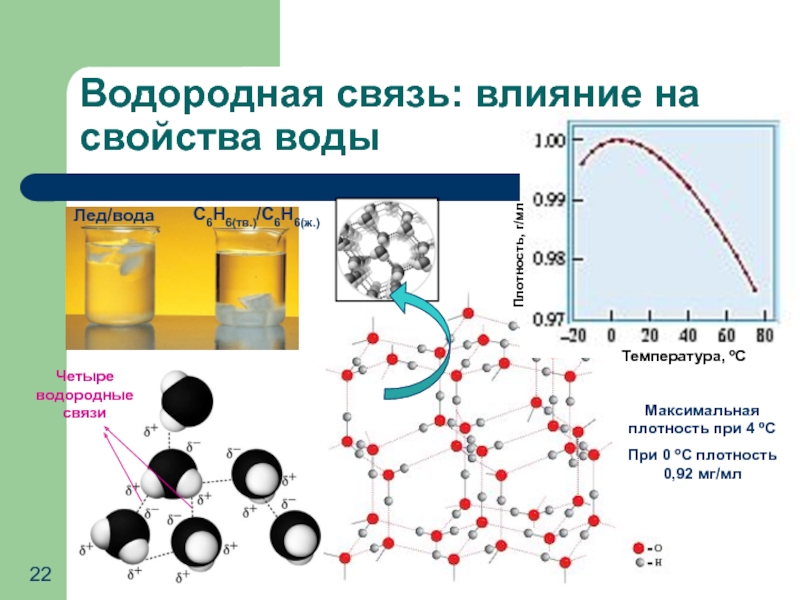
Слайд 22Водородная связь: влияние на свойства воды
Лед/вода
С6Н6(тв.)/С6Н6(ж.)
Температура, ºС
Плотность, г/мл
Четыре водородные связи
Максимальная плотность
При 0 ºС плотность 0,92 мг/мл
Слайд 23Ориентационные силы, диполь-дипольное притяжение
Осуществляется между молекулами, являющимися постоянными диполями
E ~ 1/r3
Дисперсионное
E ~ 1/r6
Ион-дипольное взаимодействие
катион
Индуцированный диполь
Индукционное притяжение
Постоянный диполь
Слабые межмолекулярные взаимодействия
Силы
Ван-дер-Ваальса
Слайд 24Слабые межмолекулярные взаимодействия: влияние на свойства соединений
Конденсация (напр., конденсация гелия
Повышение температуры кипения (напр., CH3F -78,4 ºC; CCl4 76,5 ºC) и плавления
Соединения включения, комплексы краун-эфиров
Стабилизация пространственной структуры белковой молекулы
Способность гекконов взбираться по гладким поверхностям, например стеклу
Дициклогексано-18-краун-6 (связывание К+)
Вещество