- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общие способы получения металлов презентация
Содержание
- 1. Общие способы получения металлов
- 2. Знакомство человека с металлами началось с золота,
- 3. К семи известным металлам уже только в
- 4. В окружающей нас среде химические элементы металлы
- 5. Форма нахождения элементов металлов в естественных условиях
- 6. Если металл в природных условиях находится в
- 7. Однако большинство металлов получают в результате химических
- 8. Чтобы получить металлы из руды в свободном
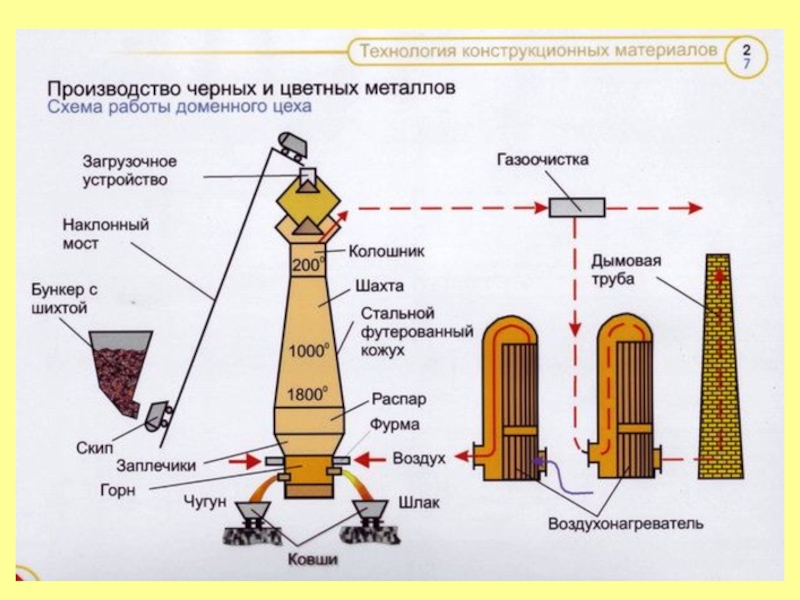
- 9. Технологические процессы, лежащие в основе промышленных способов
- 10. Восстановление с помощью водорода Водород как восстановитель
- 11. Восстановление металлами (металлотермия) Металлы используются в качестве
- 12. При высокой температуре углерод и оксид углерода(II) являются сильными восстановителями: CuO+CO=Cu+CO2 PbO+C=Pb+CO
- 13. Свободный углерод (в виде кокса) и оксид
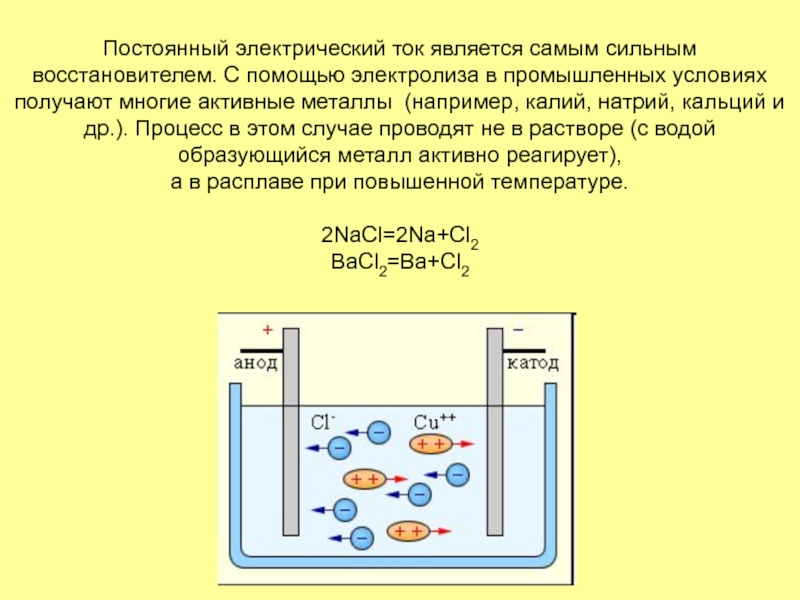
- 15. Постоянный электрический ток является самым сильным восстановителем.
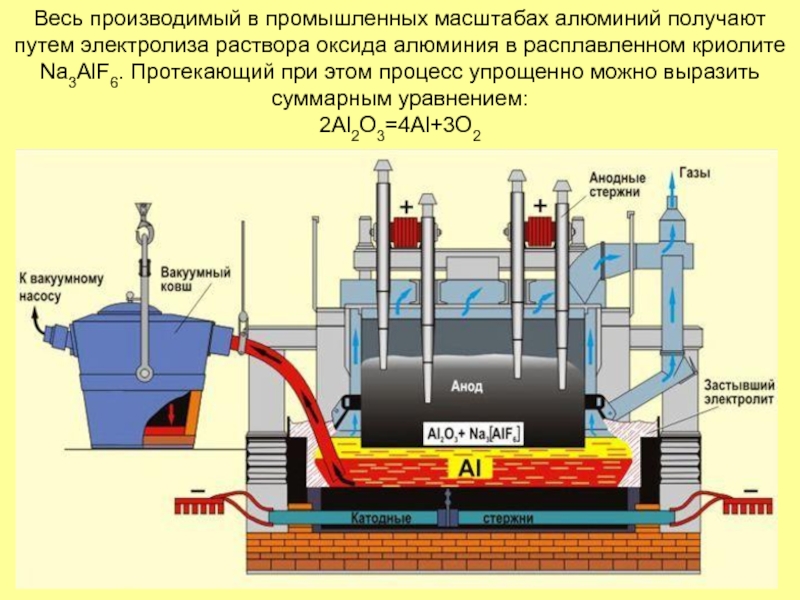
- 16. Весь производимый в промышленных масштабах алюминий получают
- 17. Домашнее задание: Параграф §65.
- 18. Список используемых источников http://ru.wikipedia.org/wiki/Каменноугольный_кокс http://ru.wikipedia.org/wiki/Серебро http://www.vostok-met.ru/wp-content/uploads/2011/02/image014.jpg http://www.dekatop.com/wp-content/uploads/2011/07/gold_01.jpg http://files.school-collection.edu.ru/dlrstore/5ca811f4-7aea-42ca-b5da-534dfd445e6c/IMG_0861.JPG http://www.asia.ru/images/target/img/product/11/90/18/11901863.jpg http://www.rmms.ru/userFiles/image/Металлургия.jpg http://inventions.ru/i/photo/aluminium1.jpg http://artdesign21.narod.ru/image/1/4951011bc5f764b6ef74e651154_prev.jpg
Слайд 2Знакомство человека с металлами началось с золота, серебра и меди, то
Римский денарий цезаря Августа, 27 г. до Р.Х., отчеканен в городе Пергам
Слайд 3К семи известным металлам уже только в средние века прибавились цинк,
Слайд 4В окружающей нас среде химические элементы металлы встречаются как в виде
Самородок серебра
Руда серебра
Слайд 5Форма нахождения элементов металлов в естественных условиях зависит от их химической
Самородок золота
Красный железняк (болотная руда)
Слайд 6Если металл в природных условиях находится в свободном состоянии, то его
Слайд 7Однако большинство металлов получают в результате химических реакций из руд. Руда –
Марганцевая руда
Слайд 8Чтобы получить металлы из руды в свободном состоянии, необходимо провести процесс
Кокс
Слайд 9Технологические процессы, лежащие в основе промышленных способов получения металлов из руд,
Слайд 10Восстановление с помощью водорода
Водород как восстановитель может использоваться для получения металлов
WO3+3H2=W+3H2O
CuO+H2=Cu+H2O
Восстановить до металла оксиды активных (Na, Ca, Al, Mg) металлов с помощью водорода невозможно.
Слайд 11Восстановление металлами (металлотермия)
Металлы используются в качестве восстановителей для получения других металлов
4CaO+2Al=Ca(AlO2)2+3Ca
Ca+2CsCl=CaCl2+2Cs