- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая и неорганическая химия. Введение презентация
Содержание
- 1. Общая и неорганическая химия. Введение
- 2. Лекция №1 Введение.
- 3. ВВЕДЕНИЕ ЦЕЛИ КУРСА создать основу для
- 4. План лекции: История химии. Роль отечественных и
- 5. Происхождение термина “химия”
- 6. Периодизация истории химии
- 7. Основные периоды в истории химии 1. Период
- 8. Античная атомистика V-IV в до н.э.
- 9. АЛХИМИЯ ЗАПАДНОЙ ЕВРОПЫ XVI в Оборудование
- 11. К концу XVIII в. в химии
- 12. Период научной химии XIX—XX вв За открытым
- 13. М. В. ЛОМОНОСОВ - ОСНОВОПОЛОЖНИК
- 14. Й. Я. БЕРЦЕЛИУС вычислил относительные атомные
- 15. МОЛЕКУЛЯРНАЯ ТЕОРИЯ АВОГАДРО
- 16. МЕЖДУНАРОДНЫЙ СЪЕЗД ХИМИКОВ В КАРЛСРУЭ.
- 17. На рубеже XVIII -
- 18. КАЗАНСКАЯ ХИМИЧЕСКАЯ ШКОЛА
- 19. Герман Иванович Гесс Герман Иванович Гесс занимался
- 20. Дмитрий Иванович Менделеев Менделеев оставил свыше 500
- 21. Итак , какие же основные понятия и
- 22. Основные понятия и законы химии.
- 23. Химия – это наука о
- 24. Задачи химии. Изучение веществ, их физических и
- 25. Основные понятия химии Атом – наименьшая
- 26. Химический элемент – это совокупность атомов с
- 27. Основные понятия химии Элементы принято обозначать
- 28. Химический знак (символ) – обозначает
- 29. Основные понятия химии Химические элементы существуют в
- 30. Примеры простых и сложных веществ: Н2
- 31. Аллотропия – способность химического элемента образовывать несколько
- 32. Аллотропные модификации углерода (С):
- 33. Аллотропия Аллотропные модификации фосфора Р: белый (желтый), красный и черный
- 34. Основные понятия химии Молекула – это электронейтральная
- 35. Химическая формула - это условная запись качественного и
- 36. Широко используются несколько видов химических формул: Простейшая
- 37. Что обозначают записи? H2- это одна
- 38. Масса атомов, молекул и ионов очень мала,
- 39. Атомная единица массы (а.е.м.) - внесистемная единица
- 40. Относительная атомная масса элемента Ar Относительная
- 41. Атомные массы элементов приведены в периодической системе элементов.
- 42. Найдите в ПСХЭ Д.И. Менделеева Относительную атомную
- 43. Масса молекулы Относительная молекулярная масса Мr (молекулярная
- 44. Количество вещества В Международной системе СИ за
- 45. В задачах : Р2O5 + 3H2O
- 46. Основные понятия химии Постоянная Авогадро (
- 47. Моль – единица количества вещества Основные понятия химии
- 48. Молярная масса (М) – масса 1 моля
- 49. Рассчитайте относительную молекулярную массу для следующих соединений:
- 50. Основные законы химии Закон
- 51. S2 + 2O2 = 2SO2 число атомов
- 52. Основные законы химии Закон объемных отношений Объемы
- 53. Основные законы химии Закон объемных отношений Следствие.
- 54. Закон постоянства состава вещества. Сформулирован Ж.-Л.
- 55. Современная
- 56. Соединения постоянного состава - дальтониды
- 57. Закон постоянства состава вещества Так, СО2 можно
- 58. Основные законы химии Закон Авогадро.
- 59. Закон Авогадро. Один моль любого
- 60. Следствия из закона Авогадро : 1. Молярный
- 61. Массы двух разных газов, занимающих
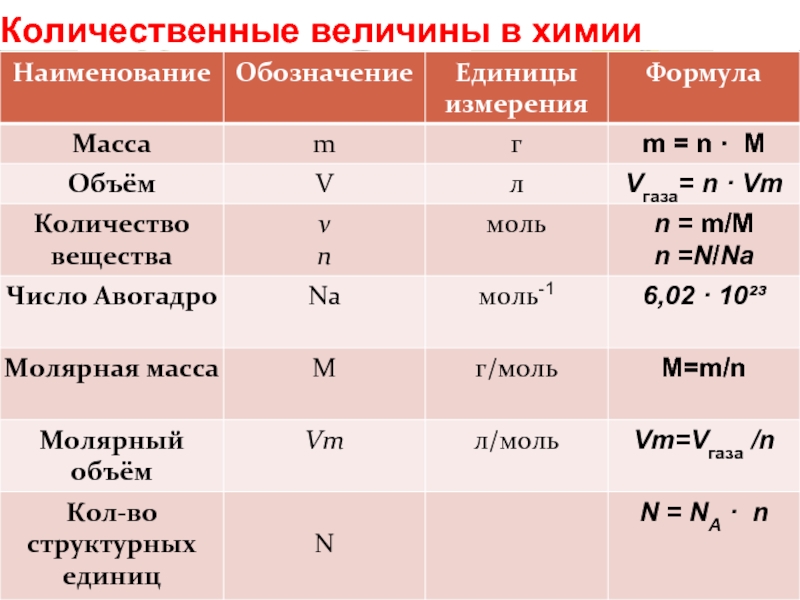
- 62. Количественные величины в химии
- 63. Примеры задач: 1.Какое количество вещества ( моль)
- 64. Роль химии Роль химии в жизни современного
- 65. Что дала людям химия
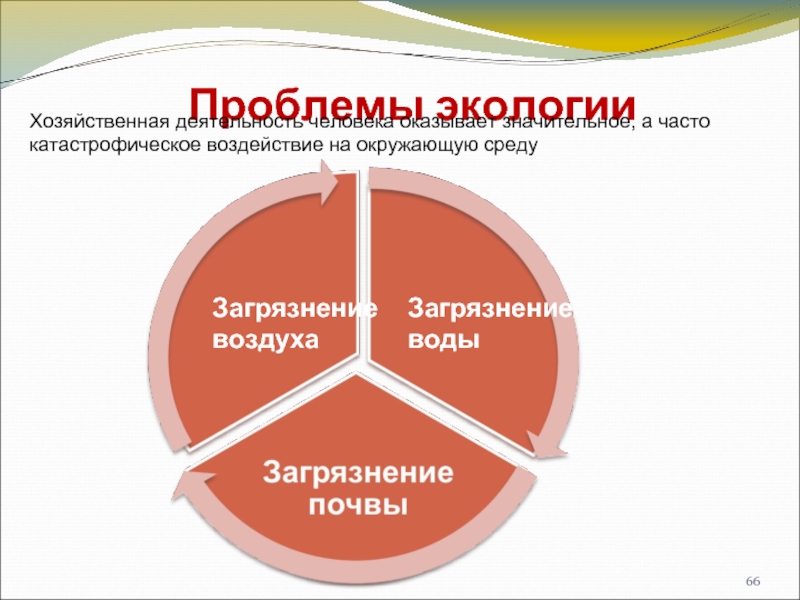
- 66. Проблемы экологии Загрязнение воды Загрязнение
- 67. 1. Загрязнение атмосферы Естественное газы
- 68. 2. Основные источники загрязнения воды
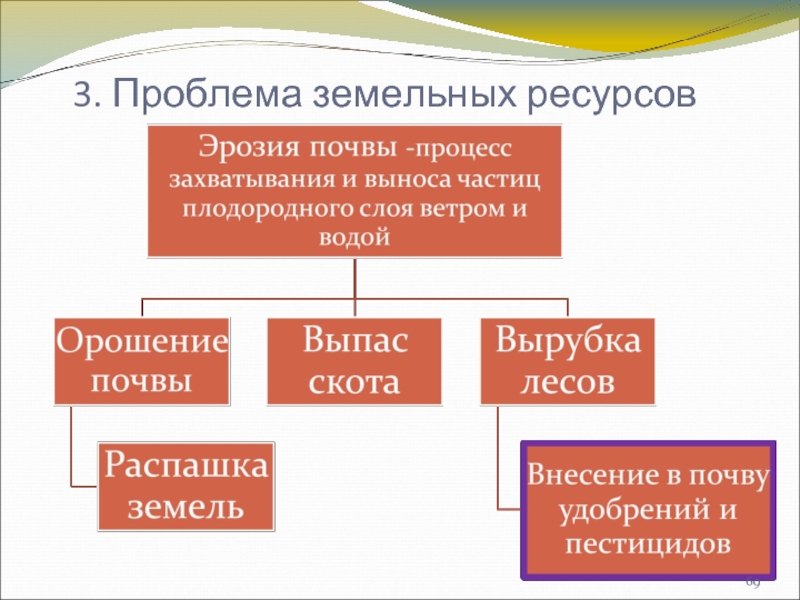
- 69. 3. Проблема земельных ресурсов
- 70. Истинное положение дел Природную среду загрязняют разные отрасли хозяйства, помимо химической промышленности:
- 71. Выводы : Опасна не сама ХИМИЯ,
- 72. Значение общей и неорганической химии В
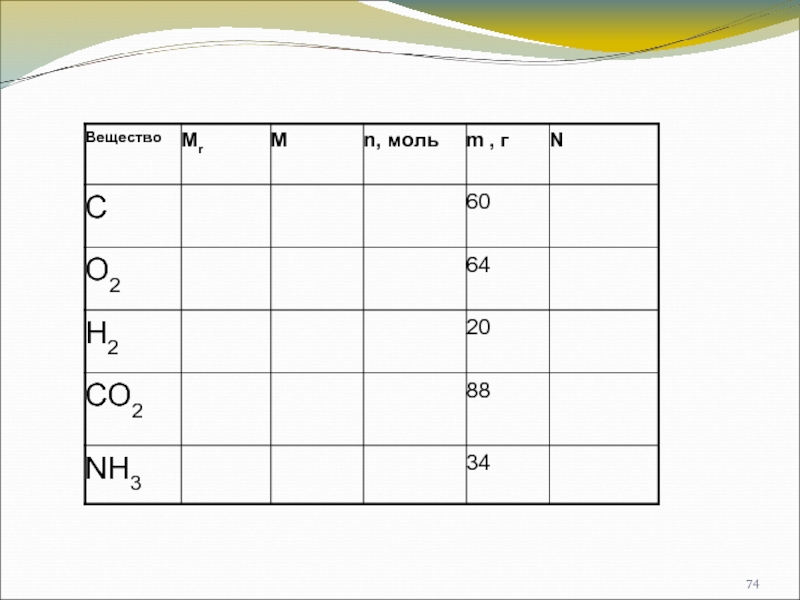
- 73. Рассчитайте молярную массу: 1 моль Fe2(SO3)3 2 моль Al(OH)3 3 моль CaO Примеры заданий:
- 75. Список используемой литературы О.С. Габриелян, И.Г. Остроумов,
- 76. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 3ВВЕДЕНИЕ
ЦЕЛИ КУРСА
создать основу для дальнейшего изучения химических дисциплин, сформировать элементарные
СОДЕРЖАНИЕ КУРСА
основные понятия и законы химии;
теория строения атома и образования химических связей в молекулах;
классы неорганических соединений;
общие закономерности протекания химических реакций, в том числе элементы химической термодинамики и химической кинетики;
основы теории растворов электролитов и неэлектролитов, закономерности окислительно-восстановительных и электрохимических процессов
типовые расчетные задачи
элементарные лабораторные навыки
Слайд 4План лекции:
История химии. Роль отечественных и зарубежных ученых в развитии химии.
Предмет
Основные законы и понятия химии
Значение неорганической химии в подготовке будущего фармацевта.
Химия и охрана окружающей среды.
Слайд 5Происхождение термина “химия”
Есть несколько версий:
от
из греческого χυμος ("хюмос"), которое можно перевести как "сок растения".
от другого греческого слова - χυμα ("хюма"), означающего "литье", "сплав - это искусство литья выплавки металлов, то есть металлургии.
Слайд 6Периодизация истории химии
Выделялют 2 основных
а) эмпирический (с древности до XVIIIв);
процесс познания через эксперимент.
б) теоретический. (XVIII – по н.в.)
В XVIII столетии все большее внимание ученые стали уделять осмыслению полученных опытных данных, попыткам объяснить их при помощи единой умозрительной концепции.
Слайд 7Основные периоды в истории химии
1. Период алхимии - с древности до
2. Период зарождения научной химии (XVI - XVIII век).
3. Период открытия основных законов химии - конец XVIII - первая половина XIX века
4. Современный период с 60-х годов XIX века до наших дней.
Разработаны периодическая классификация элементов, теория химического строения и стереохимия, теория электролитической диссоциации Аррениуса и т.д.
Слайд 8 Античная атомистика V-IV в до н.э.
Основателями первой древнегреческой
Демокрит.
Левкипп
Слайд 9АЛХИМИЯ ЗАПАДНОЙ ЕВРОПЫ XVI в
Оборудование алхимической лаборатории. Рисунки из книги
А. Либавия «Алхимия». Франкфурт. 1606 г.
Алхимическая лаборатория. Из книги: «Amphitheatrum Sapientiae Aeternae» by Heinrich Khunrath, 1595
Слайд 10
Роберт Бойль
Он положили начало рождению новой химической науки, отдельной от медицины.
Систематизируя многочисленные цветные реакции и реакции осаждения, Бойль положил начало аналитической химии. Он же стал автором одного из первых законов рождающейся физико-химической науки.
Благодаря исследованиям великого английского ученого Роберта Бойля в XVII вв. химия сформировалась как самостоятельная наука.
Слайд 11 К концу XVIII в. в химии был накоплен большой объем
Он открыл закон сохранения веществ.
Лавуазье был автором первой
классификации химических веществ
Лабораторное оборудование, которое использовал А.Л. Лавуазье
в восьмидесятых годах XVIII столетия.
Период открытия основных законов химии (с 90-х г. XVIII в. до середины XIX в.)
Слайд 12Период научной химии XIX—XX вв
За открытым Лавуазье законом сохранения массы последовал
Закон эквивалентов (И. В. Рихтер, 1791—1798)
Закон постоянства состава (Ж. Л. Пруст, 1799—1806)
Закон кратных отношений (Дж. Дальтон, 1803)
Закон объёмных отношений, или закон соединения газов (Ж. Л. Гей-Люссак, 1808)
Закон Авогадро (А. Авогадро, 1811)
Закон удельных теплоёмкостей (П. Л. Дюлонг и А. Т. Пти, 1819)
Законы электролиза (М. Фарадей, 1830-е гг.)
Закон постоянства количества теплоты (Г. Гесс, 1840)
Слайд 13 М. В. ЛОМОНОСОВ - ОСНОВОПОЛОЖНИК
М.В. Ломоносов - создатель школы российских химиков.
Ему принадлежит идея разделения химии на теоретическую (“физическая химия”) и практическую части (“техническая химия”).
Самыми выдающимися заслугами М.В. Ломоносова в области химии являются создание основ атомно-молекулярного учения и открытие закона сохранения массы вещества.
Также им был разработан, создан и внедрен в методику лабораторных исследований целый ряд приборов: вискозиметр, прибор для фильтрования под вакуумом, прибор для определения твердости, газовый барометр, пирометр и другие.
Слайд 14Й. Я. БЕРЦЕЛИУС вычислил относительные атомные массы всех известных к
Берцелиус ввел в употребление буквенные символы для обозначения элементов (1818 - 1819 гг.).
Йенс Якоб Берцелиус.
Слайд 15 МОЛЕКУЛЯРНАЯ ТЕОРИЯ АВОГАДРО
В 1814 г.
закон Афогадро
Центральным местом в теории А. Авогадро было разъяснение различий между понятиями атом и молекула.
А. Авогадро впервые показал, что газообразные простые вещества состоят из двухатомных молекул.
Слайд 16 МЕЖДУНАРОДНЫЙ СЪЕЗД ХИМИКОВ В КАРЛСРУЭ.
В середине XIX в. у различных школ и групп ученых не было единых критериев определения связанных с химической номенклатурой, обозначениями и атомной массой.
В 1860 г первая международная конференция, посвященная химии (конгрессе в Карлсруэ).
Среди участников российской делегации были Н.Н. Зинин и Д.И. Менделеев.
Результатом съезда химиков в Карлсруэ стало утверждение атомного-мголекулярного учения, были определены понятия атомного веса, а также молекулы и атома.
Слайд 17 На рубеже XVIII - XIX вв. в
Петербургская Академия наук на рубеже XVIII – XIX вв.
Слайд 18 КАЗАНСКАЯ ХИМИЧЕСКАЯ ШКОЛА
Н.Н. Зинин – химик-органик.
Открыл метод
Эта работа заложила научную основу для развития промышленного производства синтетических красителей, новых фармацевтических препаратов, душистых веществ и др.
Николай Николаевич Зинин.
Слайд 19Герман Иванович Гесс
Герман Иванович Гесс занимался разработаткой русской химической номенклатуры.
Которая
Слайд 20Дмитрий Иванович Менделеев
Менделеев оставил свыше 500 печатных трудов, среди которых классические
Открытый в 1869 Периодический закон химических элементов — получил всеобщее признание, позволил ученым предвидеть новые открытия и систематизировать накапливающийся экспериментальный материал.
Слайд 21Итак , какие же основные понятия и законы химии мы имеем
Слайд 23
Химия – это наука о составе, строении, свойствах и превращениях веществ.
Вещество
Вещество состоит из частиц, например, атомов, молекул, ионов.
Слайд 24Задачи химии.
Изучение веществ, их физических и химических свойств
Изучение превращений веществ и
Превращения веществ, сопровождающиеся изменением состава, называются химическими реакциями.
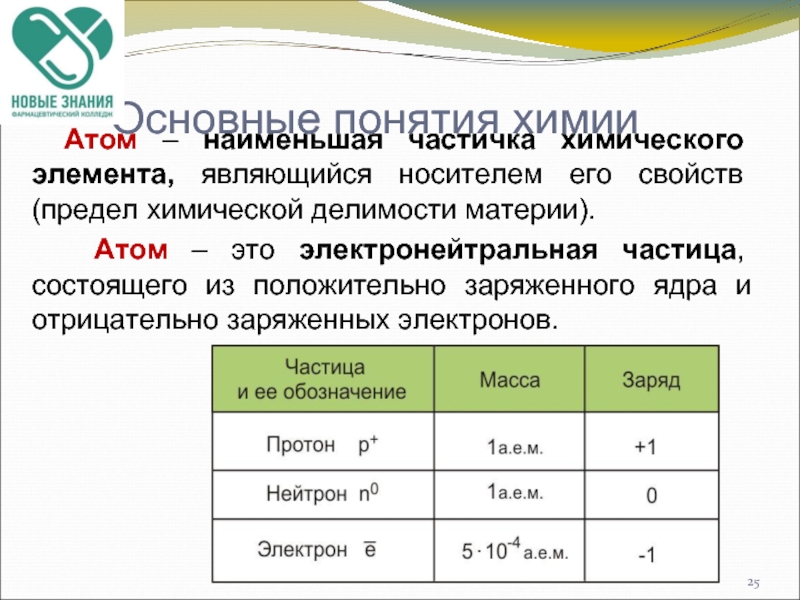
Слайд 25Основные понятия химии
Атом – наименьшая частичка химического элемента, являющийся носителем
Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов.
Слайд 26Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Объектом изучения
Основные понятия химии
Слайд 27Основные понятия химии
Элементы принято обозначать первой или первой и одной из
Слайд 28Химический знак (символ)
– обозначает название элемента, один его атом,
По символу химического элемента можно определить его атомный номер и относительную атомную массу.
Слайд 29Основные понятия химии
Химические элементы существуют в виде
простых веществ, состоящих из
сложных веществ (химических соединений), состоящих из атомов разных элементов.
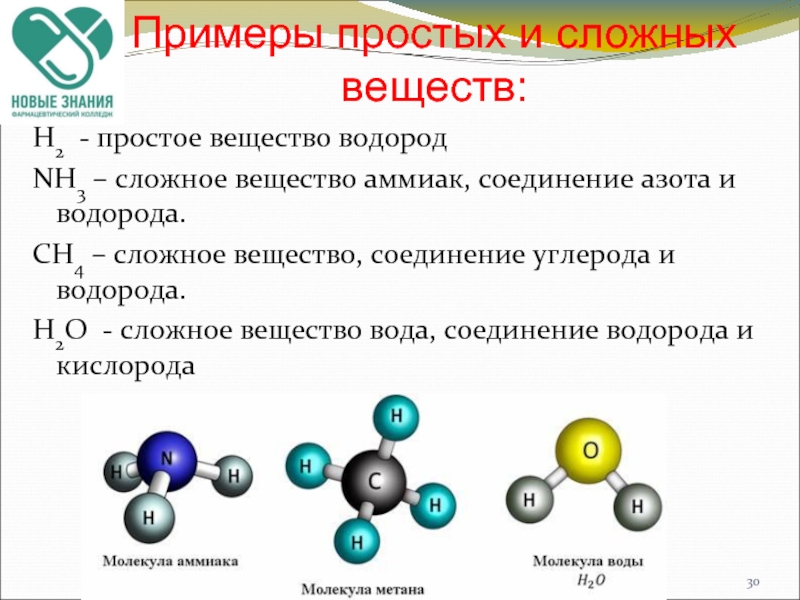
Слайд 30Примеры простых и сложных веществ:
Н2 - простое вещество водород
NH3 – сложное
СH4 – сложное вещество, соединение углерода и водорода.
Н2О - сложное вещество вода, соединение водорода и кислорода
Слайд 31 Аллотропия – способность химического элемента образовывать несколько простых веществ, называемых аллотропными
Основные понятия химии
Слайд 32
Аллотропные модификации углерода (С): алмаз, графит, фуллерен, графен, нанотрубки
Основные
Слайд 34Основные понятия химии
Молекула – это электронейтральная частица, образующаяся при возникновении ковалентных
NH3
Слайд 35Химическая формула -
это условная запись качественного и количественного состава вещества при помощи
Индекс - это цифра в химической формуле, которая ставится внизу после химического знака и обозначает число атомов данного вида.
Слайд 36 Широко используются несколько видов химических формул:
Простейшая (эмпирическая) формула показывает качественный состав
Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру.
Графическая формула отражает порядок соединения атомов, т. е. связи между ними.
Основные понятия химии
Слайд 37Что обозначают записи?
H2- это одна молекула водорода, в её состав
Слайд 38Масса атомов, молекул и ионов очень мала, 10-24 – 10-23 г
Например,
масса атома водорода
m(H) = 1,67·10-24 г или 1,67·10-27 кг,
масса атома урана (самого тяжелого элемента)
m(U) = 3,95·10-25 кг
Атомная масса элемента
Слайд 39Атомная единица массы (а.е.м.) - внесистемная единица массы.
Атомная единица массы –
m(С) = 1,99·10-26 кг
1/12 m(C) = 1/12 x 1,99·10-26 кг = 1,66·10-27 кг = 1,66·10-24 г
1 а.е.м. = 1,66·10-27 кг = 1,66·10-24 г
1 а.е.м. ≈ массе протона или нейтрона
Слайд 40Относительная атомная масса элемента Ar
Относительная атомная масса элемента показывает во
Например:
Аr(S) = 32, т.е. атом серы в 32 раза тяжелее 1/12 массы атома углерода.
Слайд 42Найдите в ПСХЭ Д.И. Менделеева Относительную атомную массу элемента Ar
Водорода
Натрия
Алюминия
Кислорода
Серы
Хлора
Слайд 43Масса молекулы
Относительная молекулярная масса Мr (молекулярная масса)
Мr равна сумме относительных атомных
Например:
Мr(О2) = 2Ar(О) = 2•16 = 32;
Mr(NO2) = Ar(N)+2Ar(O) = 14+2•16 = 46;
Мr (Н2О) = 2·1,01 + 16 = 18,01
Слайд 44Количество вещества
В Международной системе СИ за единицу количества вещества принят моль.
1 моль атомов Н, 1 моль молекул Н2
Слайд 46Основные понятия химии
Постоянная Авогадро ( ) – число атомов
При решении химических задач нужно знать, сколько структурных частиц (N) вещества содержится в определённом количестве вещества.
N = NA · n
Слайд 48Молярная масса (М)
– масса 1 моля вещества в граммах
[М] = [г/моль]
Молярная
М = Мr
Мr (Н2О) = 18,0152 а.е.м.
М(Н2О) = 18,0152 г/моль
Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро
М = NA · m0
mв-ва = n · M
Слайд 49Рассчитайте относительную молекулярную массу для следующих соединений:
CaO, CO2, Н2SO4
56
Слайд 50Основные законы химии
Закон сохранения массы.
Масса веществ, вступивших в
Слайд 52Основные законы химии
Закон объемных отношений
Объемы газов, вступающих в химическую реакцию, и
Слайд 53Основные законы химии
Закон объемных отношений
Следствие.
Стехиометрические коэффициенты в уравнениях химических реакций
2CO + O2 = 2CO2
2 объема CO реагируют с 1 объемом O2 и получается 2 объема CO2
Слайд 54
Закон постоянства состава вещества.
Сформулирован Ж.-Л. Прустом в 1799 г..
Всякое чистое вещество
Однако уже в начале XIX в. К. Бертолле показал, что элементы могут соединятся друг с другом в разных соотношениях в зависимости от массы реагирующих веществ.
Основные законы химии
Слайд 55
Современная формулировка закона постоянства состава вещества таков:
Состав
Состав соединений немолекулярной структуры (с атомной, ионной или металлической кристаллической решеткой) не является постоянным и зависит от способа их получения.
Основные законы химии
Слайд 56
Соединения постоянного состава - дальтониды (в память английского химика и физика
Состав выражается простыми формулами с целочисленными стехиометрическими индексами, например:
Н2О, НCl, ССl4, СO2
Соединения переменного состава - бертоллиды (в память французского химика Бертолле).
Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям, например
FeSx, где 1,02 < x < 1,10
Основные законы химии
Слайд 57Закон постоянства состава вещества
Так, СО2 можно получить по любой из следующих
В химически чистом СО2 всегда содержится 27,29% С и 72,71% О.
Слайд 58Основные законы химии
Закон Авогадро.
В равных объемах различных газов при одинаковых
Слайд 60Следствия из закона Авогадро :
1. Молярный объем газа VM –
объем
VM = 22,4 л/моль (дм3/моль)
н.у.: Т = 0 °С ; р = 760 мм
Vгаза= n · Vm
Слайд 61
Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся
D – относительная плотность одного газа по другому.
Основные законы химии
Слайд 63Примеры задач:
1.Какое количество вещества ( моль) содержит 12,04·10²³ атомов натрия?
2.Какова масса
3.Какой объем занимают 1,5 моль кислорода?
4.Какова масса 3 литров гелия?
n = N/ Na = 12, 04 ·10²³ / 6,02 · 10²³ = 2 моль
m = n · M(N₂) = 2 моль · 28 г/ моль = 56 г.
V= n · Vm = 1,5 моль · 22,4 л/моль = 33,6 л.
m= n· M = V/Vm · M(He)= 3л/22,4л/моль · 4г/моль = 0,54 г.
Слайд 64Роль химии
Роль химии в жизни современного общества очень велика. Она проникла
Фундаментальные законы химии применяются в науке, технике и медицине, а также во всех отраслях промышленности. В их числе металлургия, целлюлозно-бумажная, строительная, нефтеперерабатывающая.
Химическая промышленность развивается в настоящее время гораздо быстрее, чем любая другая, и в наибольшей степени определяет научно-технический прогресс.
Слайд 66Проблемы экологии
Загрязнение
воды
Загрязнение
воздуха
Хозяйственная деятельность человека оказывает значительное, а часто катастрофическое
Слайд 67 1. Загрязнение атмосферы
Естественное
газы ,выделяющиеся в результате горения лесов, извержения
атмосферная пыль, которая образуется при выветривании горных пород, эрозии почв, лесных и торфяных пожарах.
Искусственное
1) твердые частицы (резиновая автомобильная пыль)
2) газообразные вещества (углекислый газ)
3) Свинец и другие тяжелые металлы
4) Радиоактивные вещества
Слайд 70Истинное положение дел
Природную среду загрязняют разные отрасли хозяйства, помимо химической промышленности:
Слайд 71Выводы :
Опасна не сама ХИМИЯ, а пренебрежение её законами или их
Без ХИМИИ (в широком смысле этого слова) невозможно существование современного мира
Современный человек должен быть образованным в химическом отношении.
Слайд 72Значение общей и неорганической химии
В подготовке провизоров общая и неорганическая
Слайд 75Список используемой литературы
О.С. Габриелян, И.Г. Остроумов, Е.Е. Остроумова, С.А. Сладков. Химия
Бабков Александр Васильевич. Общая и неорганическая химия: учебник / А. В. Бабков, Т. И. Барабанова, В. А. Попков. - М. : ГЭОТАР-Медиа, 2013. - 384 с. : ил.













































![Молярная масса (М)– масса 1 моля вещества в граммах[М] = [г/моль] Молярная масса численно равна относительной](/img/tmb/2/156890/addbc1cd4d5a3109d8ef692678a08dc8-800x.jpg)