- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обратимость химических реакций. Химическое равновесие презентация
Содержание
- 1. Обратимость химических реакций. Химическое равновесие
- 2. Обратимые и необратимые реакции Необратимыми называют химические
- 3. Обратимые и необратимые реакции При каких условиях данная реакция будет обратимой? Необратимой?
- 4. Химическое равновесие Состояние системы, при котором скорость
- 5. Смещение химического равновесия Принцип Ле Шателье (1884г.):
- 6. Влияние изменения температуры
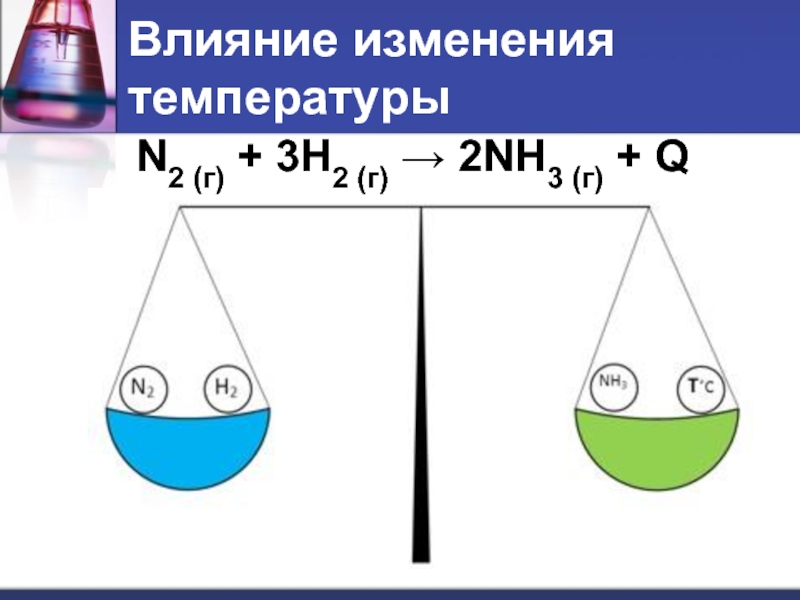
- 7. Влияние изменения температуры N2 (г) + 3H2 (г) → 2NH3 (г) + Q
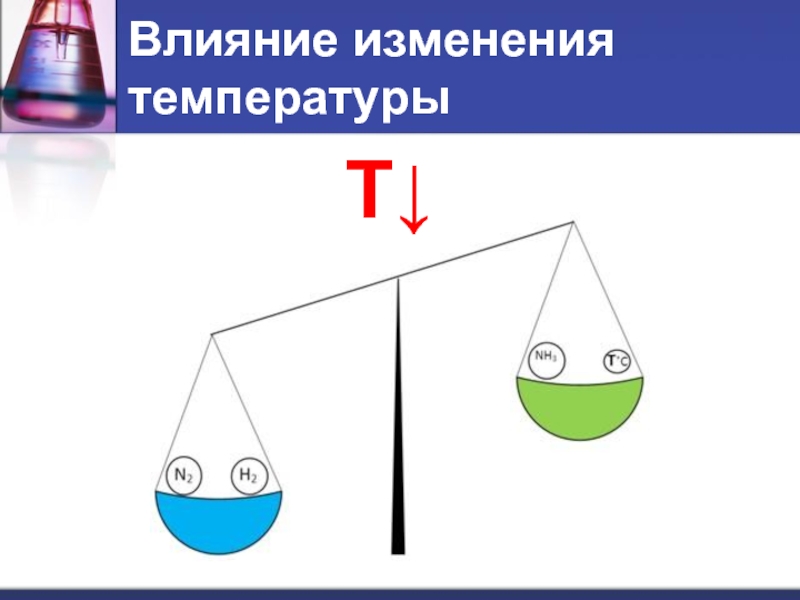
- 8. Влияние изменения температуры T↓
- 9. При повышении температуры равновесие смещается в сторону
- 10. Влияние изменения концентрации веществ СN2↑
- 11. Влияние изменения концентрации веществ При увеличении концентрации
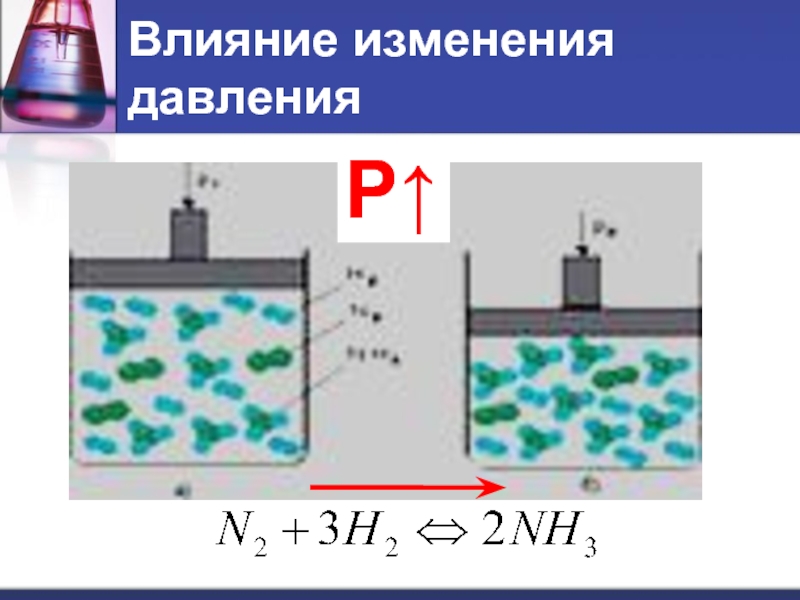
- 12. Влияние изменения давления Р↑
- 13. Влияние изменения давления При увеличении давления равновесие
- 14. Катализатор: не влияет на смещение химического равновесия (он лишь ускоряет процесс его достижения)
- 15. Принцип Ле Шателье: применим к любым равновесным системам: термодинамическим биологическим психическим педагогическим социальным экономическим
Слайд 2Обратимые и необратимые реакции
Необратимыми называют химические реакции, протекающие только в одном
направлении.
Обратимыми называют реакции, протекающие при одних и тех условиях и в прямом, и в обратном направлениях.
Обратимыми называют реакции, протекающие при одних и тех условиях и в прямом, и в обратном направлениях.
Слайд 3Обратимые и необратимые реакции
При каких условиях данная реакция будет обратимой? Необратимой?
Слайд 4Химическое равновесие
Состояние системы, при котором скорость прямой реакции равна скорости обратной
реакции, называется химическим равновесием.
Слайд 5Смещение химического равновесия
Принцип Ле Шателье (1884г.):
если на систему, находящуюся
в равновесии, оказывается внешнее воздействие, то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Слайд 9При повышении температуры равновесие смещается в сторону эндотермической реакции.
При понижении температуры
– в сторону экзотермической реакции.
Влияние изменения температуры
Слайд 11Влияние изменения концентрации веществ
При увеличении концентрации одного из веществ равновесие смещается
в сторону его расходования.
При уменьшении концентрации – в сторону его образования.
При уменьшении концентрации – в сторону его образования.
Слайд 13Влияние изменения давления
При увеличении давления равновесие смещается в сторону той реакции,
при которой объем образующихся газов меньше.
Слайд 14Катализатор:
не влияет на смещение химического равновесия
(он лишь ускоряет процесс его
достижения)