- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Непредельные углеводороды презентация
Содержание
- 1. Непредельные углеводороды
- 2. Понятие «непредельные у/в» 05.12.2015 непредельные у/в CnH2n+2
- 3. этен Гомология, номенклатура
- 4. Номенклатура ИЮПАК алкан пентан
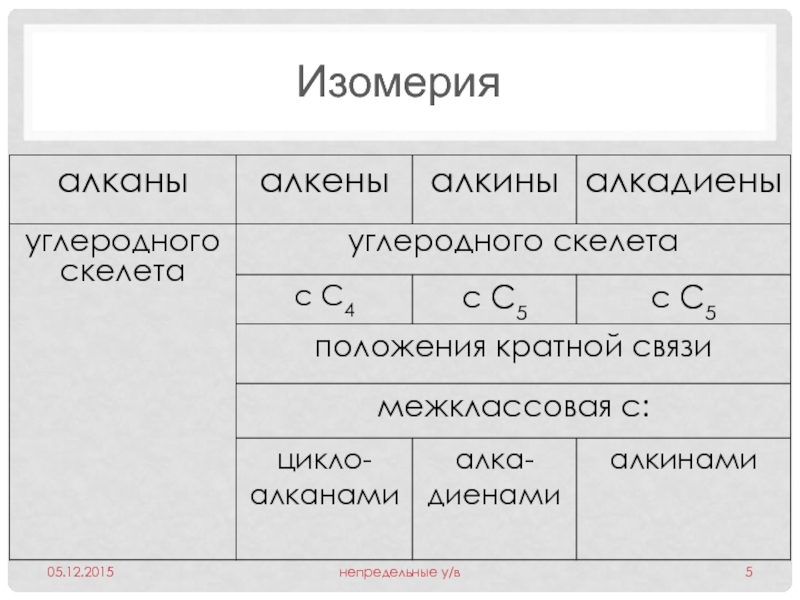
- 5. Изомерия 05.12.2015 непредельные у/в
- 6. Упражнение: 05.12.2015 непредельные у/в
- 7. В природе 05.12.2015 непредельные у/в химически активные
- 8. Наибольшее практическое значение имеют: 05.12.2015 непредельные у/в
- 9. Получение в промышленности пиролиз метана (метановый метод)
- 10. Получение в лаборатории карбидный способ:
- 11. H H
- 12. СН3-СН2-СН2-СН3
- 13. Химические свойства 05.12.2015 непредельные у/в
- 14. Реакции присоединения такие реакции называют насыщением,
- 15. Реакции гидрирования H2C=CН-СH3 + H─Н → →
- 16. Реакции гидрирования СH3-C≡C-СH3 + H─Н → CH≡CH
- 17. Реакции гидрирования H2C=СН–CН=СH2 → CH2–СН–CН–СH2 + Н–Н
- 18. Реакции галогенирования H-C≡C-H + Br2 → →
- 19. Гидратация присоединение воды; протекает
- 20. Гидрогалогенирование присоединение галогеноводородов (HCl, HBr,
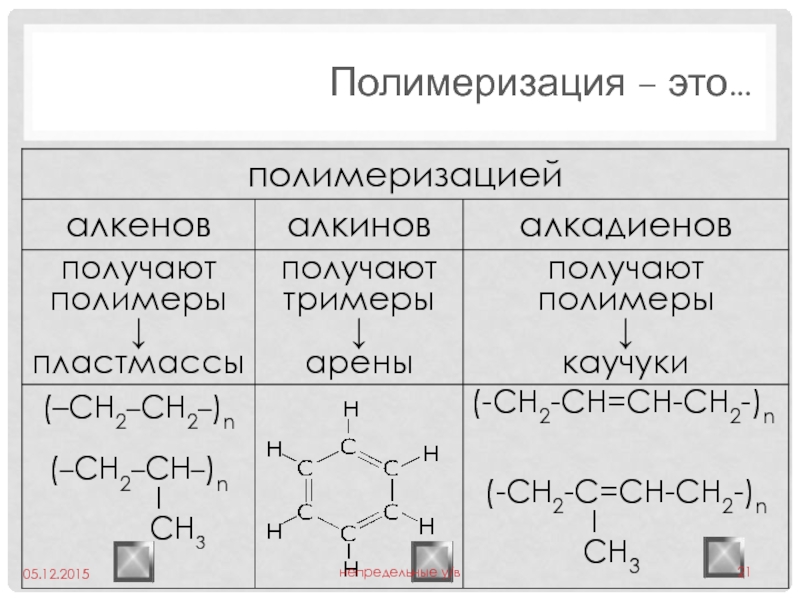
- 21. Полимеризация – это… 05.12.2015 непредельные у/в
- 22. Полимеризация сокращенное уравнение реакции
- 23. Полипропилен n(CH2=CH) → (―CH2―CH―)n
- 24. Поливинилхлорид n(CH2=CH) → (―CH2―CH―)n
- 25. Полимеризация у диеновых протекает по принципу «присоединение
- 26. Полимеризация Запишите реакции полимеризации: n(H2C=С–CН=СH2)
- 27. Полихлоропрен (спец.Каучук) n(H2C=С–CН=СH2)
- 28. Вулканизация 05.12.2015 непредельные у/в
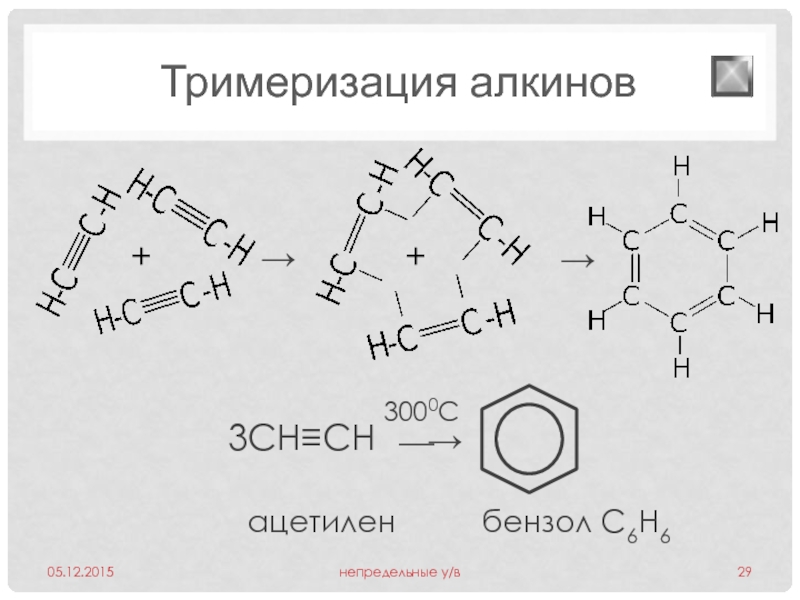
- 29. Тримеризация алкинов ацетилен
- 30. Горение и окисление все непредельные хорошо горят:
- 31. Горение и окисление с 1906г ацетилен стали
- 32. ацетилен хорошо растворим в ацетоне (25л в
- 33. Горение и окисление непредельные у/в окисляются раствором
- 34. Реакции замещения НС≡СН+2CuCl → Cu-С≡С-Cu +
- 35. Домашнее задание §4 (алкены); §5 (алкадиены);
Слайд 1CH2=CH2
10 класс, базовый уровень
Непредельные углеводороды
CH2=CH2
CH≡CH
CH≡CH
CH≡CH
CH≡CH
CH2=CH2
CH2=CH-CH=CH2
CH2=CH-CH=CH2
CH2=CH-CH=CH2
CH2=CH2
CH ≡CH
CH≡CH
CH≡CH
CH2=CH-CH=CH2
CH2=CH2
CH2=CH2
CH≡CH
CH2=CH2
CH2=CH2
CH≡CH
CH≡CH
CH2=CH2
CHΞCH
CH2=CH2
CH2=CH-CH=CH2
CH2=CH-CH=CH2
CH2=CH-CH=CH2
CH2=CH2
CH≡CH
CH≡CH
Трухина О.Е.
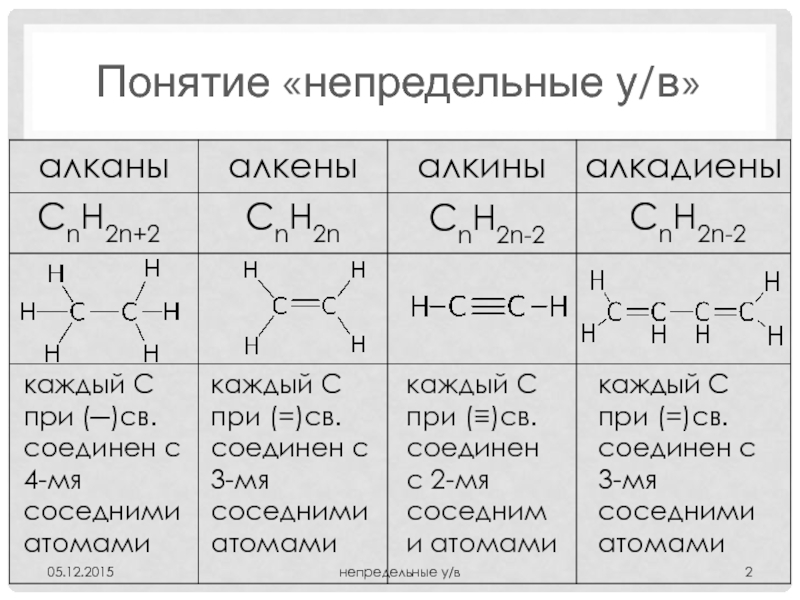
Слайд 2Понятие «непредельные у/в»
05.12.2015
непредельные у/в
CnH2n+2
CnH2n
CnH2n-2
каждый С при (─)св. соединен с 4-мя соседними
каждый С при (=)св. соединен с 3-мя соседними атомами
каждый С при (≡)св. соединен с 2-мя соседними атомами
CnH2n-2
каждый С при (=)св. соединен с 3-мя соседними атомами
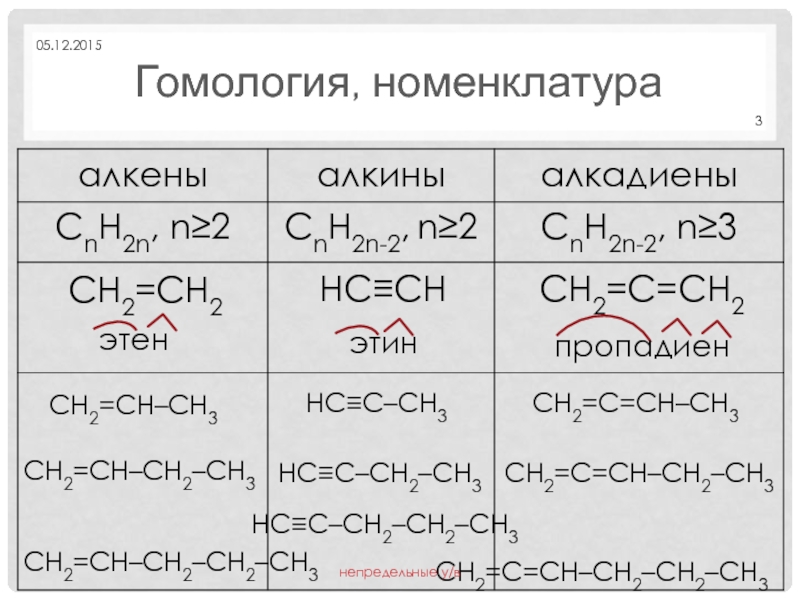
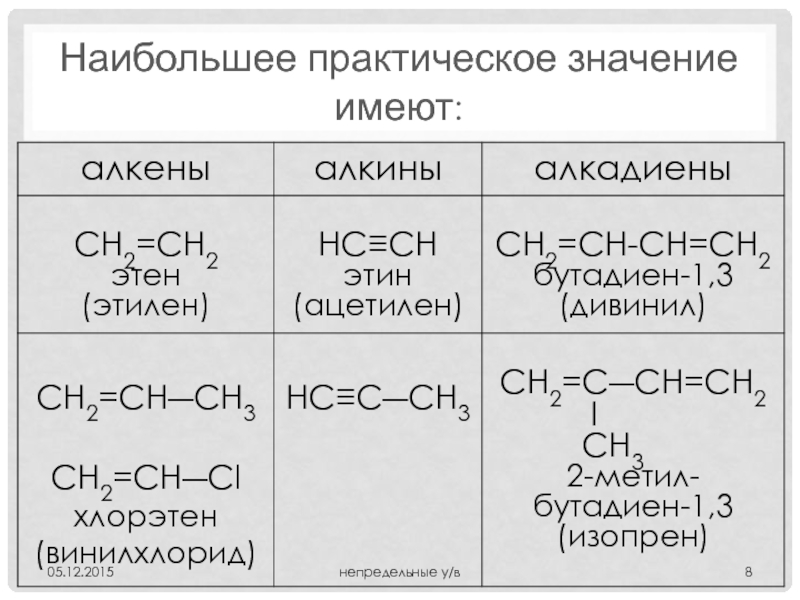
Слайд 3этен
Гомология, номенклатура
05.12.2015
CH2=CH2
CH2=CH–CH3
CH2=CH–CH2–CH3
CH2=CH–CH2–CH2–CH3
HC≡CH
этин
HC≡C–CH3
HC≡C–CH2–CH3
HC≡C–CH2–CH2–CH3
CH2=C=CH2
пропадиен
CH2=C=CH–CH3
CH2=C=CH–CH2–CH3
CH2=C=CH–CH2–CH2–CH3
непредельные у/в
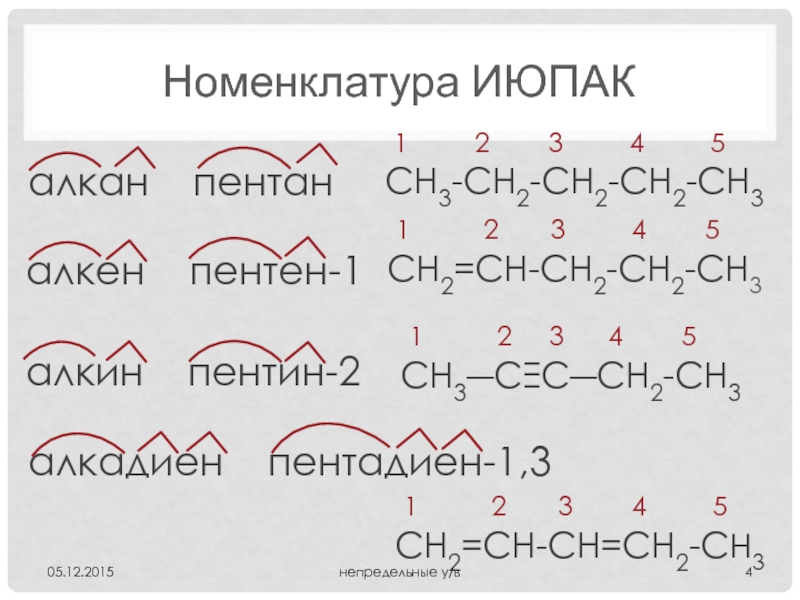
Слайд 4Номенклатура ИЮПАК
алкан пентан
алкен пентен-1
алкин пентин-2
алкадиен пентадиен-1,3
1 2 3 4 5
CH2=CH-CH2-CH2-CH3
1 2 3 4 5
CH3―CΞC―CH2-CH3
1 2 3 4 5
CH3-CH2-CH2-CH2-CH3
1 2 3 4 5
CH2=CH-CH=CH2-CH3
05.12.2015
непредельные у/в
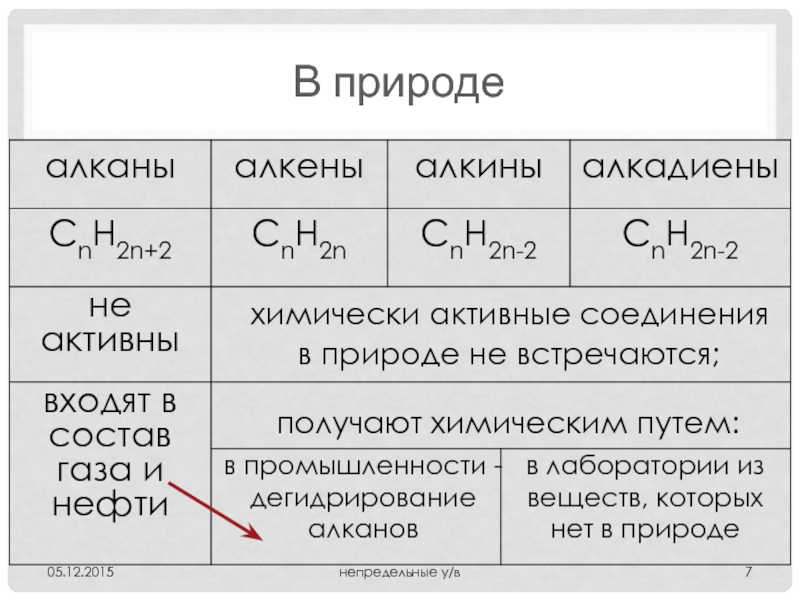
Слайд 7В природе
05.12.2015
непредельные у/в
химически активные соединения
в природе не встречаются;
получают химическим путем:
в промышленности
в лаборатории из веществ, которых нет в природе
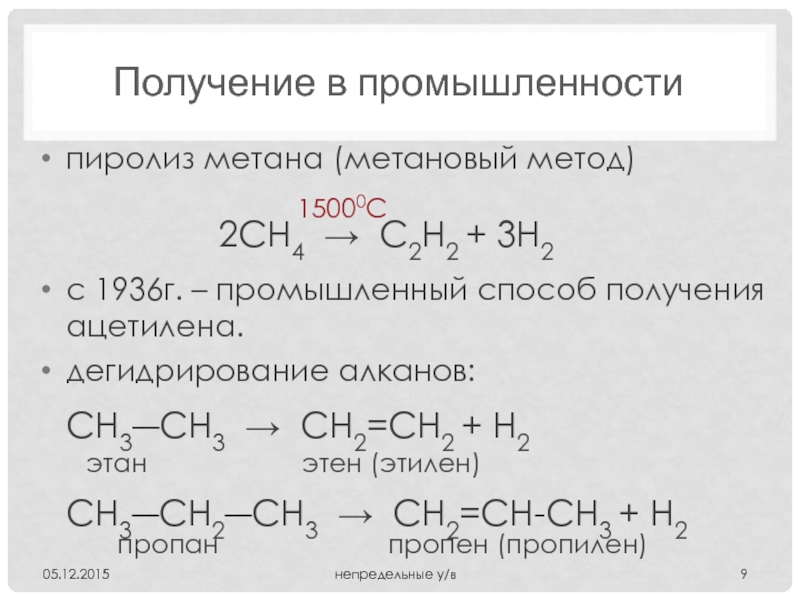
Слайд 9Получение в промышленности
пиролиз метана (метановый метод)
с 1936г. – промышленный
дегидрирование алканов:
2CH4 → C2H2 + 3H2
15000С
CH3―CH3 → CH2=CH2 + H2
этан этен (этилен)
CH3―CH2―CH3 → CH2=CH-CH3 + H2
пропан пропен (пропилен)
05.12.2015
непредельные у/в
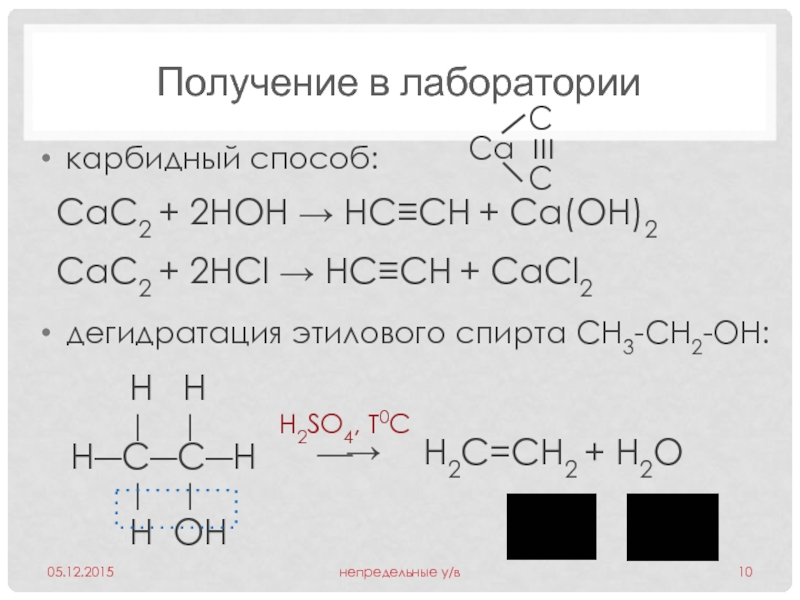
Слайд 10Получение в лаборатории
карбидный способ:
дегидратация этилового спирта СН3-СН2-ОН:
H
│ │
Н―С―С―Н
│ │
Н ОН
⎯→
Н2С=СН2 + Н2О
H2SO4, T0С
CaC2 + 2HOH → HC≡СН + Ca(ОH)2
CaC2 + 2HCl → HC≡СН + CaCl2
C
Ca III
C
05.12.2015
непредельные у/в
Слайд 11 H H
│
Н―С―С―Н +
│ │
Н ОН
Получение диеновых у/в
1932г С.В. Лебедев
⎯→
⎯→
Н2С=СН-СН=СН2 + 2Н2О + Н2
сырьё –
СН3-СН2-ОН этиловый спирт
kat=Al2O3+ZnO
05.12.2015
непредельные у/в
H H
│ │
Н―С―С―Н
│ │
Н ОН
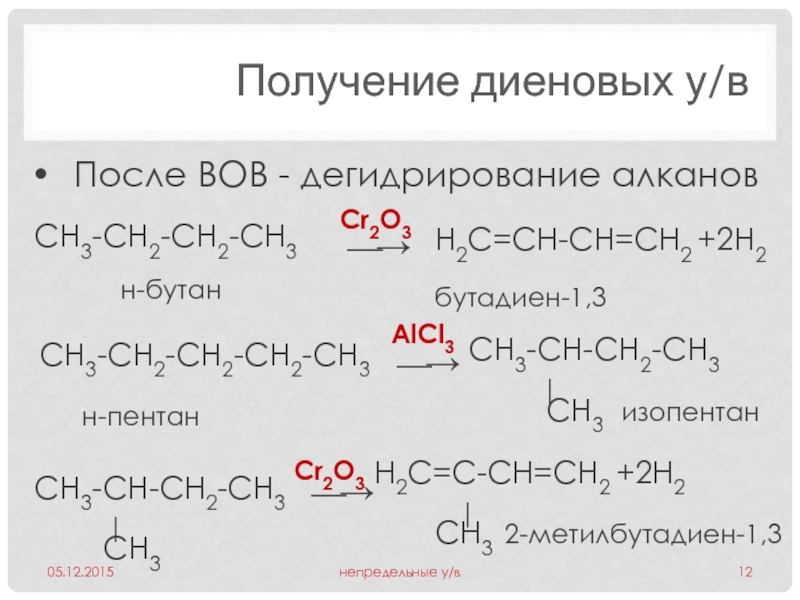
Слайд 12СН3-СН2-СН2-СН3
н-бутан
Получение диеновых у/в
После
⎯→
Н2С=СН-СН=СН2 +2Н2
бутадиен-1,3
СН3-СН2-СН2-СН2-СН3
н-пентан
⎯→
СН3-СН-СН2-СН3
│
СН3 изопентан
СН3-СН-СН2-СН3
│
СН3
⎯→
Н2С=С-СН=СН2 +2Н2
│
СН3 2-метилбутадиен-1,3
Cr2O3
AlCl3
Cr2O3
05.12.2015
непредельные у/в
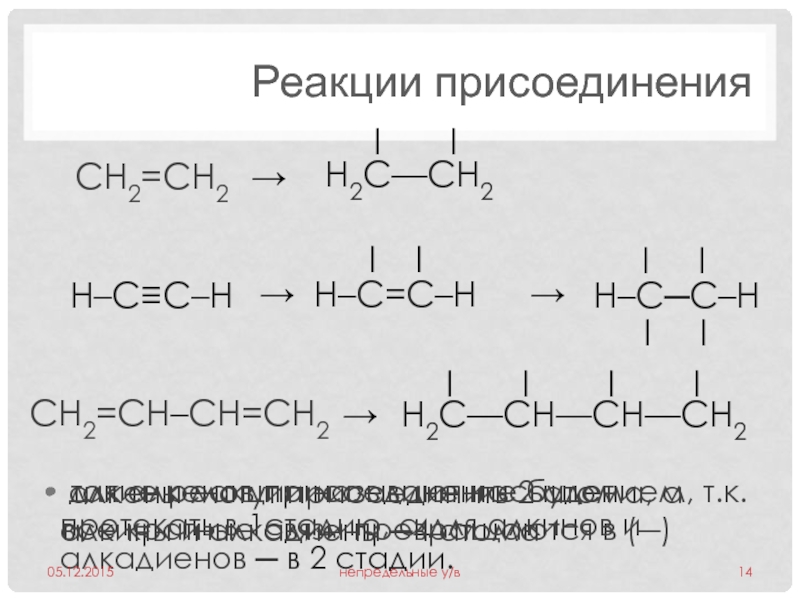
Слайд 14Реакции присоединения
такие реакции называют насыщением, т.к. все кратные связи превращаются
H–C≡C–H
→
→
H–C=C–H
l l
H–C─C–H
→
H2C—CH2
CH2=CH2
→
H2C—CH—CH—CH2
CH2=CH–CH=CH2
алкены могут присоединить 2 атома, а алкины и алкадиены ─4 атома
для алкенов присоединение будет протекать в 1стадию, а для алкинов и алкадиенов ─ в 2 стадии.
05.12.2015
непредельные у/в
l l
l l
l l
l l l l
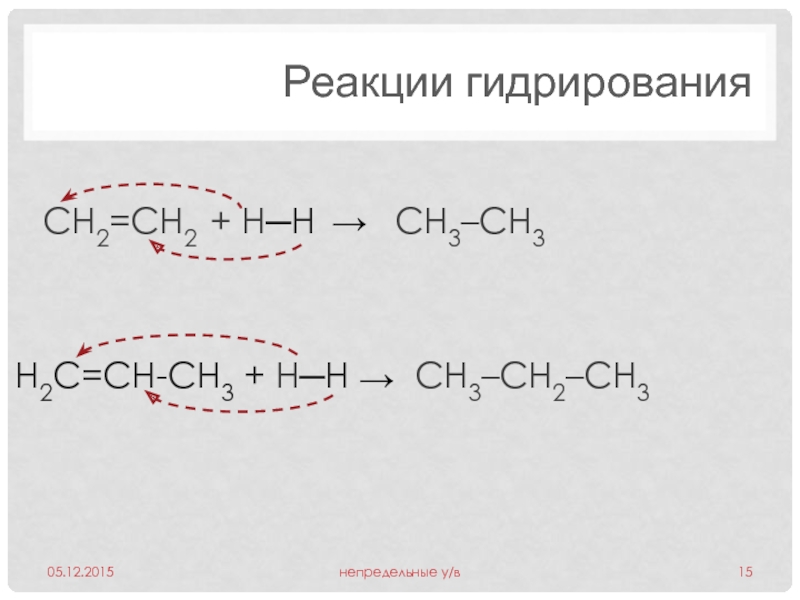
Слайд 15Реакции гидрирования
H2C=CН-СH3 + H─Н
→
→
CH2=CH2 + H─Н
05.12.2015
непредельные у/в
CH3–CH3
CH3–CH2–CH3
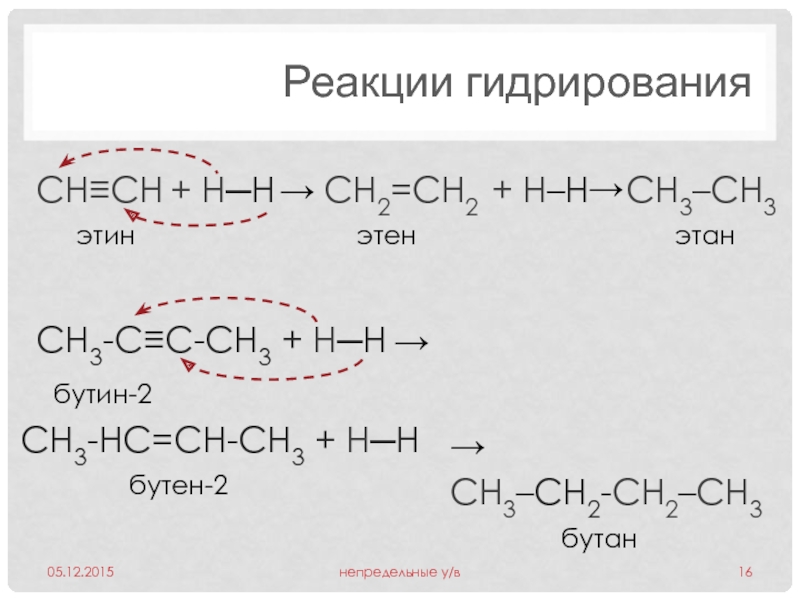
Слайд 16Реакции гидрирования
СH3-C≡C-СH3 + H─Н
→
CH≡CH + H─Н
→
05.12.2015
непредельные у/в
CH2=CH2 + H–Н
→
CH3–CH3
этин
СH3-НC=CН-СH3 + H─Н
→
CH3–СH2-CH2–CH3
бутин-2
бутан
бутен-2
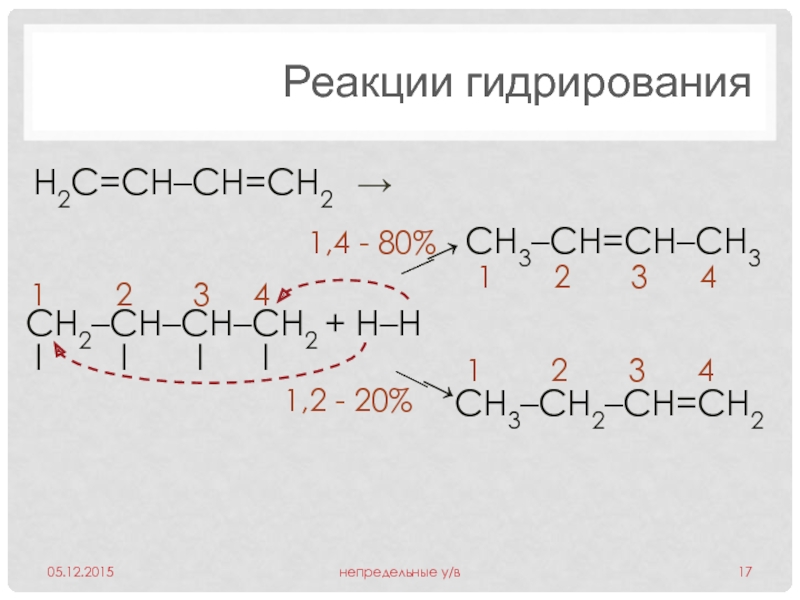
Слайд 17Реакции гидрирования
H2C=СН–CН=СH2
→
CH2–СН–CН–СH2 + Н–Н
l l
⎯→
⎯→
СН3–СН2–СН=СН2
1,2 - 20%
1,4 - 80%
CH3–СН=CН–СH3
1 2 3 4
1 2 3 4
1 2 3 4
05.12.2015
непредельные у/в
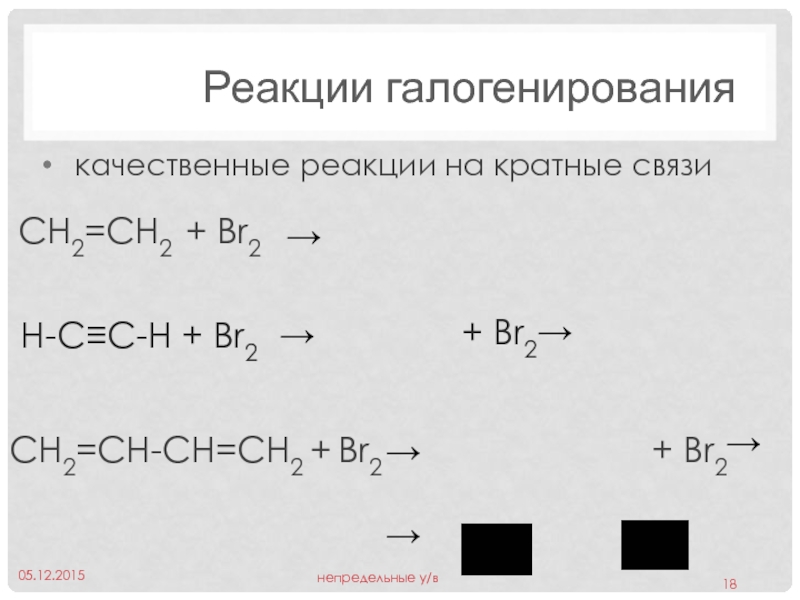
Слайд 18Реакции галогенирования
H-C≡C-H + Br2
→
→
→
CH2=CH2 + Br2
→
CH2=CH-CH=CH2 + Br2
+ Br2
→
+ Br2
→
05.12.2015
непредельные у/в
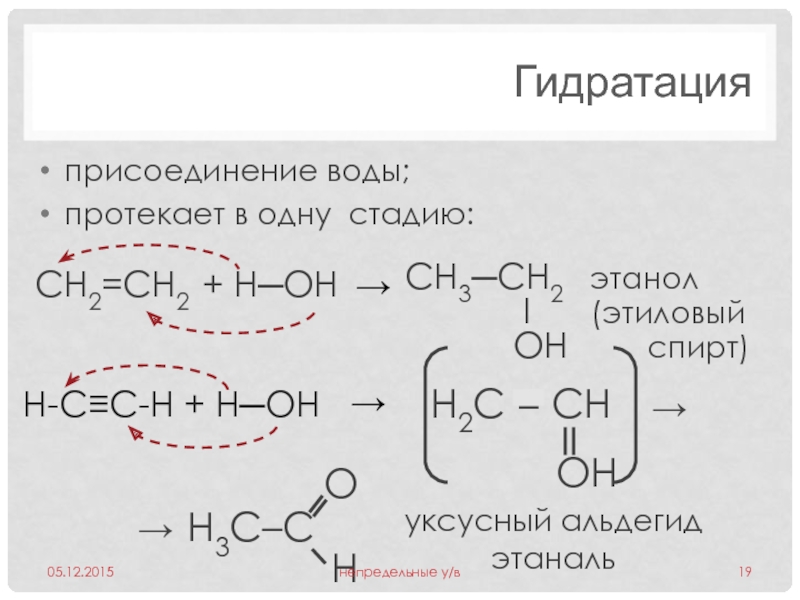
Слайд 19Гидратация
присоединение воды;
протекает в одну стадию:
H-C≡C-H + H─ОН
→
→
CH2=CH2 +
CH3─CH2 этанол
I (этиловый
OH спирт)
→
H3C–C
H2C = CН
О
Н
О
Н
уксусный альдегид
этаналь
→
05.12.2015
непредельные у/в
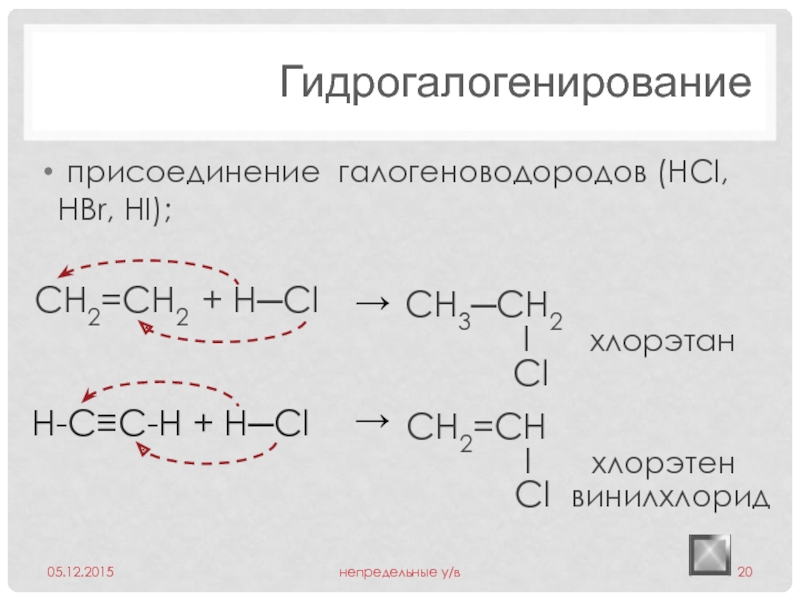
Слайд 20Гидрогалогенирование
присоединение галогеноводородов (HCl, HBr, HI);
H-C≡C-H + H─Сl
→
→
CH2=CH2 +
CH3─CH2
I хлорэтан
Cl
CH2=CH
I хлорэтен
Cl винилхлорид
05.12.2015
непредельные у/в
Слайд 22Полимеризация
сокращенное уравнение реакции
n(CH2=CH2) → (―CH2―CH2―)n
этилен-мономер
+
+
+…
…+
…+
+
+
+…
→
→
…―CH2―CH2―CH2―CH2―CH2―CH2―…
05.12.2015
непредельные у/в
Слайд 23Полипропилен
n(CH2=CH) → (―CH2―CH―)n
CH3 CH3
пропилен полипропилен
05.12.2015
непредельные у/в
Слайд 24Поливинилхлорид
n(CH2=CH) → (―CH2―CH―)n
Сl Cl
хлорэтен ПВХ
(винилхлорид) (поливинилхлорид)
это пластик, который в промтоварном магазине называется ПВХ.
05.12.2015
непредельные у/в
Слайд 25Полимеризация
у диеновых протекает по принципу «присоединение 1,4»
05.12.2015
непредельные у/в
(―CН2–CН=СH–СН2 ―)n
n(H2C=СН–CН=СH2)
1 2
1 2 3 4
→
дивиниловый каучук
1 2 3 4
1 2 3 4
1 2 3 4
1 2 3 4
...+ + +…→
...+ + +…→
Слайд 26Полимеризация
Запишите реакции полимеризации:
n(H2C=С–CН=СH2)
l
→
изопреновый каучук
05.12.2015
непредельные у/в
Слайд 27Полихлоропрен (спец.Каучук)
n(H2C=С–CН=СH2)
Сl
→
хлоропреновый каучук
05.12.2015
непредельные у/в
Слайд 30Горение и окисление
все непредельные хорошо горят:
CH2=CH2 + 3О2 → 2 CО2
этен
C4H6 + 5,5О2 → 4CО2 + 3H2О
бутадиен-1,3
05.12.2015
непредельные у/в
Слайд 31Горение и окисление
с 1906г ацетилен стали использовать для сварки и резки
на воздухе ацетилен горит коптящим пламенем:
в кислороде бледно-голубым пламенем (Т=2500-30000С)
C2H2 + О2 → С + CО + H2О
этин сажа угарный газ
2C2H2 + 5О2 → 4CО2 + 2H2О
этин
05.12.2015
непредельные у/в
Слайд 32ацетилен хорошо растворим в ацетоне (25л в 1л ацетона при 15°С
взрывоопасен, поэтому его хранят в баллонах, наполненных пористым инертным материалом, который пропитан ацетоном.
Физические свойства
05.12.2015
непредельные у/в
Слайд 33Горение и окисление
непредельные у/в окисляются раствором перманганата калия (KMnO4), обесцвечивая его:
CH2=CH2
этен I I этиленгликоль
ОH OH
O O CH≡CH + [o] → C―C этин HО OH
щавелевая кислота
II
II
05.12.2015
непредельные у/в
Слайд 34Реакции замещения
НС≡СН+2CuCl
→
Cu-С≡С-Cu + 2НCl
ацетиленид меди (I)
эта реакция позволяет отличить алкины
НС≡СН +Ag2O
→
Ag-С≡С-Ag + Н2O
ацетиленид серебра
2НС≡С-CН3 +Ag2O
→
CH3-С≡С-CH3 + Ag2O
ацетиленид серебра
2AgС≡С-CН3 +Н2O
→
05.12.2015
непредельные у/в














![Горение и окислениенепредельные у/в окисляются раствором перманганата калия (KMnO4), обесцвечивая его:CH2=CH2 + [o]→ CH2 ―CH2](/img/tmb/5/428698/d126128a30cf8326b9b4a6171bc54b02-800x.jpg)







