- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Некоторые d-элементы презентация
Содержание
- 1. Некоторые d-элементы
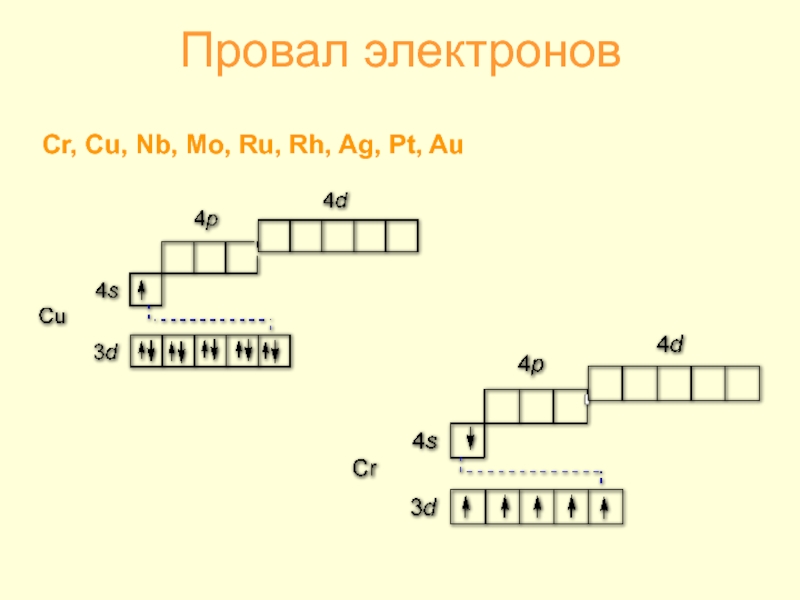
- 3. Провал электронов Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au
- 4. d-Элементы
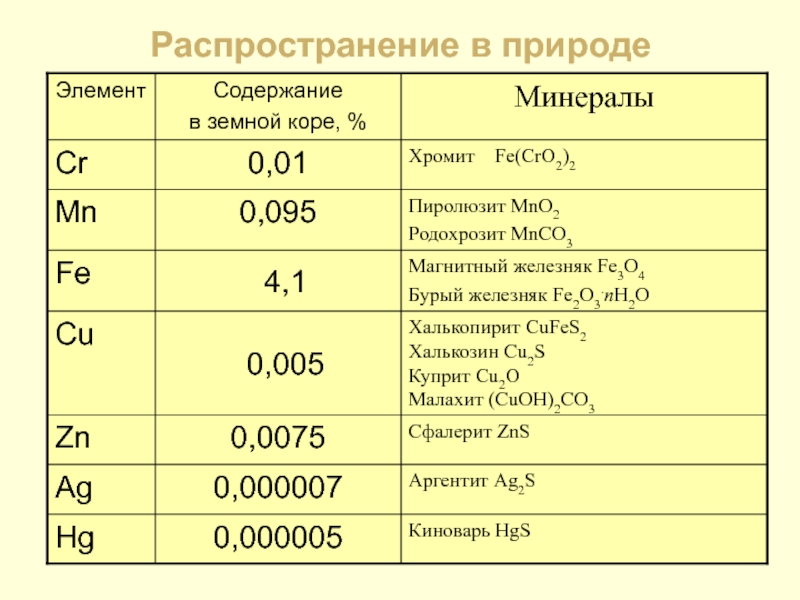
- 5. Распространение в природе
- 6. М и н е р а л
- 7. Минералы Малахит (CuOH)2CO3 Крокоит PbCrO4 Хромит (Fe,Cr2)O4
- 8. Минералы Киноварь HgS Пиролюзит MnO2 Серебро Ag
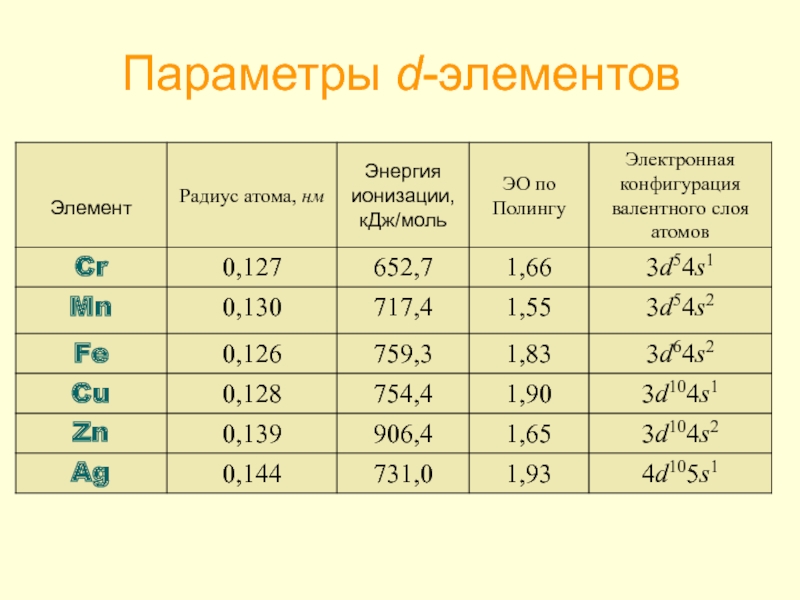
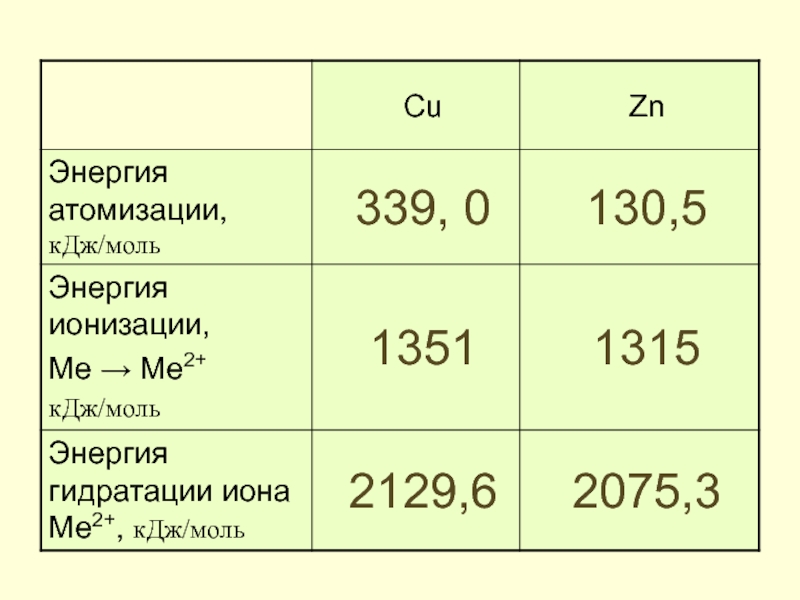
- 9. Параметры d-элементов
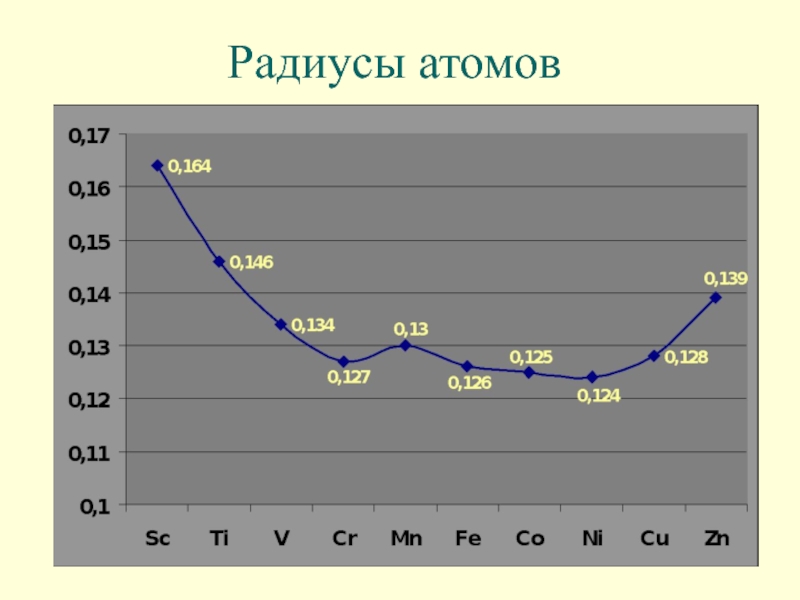
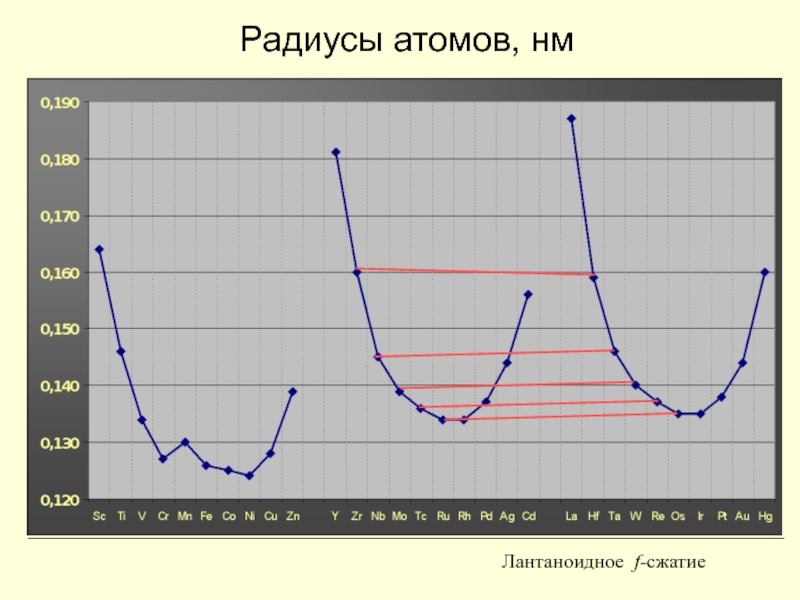
- 10. Радиусы атомов
- 11. Радиусы атомов, нм Лантаноидное f-сжатие
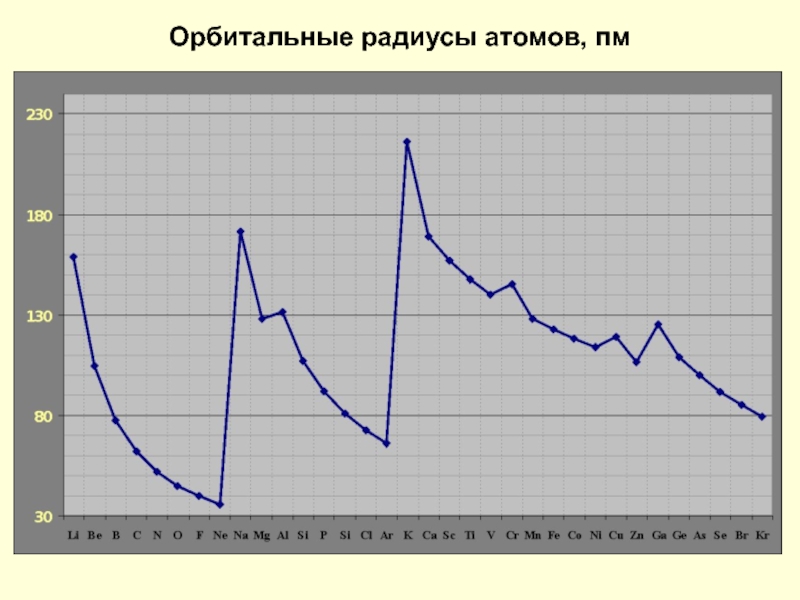
- 12. Орбитальные радиусы атомов, пм
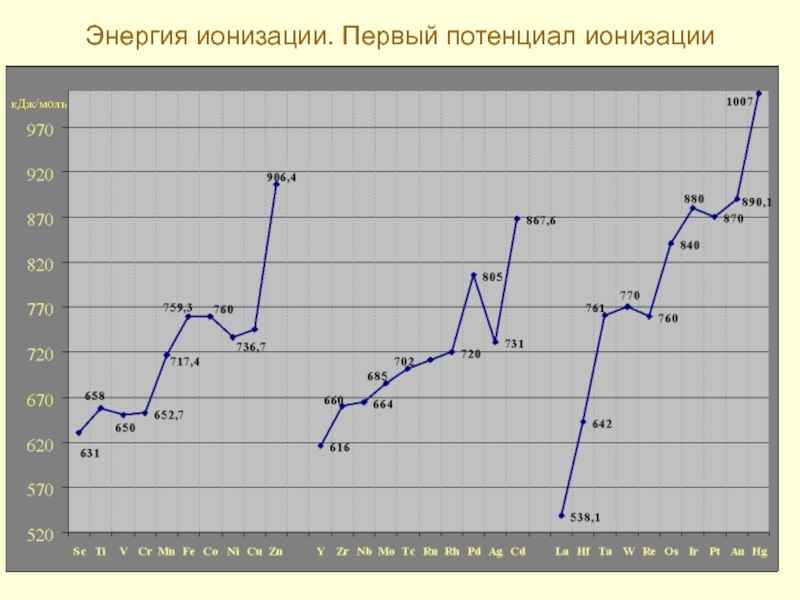
- 13. Энергия ионизации. Первый потенциал ионизации кДж/моль
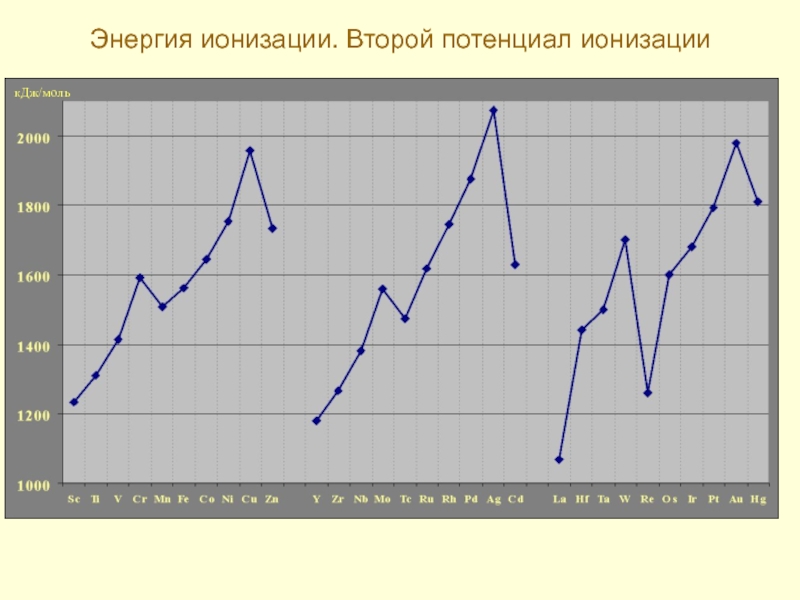
- 14. Энергия ионизации. Второй потенциал ионизации кДж/моль
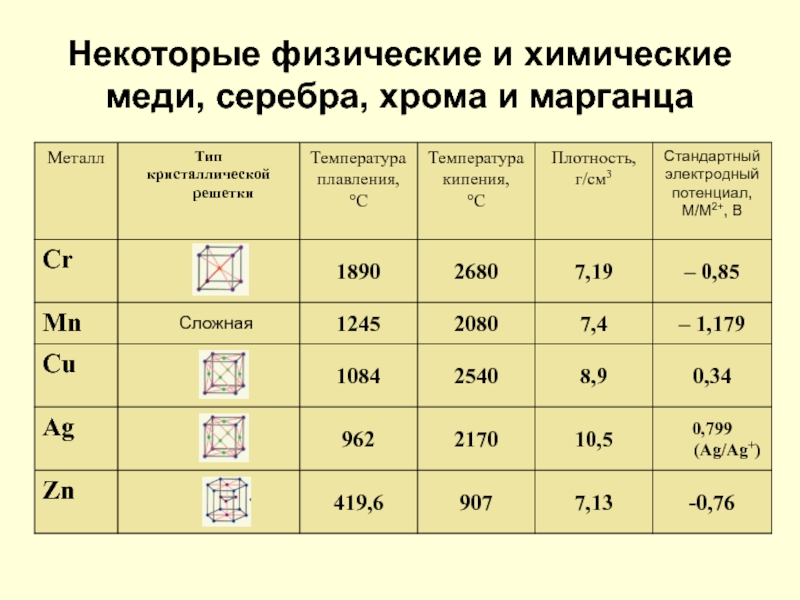
- 16. Некоторые физические и химические меди, серебра, хрома и марганца
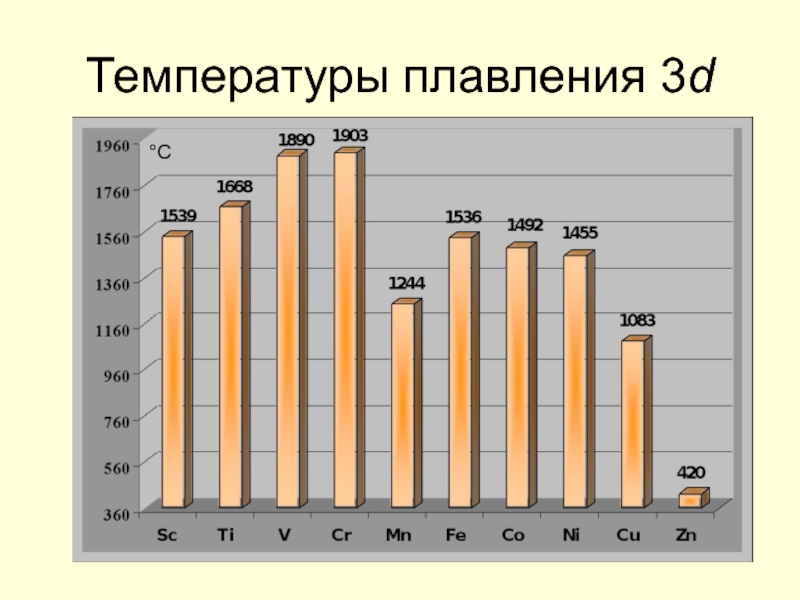
- 17. Температуры плавления 3d °С
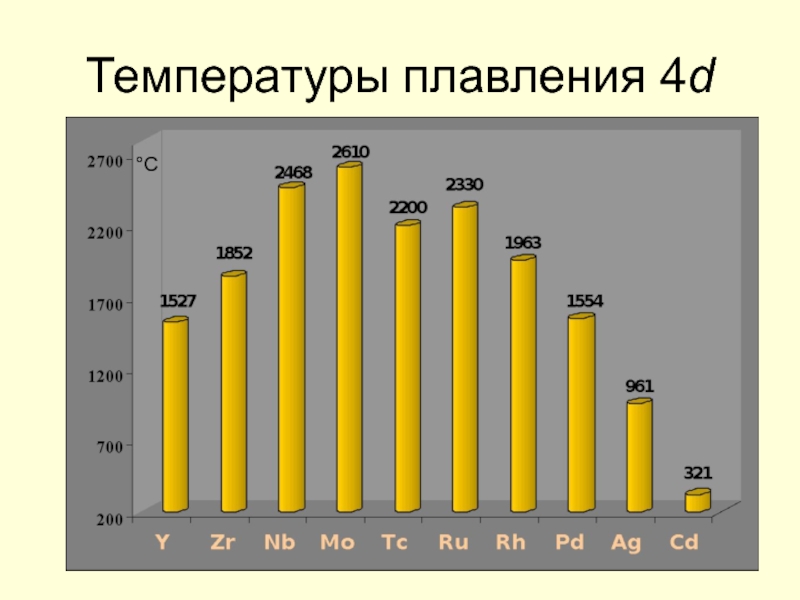
- 18. Температуры плавления 4d °С
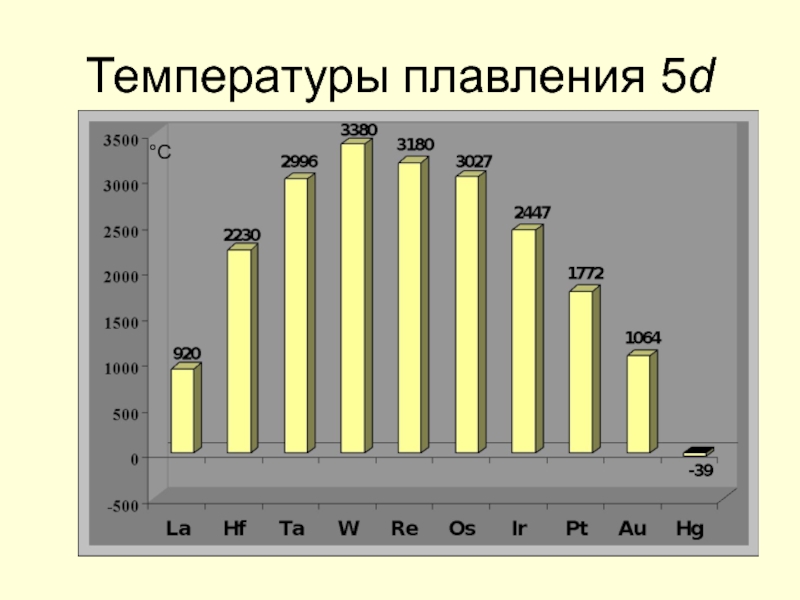
- 19. Температуры плавления 5d °С
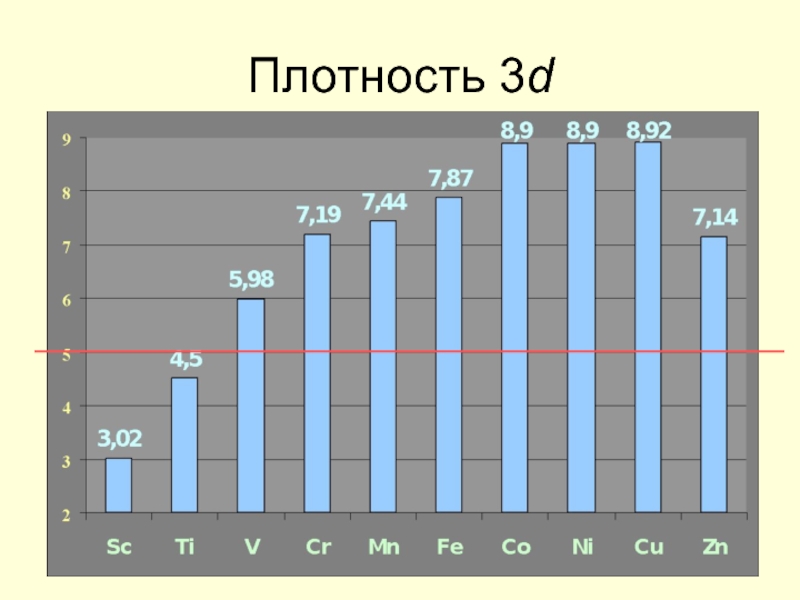
- 20. Плотность 3d
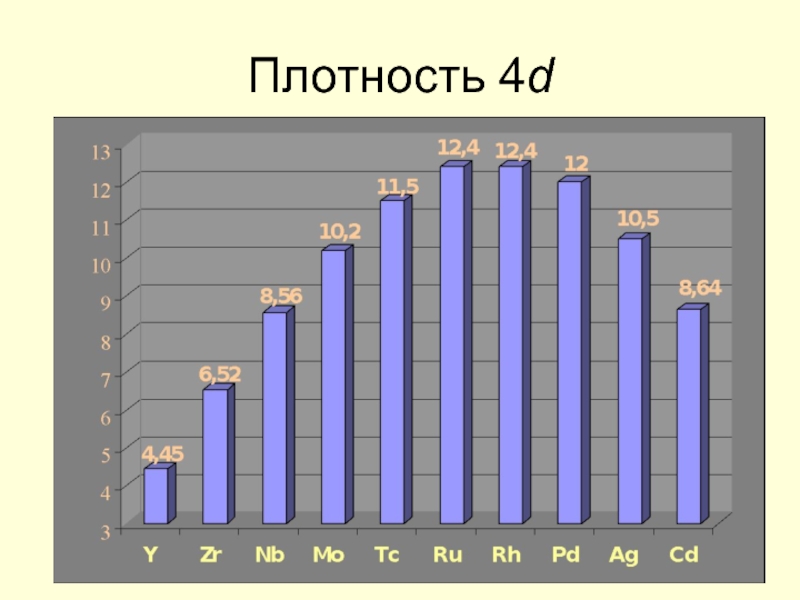
- 21. Плотность 4d
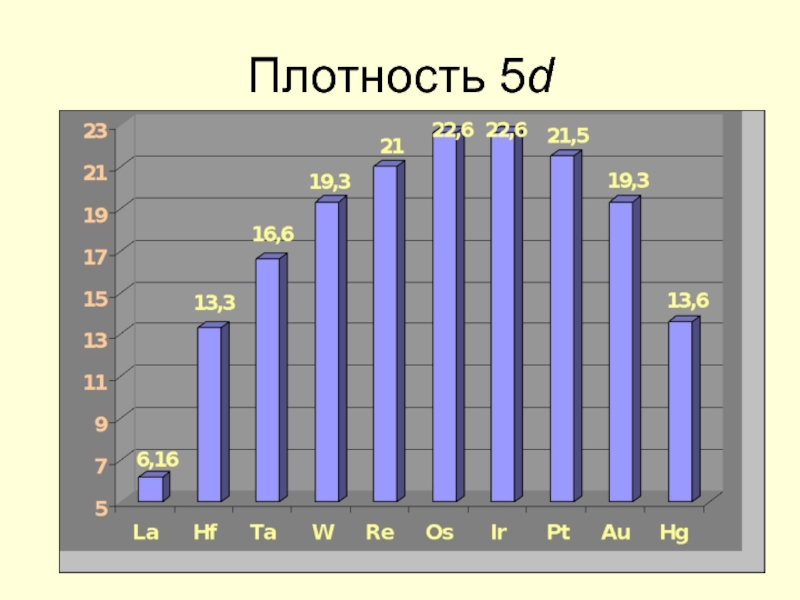
- 22. Плотность 5d
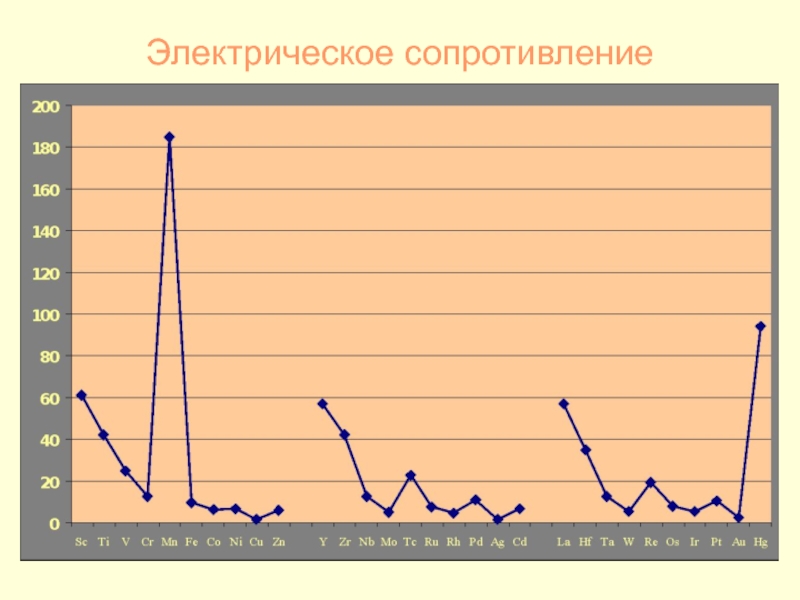
- 23. Электрическое сопротивление
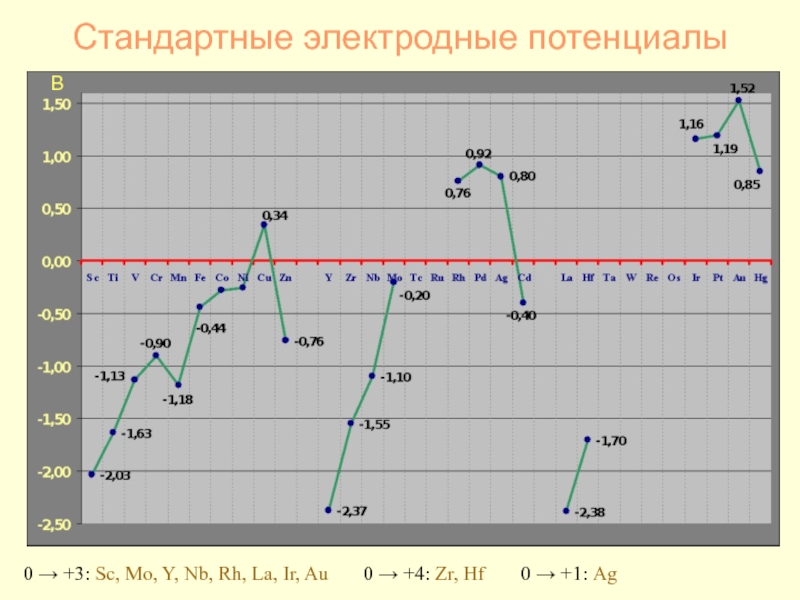
- 24. Стандартные электродные потенциалы В 0 → +3:
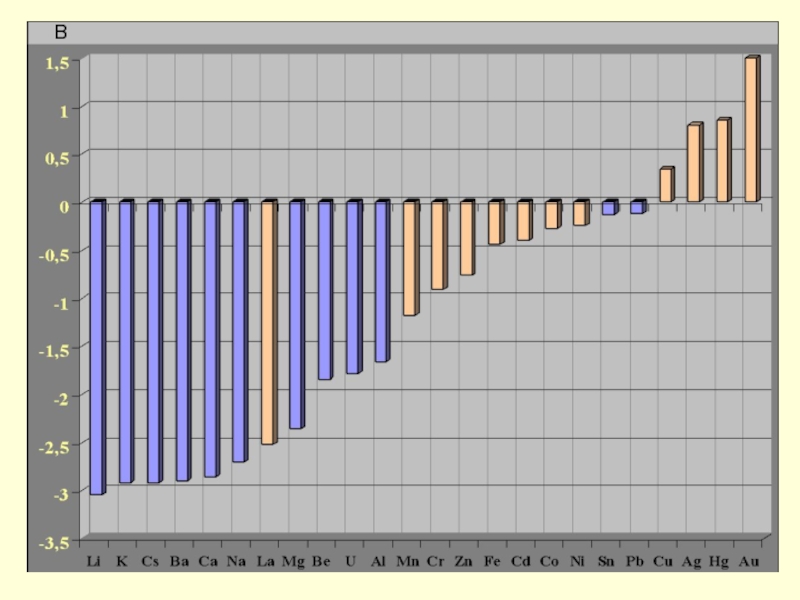
- 25. В
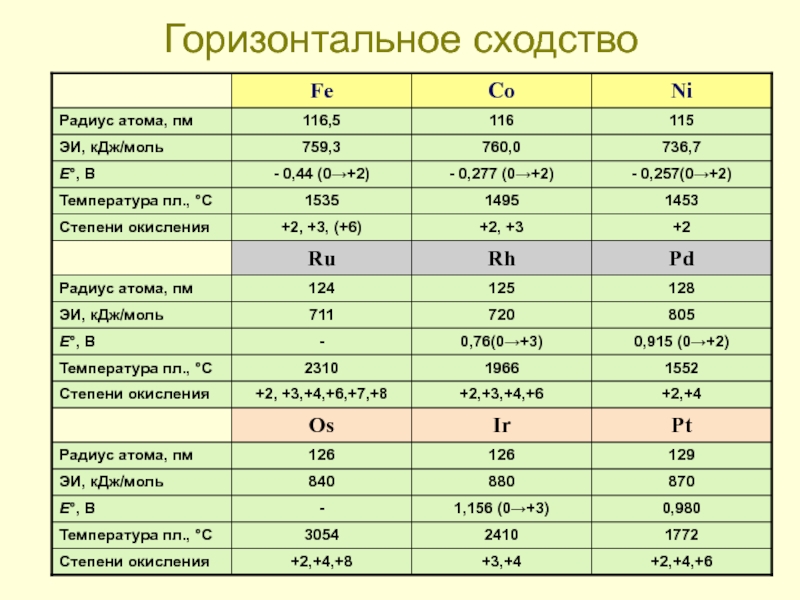
- 26. Горизонтальное сходство
- 27. Устойчивость высшей степени окисления 4Cr(порошок) + 3O2
- 28. Химические свойства меди 2Cu + O2 =
- 29. Химические свойства серебра 2Ag + Cl2 =
- 30. Химические свойства цинка Zn + H2O (пар)
- 31. Химические свойства ртути 2Hg + 2H2SO4 =
- 32. Химические свойства хрома Cr + H2SO4
- 33. Химические свойства марганца Mn + Cl2 =
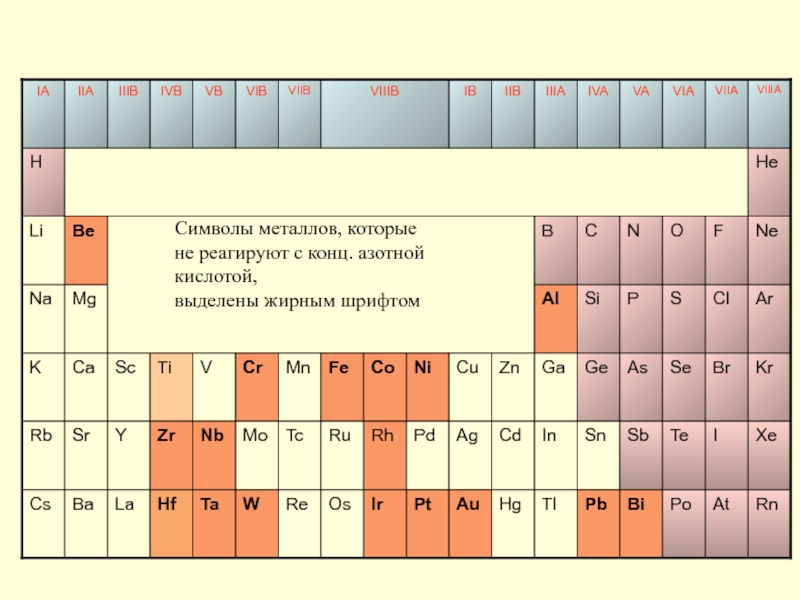
- 34. Символы металлов, которые не реагируют с конц. азотной кислотой, выделены жирным шрифтом
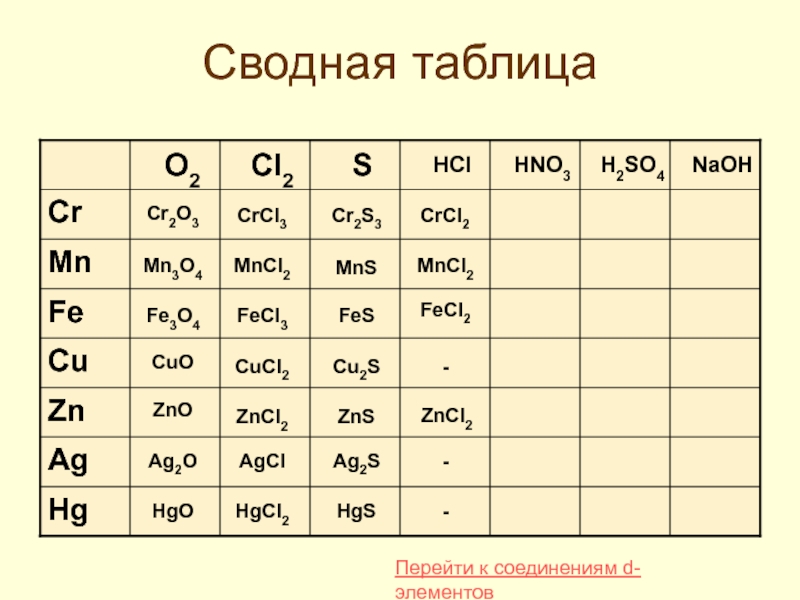
- 35. Сводная таблица Cr2O3 Mn3O4 Fe3O4 CuO ZnO
- 36. Окраска высших оксидов d-элементов
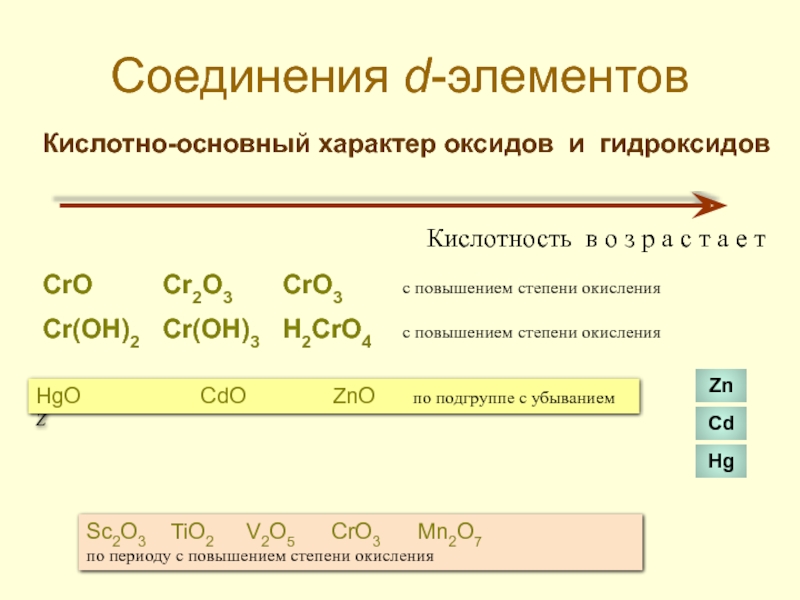
- 37. Соединения d-элементов Кислотно-основный характер оксидов и гидроксидов
- 38. Соединения меди Cu(OH)2 + 2H+ = Cu2+
- 39. Полезная информация к практикуму 2Cu2+ + [Fe(CN)6]4-
- 40. Соединения серебра Степени окисления серебра +1, +2,
- 41. Соединения хрома Хром был открыт в минерале
- 42. Соединения хрома Cr(OH)2 + 2H+ = Cr2+
- 43. Соединения марганца MnCO3 = MnO + CO2↑
- 44. Окислительные свойства перманганата 2KMnO4 + 5K2SO3 +
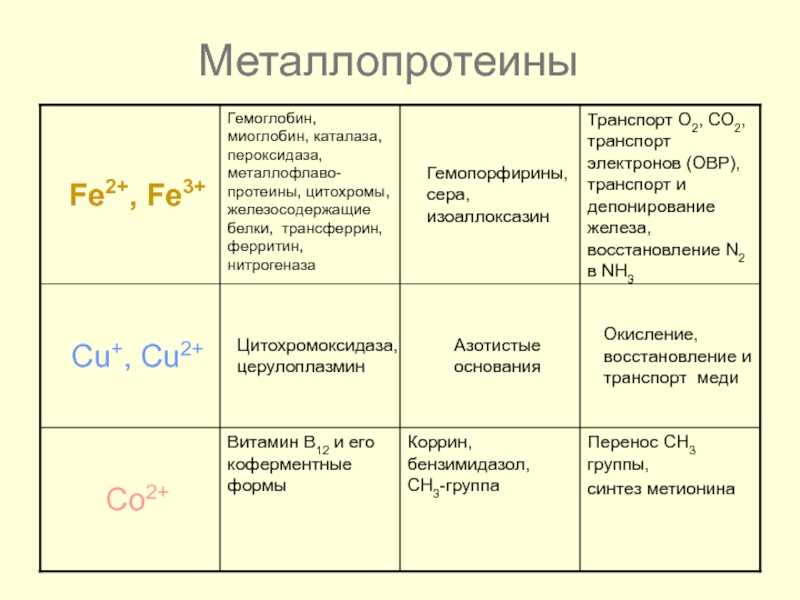
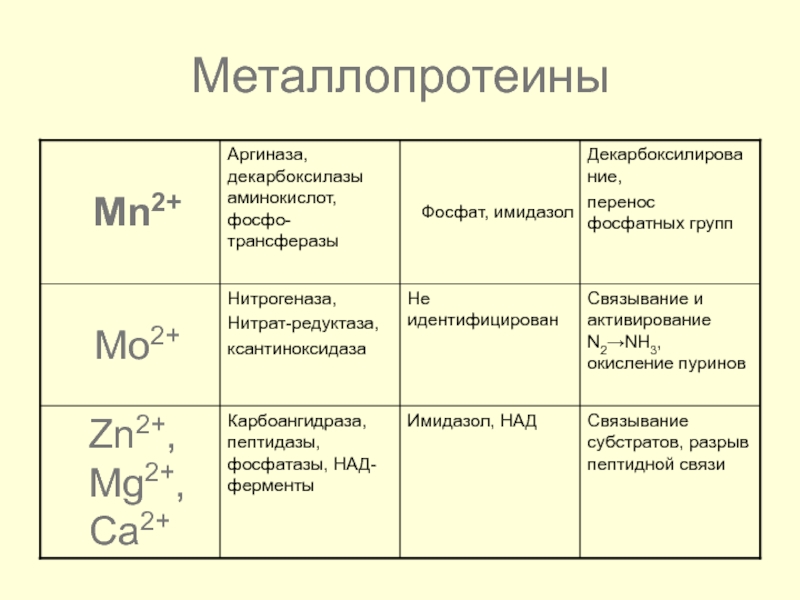
- 45. Металлопротеины
- 46. Металлопротеины
- 47. Применение
- 48. Спасибо за внимание!
Слайд 6М и н е р а л ы
Лимонит
Fe2O3∙nH2O
Магнетит
Fe3O4
Сфалерит
Смитсонит
ZnCO3
Гематит
Fe2O3
Пирит
FeS2
Слайд 24Стандартные электродные потенциалы
В
0 → +3: Sc, Mo, Y, Nb, Rh, La,
0 → +4: Zr, Hf
0 → +1: Ag
Слайд 27Устойчивость высшей степени окисления
4Cr(порошок) + 3O2 = 2Cr2O3 (медленно)
2Mo
2W + 3O2 = 2WO3 (выше 500 °С)
3Fe + 2O2 = Fe3O4 (150-600 °С, сгорание на воздухе)
Ru + O2 = RuO2 (400 °С)
Os + 2O2 = OsO4 (400 °C, сгорание на воздухе)
+3
+6
+2,+3
+4
+8
Чем обусловлена устойчивость
высшей степени окисления
У 4d- и 5d-элементов?
Экранирующее влияние электронов на f-подуровне!
MnO4- / MnO2 1,69 В
TcO4- / TcO2 0,74 В
ReO4- / ReO2 0,51 В
Слайд 28Химические свойства меди
2Cu + O2 = 2CuO
Cu + Cl2 = CuCl2
2Cu
Cu + 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
2Cu + O2 + CO2 + H2O = (CuOH)2CO3
Опыт: горение меди в хлоре
Опыт: взаимодействие меди с азотной кислотой
Опыт: взаимодействие меди с серной концентрированной кислотой
Слайд 29Химические свойства серебра
2Ag + Cl2 = 2AgCl
2Ag + S = Ag2S
2Ag
3Ag + 4HNO3 (разб.) = 3AgNO3 + NO + 2H2O
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Ag + F2 = AgF2 (>300 °C)
Слайд 30Химические свойства цинка
Zn + H2O (пар) = ZnO + H2
Zn +
Zn + H2SO4 = ZnSO4 + H2
4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S + 4H2O
4Zn + 10HNO3 (оч.разб., гор.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + H3PO4 (конц., гор.) = ZnHPO4↓ + H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Zn + 4 NH3.H2O = [Zn(NH3)4](OH)2 + H2 + 2H2O
2Zn + O2 = 2ZnO
Zn + Cl2 = ZnCl2
Zn + S = ZnS
Слайд 31Химические свойства ртути
2Hg + 2H2SO4 = Hg2SO4 + SO2 + 2H2O
Hg
конц., гор.
конц.
2Hg + O2 = 2HgO 250-350 °C
Hg + Cl2 = HgCl2 70-120 °C
Hg + HgCl2 = Hg2Cl2 250-300 °C
Hg + S = HgS
6Hg + 8HNO3 = 3Hg2(NO3)2 + 2NO + 4H2O
разб.,хол.
Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O
конц., гор.
Hg + 4HI = H2[HgI4] + H2
конц.
Опыт: взаимодействие ртути с азотной кислотой
Слайд 32Химические свойства хрома
Cr + H2SO4 (разб.) = CrSO4 + H2↑
4Cr (порошок)
Не реагирует с холодной водой, щелочами,
гидратом аммиака, пассивируется в концентрированной
и разбавленной азотной кислоте, «царской водке».
2Cr + 3H2O (пар) = Cr2O3 + 3H2
Cr + 2HCl = CrCl2 + H2
Cr + 2F2 = CrF4 (350-500 °C)
Слайд 33Химические свойства марганца
Mn + Cl2 = MnCl2
Mn + O2 =
Mn + S = MnS
Mn (порошок) + 2H2O (пар) = Mn(OH)2 + H2↑
Mn + 2HCl = MnCl2 + H2↑
Mn + H2SO4 = MnSO4 + H2↑
Mn + 2H2SO4 (конц.) = MnSO4 + SO2↑ + 2H2O
3Mn + 8HNO3 (конц.) = 3Mn(NO3)2 + 2NO↑ + 4H2O
Слайд 35Сводная таблица
Cr2O3
Mn3O4
Fe3O4
CuO
ZnO
Ag2O
HgO
CrCl3
MnCl2
FeCl3
CuCl2
ZnCl2
AgCl
HgCl2
CrCl2
MnCl2
FeCl2
-
ZnCl2
-
-
Cr2S3
MnS
FeS
Cu2S
ZnS
Ag2S
HgS
Перейти к соединениям d-элементов
Слайд 37Соединения d-элементов
Кислотно-основный характер оксидов и гидроксидов
Кислотность в о з р а
CrO Cr2O3 CrO3 с повышением степени окисления
Cr(OH)2 Cr(OH)3 H2CrO4 с повышением степени окисления
HgO CdO ZnO по подгруппе с убыванием Z
Zn
Cd
Hg
Sc2O3 TiO2 V2O5 CrO3 Mn2O7
по периоду с повышением степени окисления
Слайд 38Соединения меди
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Cu(OH)2 + 2OH–
Сульфат меди(II) пятиводный CuSO4 • 5H2O – медный купорос;
Карбонат гидроксомеди(II) (CuOH)2CO3,
основной компонент минерала малахита
Степени окисления меди +1, +2, +3
CuO + 2H+ = Cu2+ + 2H2O
2Cu2+ + 2NH3.H2O + SO42- = (CuOH)2SO4 + 2NH4+
[Cu(NH3)4]2+
Слайд 39Полезная информация к практикуму
2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]↓
Cu2+ + S2- =
CuS + 2H+ -X?
CuSO4 + H2S = CuS↓ + H2SO4
3CuSO4 + 2Al = Al2(SO4)3 + 3CuCl2
3CuCl2 + 2Al = 2AlCl3 + 3Cu
Слайд 40Соединения серебра
Степени окисления серебра +1, +2, +3
Ag2O
2AgNO3 + 2NaOH = Ag2O↓
AgNO3 Растворимость 225,5 г/100 г Н2О при 20 °С
ПР = 1,6·10-8
AgCl + 2NH3 = [Ag(NH3)2]Cl
К.ч. = 2
[Ag(NH3)2]OH реактив Толленса
AgI + Na2S2O3 = Na3[Ag(S2O3)2] + NaI
Слайд 42Соединения хрома
Cr(OH)2 + 2H+ = Cr2+ + 2H2O
4CrCl2 + 4HCl +
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
CrO3 + H2O = H2CrO4
2CrO42– + 2H+ Cr2O72– + H2O
K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
K2Cr2O7 + K2SO3 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + H2O
CrO Cr(OH)2
Cr2O3 Cr(OH)3
CrO3 H2CrO4
+2
+3
+6
Кислотность
Степени окисления хрома +2, +3, +4, +6
CrO(OH)
CrO2
ферромагнитен
Слайд 43Соединения марганца
MnCO3 = MnO + CO2↑
MnO2 + H2 = MnO
MnO + 2HCl = MnCl2 + H2O
2Mn(OH)2 + O2 + H2O = 2MnO(OH)2
MnO2 + 4HCl (конц.) = MnCl2 + Cl2↑ + 2H2O
MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O
2MnO2 + 2H2SO4 = 2MnSO4 + 2H2O + O2↑
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O.
Mn2O7 + H2O = 2HMnO4
Mn2O7 + 2NaOH = 2NaMnO4 + H2O
MnO Mn(OH)2
MnO2 MnO(OH)2
Mn2O7 HMnO4
+2
+4
+7
Кислотность
Степени окисления марганца +2, +3, +4, +6, +7
Слайд 44Окислительные свойства перманганата
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH
2KMnO4 + K2SO3 + 2KOH = 2 K2MnO4 + K2SO4 + H2O
2K2MnO4 + 2H2O 2KMnO4 + MnO2 + 4KOH
2KMnO4 = K2MnO4 + MnO2 + O2↑
Δ
+7
+7
+7
+7
+6
+2
+4
+4
+6
+6
+7
+4
Опыт: восстановление перманганата в кислой среде
Опыт: восстановление перманганата в нейтральн. ср.
Опыт: восстановление перманганата в щелочной среде













![Соединения медиCu(OH)2 + 2H+ = Cu2+ + 2H2O Cu(OH)2 + 2OH– = [Cu(OH)4]2– Сульфат меди(II)](/img/tmb/4/368569/f8a0cd9986e2e242af73b8a5a11523c7-800x.jpg)
![Полезная информация к практикуму2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]↓Cu2+ + S2- = CuS↓CuS + 2H+ -X?CuSO4](/img/tmb/4/368569/7e7a7ad5f79e804866a3ee8ab2268dff-800x.jpg)