- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества презентация
Содержание
- 1. Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества
- 2. а Модели молекул: б г в
- 3. Превращения воды
- 4. Химический элемент и простое вещество Атомы
- 5. Атомы химических элементов S и
- 6. Химический
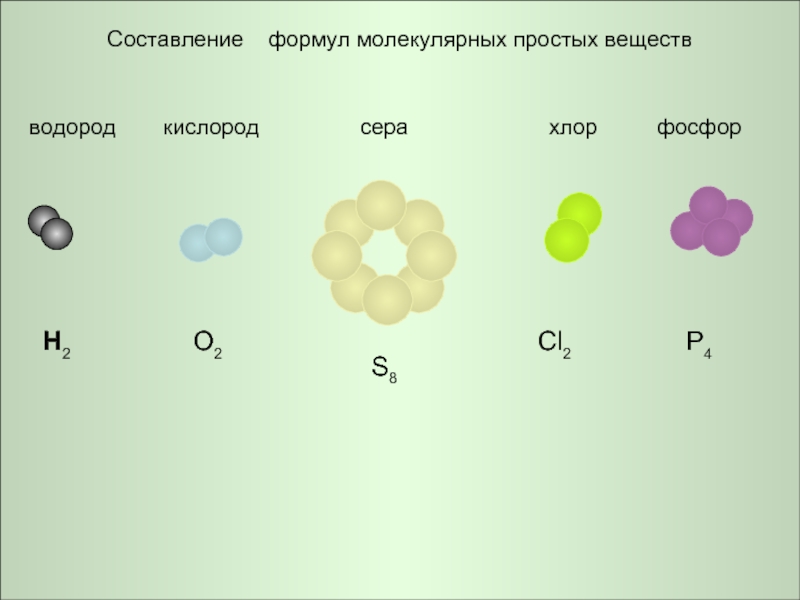
- 7. Составление формул молекулярных простых веществ
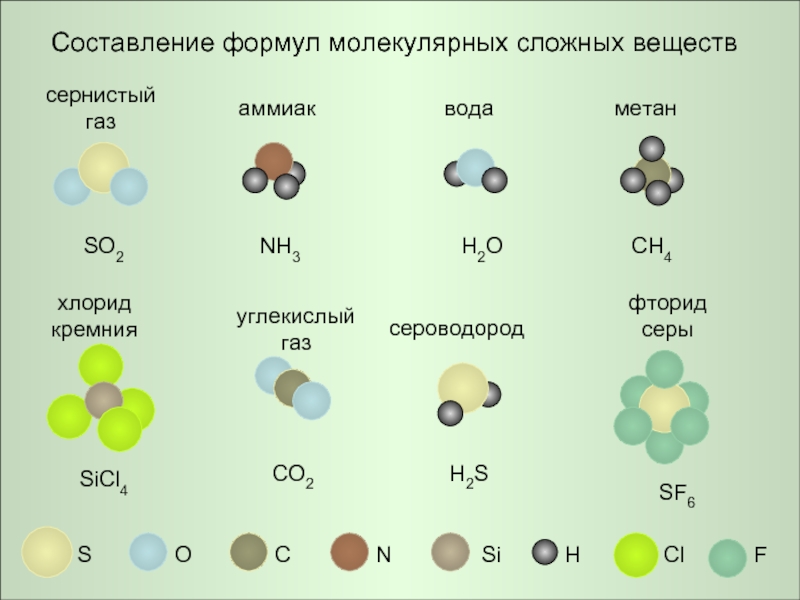
- 8. Составление формул молекулярных сложных веществ
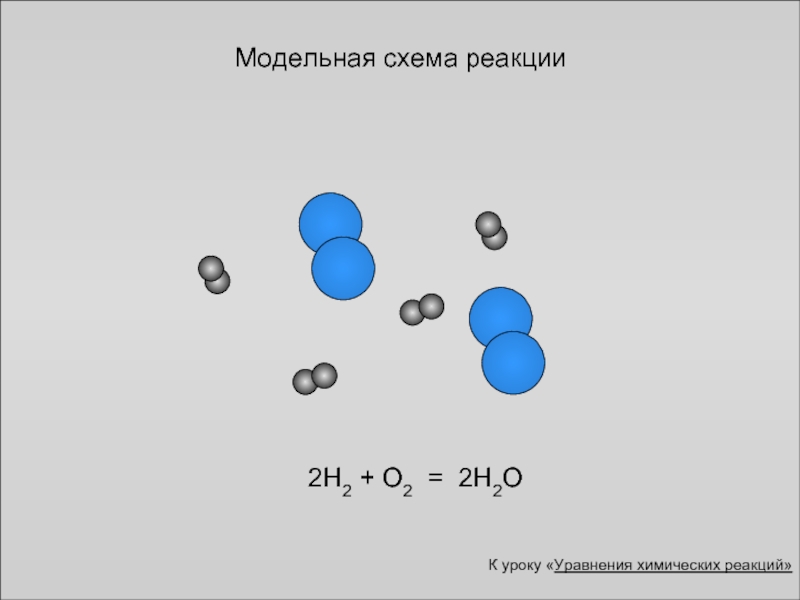
- 10. Модельная схема реакции
- 12. Модельная схема реакции
- 13. Период Элемент № группы Формула
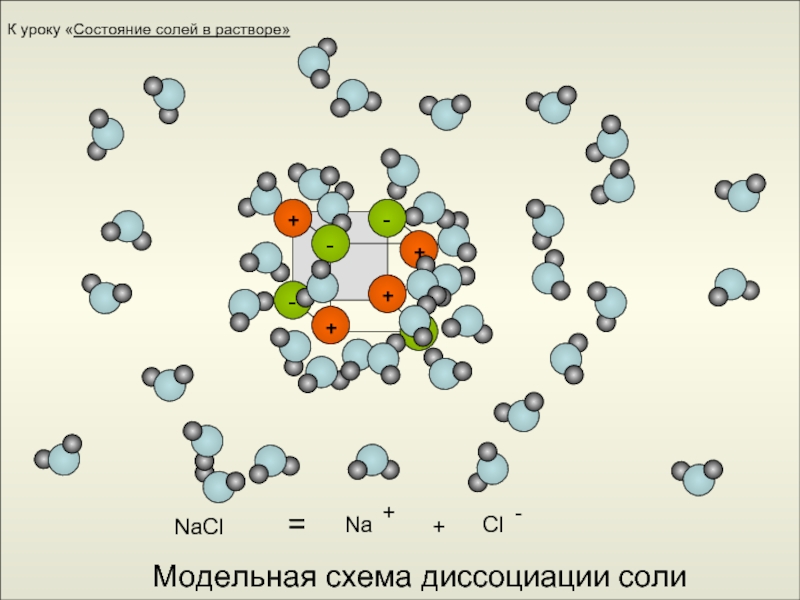
- 15. Модельная схема диссоциации соли NaCl
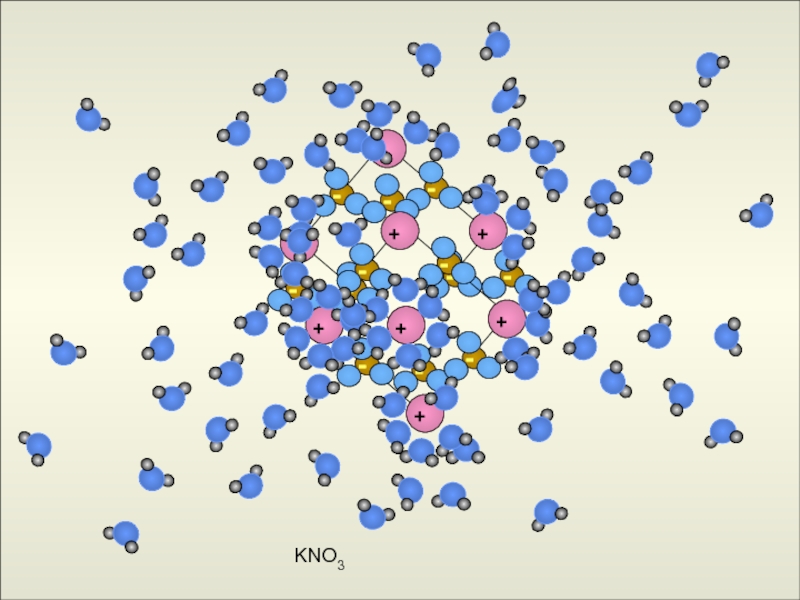
- 16. KNO3
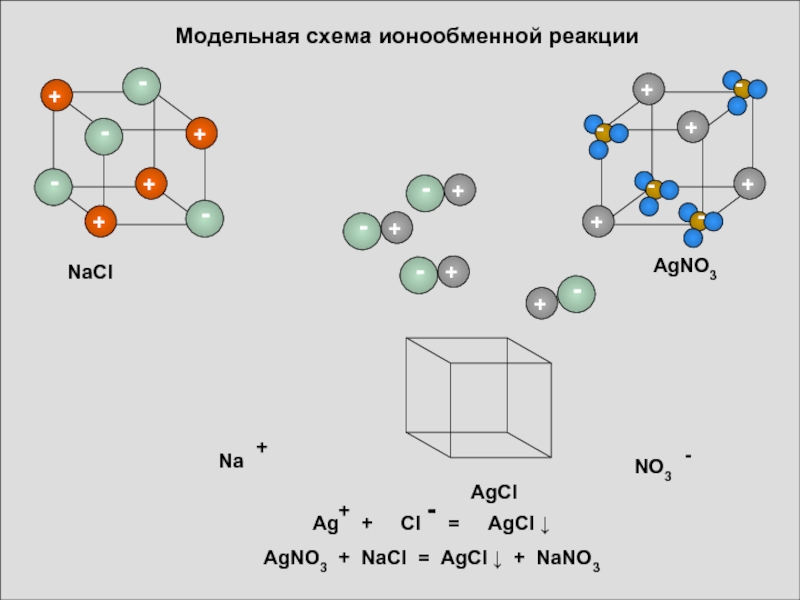
- 17. Модельная схема ионообменной реакции AgCl NaCl AgNO3
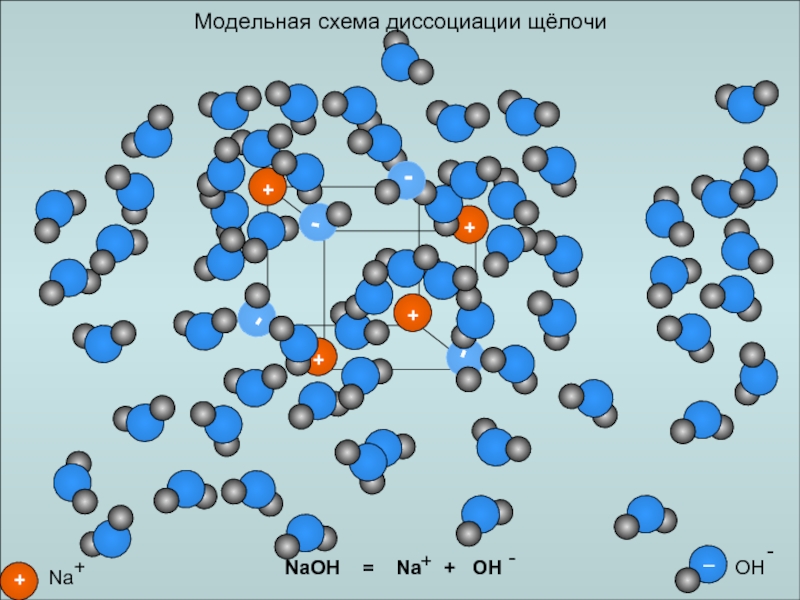
- 20. Модельная схема диссоциации щёлочи
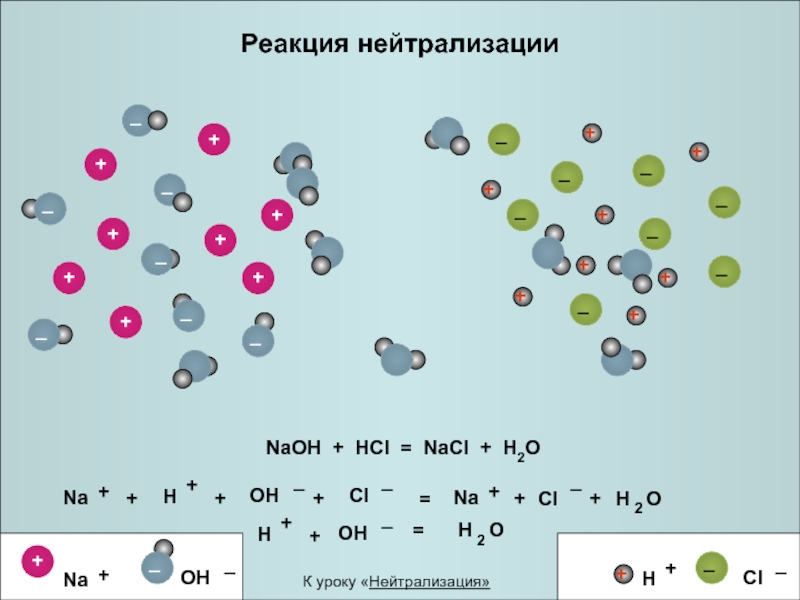
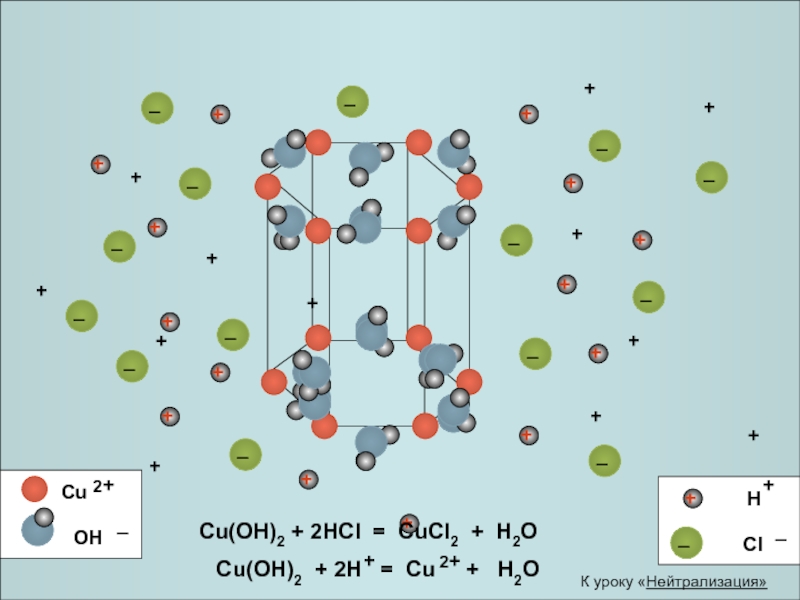
- 21. Реакция нейтрализации NaOH +
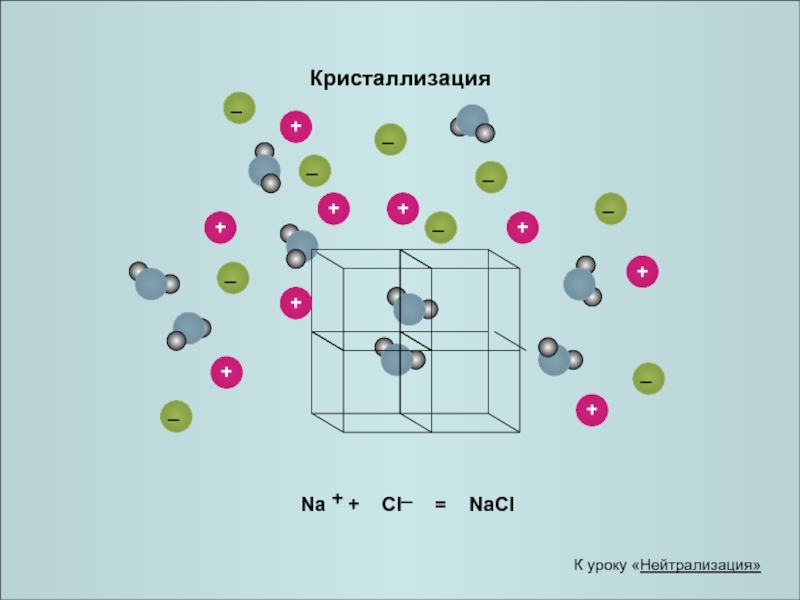
- 22. Кристаллизация
- 24. Элемент Аr Высшая валентность Ф-лы прос-тых
- 25. Взаимосвязь классов неорганических веществ Металлы Оксиды
- 27. H He Li
Слайд 1
Лилия Кузнецова
Наглядное пособие
«Динамические модели»
Электронное приложение к учебнику «Химия-8»
© Кузнецова
Слайд 2
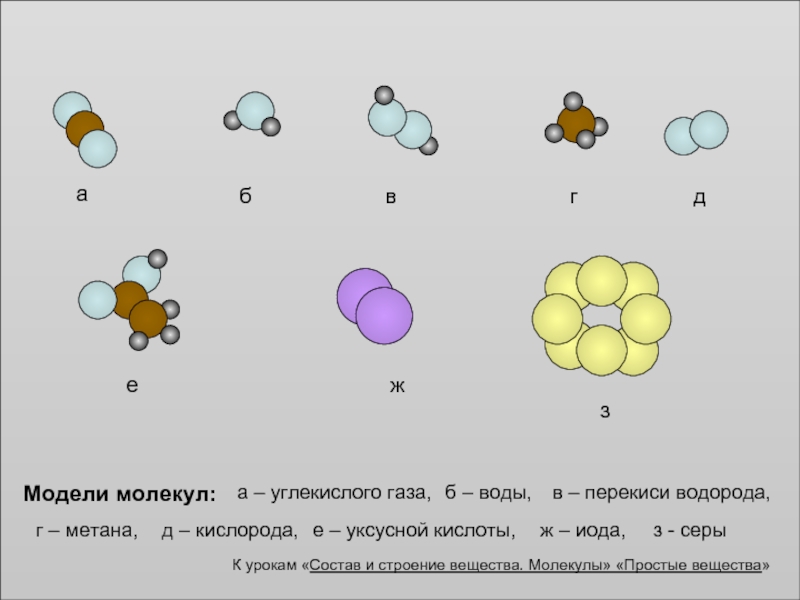
а
Модели молекул:
б
г
в
е
д
ж
з
а – углекислого газа,
б – воды,
в – перекиси водорода,
г –
д – кислорода,
е – уксусной кислоты,
ж – иода,
з - серы
К урокам «Состав и строение вещества. Молекулы» «Простые вещества»
Слайд 3
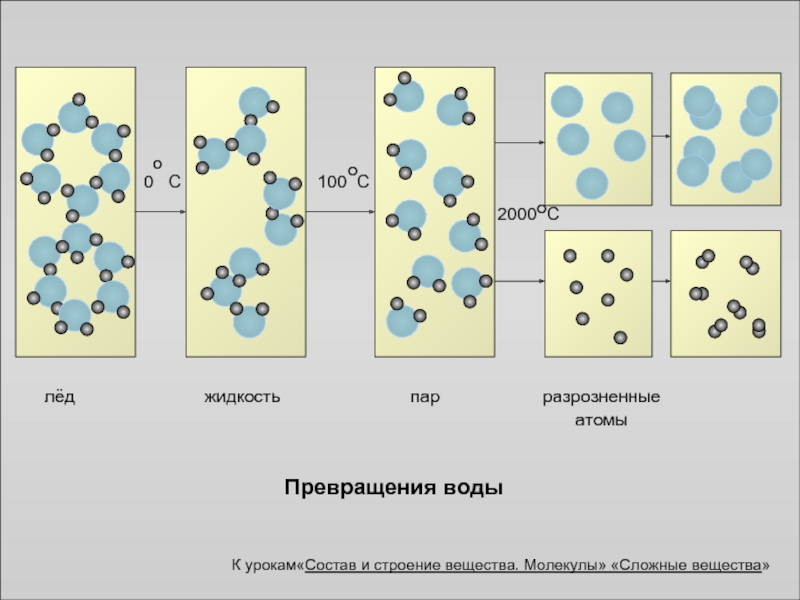
Превращения воды
лёд
пар
жидкость
разрозненные
атомы
К урокам«Состав и строение вещества. Молекулы» «Сложные вещества»
Слайд 4
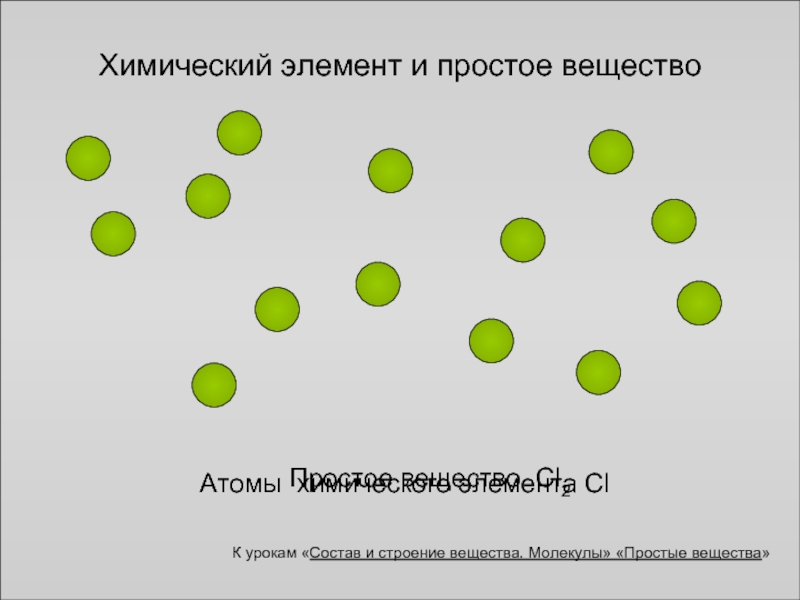
Химический элемент и простое вещество
Атомы химического элемента Cl
К урокам «Состав и строение вещества. Молекулы» «Простые вещества»
Слайд 5
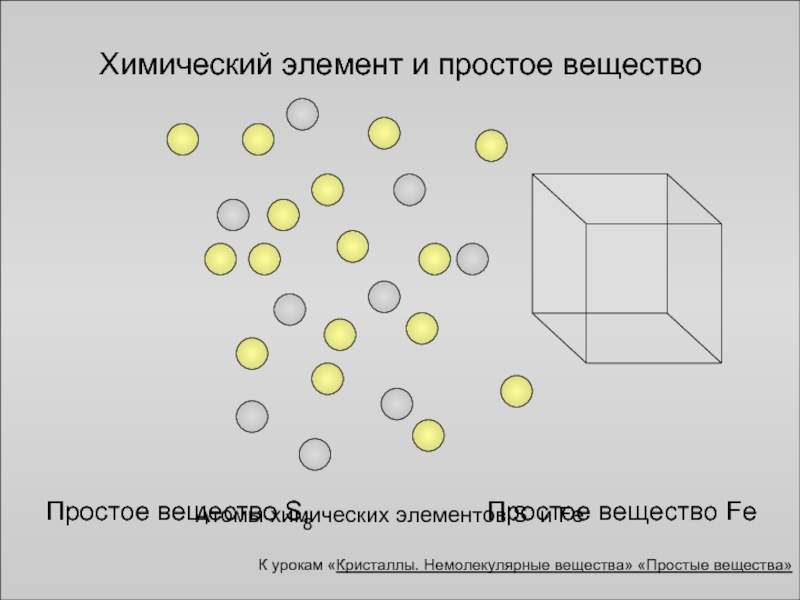
Атомы химических элементов S и Fe
Простое вещество Fe
Химический элемент
Простое вещество S8
К урокам «Кристаллы. Немолекулярные вещества» «Простые вещества»
Слайд 6
Химический элемент Al
Простое вещество Al
К урокам «Кристаллы. Немолекулярные вещества» «Простые вещества»
Слайд 8
Составление формул молекулярных сложных веществ
S
O
C
N
H
Cl
Si
F
сернистый
газ
аммиак
вода
метан
сероводород
углекислый
газ
хлорид
кремния
фторид
серы
SO2
NH3
H2O
CH4
SiCl4
CO2
H2S
SF6
Слайд 9
Al
Cl
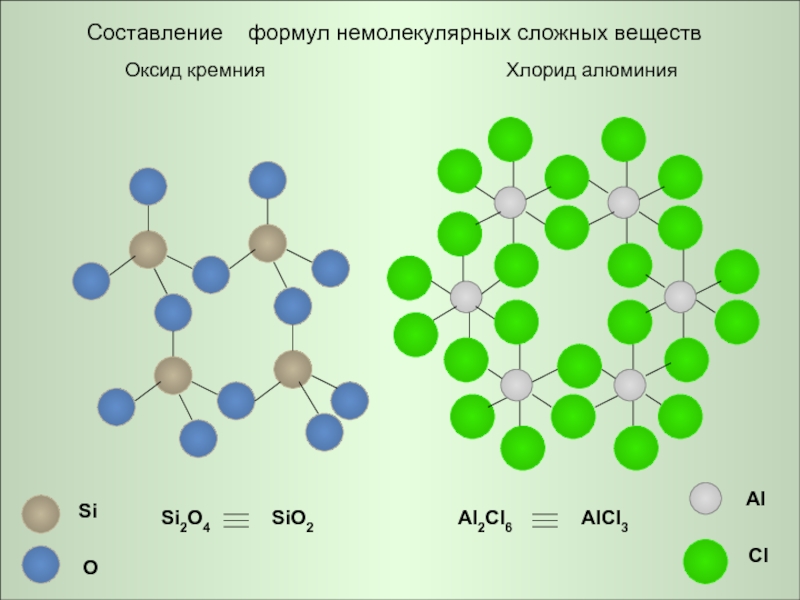
Оксид кремния
Si
O
Si2O4
SiO2
Al2Cl6
AlCl3
Хлорид алюминия
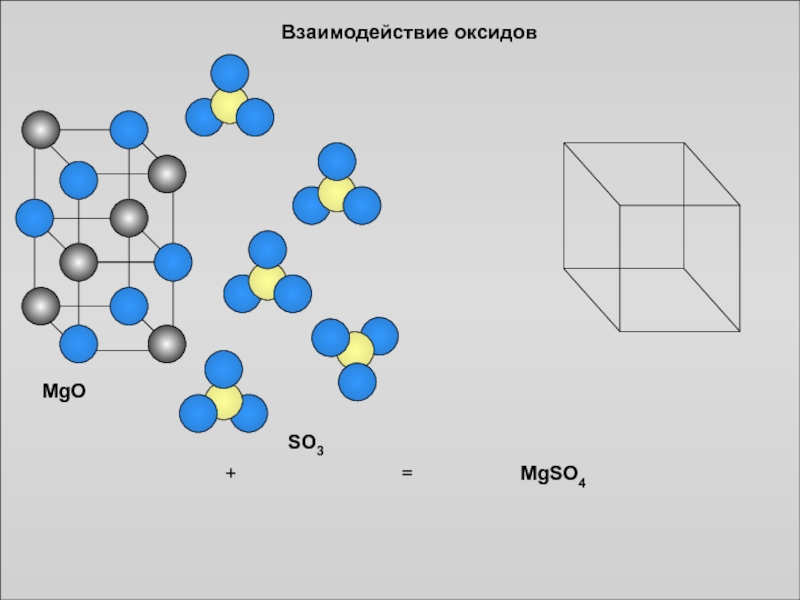
Составление формул немолекулярных сложных веществ
Слайд 11
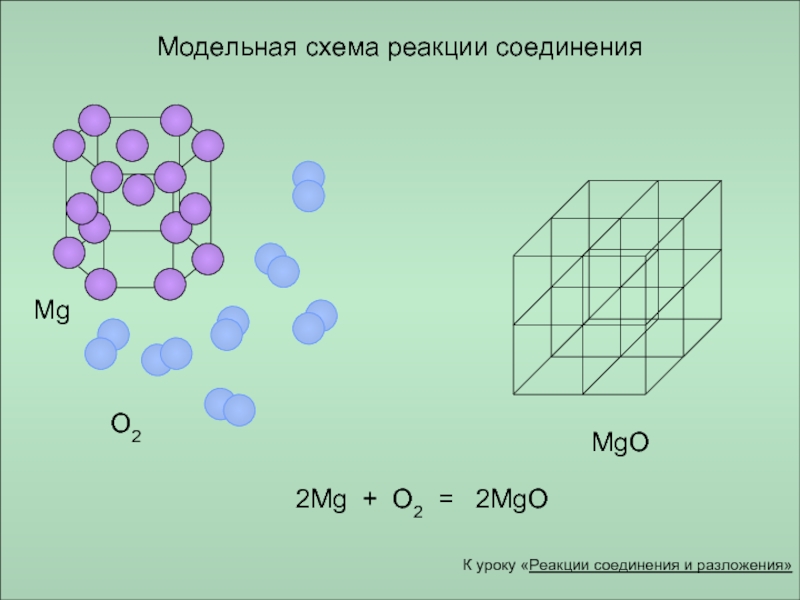
Модельная схема реакции соединения
Mg
O2
MgO
2Mg + O2 = 2MgO
К уроку
Слайд 12
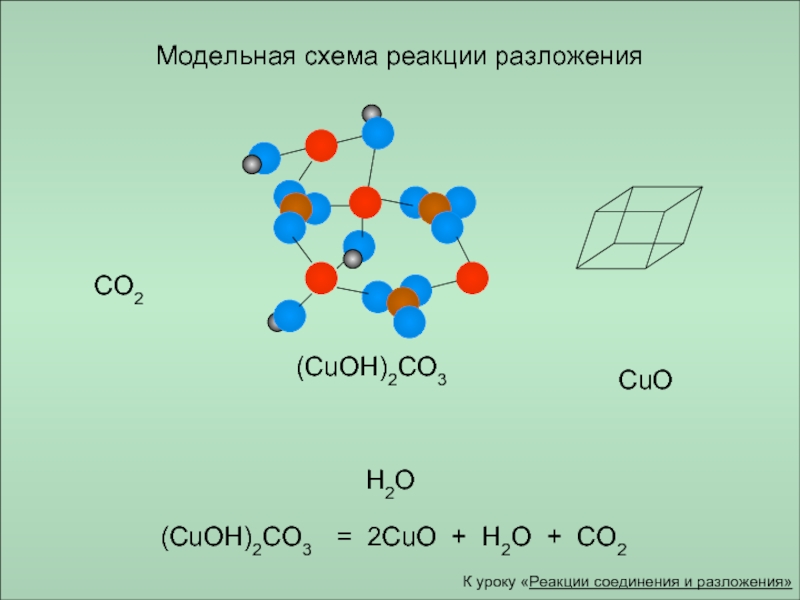
Модельная схема реакции разложения
(CuOH)2CO3
CO2
CuO
H2O
(CuOH)2CO3 = 2CuO + H2O +
К уроку «Реакции соединения и разложения»
Слайд 13
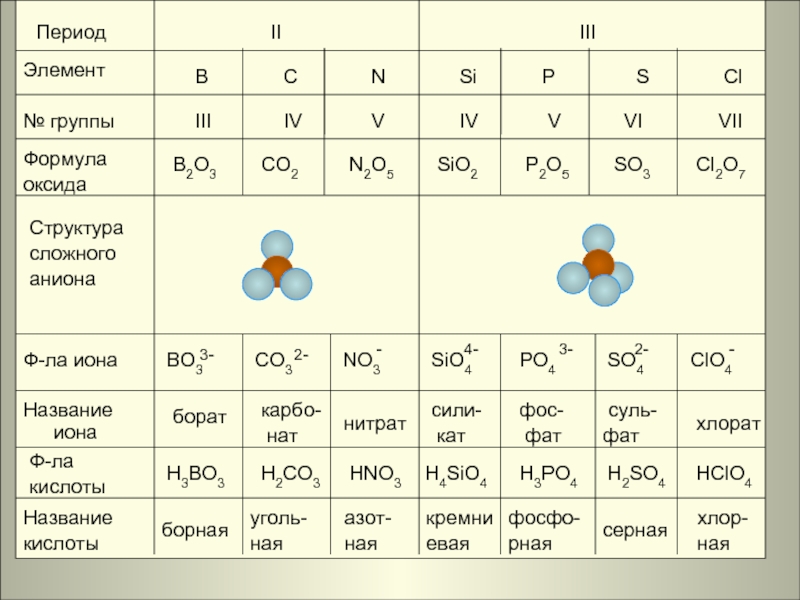
Период
Элемент
№ группы
Формула
оксида
Структура
сложного
аниона
Ф-ла иона
Название иона
Ф-ла
кислоты
Название
кислоты
II
III
C
N
Si
P
S
Cl
III
IV
V
IV
V
VI
VII
B2O3
CO2
N2O5
SiO2
P2O5
SO3
Cl2O7
BO3
3-
CO3
2-
NO3
-
SiO4
4-
PO4
3-
SO4
2-
ClO4
-
H3BO3
H2CO3
HNO3
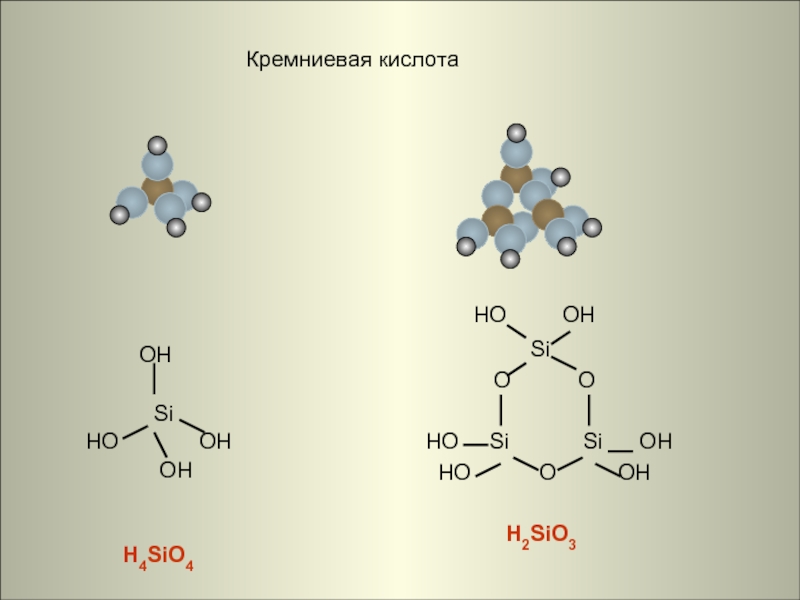
H4SiO4
H3PO4
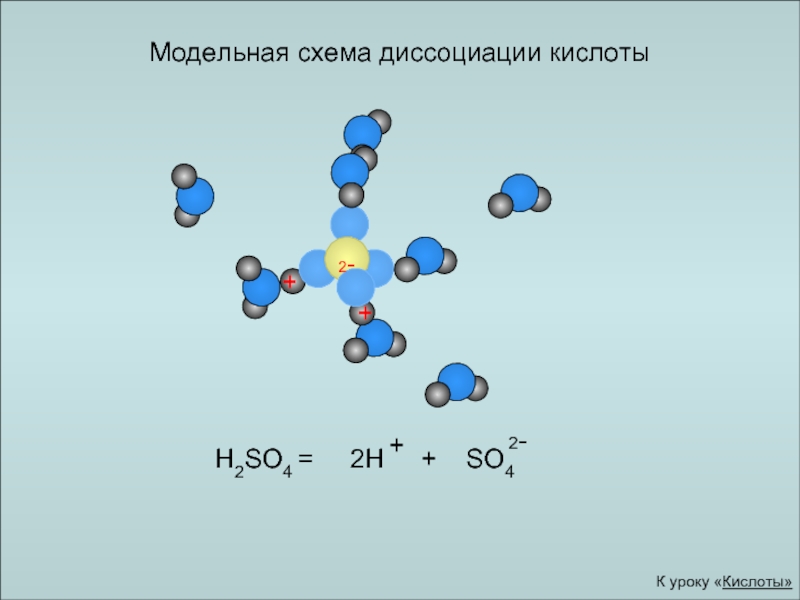
H2SO4
HClO4
борат
карбо-
нат
нитрат
сили-
кат
фос-
фат
суль-
фат
хлорат
борная
уголь-
ная
азот-
ная
кремни
евая
фосфо-
рная
серная
хлор-
ная
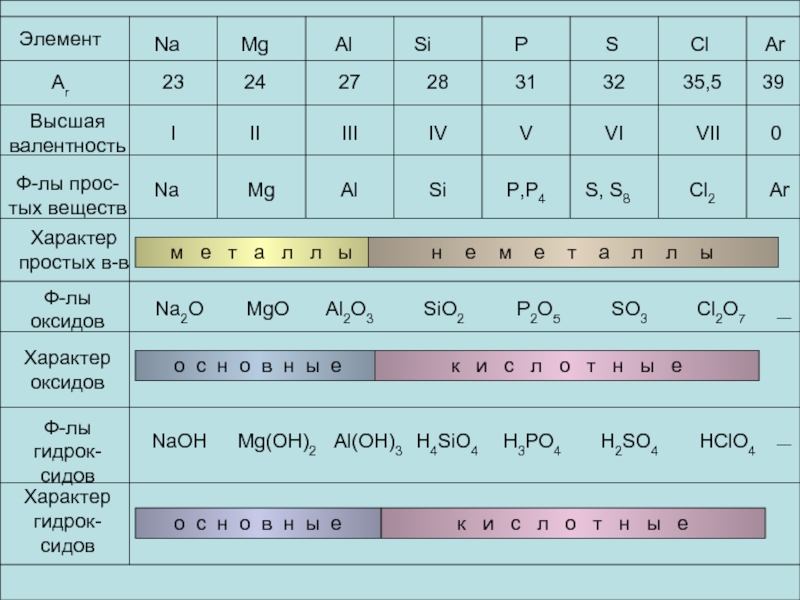
Слайд 24
Элемент
Аr
Высшая валентность
Ф-лы прос-тых веществ
Характер простых в-в
Ф-лы оксидов
Характер оксидов
Ф-лы гидрок-сидов
Характер гидрок-сидов
Na
23
24
27
28
31
32
35,5
39
I
II
III
IV
V
VI
VII
0
Na
Mg
Al
Si
P,P4
S, S8
Cl2
Ar
м е т а л л ы
о с н о в н ы е
о с н о в н ы е
н е м е т а л л ы
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
к и с л о т н ы е
NaOH
Mg(OH)2
Al(OH)3
H4SiO4
H3PO4
H2SO4
HClO4
к и с л о т н ы е
__
__
Слайд 25
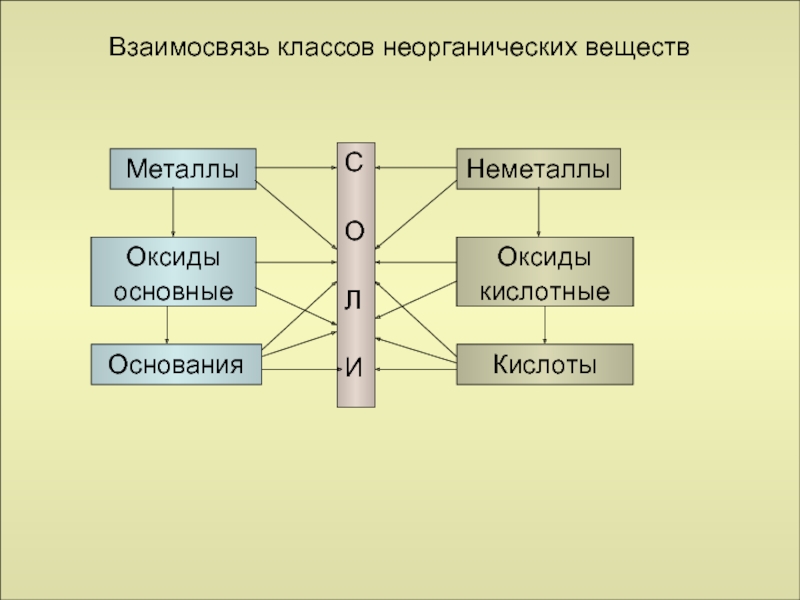
Взаимосвязь классов неорганических веществ
Металлы
Оксиды
металлов
Основания
Неметаллы
Оксиды
неметаллов
Кислоты
С
О
Л
И
Оксиды
основные
Оксиды
кислотные
Слайд 26
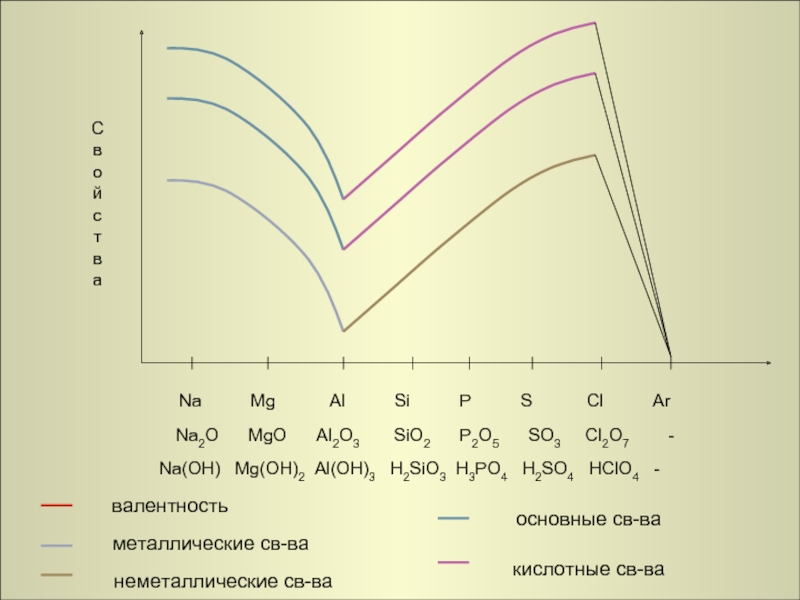
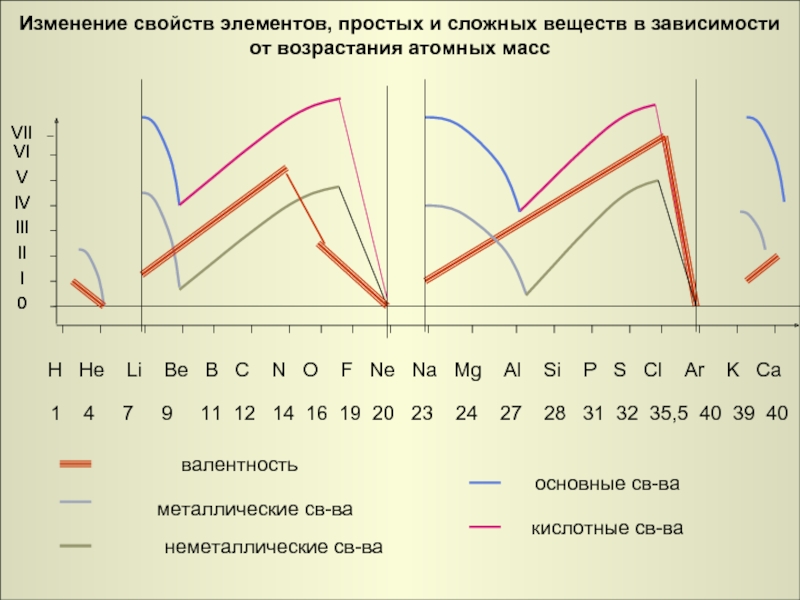
Na Mg Al Si P S Cl Ar
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7 -
Na(OH) Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4 -
С
в
о
й
с
т
в
а
основные св-ва
кислотные св-ва
неметаллические св-ва
валентность
металлические св-ва
Слайд 27
H He Li Be B C
1 4 7 9 11 12 14 16 19 20 23 24 27 28 31 32 35,5 40 39 40
основные св-ва
кислотные св-ва
IV
VI
V
VII
II
I
III
0
валентность
IV
VI
V
VII
II
I
III
0
металлические св-ва
неметаллические св-ва
Изменение свойств элементов, простых и сложных веществ в зависимости от возрастания атомных масс