- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Метод молекулярных орбиталей презентация
Содержание
- 1. Метод молекулярных орбиталей
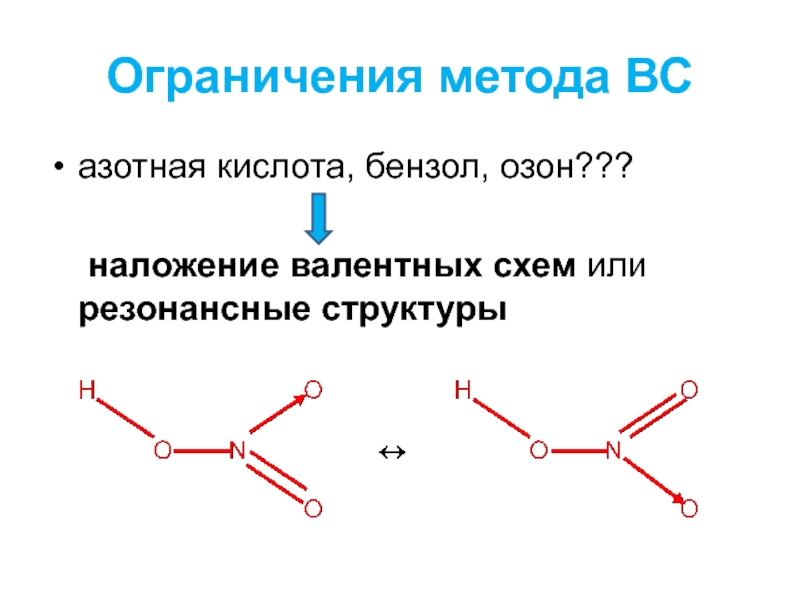
- 2. Ограничения метода ВС азотная кислота, бензол, озон??? наложение валентных схем или резонансные структуры
- 3. Метод МО (Малликен, Хунд): молекула – совокупность
- 4. ЛКАО ψ(МО)связ = С1ψ(АО1) + С2ψ(АО2) ψ(МО)разр
- 5. Принципы метода МО 1. Как и в
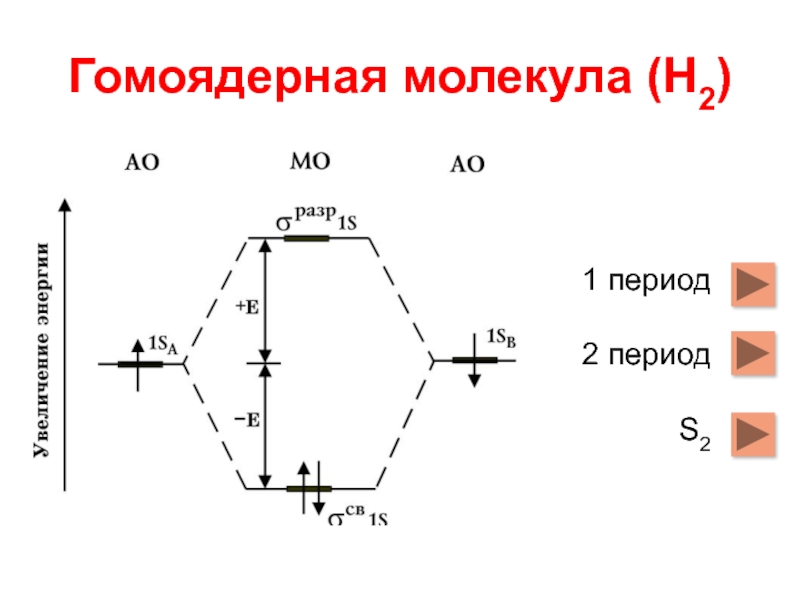
- 6. Гомоядерная молекула (Н2) 1 период 2 период S2
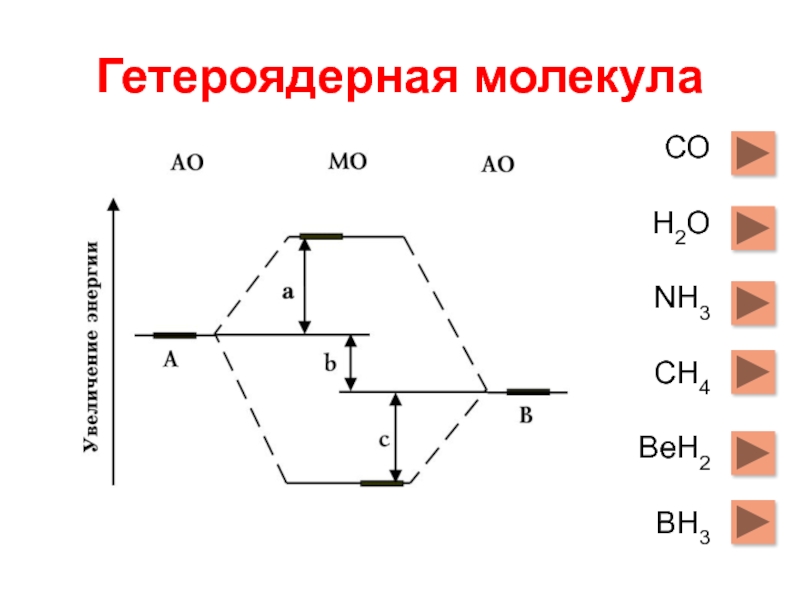
- 7. Гетероядерная молекула СО Н2О
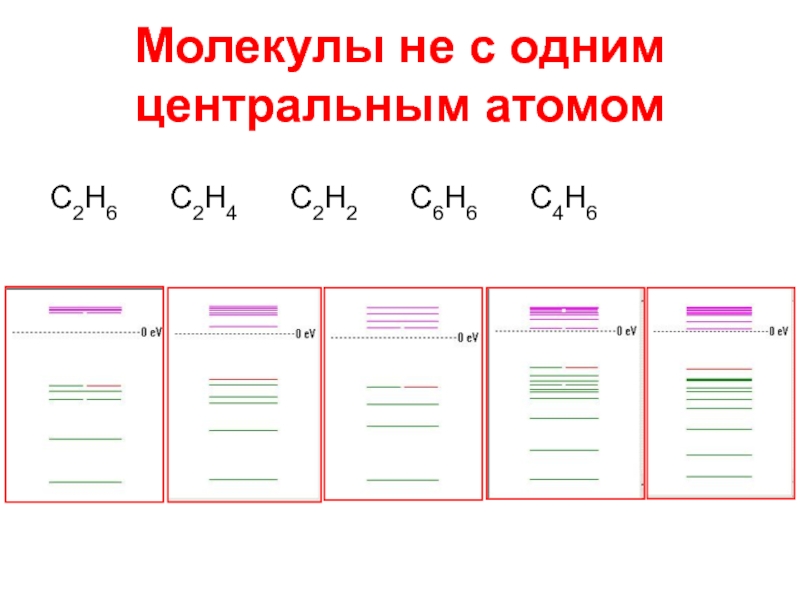
- 8. Молекулы не с одним центральным атомом С2Н6 С2Н4 С2Н2 С6Н6 С4Н6
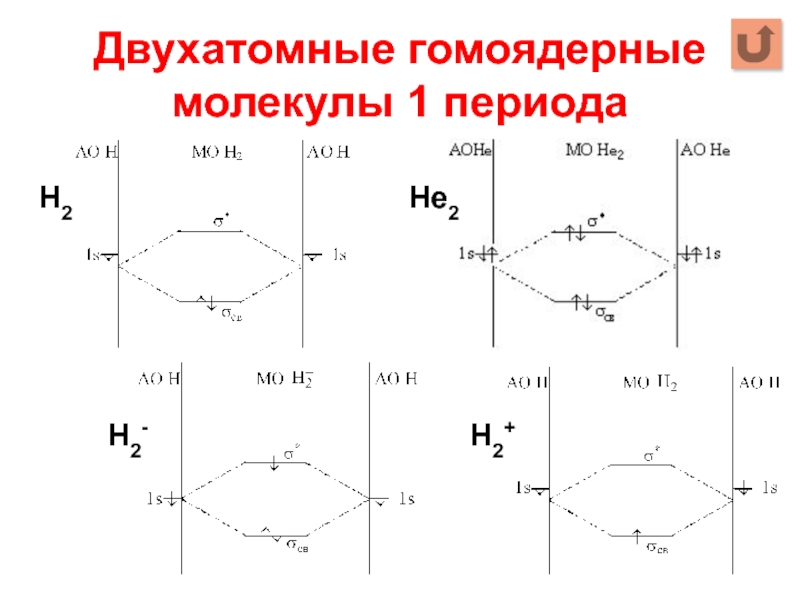
- 10. Двухатомные гомоядерные молекулы 1 периода Н2 Не2 Н2- Н2+
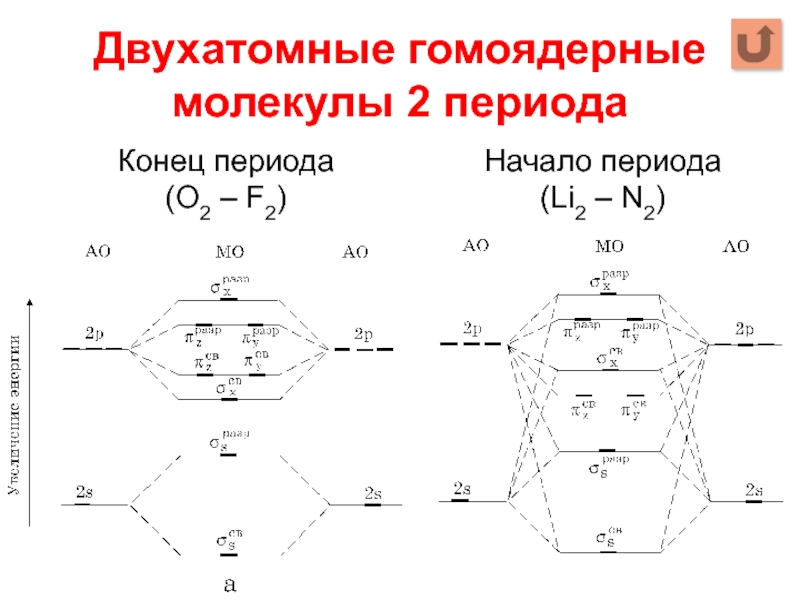
- 11. Двухатомные гомоядерные молекулы 2 периода Начало
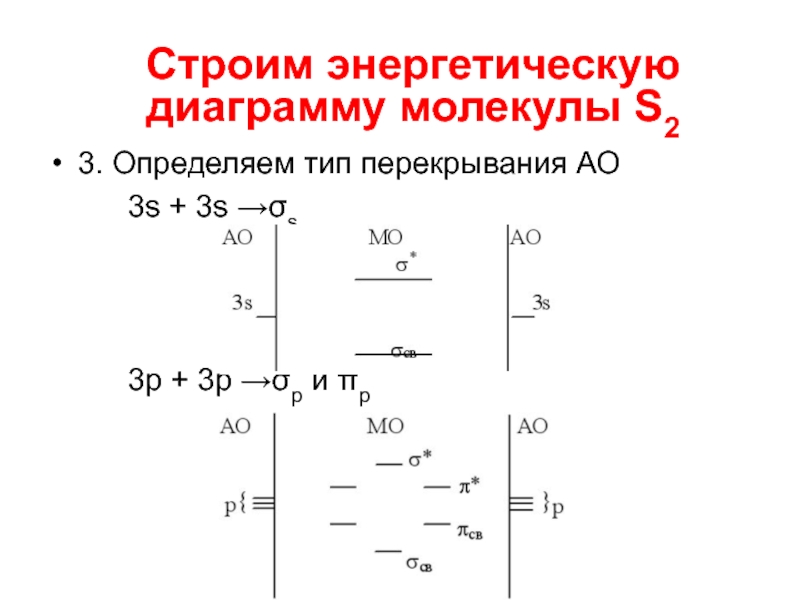
- 12. Строим энергетическую диаграмму молекулы S2 1. Строим
- 13. 3. Определяем тип перекрывания АО 3s +
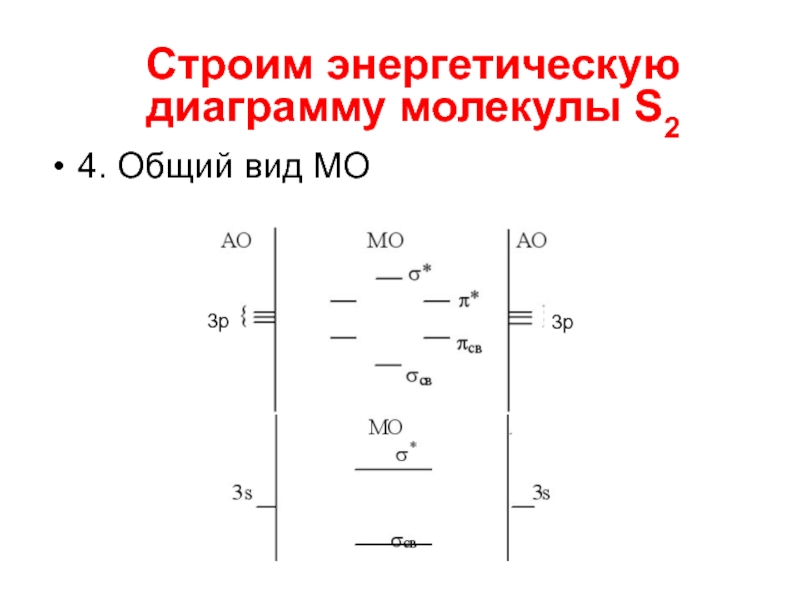
- 14. 4. Общий вид МО Строим энергетическую диаграмму молекулы S2 3р 3р
- 15. 5. Заполняем орбитали электронами
- 16. Cтроим энергетическую диаграмму молекулы СО 1. Строим
- 17. 3. Определяем тип перекрывания АО 2s +
- 18. Заполняем орбитали электронами Строим энергетическую диаграмму молекулы СО
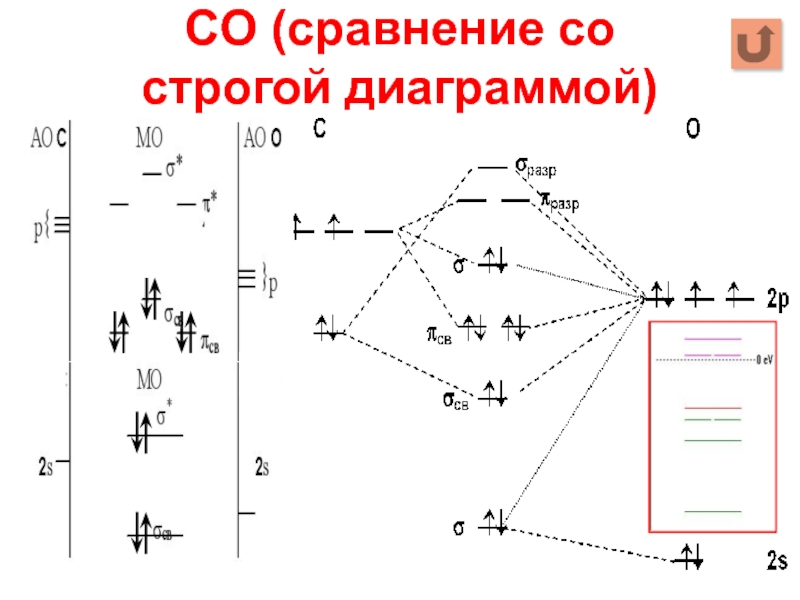
- 19. CO (сравнение со строгой диаграммой)
- 20. Строим энергетическую диаграмму молекулы Н2О 1. Строим
- 21. Строим энергетическую диаграмму молекулы Н2О 3. Определяем
- 22. Строим энергетическую диаграмму молекулы Н2О
- 23. NH3 Σ МО = 4 АО N
- 24. NH3
- 25. CH4 Σ МО = 4 АО C
- 26. CH4
- 27. BeH2 Σ МО = 4 АО Be
- 28. BH3 Σ МО = 4 АО B
Слайд 2Ограничения метода ВС
азотная кислота, бензол, озон???
наложение валентных схем или резонансные структуры
Слайд 3Метод МО
(Малликен, Хунд):
молекула – совокупность ядер и электронов,
каждый электрон движется
в поле остальных электронов и ядер.
(связь многоцентровая, многоэлектронная)
(связь многоцентровая, многоэлектронная)
Слайд 4ЛКАО
ψ(МО)связ = С1ψ(АО1) + С2ψ(АО2)
ψ(МО)разр = С3ψ(АО1) – С4ψ(АО2)
Энергии АО близки
⇒ С1 и С2 близки ⇒ максимальное перекрывание, снижение энергии связывающих МО
Энергии АО сильно различаются ⇒ несвязывающие МО
Энергии АО сильно различаются ⇒ несвязывающие МО
Слайд 5Принципы метода МО
1. Как и в атоме, в молекуле е занимают
соответствующие
орбитали.
При этом продолжают действовать:
принцип min Е,
принцип Паули,
правило Хунда
2. Число МО = суммарному числу АО
При этом продолжают действовать:
принцип min Е,
принцип Паули,
правило Хунда
2. Число МО = суммарному числу АО
Слайд 12Строим энергетическую диаграмму молекулы S2
1. Строим АО внешнего уровня
2. Определяем число
МО: Σ АО = Σ МО
4АО S + 4АО S = 8МО
4АО S + 4АО S = 8МО
Слайд 133. Определяем тип перекрывания АО
3s + 3s →σs
3p + 3p →σp
и πp
Строим энергетическую диаграмму молекулы S2
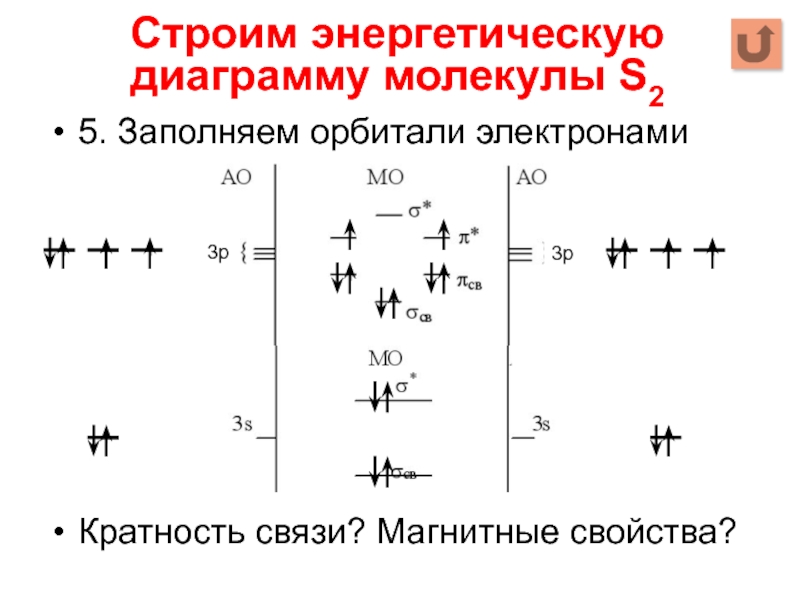
Слайд 155. Заполняем орбитали электронами
Кратность связи? Магнитные свойства?
Строим энергетическую диаграмму молекулы S2
3р
3р
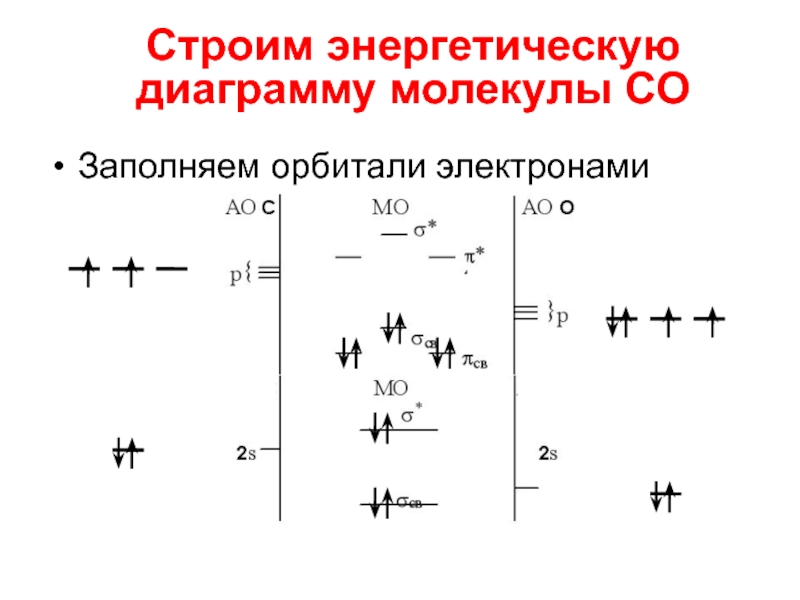
Слайд 16Cтроим энергетическую диаграмму молекулы СО
1. Строим АО внешнего уровня
2. Определяем число
МО: Σ АО = Σ МО
4АО С + 4АО О = 8МО
4АО С + 4АО О = 8МО
Слайд 173. Определяем тип перекрывания АО
2s + 2s →σs
2p + 2p →σp
и πp
Строим энергетическую диаграмму молекулы СО
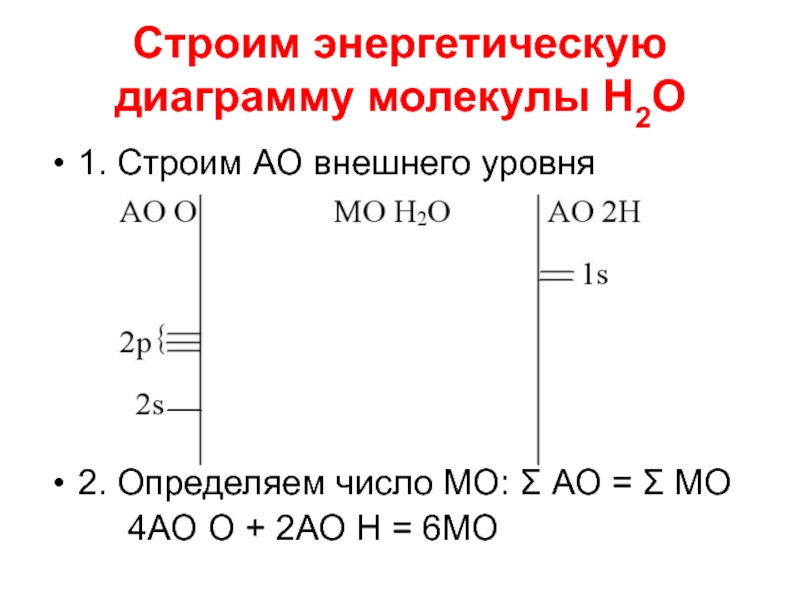
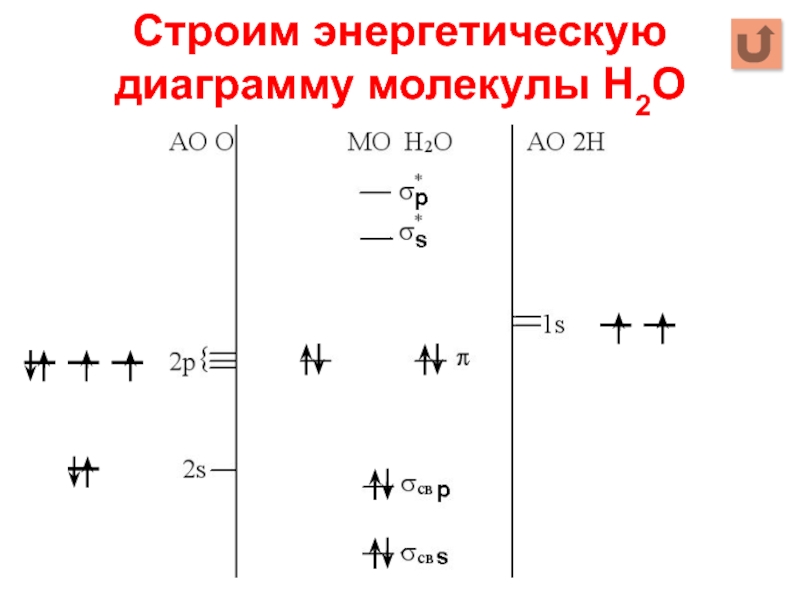
Слайд 20Строим энергетическую диаграмму молекулы Н2О
1. Строим АО внешнего уровня
2. Определяем число
МО: Σ АО = Σ МО
4АО О + 2АО Н = 6МО
4АО О + 2АО Н = 6МО
Слайд 21Строим энергетическую диаграмму молекулы Н2О
3. Определяем тип перекрывания АО
2s + 1s
→σs
2p + 1s →σp
4. Определяем число связывающих, разрыхляющих, несвязывающих МО
Σ МОсвязывающих = Σ МОразрыхляющих = Σ АОmin =
= 2 * 1 АО Н = 2
Σ МОнесвязывающих = Σ МО – Σ МОсвязывающих – – Σ МОразрыхляющих = 6 – 2 – 2 = 2
2p + 1s →σp
4. Определяем число связывающих, разрыхляющих, несвязывающих МО
Σ МОсвязывающих = Σ МОразрыхляющих = Σ АОmin =
= 2 * 1 АО Н = 2
Σ МОнесвязывающих = Σ МО – Σ МОсвязывающих – – Σ МОразрыхляющих = 6 – 2 – 2 = 2
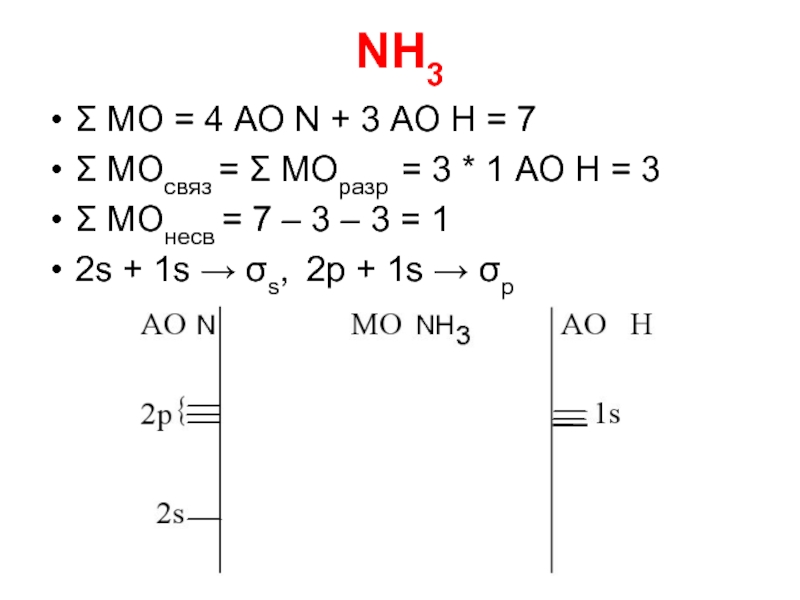
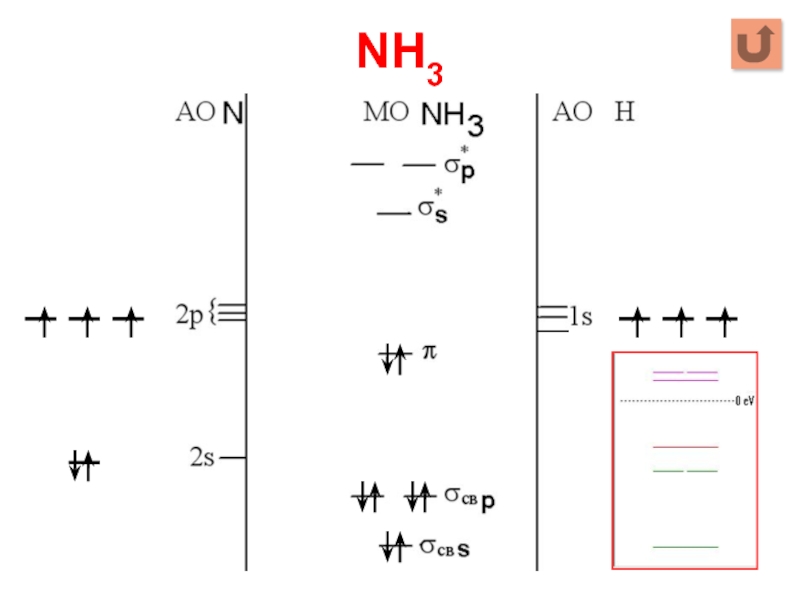
Слайд 23NH3
Σ МО = 4 АО N + 3 АО Н =
7
Σ МОсвяз = Σ МОразр = 3 * 1 АО Н = 3
Σ МОнесв = 7 – 3 – 3 = 1
2s + 1s → σs, 2p + 1s → σp
Σ МОсвяз = Σ МОразр = 3 * 1 АО Н = 3
Σ МОнесв = 7 – 3 – 3 = 1
2s + 1s → σs, 2p + 1s → σp
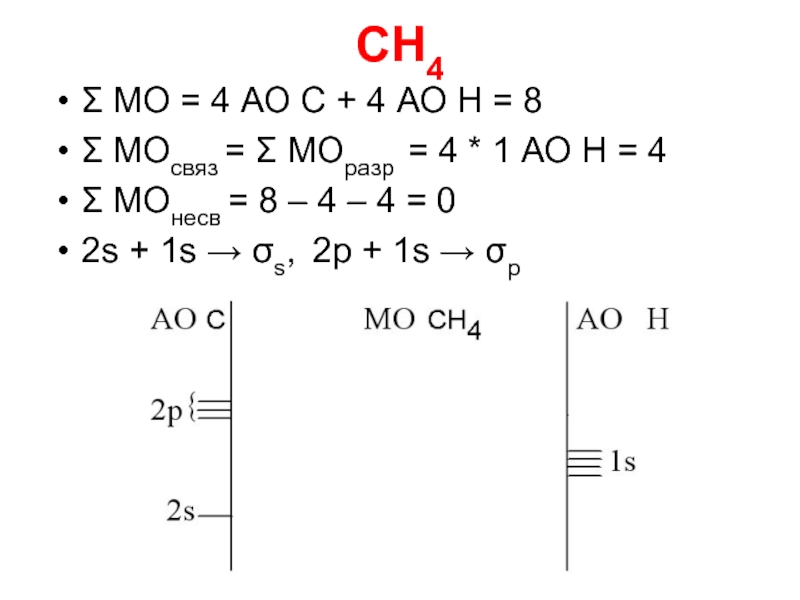
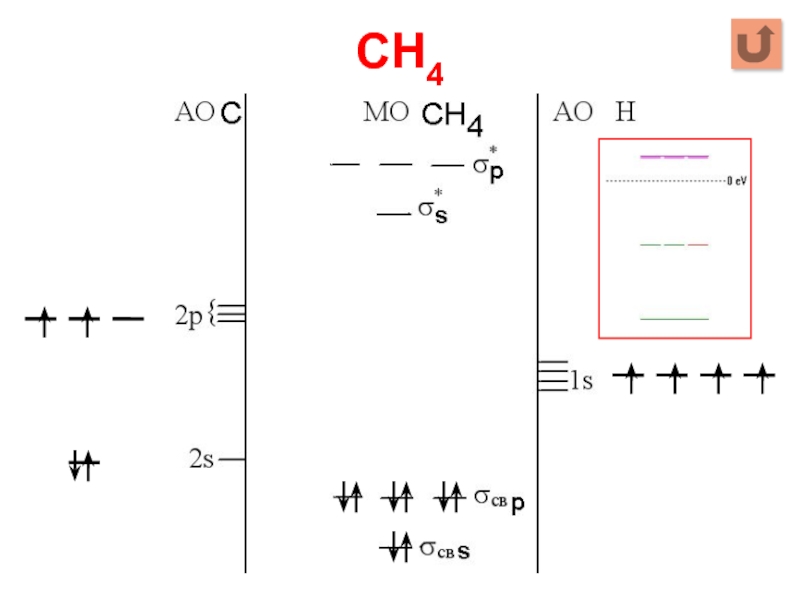
Слайд 25CH4
Σ МО = 4 АО C + 4 АО Н =
8
Σ МОсвяз = Σ МОразр = 4 * 1 АО Н = 4
Σ МОнесв = 8 – 4 – 4 = 0
2s + 1s → σs, 2p + 1s → σp
Σ МОсвяз = Σ МОразр = 4 * 1 АО Н = 4
Σ МОнесв = 8 – 4 – 4 = 0
2s + 1s → σs, 2p + 1s → σp
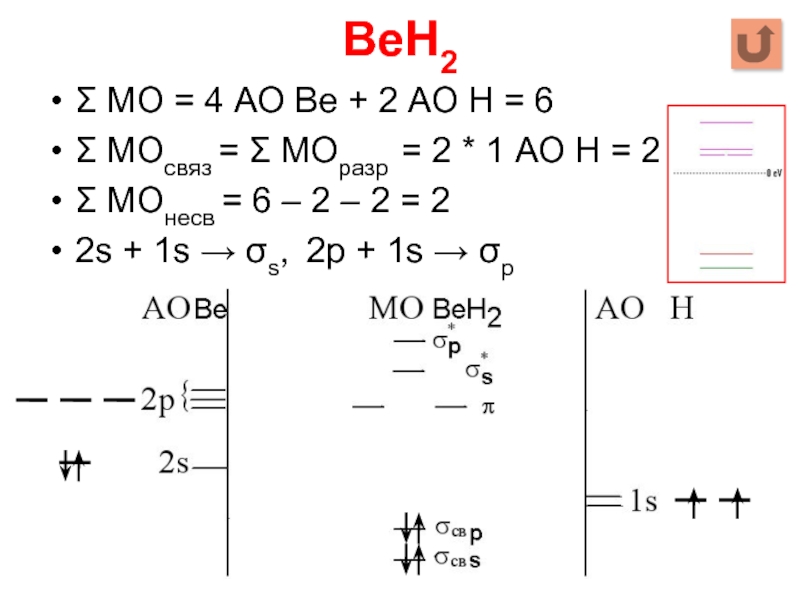
Слайд 27BeH2
Σ МО = 4 АО Be + 2 АО Н =
6
Σ МОсвяз = Σ МОразр = 2 * 1 АО Н = 2
Σ МОнесв = 6 – 2 – 2 = 2
2s + 1s → σs, 2p + 1s → σp
Σ МОсвяз = Σ МОразр = 2 * 1 АО Н = 2
Σ МОнесв = 6 – 2 – 2 = 2
2s + 1s → σs, 2p + 1s → σp
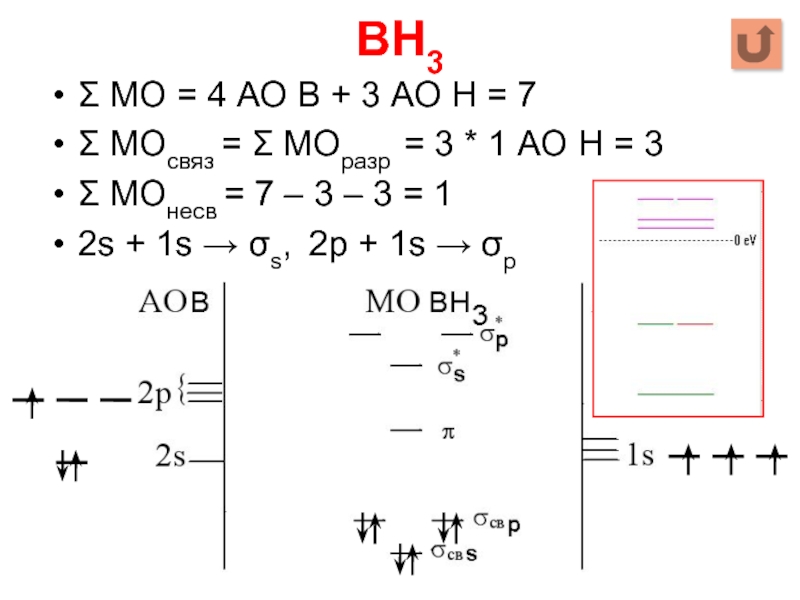
Слайд 28BH3
Σ МО = 4 АО B + 3 АО Н =
7
Σ МОсвяз = Σ МОразр = 3 * 1 АО Н = 3
Σ МОнесв = 7 – 3 – 3 = 1
2s + 1s → σs, 2p + 1s → σp
Σ МОсвяз = Σ МОразр = 3 * 1 АО Н = 3
Σ МОнесв = 7 – 3 – 3 = 1
2s + 1s → σs, 2p + 1s → σp