- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлическая связь презентация
Содержание
- 1. Металлическая связь
- 2. Атомы металлов легко отдают электроны т. к. у
- 3. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ - связь в
- 4. ОБРАЗОВАНИЕ МЕТАЛЛИЧЕСКОЙ СВЯЗИ
- 5. Оторвавшиеся электроны перемещаются от одного
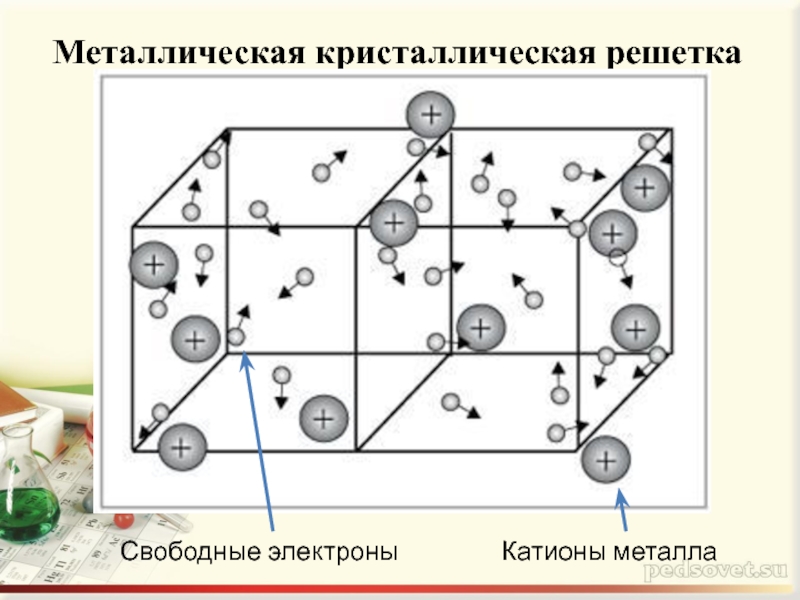
- 6. Металлическая кристаллическая решетка Свободные электроны Катионы металла
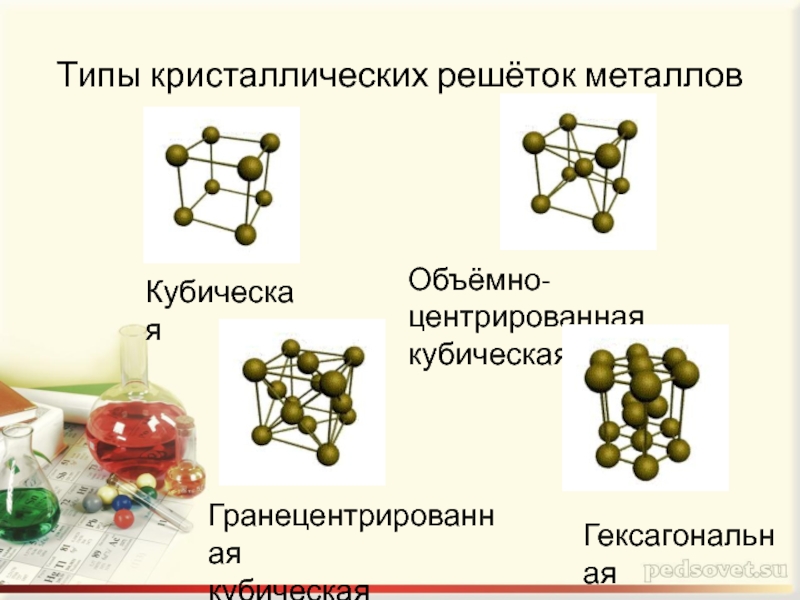
- 7. Типы кристаллических решёток металлов Кубическая Объёмно-центрированная кубическая Гранецентрированная кубическая Гексагональная
- 8. Металлическая связь характерна для металлов и их сплавов в твёрдом и жидком состоянии
- 9. Металлическая связь характеризуется: Небольшим числом валентных электронов
- 10. Металлический блеск Теплопроводность Электропроводность Ковкость (пластичность)
- 11. Металлическая связь похожа на Ионную связь (происходит
- 12. Металлическая химическая связь характерна для металлов и
- 13. В металлической связи как и в
Слайд 2Атомы металлов легко отдают электроны т. к. у них большой атомный радиус
и мало электронов на внешнем уровне(1-3)
Ме0 – n ē ⇆ Men+
атомы ионы
металла металла
Слайд 3МЕТАЛЛИЧЕСКАЯ СВЯЗЬ -
связь в металлах и сплавах, которую выполняют
относительно свободные электроны между ионами металлов в металлической кристаллической решетке
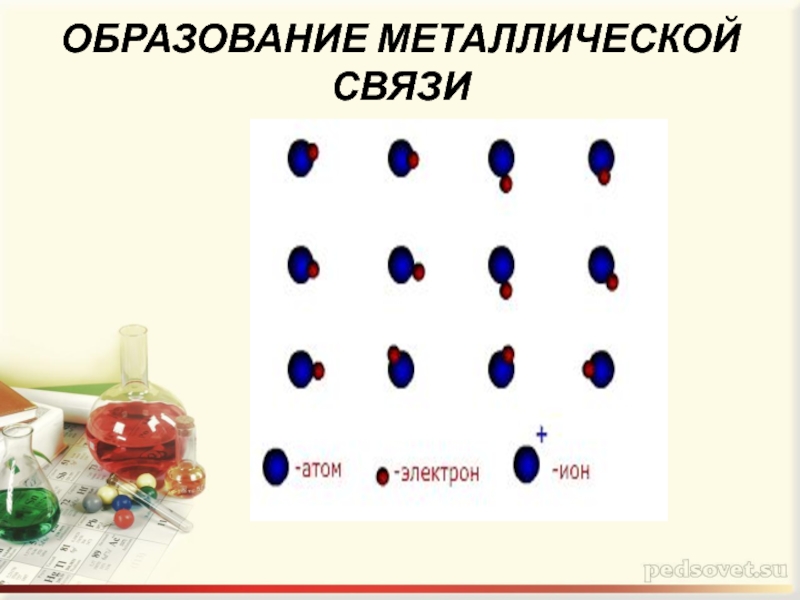
Слайд 5 Оторвавшиеся электроны перемещаются от одного иона к другому ,
связывая их в единое целое
Небольшое количество обобществлённых электронов связывает большое число атомов и ионов
Небольшое количество обобществлённых электронов связывает большое число атомов и ионов
ОБРАЗОВАНИЕ МЕТАЛЛИЧЕСКОЙ СВЯЗИ
Слайд 7Типы кристаллических решёток металлов
Кубическая
Объёмно-центрированная
кубическая
Гранецентрированная
кубическая
Гексагональная
Слайд 9Металлическая связь характеризуется:
Небольшим числом валентных электронов
Она слабее ковалентной и ионной связи
Она
определяет все основные свойства металлов
Слайд 10Металлический блеск
Теплопроводность
Электропроводность
Ковкость (пластичность)
Наличием свободных электронов объясняются физические свойства металлов
Слайд 11Металлическая связь похожа на
Ионную связь (происходит образование катионов, ē связывают ионы
Ме за счет электростатического притяжения)
Ковалентную связь (основана на обобществлении ē)
Ковалентную связь (основана на обобществлении ē)
Слайд 12Металлическая химическая связь характерна для металлов и их сплавов
Металлическая связь как
и ковалентная образуется за счёт обобществления электронов.
Выводы
Слайд 13В металлической связи как и в ионной образуются ионы.
Основа химической
связи одна - электростатическое взаимодействие противоположно заряженных частиц: протонов в ядре и электронов.
Выводы