- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Материаловедение как наука презентация
Содержание
- 1. Материаловедение как наука
- 2. МЕТАЛЛОВЕДЕНИЕ наука, изучающая строение и свойства металлов
- 3. Черные металлы Для них характерны: темно-серый цвет;
- 4. ЧЕРНЫЕ МЕТАЛЛЫ Железные металлы: Fe; Co; Ni;
- 5. ЦВЕТНЫЕ МЕТАЛЛЫ Для них характерны: определенная окраска;
- 6. ЦВЕТНЫЕ МЕТАЛЛЫ Легкие металлы: Be; Mg; Al.
- 7. Кристаллическое строение металлов Правильное, закономерное
- 8. Кристаллическое строение металлов Элементарная кристаллическая ячейка
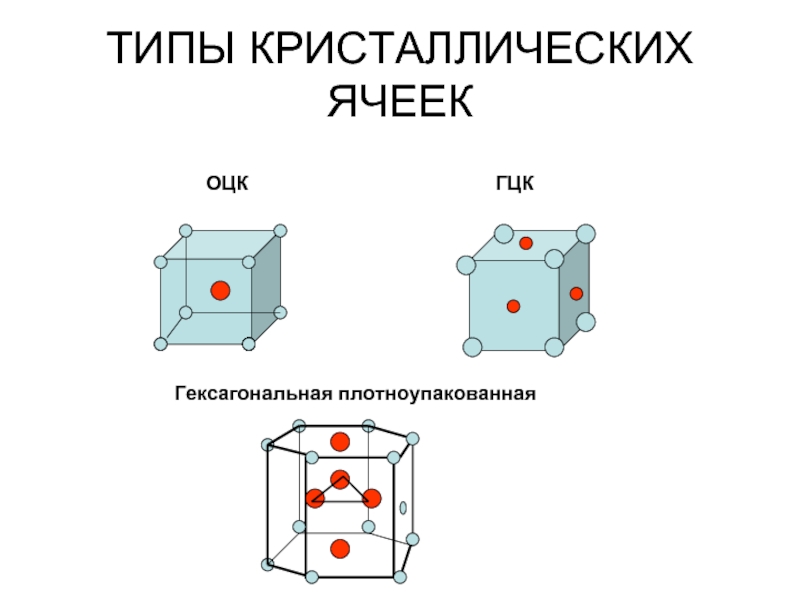
- 9. ТИПЫ КРИСТАЛЛИЧЕСКИХ ЯЧЕЕК
- 10. Реальное строение металлических кристаллов Строение металлов является
- 11. Реальное строение металлических кристаллов Точечные дефекты кристаллического строения: вакансия замещенный атом внедренный атом
- 12. Реальное строение металлических кристаллов Линейный дефект кристаллической
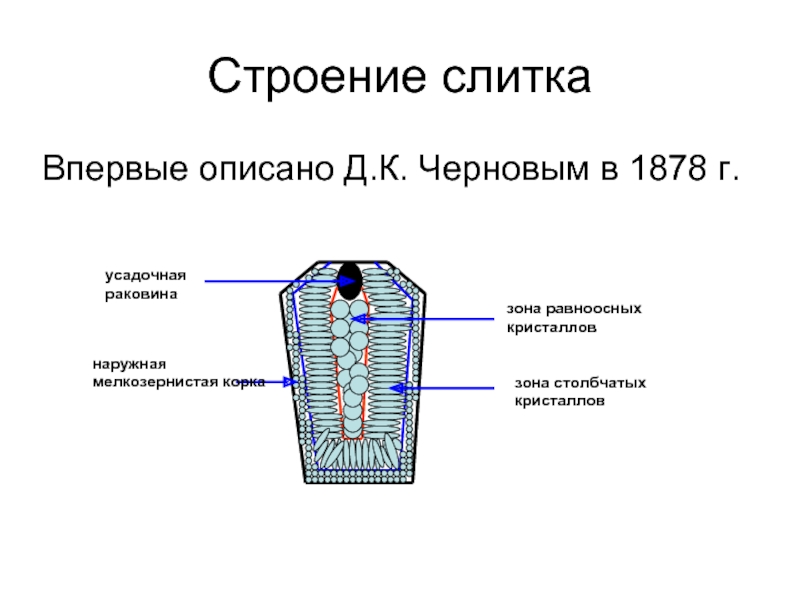
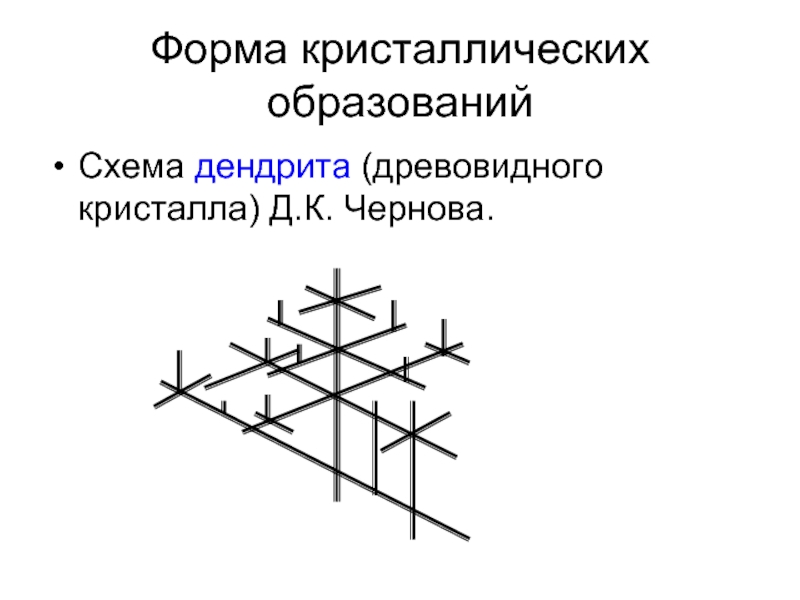
- 13. Строение слитка Впервые описано Д.К. Черновым в 1878 г.
- 14. Форма кристаллических образований Схема дендрита (древовидного кристалла) Д.К. Чернова.
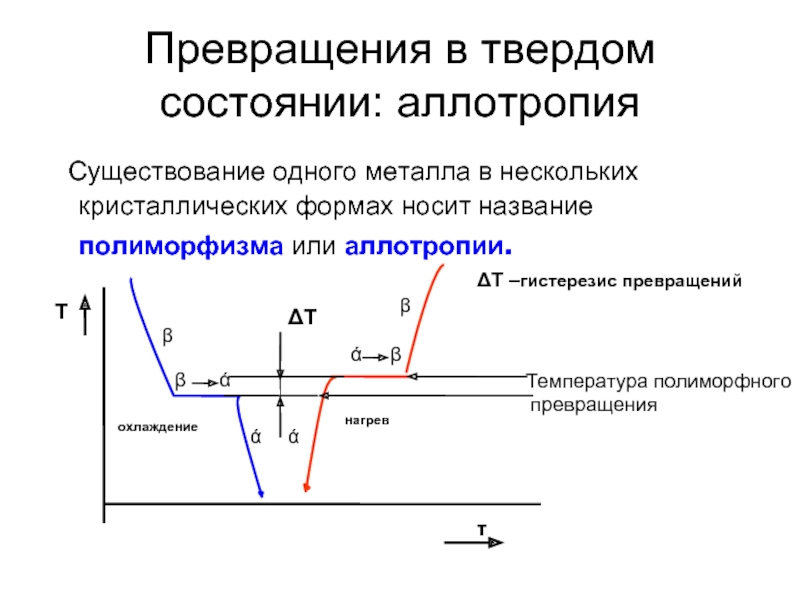
- 15. Превращения в твердом состоянии: аллотропия Существование
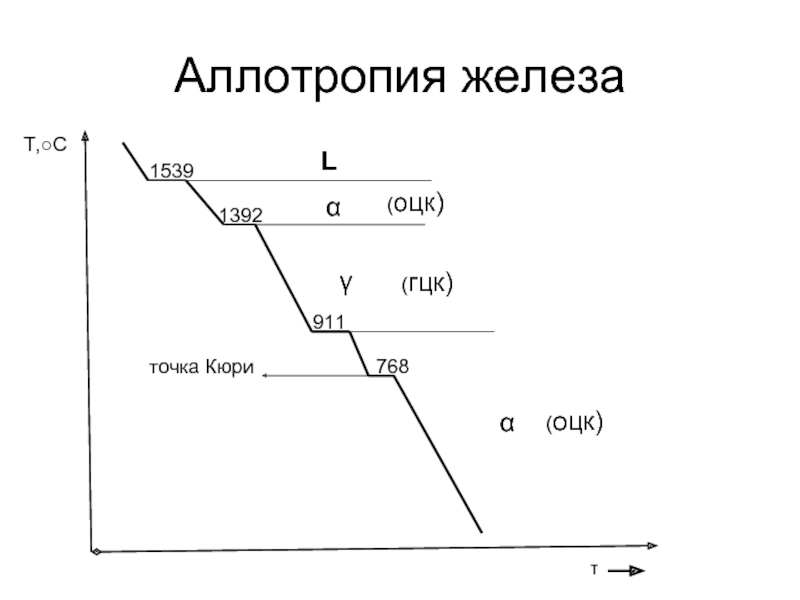
- 16. Аллотропия железа τ
- 17. Строение сплавов Сплав – вещество, получаемое сплавлением
- 18. Строение сплавов Твердый раствор на основе одного
- 19. Строение сплавов Химическое соединение: Соотношение чисел атомов
- 20. Правило фаз
- 21. Правило фаз (закон Гиббса) Правило фаз дает
- 22. Диаграмма состояния Диаграмма состояния показывает изменение состояния
- 23. Диаграмма состояния для сплавов, образующих механические смеси
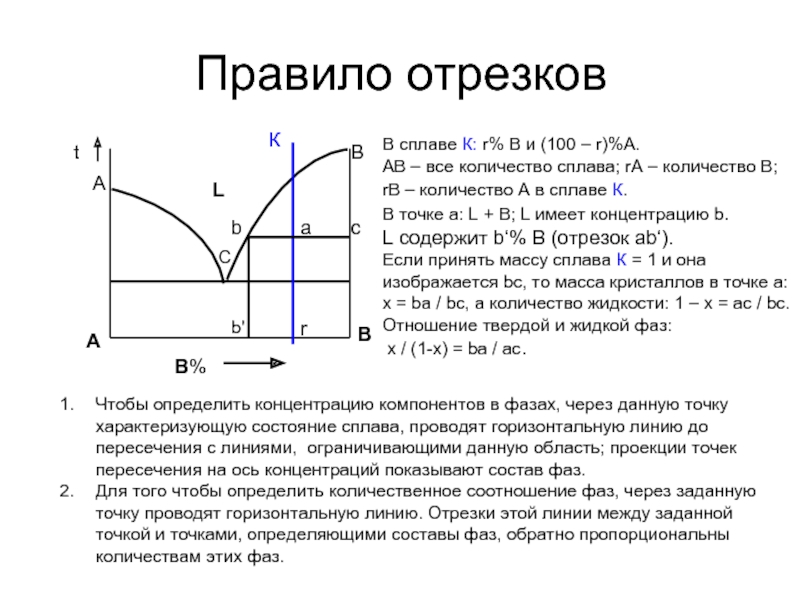
- 24. Правило отрезков В% А В
- 25. Диаграмма для сплавов с неограниченной растворимостью в
- 26. Диаграммы состояния для сплавов с ограниченной растворимостью
- 27. Описание процесса охлаждения сплава 2 Выше точки
- 28. Количественное определение фаз и структурных составляющих в
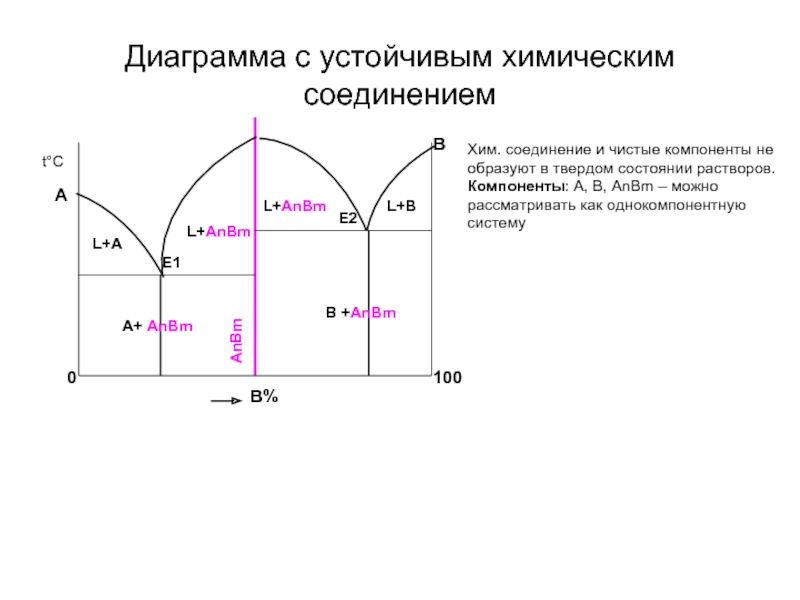
- 29. Диаграмма с устойчивым химическим соединением 100
- 30. Диаграмма железо – углерод. Железоуглеродистые
- 31. Свойства и строение компонентов диаграммы железо -
- 32. Обозначения, принятые для дальнейшего изложения. L –
- 33. Нонвариантные реакции на диаграмме Т=1499°С (линия HJB):
- 34. Процессы кристаллизации сплавов с содержанием углерода более
- 35. Вторичная кристаллизация весьма малоуглеродистых сплавов Сплав типа К1 (содержание углерода 0,01
- 36. Вторичная кристаллизация сталей t°С Заэвтектоидный сплав К2
- 37. Превращения при вторичной кристаллизации в высокоуглеродистых сплавах
- 38. Классификация сталей По составу: углеродистые и
- 39. Углеродистые стали Основной металлический материал промышленности –
- 40. Конструкционная углеродистые стали обыкновенного качества общего назначения Химический состав:
- 41. Маркировка различных групп углеродистых сталей обыкновенного качества
- 42. Маркировка углеродистых сталей обычного качества разных способов
- 43. Влияние углерода на свойства сталей δ% 0
- 44. Влияние постоянных примесей на свойства стали Марганец
- 45. Применение конструкционных углеродистых сталей обыкновенного качества
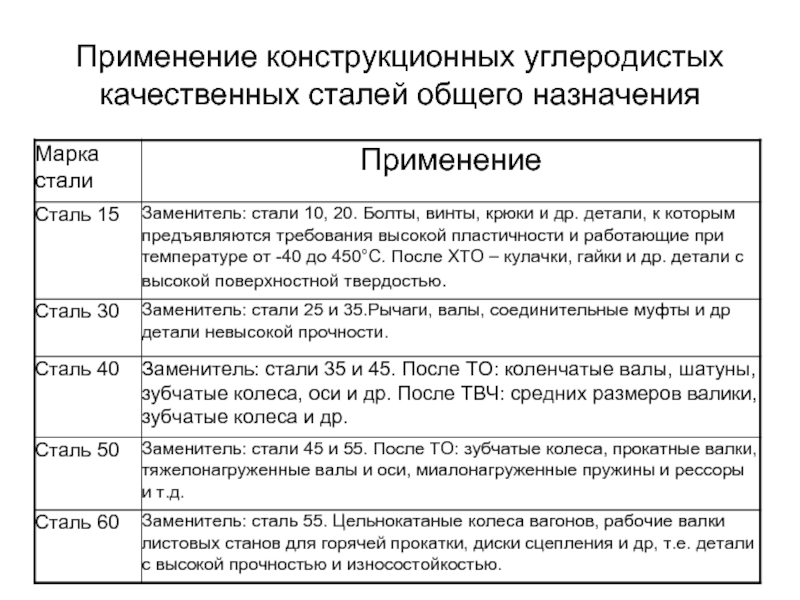
- 46. Конструкционные углеродистые качественные стали общего назначения 08;
- 47. Применение конструкционных углеродистых качественных сталей общего назначения
- 48. Углеродистые инструментальные стали У7; У7А; У8; У8А;
- 49. Быстрорежущие стали Стали, предназначенные для изготовления режущего
- 50. Твердые сплавы Твердый сплав является металлокерамическим. Для
- 51. Конструкционные легированные стали Система маркировки по
- 52. Примеры применения конструкционных легированных сталей
- 53. Процесс графитизации Tckb При определенных
- 54. Чугуны Белый чугун – название
- 55. Серые чугуны Излом такого чугуна имеет серый
- 56. Серые чугуны В высокопрочном сером чугуне
- 57. Марки серых чугунов σв- предел
- 58. Механические свойства металлических материалов и методы их
- 59. Механические свойства металлических материалов и методы их
- 60. Испытание на растяжение Разрушение образца
- 61. Диаграмма растяжения с площадкой текучести
- 62. Диаграмма растяжения без площадки текучести σ0,2 –
- 63. Испытание на сжатие d0 h0
- 64. Диаграммы растяжения и сжатия пластичного и хрупкого
- 65. Испытания на изгиб σи – предел прочности
- 66. асимметричный Переменные циклы напряжений
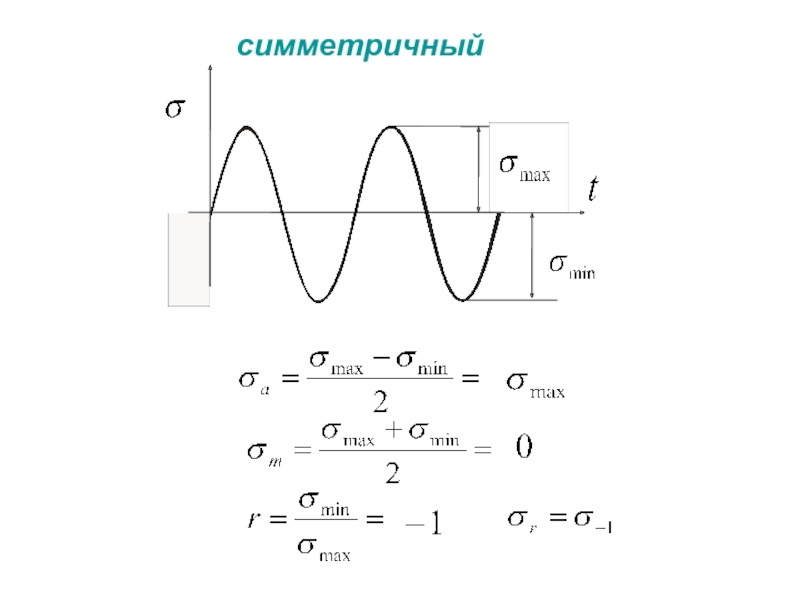
- 67. симметричный
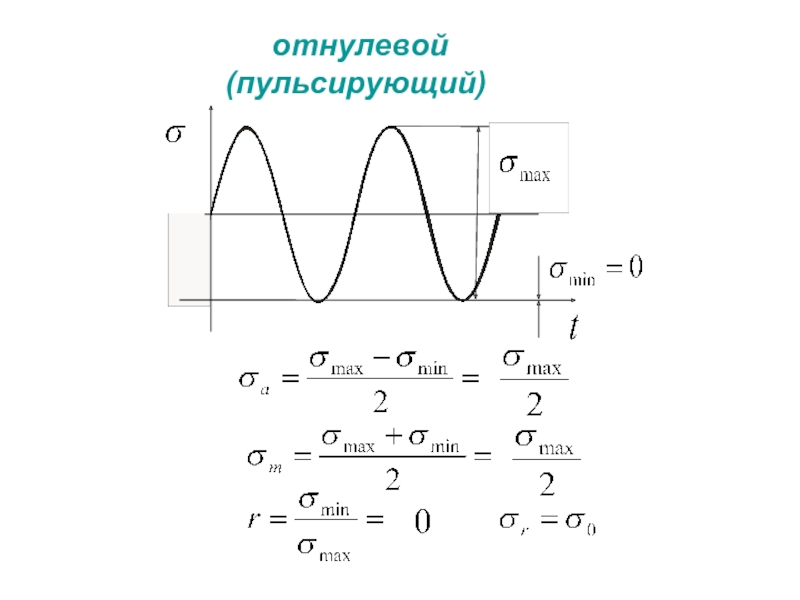
- 68. отнулевой (пульсирующий)
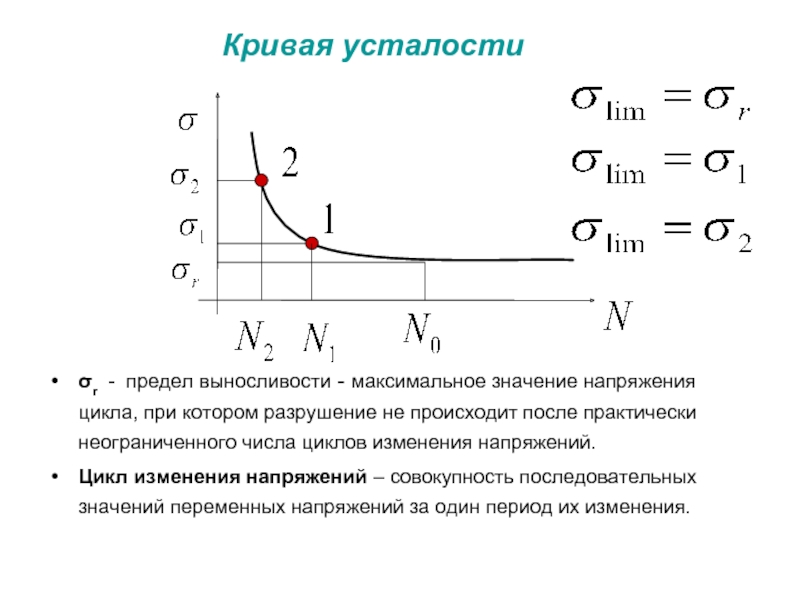
- 69. Кривая усталости σr
- 70. Методы определения твердости материалов. Измерение твердости –
- 71. Методы определения твердости материалов. Методы HB и
- 72. Сплавы меди Латуни – сплавы меди с
- 73. Сплавы меди Оловянистые бронзы – сплавы меди
- 74. Сплавы меди Сплавы меди с алюминием, кремнием,
- 75. Термическая обработка Технология металлов включает в
- 76. Основные виды термической обработки Отжиг (первого рода)
- 77. Сложные виды термической обработки Химико-термическая обработка –
- 78. Виды термической обработки стали 2 K E
- 79. Четыре основных превращения в стали Превращение перлита
- 80. Практическое значение температуры рекристаллизации Горячая обработка давлением
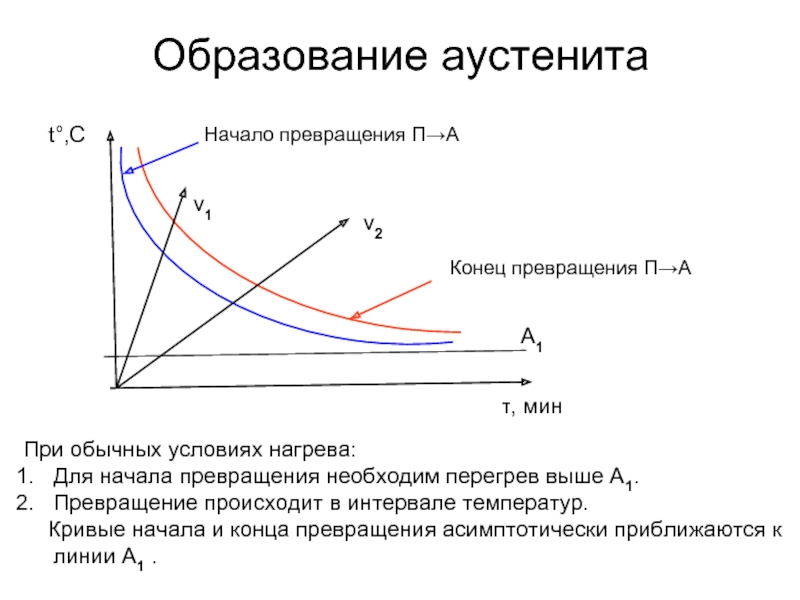
- 81. Образование аустенита t°,С При обычных условиях нагрева:
- 82. Отжиг пластически деформированного металла Пластическая деформация приводит
- 83. Распад аустенита Диаграмма изотермического превращения аустенита
- 84. Превращения при отпуске
- 85. Влияние параметров закалки на твердость стали 30
- 86. Влияние температуры отпуска на свойства закаленной стали
- 87. Практика термической обработки Закалка стали. Закаливаемость –
- 88. Внутренние напряжения при закалке Внутренние напряжения первого
- 89. Химико-термическая обработка. Преимущества по сравнению с закалкой
Слайд 1МАТЕРИАЛОВЕДЕНИЕ
КУРС ЛЕКЦИЙ
«Металлы суть светлые тела, которые
ковать можно.»
Слайд 2МЕТАЛЛОВЕДЕНИЕ
наука, изучающая строение и свойства металлов и устанавливающая связь между их
В технике под металлами понимают вещества, обладающие «металлическим блеском» и пластичностью.
Слайд 3Черные металлы
Для них характерны:
темно-серый цвет;
большая плотность;
высокая температура плавления;
во многих случаях -
Наиболее типичный представитель этой группы металлов – железо.
Слайд 4ЧЕРНЫЕ МЕТАЛЛЫ
Железные металлы: Fe; Co; Ni; Mn…
Тугоплавкие металлы: W; V; Cr…
РЗМ:
Урановые металлы – актиниды.
Щелочноземельные металлы.
Слайд 5ЦВЕТНЫЕ МЕТАЛЛЫ
Для них характерны:
определенная окраска;
высокая пластичность;
малая твердость;
относительно низкая температура плавления;
отсутствие полиморфизма.
Слайд 6ЦВЕТНЫЕ МЕТАЛЛЫ
Легкие металлы: Be; Mg; Al.
Благородные металлы: Ag; Au; металлы платиновой
Легкоплавкие металлы: Zn; Hg; Sn; Pb…
Слайд 7Кристаллическое строение металлов
Правильное, закономерное расположение частиц (атомов, молекул) в
Кристаллическое состояние можно представить в виде пространственной решетки, в узлах которой расположены атомы.
Слайд 8Кристаллическое строение металлов
Элементарная кристаллическая ячейка – наименьший комплекс атомов, который
Принятое изображение кристаллических решеток – условно.
Слайд 10Реальное строение металлических кристаллов
Строение металлов является поликристаллическим.
Кристаллы неправильной формы в металле
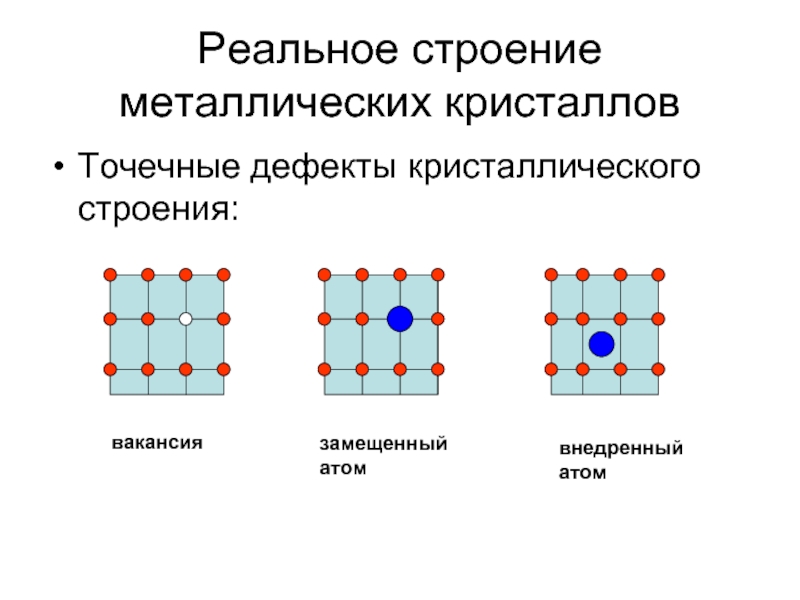
Слайд 11Реальное строение металлических кристаллов
Точечные дефекты кристаллического строения:
вакансия
замещенный атом
внедренный атом
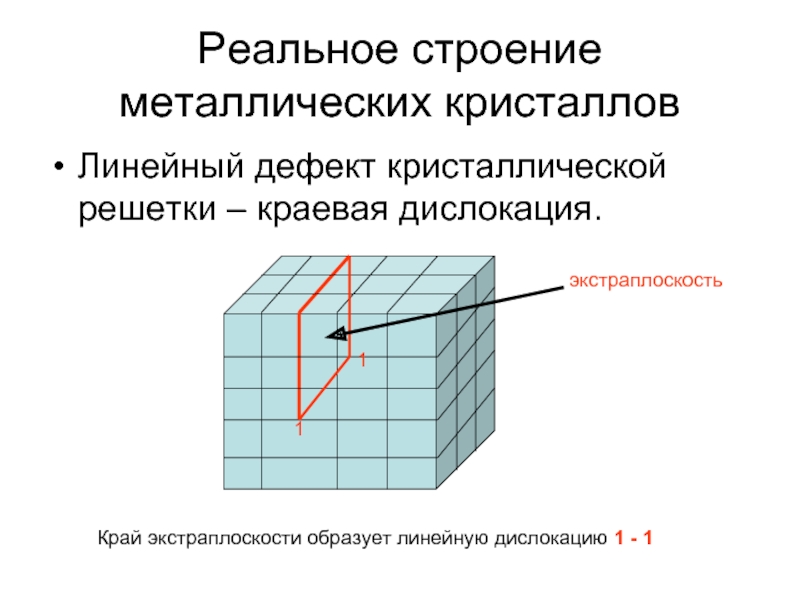
Слайд 12Реальное строение металлических кристаллов
Линейный дефект кристаллической решетки – краевая дислокация.
Край экстраплоскости
Слайд 15Превращения в твердом состоянии: аллотропия
Существование одного металла в нескольких кристаллических
Т
ΔТ –гистерезис превращений
Температура полиморфного
превращения
Слайд 17Строение сплавов
Сплав – вещество, получаемое сплавлением двух или более компонентов.
Механическая смесь:
кристаллы А
кристаллы В
Кристаллы
Кристаллы А и В имеют различные кристаллические решетки.
Слайд 18Строение сплавов
Твердый раствор на основе одного из компонентов сплава: образуется в
Состоит из одного вида кристаллов и имеет одну кристаллическую решетку.
различают твердые растворы замещения (ограниченные и неограниченные)
и внедрения.
Слайд 19Строение сплавов
Химическое соединение:
Соотношение чисел атомов элементов соответствует стехиометрической пропорции и може6т
Образуется специфическая (отличная от элементов, составляющих химическое соединение) кристаллическая решетка с упорядоченным расположением в ней атомов компонентов.
Химическое соединение характеризуется определенной температурой плавления.
Слайд 20Правило фаз
C – число степеней свободы
k – число компонентов
f - количество фаз
1 – число переменных
Это выражение применяют к металлическим системам, считая, что давление и концентрация постоянны.
Слайд 21Правило фаз (закон Гиббса)
Правило фаз дает количественную зависимость между степенью свободы
Фаза: однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяются скачком.
Компоненты: вещества, образующие систему.
Число степеней свободы (вариантность) системы: число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз.
Слайд 22Диаграмма состояния
Диаграмма состояния показывает изменение состояния в зависимости от температуры и
Для построения диаграмм состояния пользуются результатами термического анализа: строят кривые охлаждения и по остановкам и перегибами на этих кривых, определяют температуры фазовых превращений. Линиями соединяют точки аналогичных превращений.
Каждая точка на диаграмме состояния показывает состояние сплава данной концентрации при данной температуре.
Слайд 23Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (1
1
Компоненты: вещества А и В (k=2).
Фазы: жидкость L, кристаллы А и кристаллы В (максимальное значение f=3).
C = k – f + 1
Эвтектика – механическая смесь двух (или более) видов кристаллов, одновременно кристаллизовавшихся из жидкости.
L
A + B
Слайд 24Правило отрезков
В%
А
В
А
С
В
t
К
b
a
c
r
Чтобы определить концентрацию компонентов в фазах, через данную точку характеризующую
Для того чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
b'
В сплаве К: r% В и (100 – r)%А.
АВ – все количество сплава; rА – количество В;
rВ – количество А в сплаве К.
В точке а: L + В; L имеет концентрацию b.
L содержит b‘% В (отрезок ab‘).
Если принять массу сплава К = 1 и она изображается bc, то масса кристаллов в точке а: х = ba / bc, а количество жидкости: 1 – х = ас / bc.
Отношение твердой и жидкой фаз:
х / (1-х) = ba / ас.
L
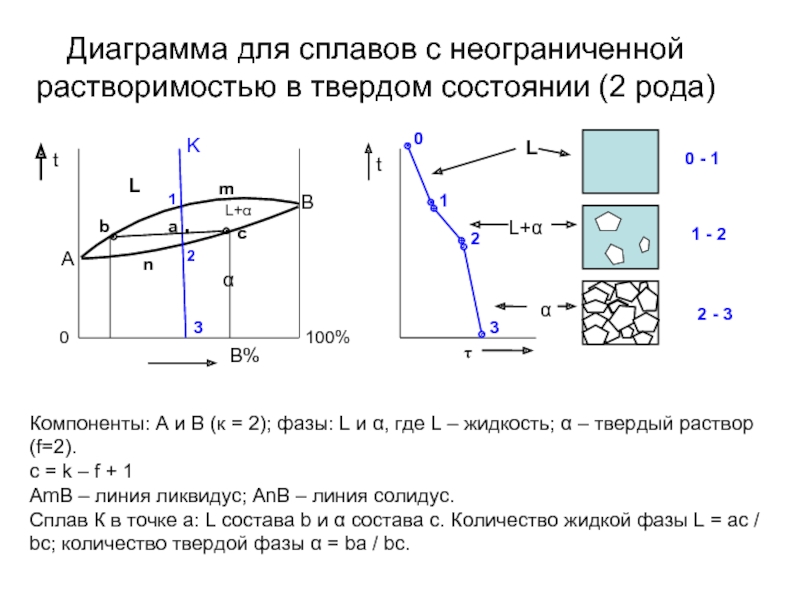
Слайд 25Диаграмма для сплавов с неограниченной растворимостью в твердом состоянии (2 рода)
100%
Компоненты:
c = k – f + 1
AmB – линия ликвидус; AnB – линия солидус.
Сплав К в точке а: L состава b и α состава с. Количество жидкой фазы L = ac / bc; количество твердой фазы α = ba / bc.
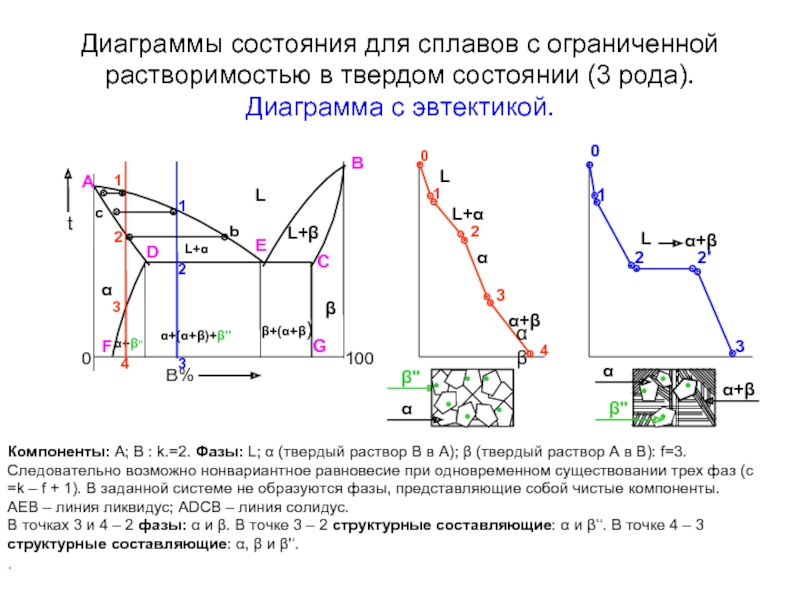
Слайд 26Диаграммы состояния для сплавов с ограниченной растворимостью в твердом состоянии (3
B%
Компоненты: А; В : k.=2. Фазы: L; α (твердый раствор В в А); β (твердый раствор А в В): f=3. Следовательно возможно нонвариантное равновесие при одновременном существовании трех фаз (с =k – f + 1). В заданной системе не образуются фазы, представляющие собой чистые компоненты.
АЕВ – линия ликвидус; АDCB – линия солидус.
В точках 3 и 4 – 2 фазы: α и β. В точке 3 – 2 структурные составляющие: α и β‘‘. В точке 4 – 3 структурные составляющие: α, β и β'‘.
.
0
0
•
α
β''
α+β
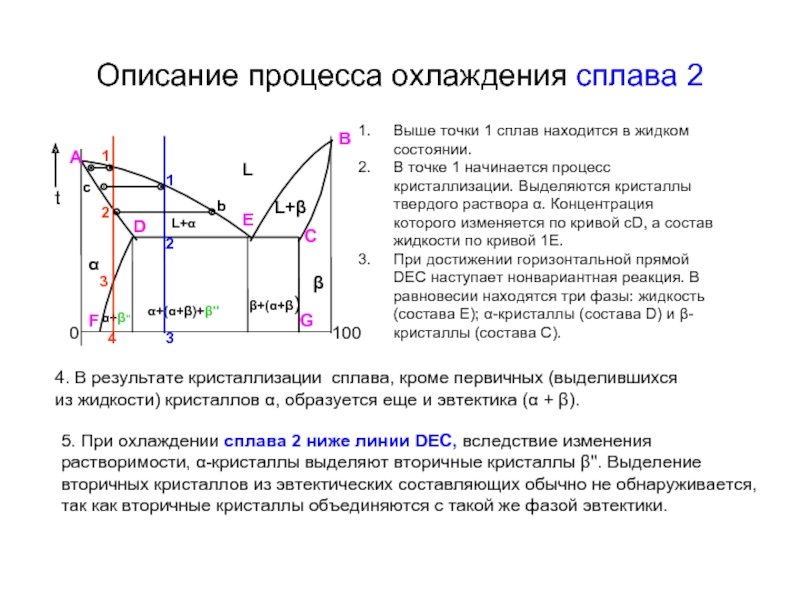
Слайд 27Описание процесса охлаждения сплава 2
Выше точки 1 сплав находится в жидком
В точке 1 начинается процесс кристаллизации. Выделяются кристаллы твердого раствора α. Концентрация которого изменяется по кривой сD, а состав жидкости по кривой 1Е.
При достижении горизонтальной прямой DEC наступает нонвариантная реакция. В равновесии находятся три фазы: жидкость (состава Е); α-кристаллы (состава D) и β-кристаллы (состава С).
4. В результате кристаллизации сплава, кроме первичных (выделившихся из жидкости) кристаллов α, образуется еще и эвтектика (α + β).
5. При охлаждении сплава 2 ниже линии DEC, вследствие изменения растворимости, α-кристаллы выделяют вторичные кристаллы β''. Выделение вторичных кристаллов из эвтектических составляющих обычно не обнаруживается, так как вторичные кристаллы объединяются с такой же фазой эвтектики.
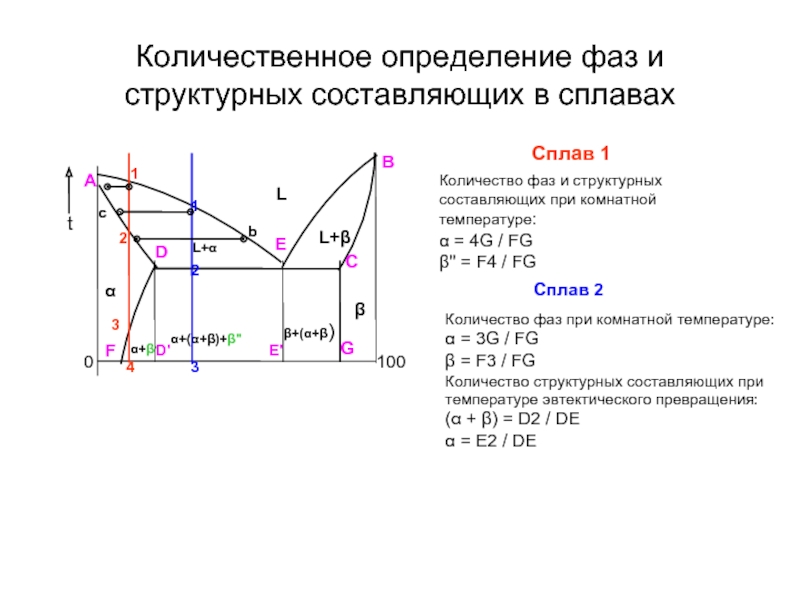
Слайд 28Количественное определение фаз и структурных составляющих в сплавах
Сплав 1
Количество фаз и
α = 4G / FG
β'' = F4 / FG
Сплав 2
Количество фаз при комнатной температуре:
α = 3G / FG
β = F3 / FG
Количество структурных составляющих при температуре эвтектического превращения:
(α + β) = D2 / DЕ
α = E2 / DЕ
Слайд 29Диаграмма с устойчивым химическим соединением
100
Хим. соединение и чистые компоненты не образуют
Слайд 30Диаграмма железо – углерод.
Железоуглеродистые сплавы – стали и чугуны.
Железо образует с углеродом химическое соединение – цементит Fe3C. Устойчивое химическое соединение можно рассматривать как компонент, а диаграмму при этом можно рассматривать по частям от железа до Fe3C (6,67%С). Это оправдано еще и тем, что на практике применяют металлические сплавы с содержанием углерода не более 5%.
Слайд 31Свойства и строение компонентов диаграммы железо - углерод
Железо – Fe: Тпл
Цементит – химическое соединение углерода с железом (карбид железа) Fe3C: Тпл = 1250°С; кристаллическая решетка крайне сложна; аллотропических превращений не испытывает; магнитные свойства теряет при 217°С; имеет практически нулевую пластичность; при определенных условиях распадается с образованием свободного углерода (графита); твердый раствор металлов на базе решетки цементита называют легированным цементитом.
Слайд 32Обозначения, принятые для дальнейшего изложения.
L – жидкость (жидкий раствор углерода в
Ц – цементит, соответствует линии DFKL.
Ф – феррит – структурная составляющая, незначительный раствор углерода в α-железе, на диаграмме располагается левее линий GPQ и AHN.
А – аустенит – структурная составляющая, твердый раствор углерода в γ-железе, область на диаграмме NJESG/
Слайд 33Нонвариантные реакции на диаграмме
Т=1499°С (линия HJB): L(B)+Ф(H)→A(J) - перетектическая реакция, наблюдается
Т=1147°С (линия ECF): L(С)→А(H)+Ц – эвтектическая реакция, наблюдается у сплавов с содержанием углерода более 2,14% С, образовавшуюся в результате реакции эвтектическую смесь называют ледебуритом.
Т=727°С (линия PSK): A(S)→Ф(P)+Ц – эвтектоидная реакция, наблюдается у всех сплавов с содержанием углерода более 0,02%, образовавшуюся в результате реакции эвтектоидную смесь называют перлитом.
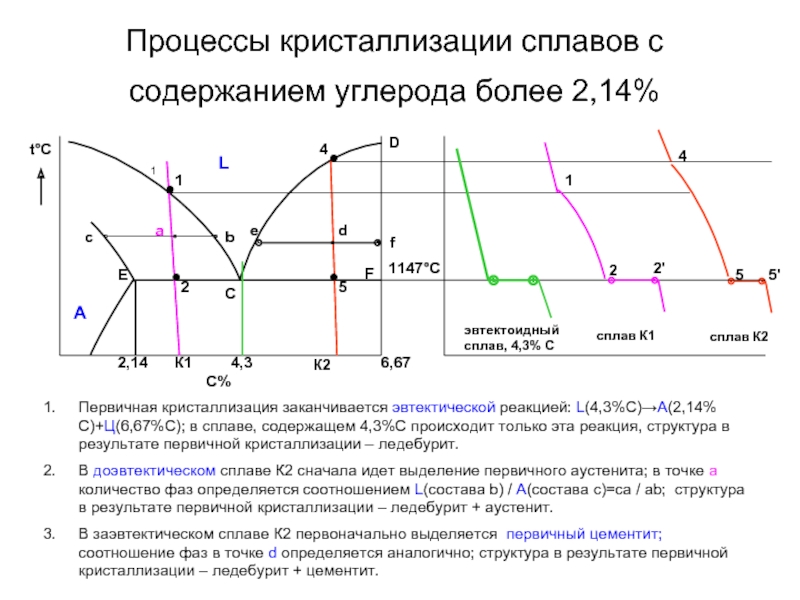
Слайд 34Процессы кристаллизации сплавов с содержанием углерода более 2,14%
t°С
5'
сплав К2
Первичная кристаллизация
В доэвтектическом сплаве К2 сначала идет выделение первичного аустенита; в точке а количество фаз определяется соотношением L(состава b) / А(состава с)=са / аb; структура в результате первичной кристаллизации – ледебурит + аустенит.
В заэвтектическом сплаве К2 первоначально выделяется первичный цементит; соотношение фаз в точке d определяется аналогично; структура в результате первичной кристаллизации – ледебурит + цементит.
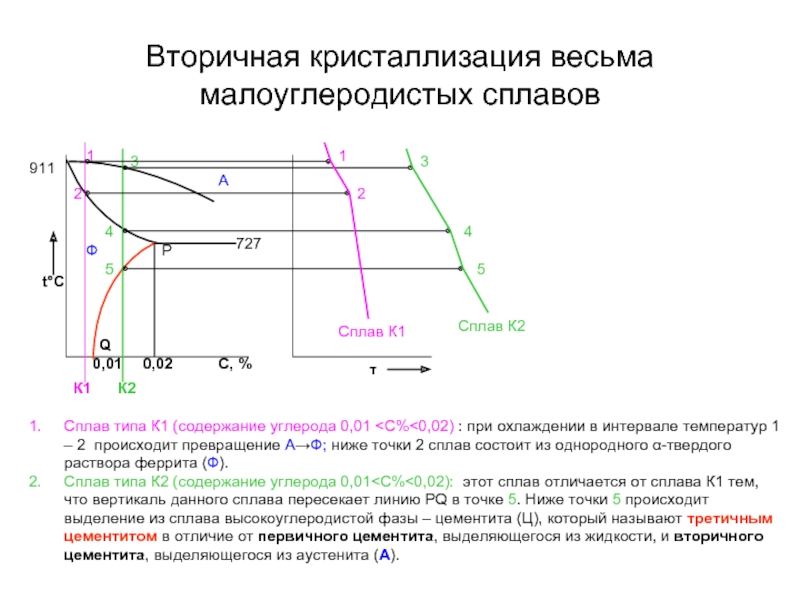
Слайд 35Вторичная кристаллизация весьма малоуглеродистых сплавов
Сплав типа К1 (содержание углерода 0,01
Сплав типа К2 (содержание углерода 0,01<С%<0,02): этот сплав отличается от сплава К1 тем, что вертикаль данного сплава пересекает линию РQ в точке 5. Ниже точки 5 происходит выделение из сплава высокоуглеродистой фазы – цементита (Ц), который называют третичным цементитом в отличие от первичного цементита, выделяющегося из жидкости, и вторичного цементита, выделяющегося из аустенита (А).
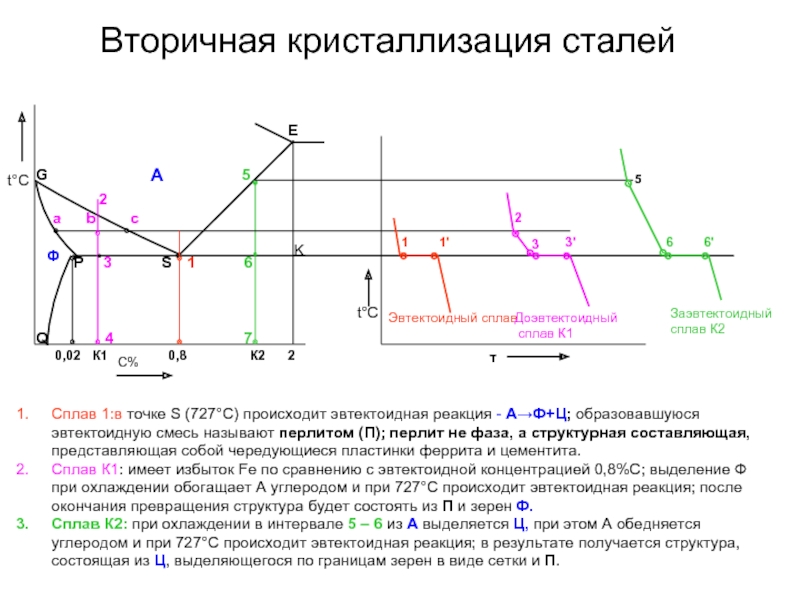
Слайд 36Вторичная кристаллизация сталей
t°С
Заэвтектоидный
сплав К2
Сплав 1:в точке S (727°С) происходит эвтектоидная реакция
Сплав К1: имеет избыток Fe по сравнению с эвтектоидной концентрацией 0,8%С; выделение Ф при охлаждении обогащает А углеродом и при 727°С происходит эвтектоидная реакция; после окончания превращения структура будет состоять из П и зерен Ф.
Сплав К2: при охлаждении в интервале 5 – 6 из А выделяется Ц, при этом А обедняется углеродом и при 727°С происходит эвтектоидная реакция; в результате получается структура, состоящая из Ц, выделяющегося по границам зерен в виде сетки и П.
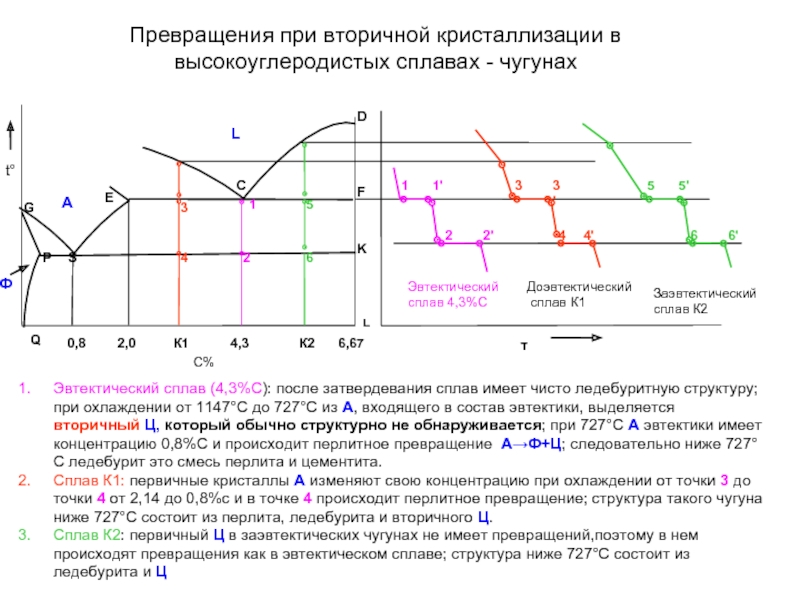
Слайд 37Превращения при вторичной кристаллизации в высокоуглеродистых сплавах - чугунах
С%
Ф
t°
Эвтектический сплав (4,3%С):
Сплав К1: первичные кристаллы А изменяют свою концентрацию при охлаждении от точки 3 до точки 4 от 2,14 до 0,8%с и в точке 4 происходит перлитное превращение; структура такого чугуна ниже 727°С состоит из перлита, ледебурита и вторичного Ц.
Сплав К2: первичный Ц в заэвтектических чугунах не имеет превращений,поэтому в нем происходят превращения как в эвтектическом сплаве; структура ниже 727°С состоит из ледебурита и Ц
K
L
F
D
6,67
τ
Заэвтектический
сплав К2
Слайд 38Классификация сталей
По составу: углеродистые и легированные (никелевые, хромистые, хромоникелевые и
По равновесной структуре: доэвтектоидные, эвтектоидные, заэвтектоидные.
По структуре после охлаждения на воздухе: перлитные, мартенситные, аустенитные.
И т. д.
По назначению: конструкционные инструментальные, стали и сплавы с особыми свойствами.
Слайд 39Углеродистые стали
Основной металлический материал промышленности – углеродистая сталь.
Углерод вводится в простую
Технологические примеси: марганец, кремний.
Постоянные примеси: сера, фосфор, кислород, азот, водород.
Случайные примеси: хром, никель, медь и др..
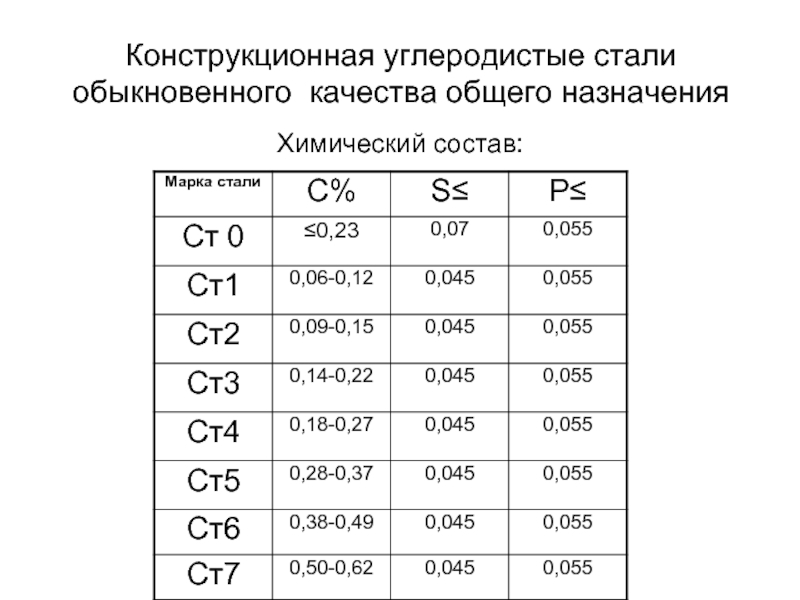
Слайд 40Конструкционная углеродистые стали обыкновенного качества общего назначения
Химический состав:
Слайд 41Маркировка различных групп углеродистых сталей обыкновенного качества
Группа А – с гарантируемыми
Группа Б – с гарантируемым химическим составом (подвергается горячей обработке у потребителя): маркируется аналогично группе А, но с дополнительными буквами М, К, Б, что характеризует способ производства – мартеновский, конверторный, бессемеровский соответственно. Например, МСт3, БСт4, КСт5.
Группа В – с гарантируемыми механическими свойствами и химическим составом (подвергается сварке у потребителя)маркируется аналогично группе А, но с добавлением буквы В. Например, ВСт5.
Слайд 42Маркировка углеродистых сталей обычного качества разных способов раскисления
Кипящая сталь - раскисленная только марганцем, содержит в марке буквы кп. Например, МСт1кп. Кипящие стали имеют наиболее низкое качество.
Спокойная сталь – раскисленная марганцем, кремнием и алюминием, содержит в марке буквы сп. Например, ВСт3сп. Спокойные стали имеют наиболее высокое качество.
Полуспокойная сталь – раскисленная марганцем и алюминием, содержит в марке буквы пс. Например, МСт4пс. Промежуточный вариант качества между кипящей и спокойной сталью.
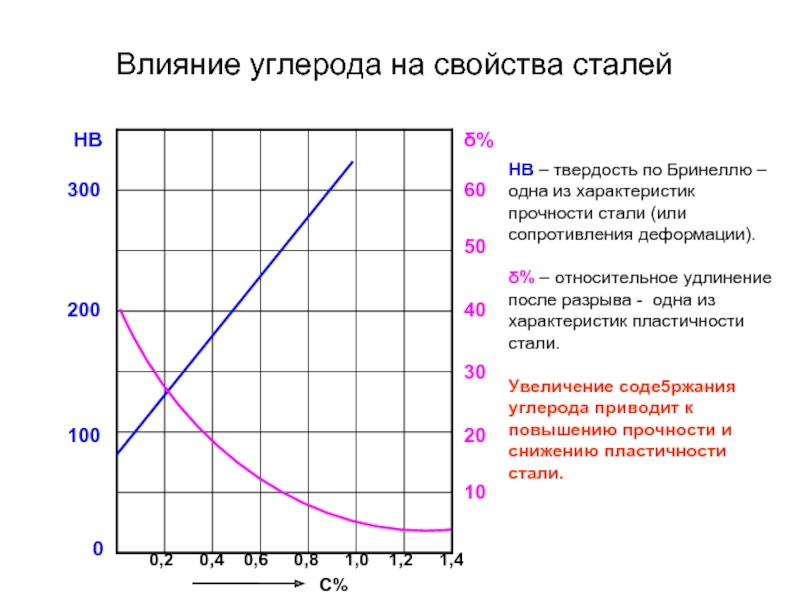
Слайд 43Влияние углерода на свойства сталей
δ%
0
10
20
30
40
50
60
0,2
0,4
0,6
0,8
1,0
1,2
1,4
С%
HB – твердость по Бринеллю – одна
δ% – относительное удлинение после разрыва - одна из характеристик пластичности стали.
Увеличение соде5ржания углерода приводит к повышению прочности и снижению пластичности стали.
Слайд 44Влияние постоянных примесей на свойства стали
Марганец – вводится в любую сталь
Кремний – вводится в сталь для раскисления, структурно не обнаруживается.
Фосфор – попадает в сталь из руды, топлива и флюсов; вызывает хладноломкость стали (склонность к хрупкому разрушению при понижении температуры); облегчает обрабатываемость стали резанием (в автоматных сталях содержание фосфора до 0,15%).
Сера – попадает в сталь из руды и печных газов; вызывает явление красноломкости стали (охрупчивание стали при температуре красного каления ≈ 800°С); облегчает обрабатываемость стали резанием (в автоматных сталях содержание серы до 0,3%).
Газы – содержание в стали зависит от способа производства; при большом количестве водорода могут образоваться опасные флокены; кислород и азот образуют неметаллические включения (соответственно оксиды и нитриды).
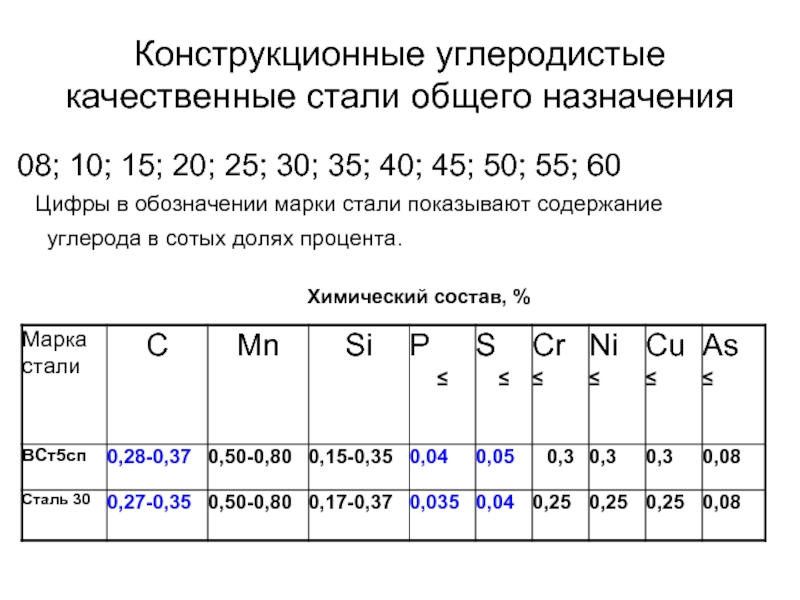
Слайд 46Конструкционные углеродистые качественные стали общего назначения
08; 10; 15; 20; 25; 30;
Цифры в обозначении марки стали показывают содержание углерода в сотых долях процента.
Химический состав, %
Слайд 48Углеродистые инструментальные стали
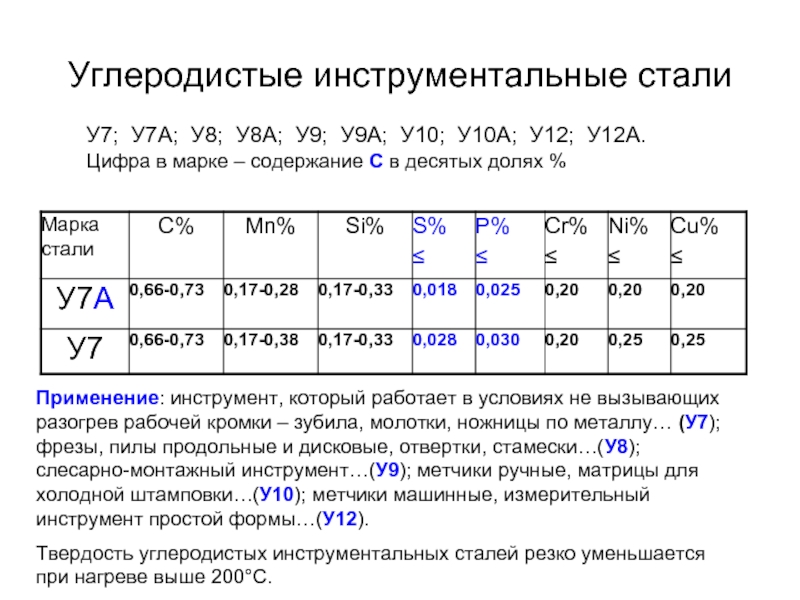
У7; У7А; У8; У8А; У9; У9А; У10; У10А; У12;
Цифра в марке – содержание С в десятых долях %
Применение: инструмент, который работает в условиях не вызывающих разогрев рабочей кромки – зубила, молотки, ножницы по металлу… (У7); фрезы, пилы продольные и дисковые, отвертки, стамески…(У8); слесарно-монтажный инструмент…(У9); метчики ручные, матрицы для холодной штамповки…(У10); метчики машинные, измерительный инструмент простой формы…(У12).
Твердость углеродистых инструментальных сталей резко уменьшается при нагреве выше 200°С.
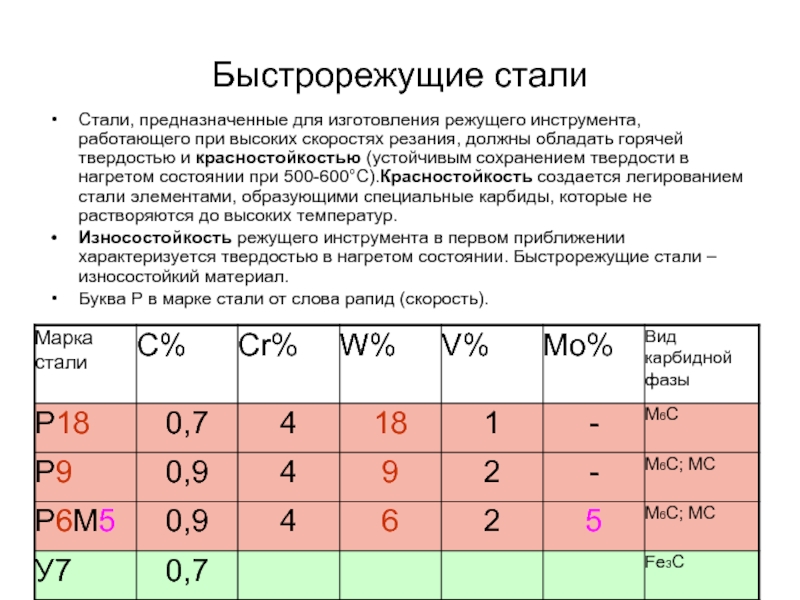
Слайд 49Быстрорежущие стали
Стали, предназначенные для изготовления режущего инструмента, работающего при высоких скоростях
Износостойкость режущего инструмента в первом приближении характеризуется твердостью в нагретом состоянии. Быстрорежущие стали – износостойкий материал.
Буква Р в марке стали от слова рапид (скорость).
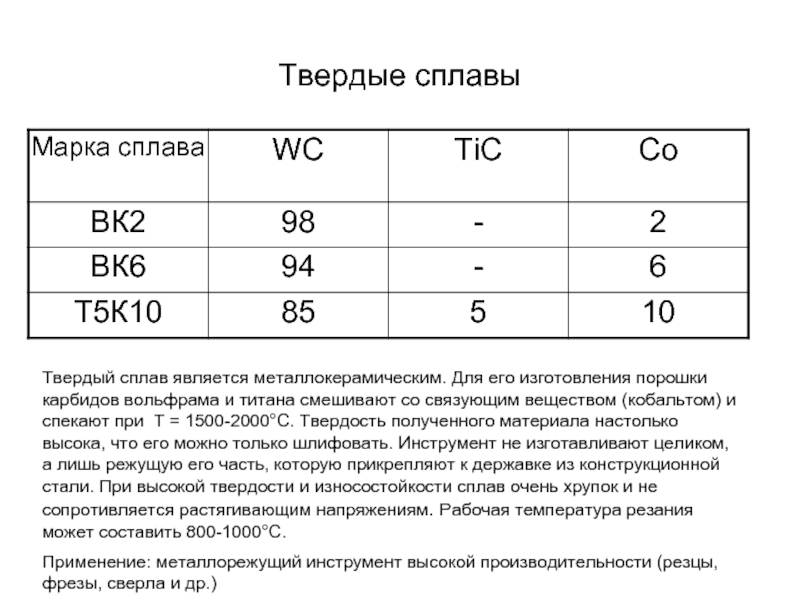
Слайд 50Твердые сплавы
Твердый сплав является металлокерамическим. Для его изготовления порошки карбидов вольфрама
Применение: металлорежущий инструмент высокой производительности (резцы, фрезы, сверла и др.)
Слайд 51Конструкционные легированные стали
Система маркировки по ГОСТу
Обозначения состоят из цифр и
Каждый легирующий элемент обозначается буквой. Например, Н – никель, Х – хром, М – молибден, Г – марганец, С – кремний, Ю – алюминий и т.д.
Первые цифры в обозначении показывают среднее содержание углерода в сотых долях процента (у высокоуглеродистых инструментальных сталей в десятых долях процента).
Цифры, идущие после буквы, указывают на примерное содержание данного легирующего элемента в процентах ( при содержании элемента менее 1% цифра отсутствует).
Примеры: 30ХМА; 10ГН2МФА; 20Х2Н4; 30ГСЛ и т.д.
Буква А в конце марки стали показывает, что в ней ограничено содержание серы и фосфора, а в середине марки – азот; буква Л в конце марки стали – литейная сталь (точнее - улучшенные литейные свойства).
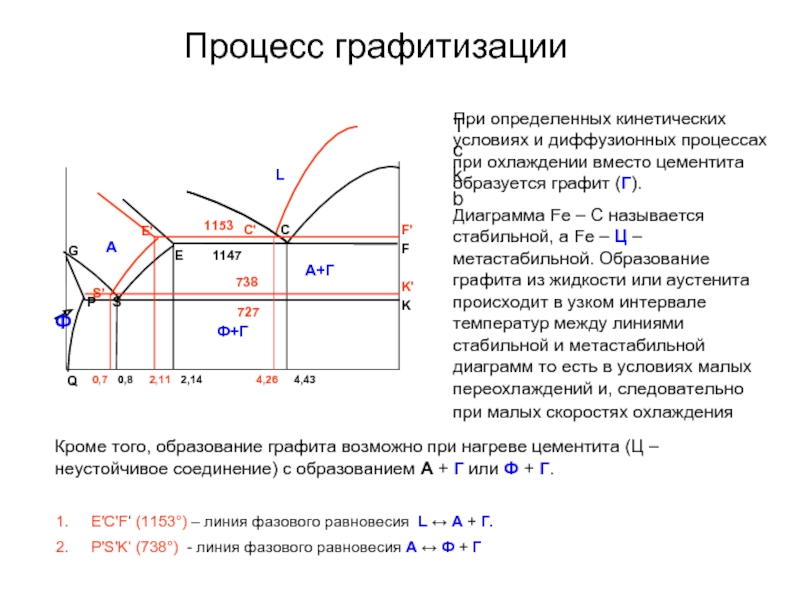
Слайд 53Процесс графитизации
Tckb
При определенных кинетических условиях и диффузионных процессах при охлаждении
Диаграмма Fe – C называется стабильной, а Fe – Ц – метастабильной. Образование графита из жидкости или аустенита происходит в узком интервале температур между линиями стабильной и метастабильной диаграмм то есть в условиях малых переохлаждений и, следовательно при малых скоростях охлаждения
Е'С'F‘ (1153°) – линия фазового равновесия L ↔ А + Г.
P'S'K‘ (738°) - линия фазового равновесия А ↔ Ф + Г
Кроме того, образование графита возможно при нагреве цементита (Ц – неустойчивое соединение) с образованием А + Г или Ф + Г.
Слайд 54Чугуны
Белый чугун – название получил по матово-белому цвету излома;
структура
свойства: высокая твердость и износостойкость, хрупкость, практически не поддается обработке режущим инструментом;
марки: ИЧХ3, ИЧХ5, ИЧХ15… (износостойкий хромистый чугун с содержанием хрома 3%, 5%, 15% соответственно…);
применение: детали, работающие в условиях интенсивного износа без ударных нагрузок(например, линейки направляющих, детали шаровых мельниц).
Слайд 55Серые чугуны
Излом такого чугуна имеет серый цвет. Обладает хорошими литейными свойствами.
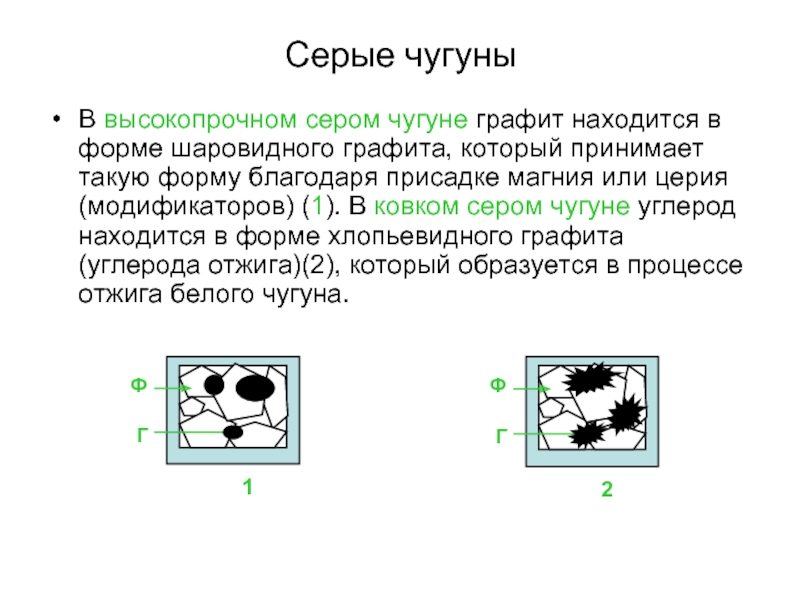
Слайд 56Серые чугуны
В высокопрочном сером чугуне графит находится в форме шаровидного
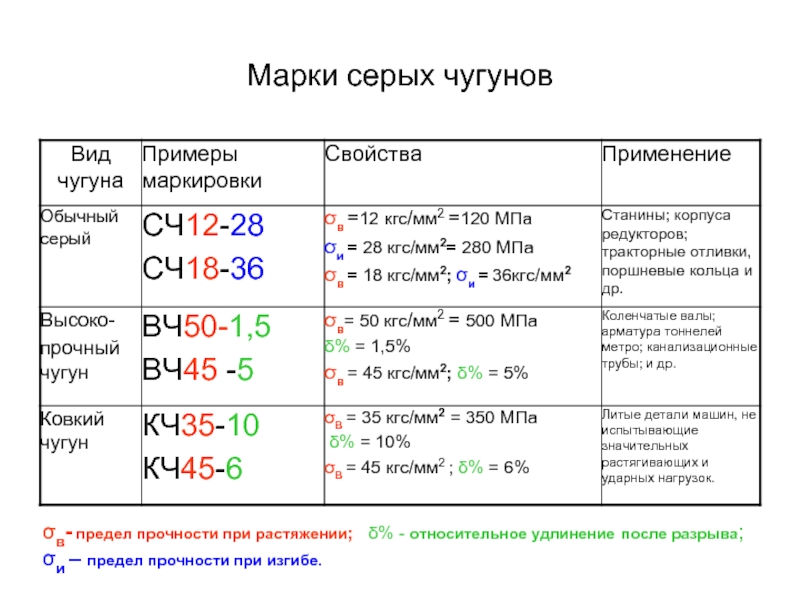
Слайд 57Марки серых чугунов
σв- предел прочности при растяжении; δ% - относительное
Слайд 58Механические свойства металлических материалов и методы их определения
Аспекты выбора материалов для
Механические (конструкционные) свойства материалов.
Технологические свойства материалов. Это часть общих физико-химических свойств, по которым на основании практического опыта проектируют и реализуют процесс получения узлов и деталей макшин с наилучшими служебными свойствами. Методы определения технологических свойств стандартизованы.К числу важнейших относятся: свариваемость, паяемость, упрочняемость, обрабатываемость резанием, литейные свойства и технологическая деформируемость.
Экономические параметры, связанные с изготовлением деталей.
Слайд 59Механические свойства металлических материалов и методы их определения
Детали должны выдерживать (передавать)
Способность материала в конструкции сопротивляться внешним воздействиям, (т.е. свойства материала), принято оценивать механическими характеристиками. Один и тот же материал при различных внешних условиях (температура, скорость нагружения и т.д.) может иметь различные механические свойства.
Количественная оценка механических свойств материалов производится путем испытаний образцов в специальных испытательных машинах при определенных условиях. Размеры образцов и методики проведения испытаний стандартизованы.
Слайд 60Испытание на растяжение
Разрушение образца из пластичного материала
Образец для испытаний
Относительное
сужение
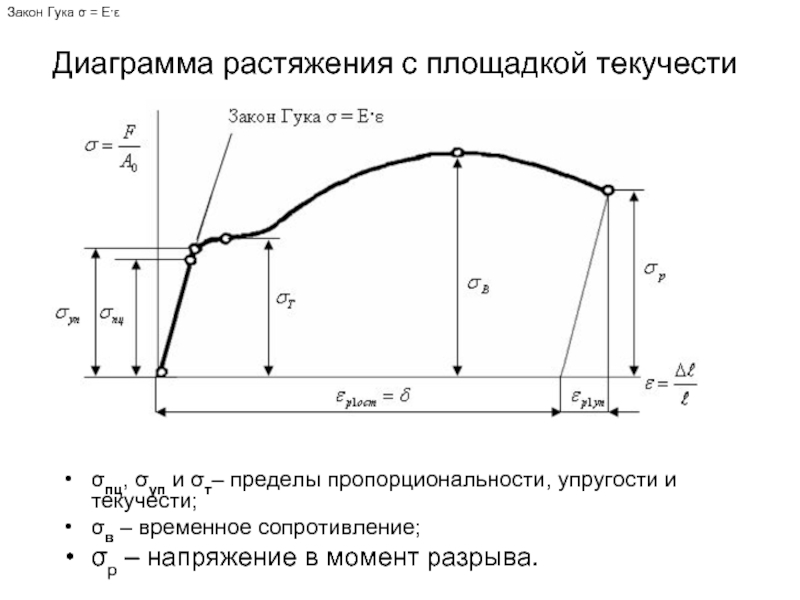
Слайд 61Диаграмма растяжения с площадкой текучести
σпц, σуп и σт– пределы пропорциональности,
σв – временное сопротивление;
σр – напряжение в момент разрыва.
Закон Гука σ = E·ε
Слайд 62Диаграмма растяжения без площадки текучести
σ0,2 – условный предел
текучести
σр,ист – истинное
σ0,2
0,2%
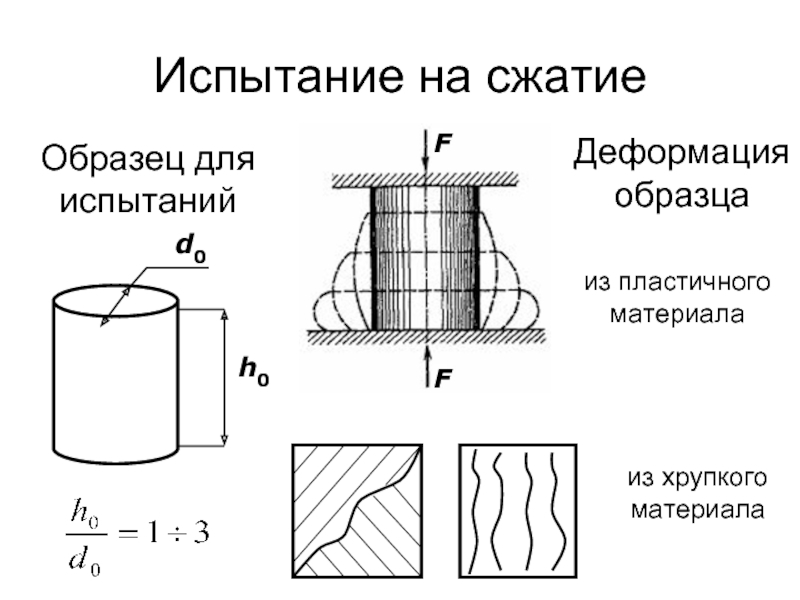
Слайд 63Испытание на сжатие
d0
h0
Образец для испытаний
Деформация образца
из пластичного материала
из хрупкого материала
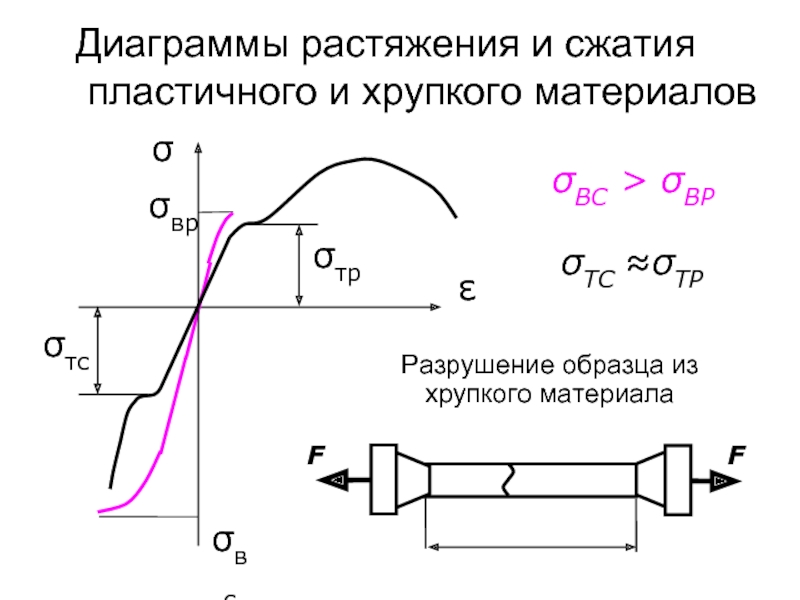
Слайд 64Диаграммы растяжения и сжатия пластичного и хрупкого материалов
σ
σВС > σВР
F
Разрушение
σвс
σТС ≈σТР
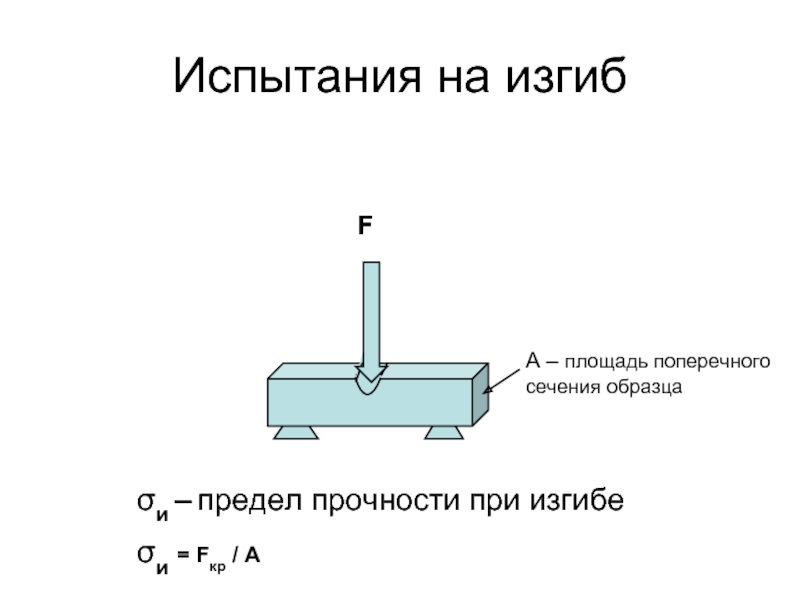
Слайд 65Испытания на изгиб
σи – предел прочности при изгибе
σи = Fкр /
А – площадь поперечного сечения образца
Слайд 69 Кривая усталости
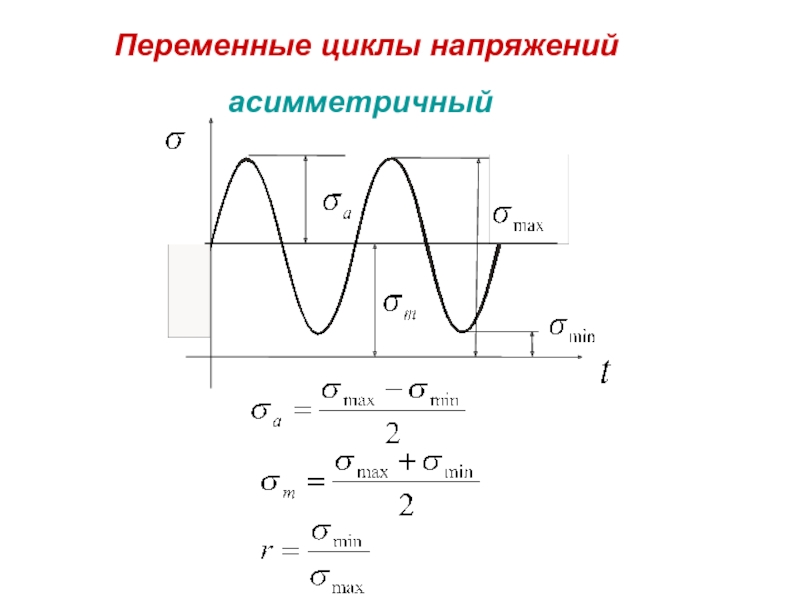
σr - предел выносливости - максимальное значение напряжения цикла,
Цикл изменения напряжений – совокупность последовательных значений переменных напряжений за один период их изменения.
Слайд 70Методы определения твердости материалов.
Измерение твердости – упрощенный метод определения прочности. Твердость
Метод Бринелля: в испытуемый материал под действием силы Р внедряется шарик (индентор) диаметром D; число твердости по Бринеллю – НВ = Р / S, где S – сферическая поверхность отпечатка с диаметром d.
Метод Роквелла: индентор – алмазный конус или стальной шарик; числом твердости считают величину обратную глубине вдавливания h; прибор имеет три шкалы: HRB – при вдавливании стального шарика; HRA и HRC при вдавливании алмазного конуса ( с различной нагрузкой).
Метод Виккерса: индентор – алмазная пирамида; критерий числа твердости HV – диагональ отпечатка d.
Слайд 71Методы определения твердости материалов.
Методы HB и HRB применяют для мягких материалов;
Между различными методами существует примерная корреляция. По соответствующим таблицам можно перевести значение твердости, полученное одним из методов в значения твердости соответствующие другим методам.
Число твердости по Бринеллю приблизительно в три раза больше чем предел прочности: НВ ≈ σв / 3.
Метод определения микротвердости Н применим для определения твердости отдельных структурных составляющих. Индентор – алмазная пирамида при очень небольшой нагрузке (до 100г).
Метод Шора - экспресс-метод определения твердости (HSD) крупных изделий в условиях производства по отскоку стального шарика
Слайд 72Сплавы меди
Латуни – сплавы меди с цинком – при содержании цинка
Свойства латуней:
Сплав обладает высокой пластичностью, которая достигает максимального значения при 30% Zn. Латуни легко поддаются пластической деформации.
Литейные свойства латуней: малая склонность к ликвации; хорошая жидкотекучесть; склонность к образованию концентрированной усадочной раковины.
Механические свойства латуней: невысокая прочность – σв = 300 – 350 МПа при δ% = 40% - 20%.
Марки латуней:
Двойные латуни: Л62 (62%Cu; 38% Zn) Л68; Л70; в том числе ювелирные латуни (томпаки): Л80; Л85; Л96.
Специальные латуни: ЛС59-1 – автоматная латунь (59%Cu;1% Pb; 40% Zn); морская латунь – ЛО60-1 (60%Cu; 1%Sn; 39% Zn); латунь с повышенной прочностью – ЛАН59-3-2 (59%Cu; 3%Al; 2%Ni; 36%Zn).
Слайд 73Сплавы меди
Оловянистые бронзы – сплавы меди с оловом.
Свойства
Бронзы, содержащие более 5% – 6% Sn обладают низкой пластичностью, их не куют и не прокатывают, а применяют в литом виде.
Высокие литейные свойства бронз определяются прежде всего малой усадкой (менее 1%) при довольно низкой жидкотекучести.
Бронзы обеспечивают высокую стойкость против истирания; бронза с 10% олова - наилучший антифрикционный материал.
Высокая химическая стойкость.
Применение:
Отливки сложной формы, в т.ч. художественное литье.
Вкладыши подшипников какчения.
Арматура (паровая, водяная и др.)
Слайд 74Сплавы меди
Сплавы меди с алюминием, кремнием, бериллием и др. элементами также
Эти бронзы не имеют такой низкой усадки как оловянистакя бронза, но превосходят ее по механическим свойствам (алюминиевая, кремнистая), по химической стойкости (алюминиевая), по жидкотекучести (кремнистая), по твердости и упругости (бериллиевая).
Марки бронз
БрО10 90%Cu; 10%Sn
БрОЦСН 3-7-5-1 84%Cu; 3%Sn; 7%Zn; 5%Pb; 1%Ni
БрАЖН 10-4-4 82%Cu; 10%Al; 4%Fe; 4%Ni
Слайд 75Термическая обработка
Технология металлов включает в себя:
Металлургию – получение металла заданного
Механическую технологию – получение из металла изделий заданной формы.
Термическую обработку – получение заданных свойств.
Параметры термической обработки:
Максимальная температура нагрева – tmax.
Время выдержки сплава при температуре нагрева - τв .
Скорость нагрева - vнагр .
Скорость охлаждения – vохл.
Режим термической обработки можно представить в виде график в координатах температура - время
Слайд 76Основные виды термической обработки
Отжиг (первого рода) – термическая операция, состоящая в
Отжиг (второго рода) – нагрев металла выше температуры превращения с последующим достаточно медленным охлаждением для получения структурно устойчивого состояния сплава.
Закалка – нагрев металла выше температуры превращения с последующим достаточно быстрым охлаждением для получения структурно неустойчивого состояния сплава.
Отпуск – нагрев закаленного сплава ниже температуры превращения для получения более устойчивого структурного состояния .
Слайд 77Сложные виды термической обработки
Химико-термическая обработка – нагрев сплава в соответствующих химических
Термомеханическая (термопластическая) обработка – деформация и последующая термическая обработка, сохраняющая в той или иной форме результаты наклепа
Слайд 78Виды термической обработки стали
2
K
E
Основа изучения термообработки стали – диаграмма железо –
Общепринятые обозначения критических точек (А):
А1 – линия PSK – соответствует превращению
А ↔ П;
А3 – линия GSE – соответствует началу выпадения или концу растворения Ф (в доэвтектоидных сталях) или Ц (в заэвтектоидных сталях);
Аc1 и Аc3 – обозначение критических точек при нагреве;
Аr1 и Ar3 – обозначение критических точек при охлаждении.
Отжиг – нагрев выше Ас3 с последующим медленным охлаждением (если охлаждение происходит на воздухе то такой вид термообработки называют нормализацией); при охлаждении из межкритического интервала термообработку называют неполным отжигом.
Закалка нагрев выше Ас3 с последующим быстрым охлаждением; при охлаждении из межкритического интервала термообработку называют неполной закалкой.
Отпуск – нагрев закаленной стали ниже Ас3.
Слайд 79Четыре основных превращения в стали
Превращение перлита в аустенит при нагреве: П→А.
Превращение
Превращение аустенита в мартенсит при закалке: А→М. (Мартенсит – пересыщенный твердый раствор углерода в α-железе.
Превращение мартенсита в перлит (феррито – карбидную смесь) чаще всего при нагреве: М→П.
Представленные фазовые превращения используются при термообработке и обусловлены изменением температуры.
Слайд 80Практическое значение температуры рекристаллизации
Горячая обработка давлением – пластическое деформирование выше температуры
Холодная обработка давлением – пластическая деформация ниже температуры рекристаллизации. Такая обработка вызывает наклеп (нагартовку) металла – упрочнение металла под действием пластической деформации.
Слайд 81Образование аустенита
t°,С
При обычных условиях нагрева:
Для начала превращения необходим перегрев выше А1.
Превращение
Кривые начала и конца превращения асимптотически приближаются к линии А1 .
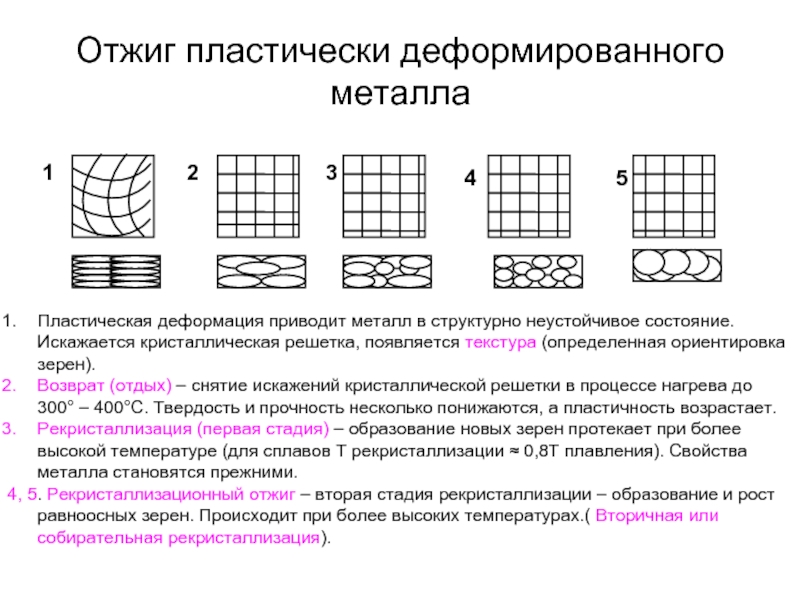
Слайд 82Отжиг пластически деформированного металла
Пластическая деформация приводит металл в структурно неустойчивое состояние.
Возврат (отдых) – снятие искажений кристаллической решетки в процессе нагрева до 300° – 400°С. Твердость и прочность несколько понижаются, а пластичность возрастает.
Рекристаллизация (первая стадия) – образование новых зерен протекает при более высокой температуре (для сплавов Т рекристаллизации ≈ 0,8Т плавления). Свойства металла становятся прежними.
4, 5. Рекристаллизационный отжиг – вторая стадия рекристаллизации – образование и рост равноосных зерен. Происходит при более высоких температурах.( Вторичная или собирательная рекристаллизация).
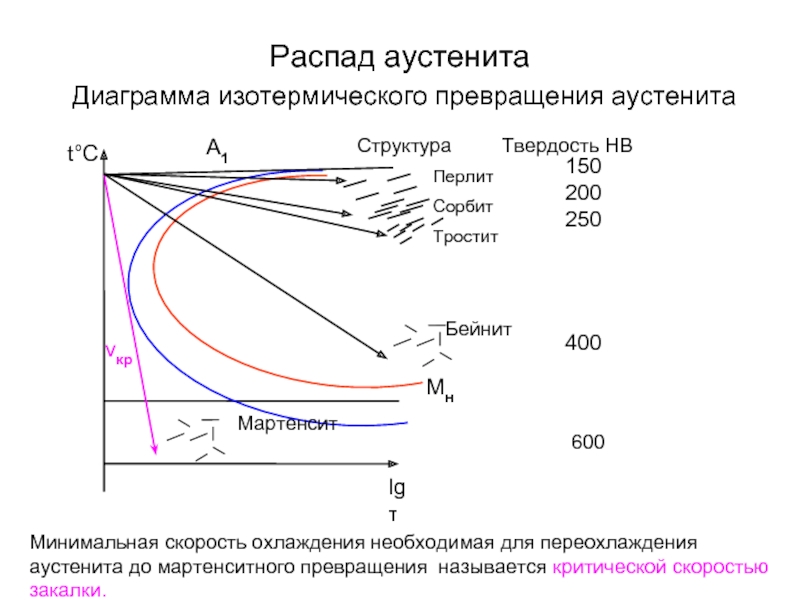
Слайд 83Распад аустенита
Диаграмма изотермического превращения аустенита
А1
Структура
Твердость НВ
t°С
Минимальная скорость охлаждения необходимая для
Слайд 84Превращения при отпуске
Исходная структура: мартенсит – структура
Первое превращение: в интервале температур 80° - 200°С образуется мартенсит отпуска, при этом тетрагонапьность решетки мартенсита уменьшается вследствие выделения карбидов.
Второе превращение: в интервале температур 200° - 300°С происходит распад остаточного аустенита с образованием мартенсита отпуска, при этом объем увеличивается.
Третье превращение: в интервале температур 300° - 400°С происходит снятие внутренних напряжений, возникающих в результате предыдущих превращений, сопровождавшимися объемными изменениями.
Четвертое превращение: выше 400°С происходит интенсивная коагуляция карбидов, образуется смесь Ф + Ц в виде тростита (350° - 500°С) или сорбита (500° - 600°С).
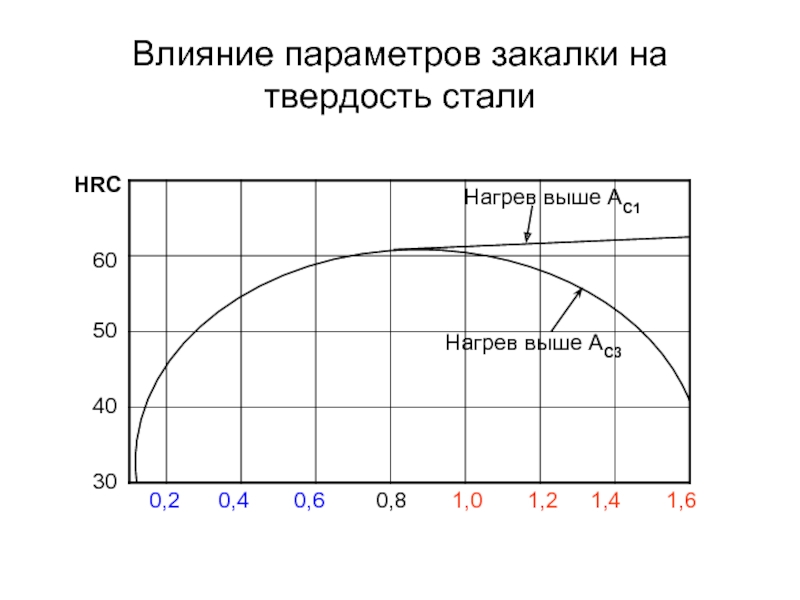
Слайд 85Влияние параметров закалки на твердость стали
30
40
50
60
HRC
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
Нагрев выше АС3
Нагрев выше АС1
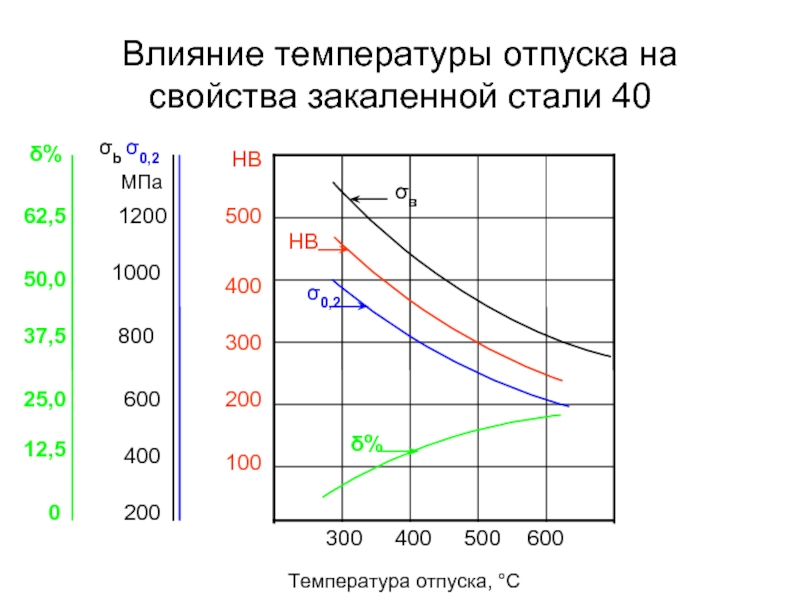
Слайд 86Влияние температуры отпуска на свойства закаленной стали 40
200
0
300
400
500
600
Температура отпуска, °С
Слайд 87Практика термической обработки
Закалка стали.
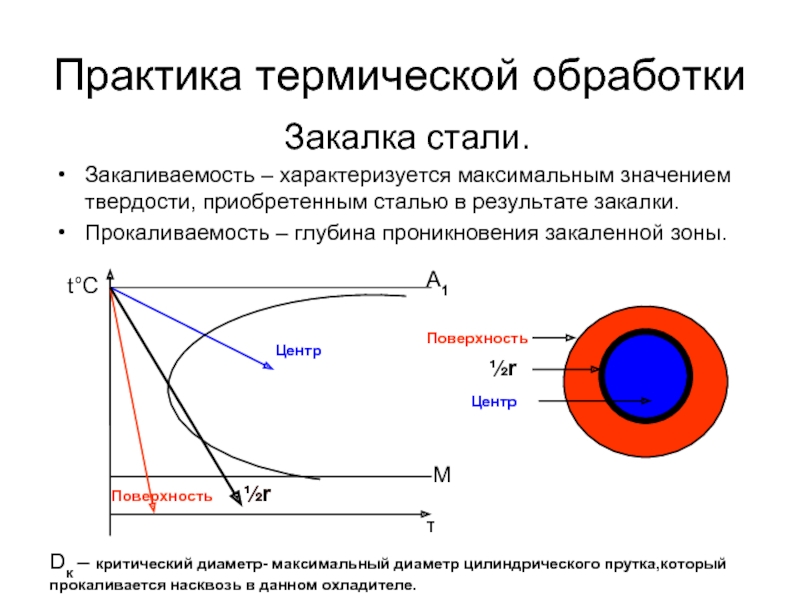
Закаливаемость – характеризуется максимальным значением твердости, приобретенным сталью
Прокаливаемость – глубина проникновения закаленной зоны.
А1
Dк – критический диаметр- максимальный диаметр цилиндрического прутка,который прокаливается насквозь в данном охладителе.
Слайд 88Внутренние напряжения при закалке
Внутренние напряжения первого рода (термические): зональные внутренние напряжения,
Внутренние напряжения второго рода (структурные): возникают внутри зерна или между соседними зернами. Эти напряжения возникают между различными фазами вследствие того, что у них разные коэффициенты линейного расширения, или из-за образования новой фазы с иным объемом.
Остаточные напряжения – напряжения, которые сохранилась в детали в результате охлаждения.
Отпуск – необходимое и радикальное средство уменьшения остаточных напряжений.
Слайд 89Химико-термическая обработка.
Преимущества по сравнению с закалкой ТВЧ:
Независимость от внешней формы изделия.
Большее
Последствия перегрева могут быть устранены последующей термической обработкой.
Виды ХТО:
Цементация – насыщение поверхности детали углеродом с последующей закалкой, при которой на поверхности получается высокоуглеродистый мартенсит, а в сердцевине сохраняется низкая твердость и высокая вязкость.
Азотирование – насыщение поверхности детали азотом, которое осуществляют на готовых деталях, т.к. азотированный слой обладает высокой твердостью, а размеры изделий изменяются после азотирования крайне мало.
Цианирование.
Диффузионная металлизация – процесс диффузионного насыщения поверхности деталей металлами. Например: хромирование или алитирование для повышения жаростойкости изделий.