- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Магний. Электронное строение атома Mg презентация
Содержание
- 1. Магний. Электронное строение атома Mg
- 2. 24 Mg +12 0 2e
- 3. Металл Связь
- 4. Физические свойства Mg
- 5. 2Mg + O2 = 2MgO
- 6. Горение Mg в кислороде
- 8. Горение Mg в хлоре Mg + Cl2 = MgCl2
- 9. Вспышка смеси Mg + AgNO3 от
- 10. «Горение магния на воздухе» 2Mg + O2 = 2MgO
- 11. Магнийтермия
- 12. Нахождение Mg в земной коре
- 13. Получение Mg
- 14. Применение Mg и его сплавов
- 15. Выводы Магний – химический элемент II
Слайд 2
24
Mg
+12
0
2e
8e
2e
1s2
2s2
2p6
3s2
Краткая электронная запись
1s2
2s2
2p6
3s2
Порядок заполнения
Электронное строение атома Mg
Слайд 3
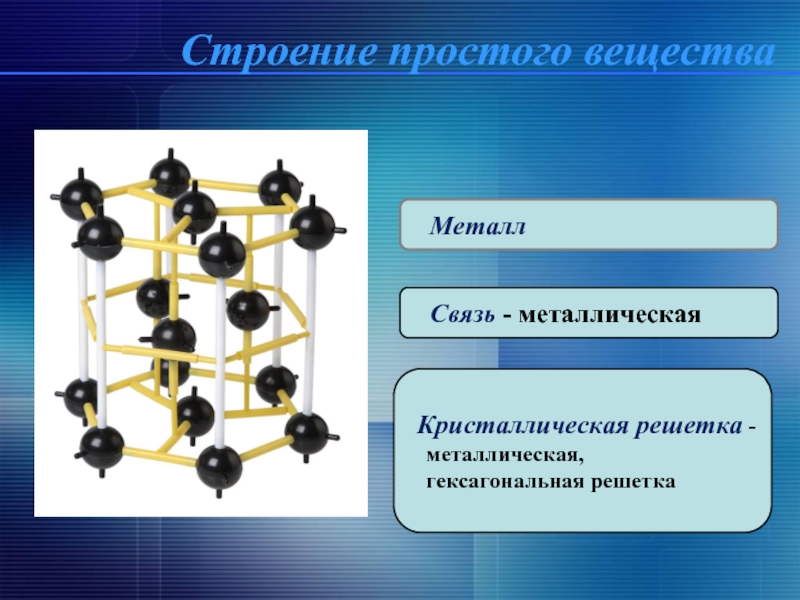
Металл
Связь - металлическая
Кристаллическая решетка -
гексагональная решетка
Строение простого вещества
Слайд 5
2Mg + O2 = 2MgO
t
Mg + S =
C неметаллами ( кислородом, серой)
Mg+ Cl2 = Mg Cl2
3Mg + N2 = Mg3N2
C неметаллами ( галогенами, азотом)
Mg + 2H2O = Mg(OH)2 + H2↑
C водой
Mg + 2HCl = Mg Cl2 + H2↑
4Mg+5H2SO4=4MgSO4+H2S+4H2O
C кислотами
4Mg + Fe3O4 = 4MgO + 3Fe
3Mg + Al2O3 = 3Mg O + 2Al
C оксидами металлов
Химические свойства Mg
Слайд 7
Что будет, если тушить магний водой?
На заводе по переработке вторичного сырья в Уолтон Хиллс, штат Огайо возник пожар. В здании было большое количество металлов, среди них титан, сталь и магний. Пожарные, опасаясь, что огонь перекинется на соседнюю бензозаправку решили залить горящее здание водой. Результат не заставил себя ждать - произошел сильный взрыв, во все стороны разлетелись куски раскаленного добела магния. Ослепительный огонь поднялся на высоту 50 м. Однако пожарных это ни чему не научило - они продолжили заливать здание, что вызвало новые взрывы магния. Пожарные вынуждены были отступать под дождем горящего магния. От жара огня начали плавиться стены здания. Единственный способ погасить пожар магния - засыпать металл большим количеством песка, что было в данном случае технически невозможно, но это не повод заливать горящий магний водой. Некомпетентные действия пожарных значительно усугубили масштаб аварии.
Mg + 2H2O = Mg(OH)2 + H2
Слайд 11
Магнийтермия
Магнийтермия – получение металлов восстановлением оксидов
4Mg+ Fe3O4 = 4MgO + 3Fe
3Mg + Al2O3 = 3MgO + 2Al