РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ (SN) В РЯДУ КАРБОНОВЫХ КИСЛОТ
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 9. Реакции нуклеофильного замещения(Sn) в ряду карбоновых кислот презентация
Содержание
- 1. Лекция 9. Реакции нуклеофильного замещения(Sn) в ряду карбоновых кислот
- 2. ПЛАН 9.1 Классификация и номенклатура карбоновых кислот
- 3. Предельные одноосновные карбоновые кислоты
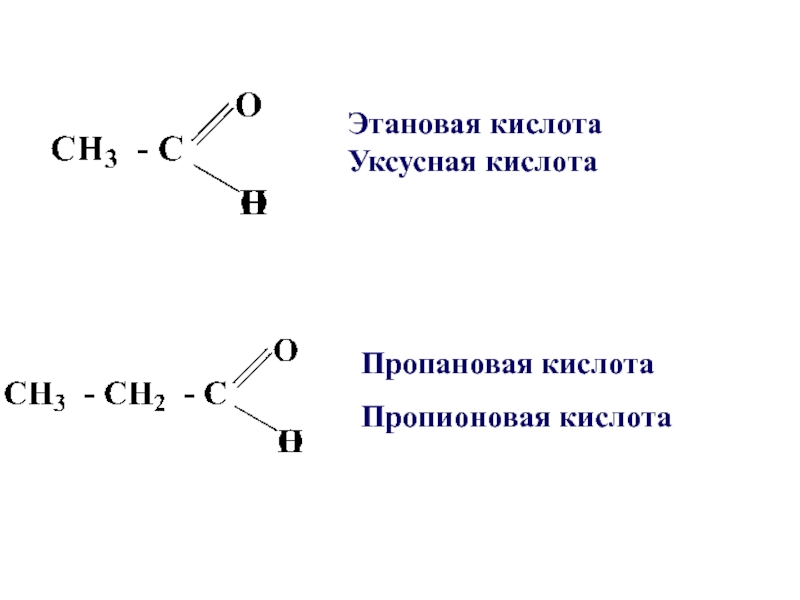
- 4. Пропановая кислота Пропионовая кислота Этановая кислота Уксусная кислота
- 5. Бутановая кислота Масляная кислота Пентановая кислота Валериановая кислота
- 6. Гексановая кислота Капроновая кислота Козы являются источником
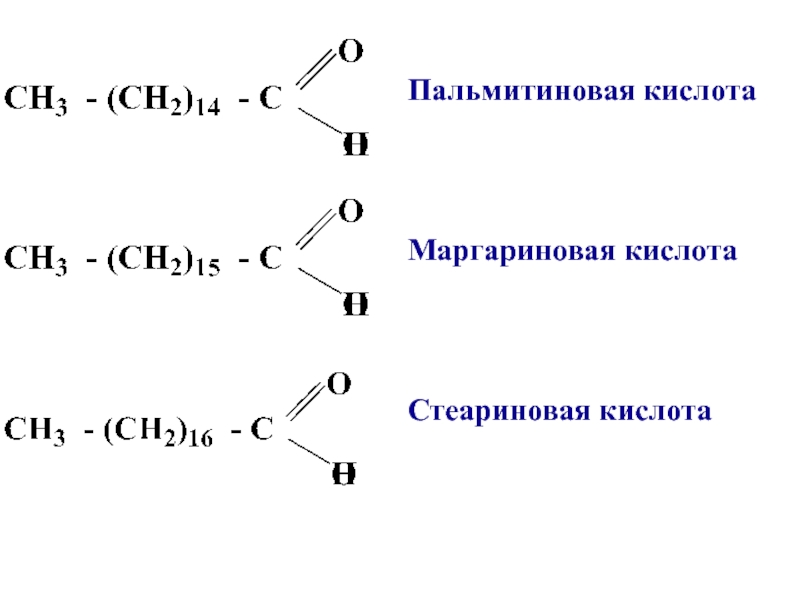
- 7. Пальмитиновая кислота Маргариновая кислота Стеариновая кислота
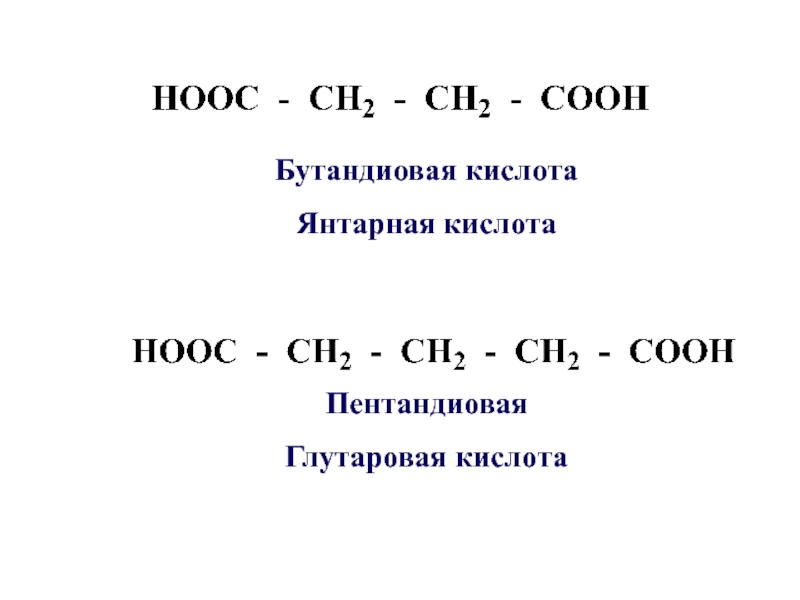
- 9. Пентандиовая Глутаровая кислота Бутандиовая кислота Янтарная кислота
- 10. Непредельные одноосновные кислоты
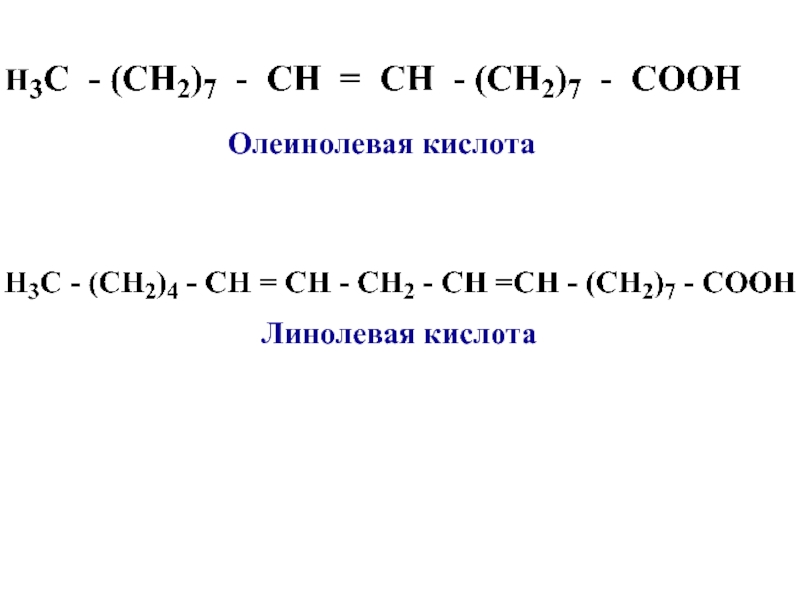
- 11. Линолевая кислота Олеинолевая кислота
- 12. Линоленовая кислота Арахидоновая кислота
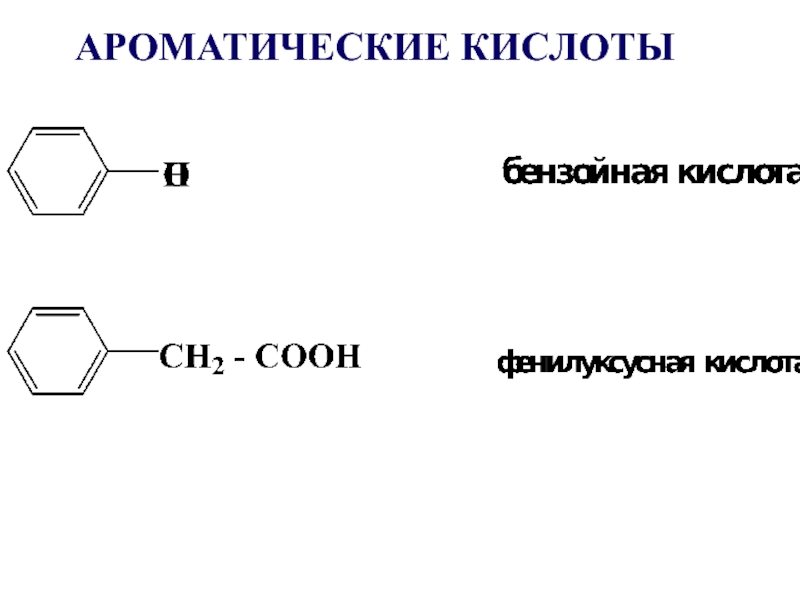
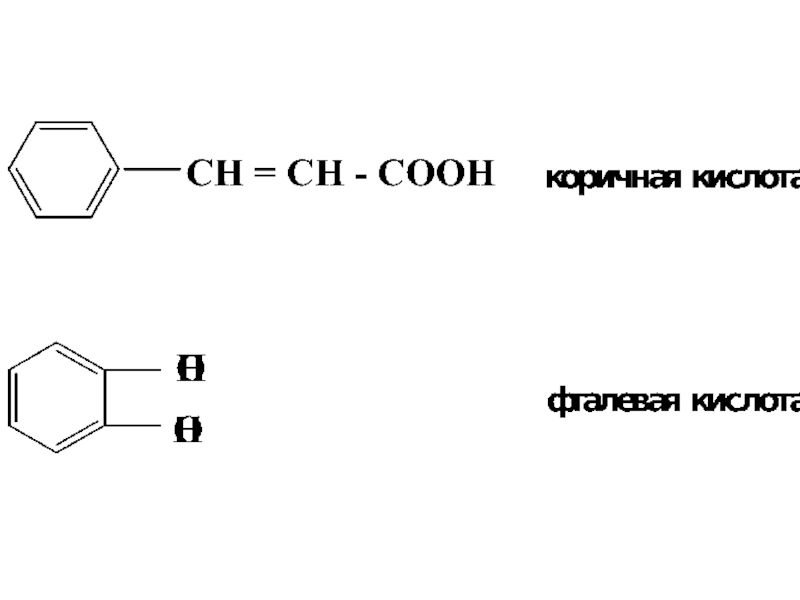
- 13. АРОМАТИЧЕСКИЕ КИСЛОТЫ
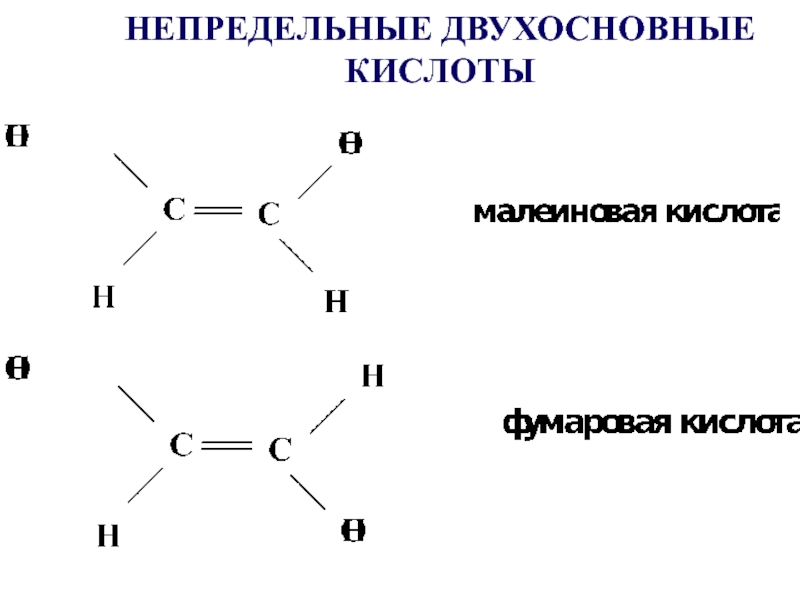
- 15. НЕПРЕДЕЛЬНЫЕ ДВУХОСНОВНЫЕ КИСЛОТЫ
- 16. Карбоксильная группа состоит из карбонильной и
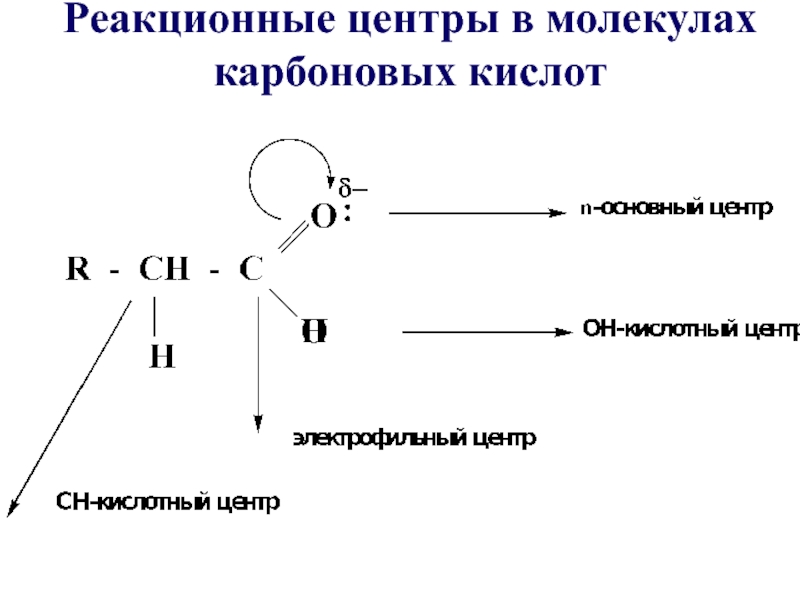
- 17. Реакционные центры в молекулах карбоновых кислот
- 18. Характеристика реакционной способности карбоновых кислот: •У карбоновых
- 19. •У карбоновых кислот частичный положительный
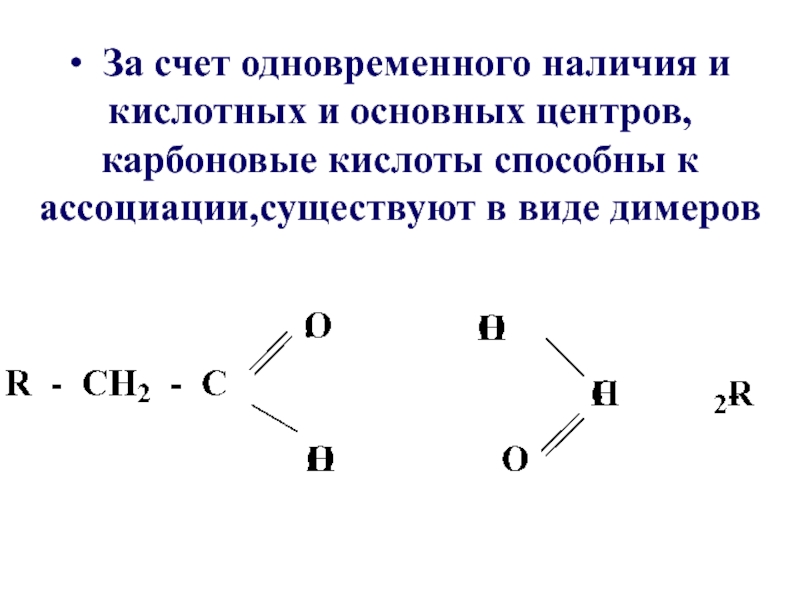
- 20. • За счет одновременного наличия и кислотных
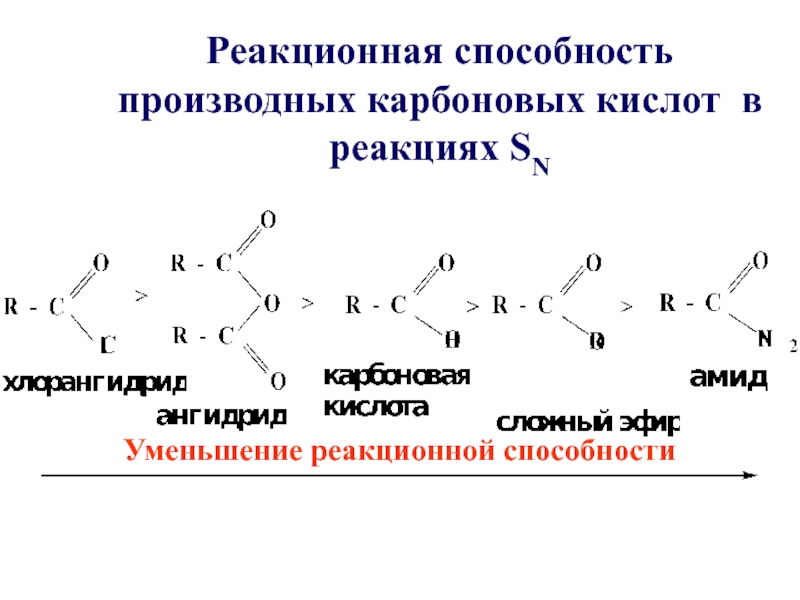
- 21. Реакционная способность производных карбоновых кислот в реакциях SN Уменьшение реакционной способности
- 22. 9.3 Реакции нуклеофильного замещения (SN), их роль
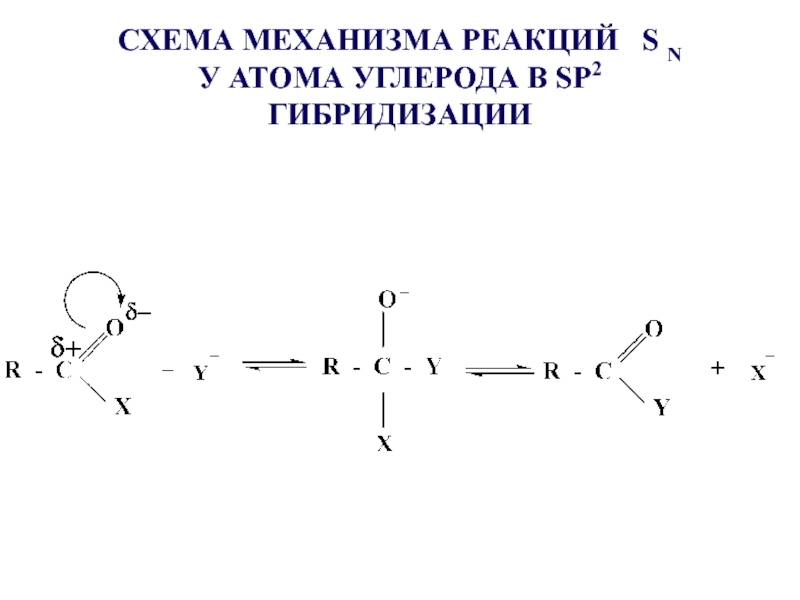
- 23. СХЕМА МЕХАНИЗМА РЕАКЦИЙ S N
- 24. Реакция протекает при наличии сильного нуклеофила
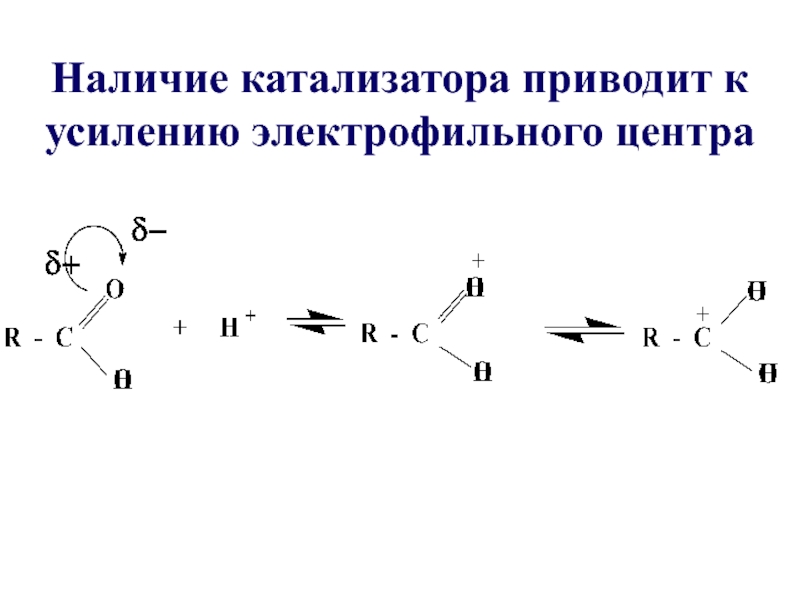
- 25. Наличие катализатора приводит к усилению электрофильного центра
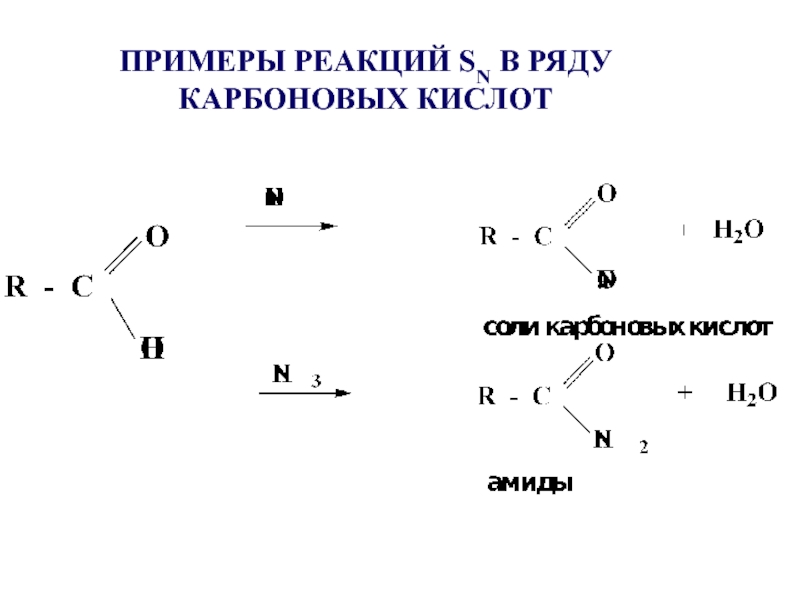
- 26. ПРИМЕРЫ РЕАКЦИЙ SN В РЯДУ КАРБОНОВЫХ КИСЛОТ
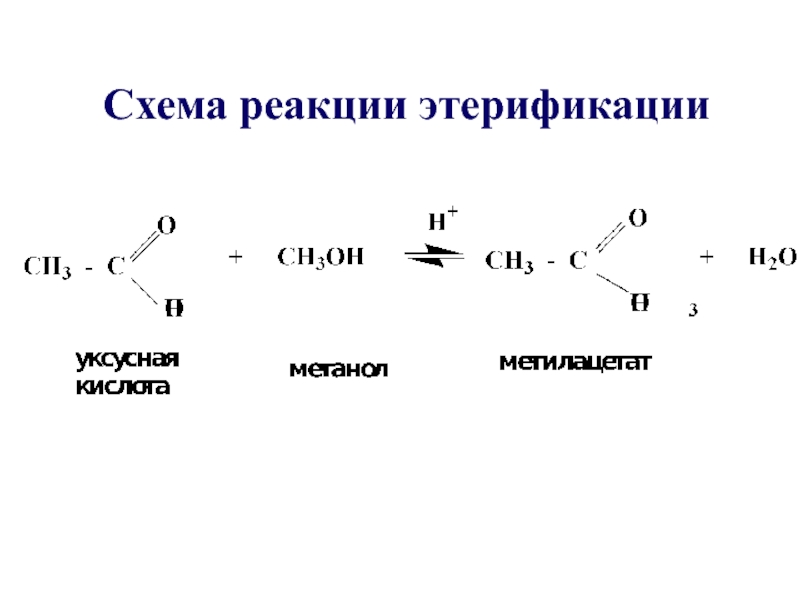
- 28. Схема реакции этерификации
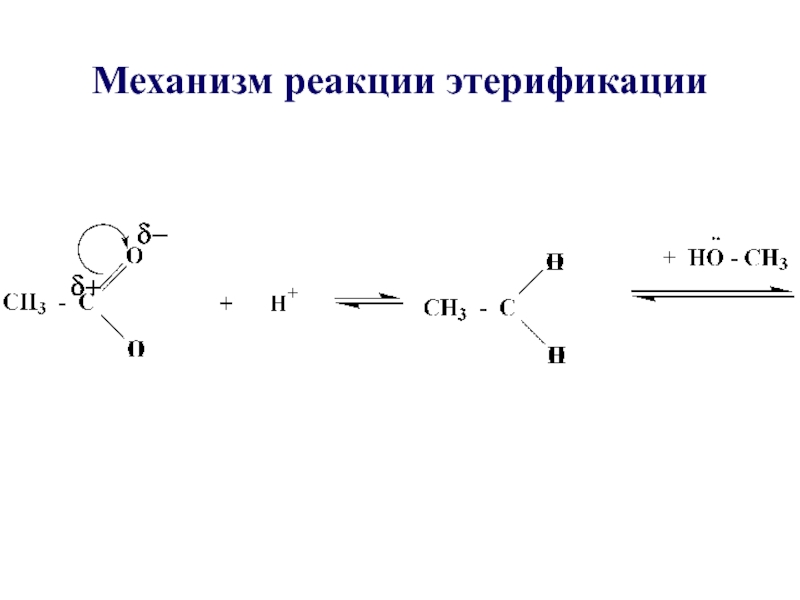
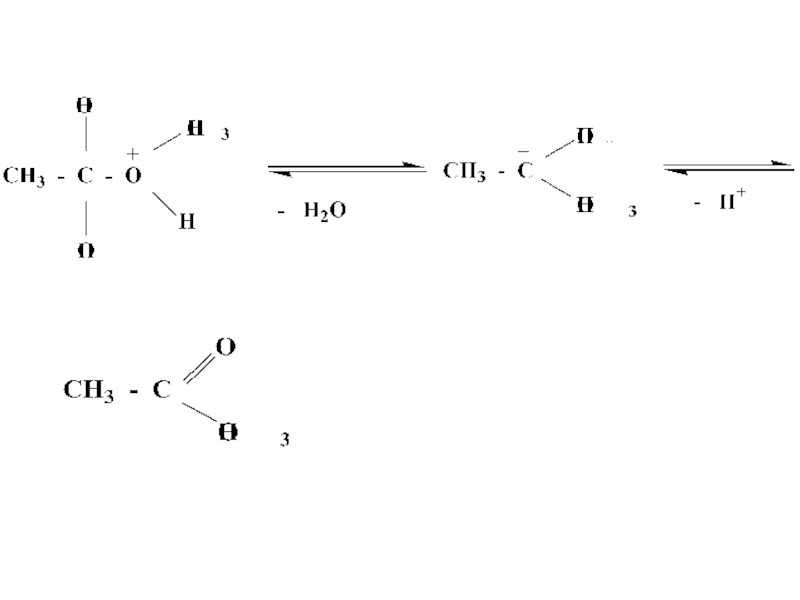
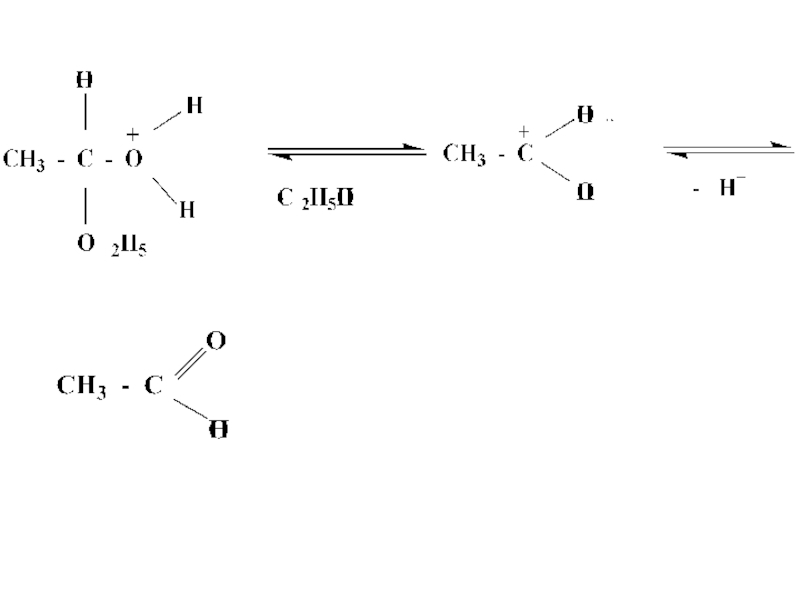
- 29. Механизм реакции этерификации
- 31. Реакция этерификации протекает в присутствии минеральных кислот,
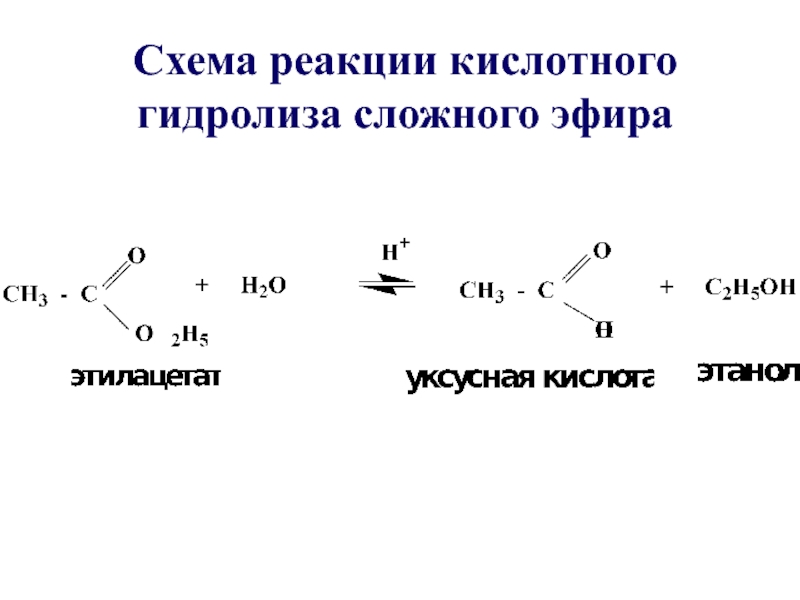
- 32. Схема реакции кислотного гидролиза сложного эфира
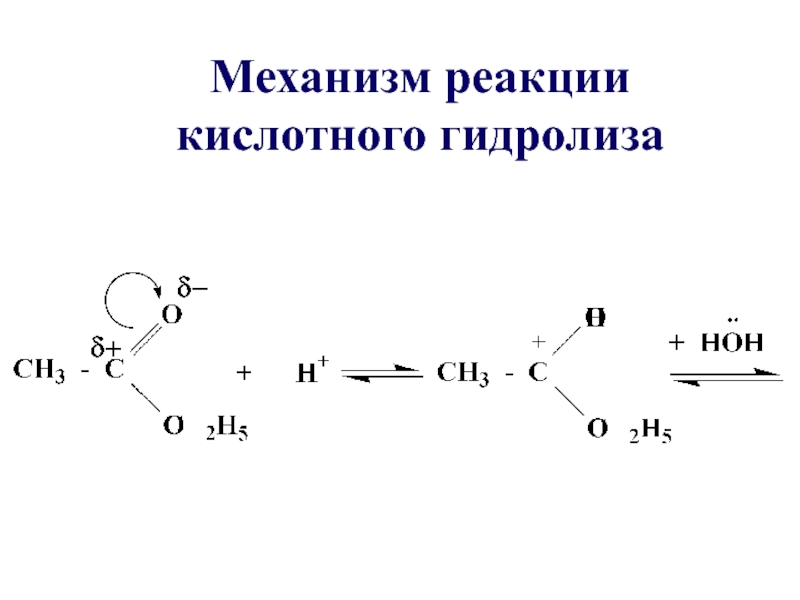
- 33. Механизм реакции кислотного гидролиза
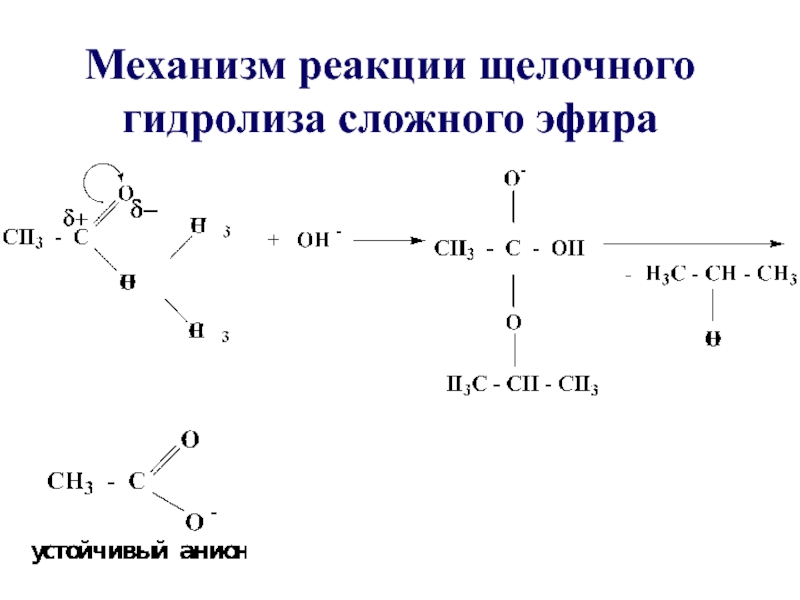
- 35. В щелочной среде гидролиз необратим, причиной этого является образование в щелочной среде стабильного ацилат-иона
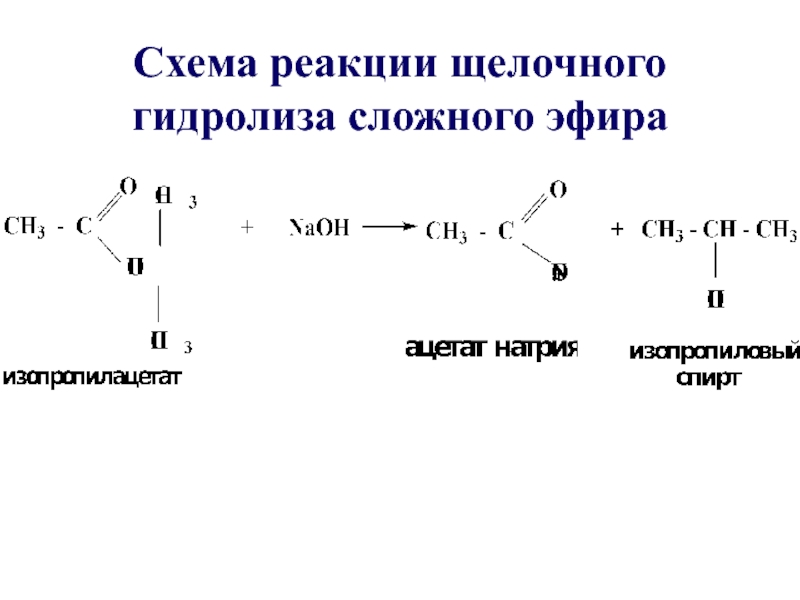
- 36. Схема реакции щелочного гидролиза сложного эфира
- 37. Механизм реакции щелочного гидролиза сложного эфира
- 38. Для практического получения сложных эфиров обычно
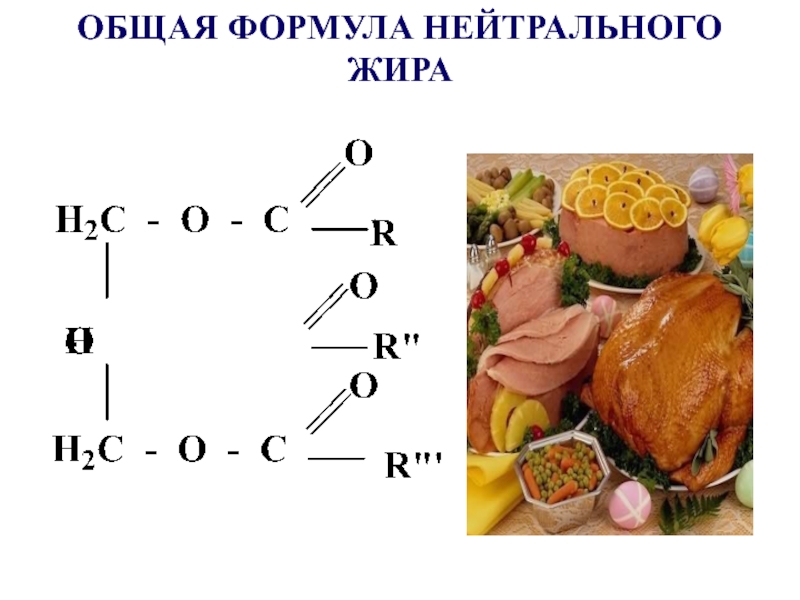
- 39. Сложными эфирами являются жиры и липиды, в
- 40. ОБЩАЯ ФОРМУЛА НЕЙТРАЛЬНОГО ЖИРА
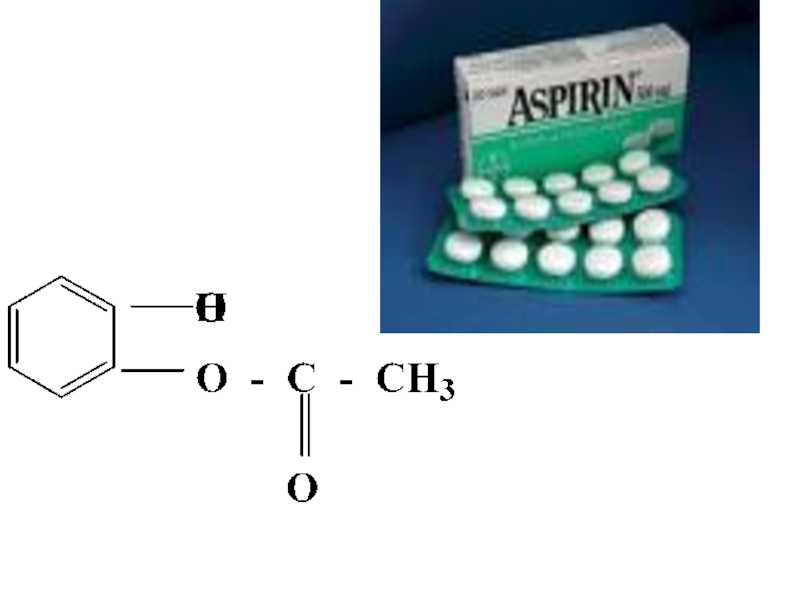
- 41. Многие лекарственные препараты являются сложными эфирами.
- 43. Аспирин использовали при лечении зубной, головной боли
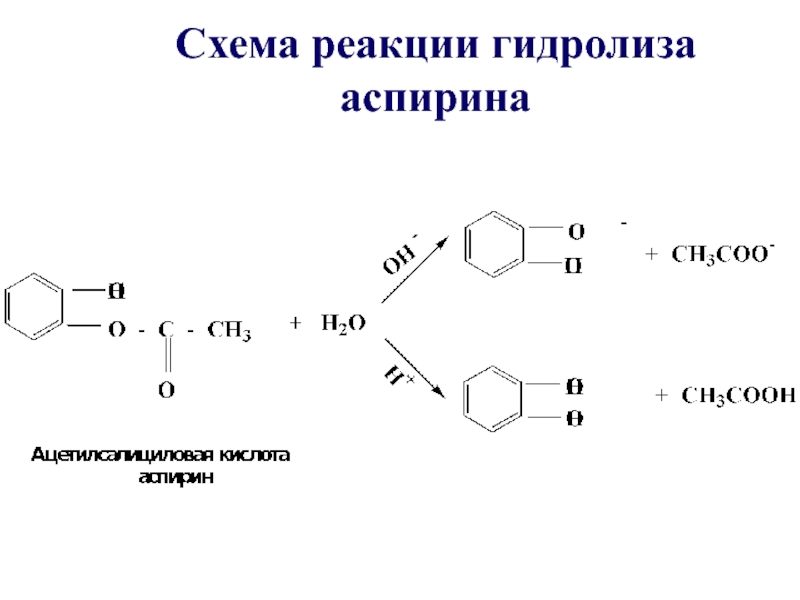
- 44. Схема реакции гидролиза аспирина
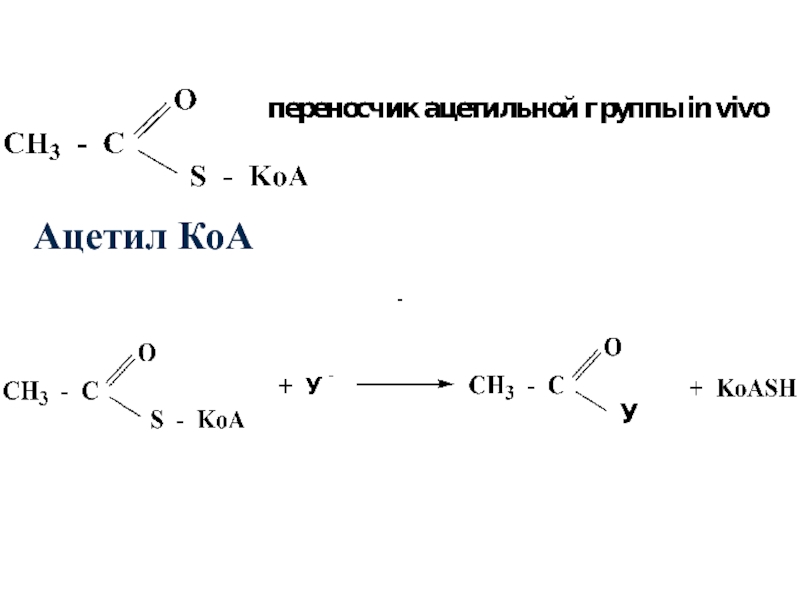
- 45. Сложные тиоэфиры наряду со сложными эфирами
- 46. Ацетил КоА
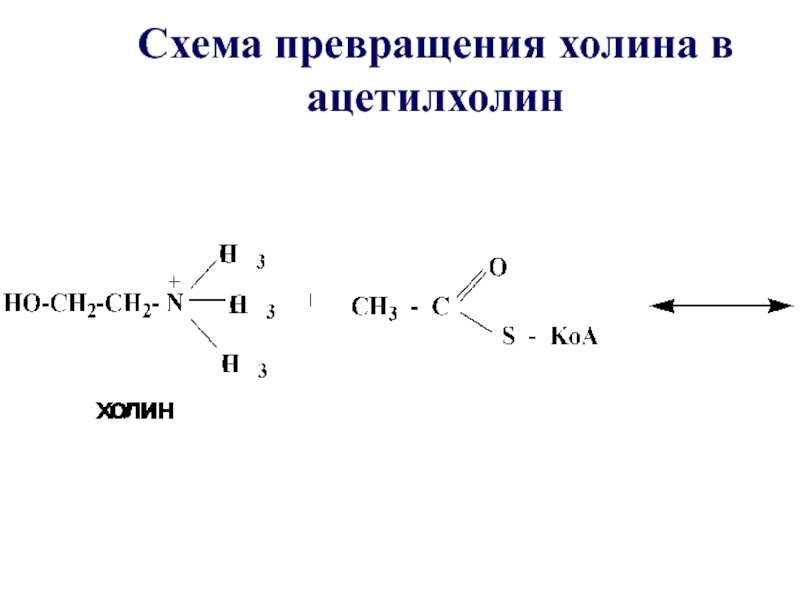
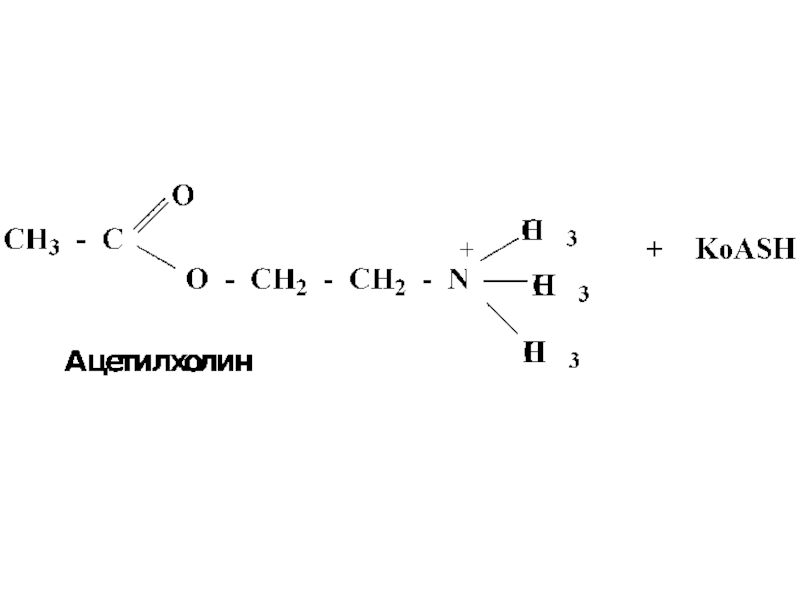
- 47. Таким образом осуществляется превращение холина в ацетилхолин – нейромедиатор, посредник при передаче нервного импульса
- 48. Схема превращения холина в ацетилхолин
- 50. При передаче нервного импульса ацетилхолин синтезируется в
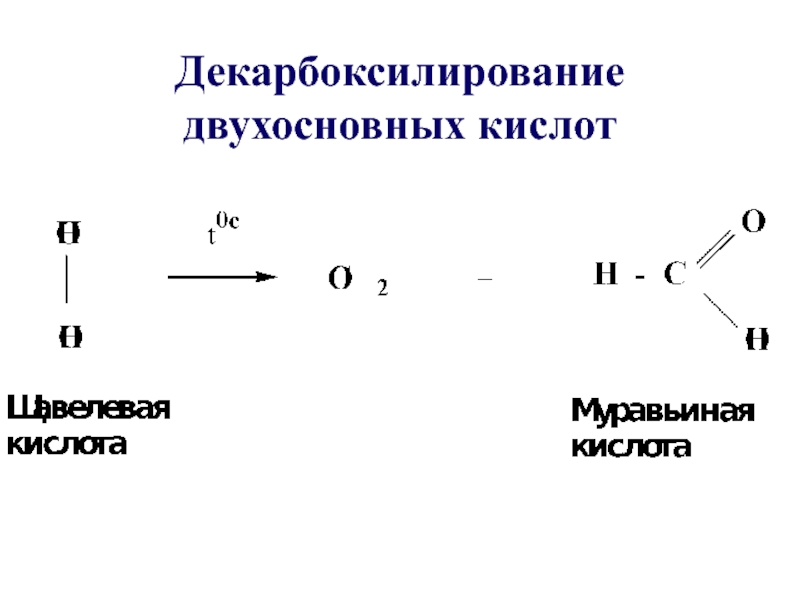
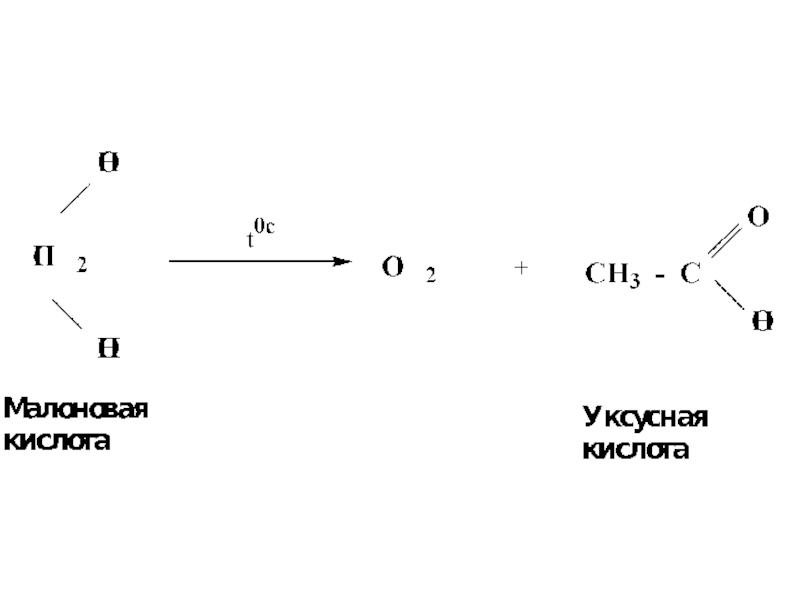
- 51. Схемы реакций декарбоксилирования Реакции декарбоксилирования карбоновых кислот
- 52. Декарбоксилирование двухосновных кислот
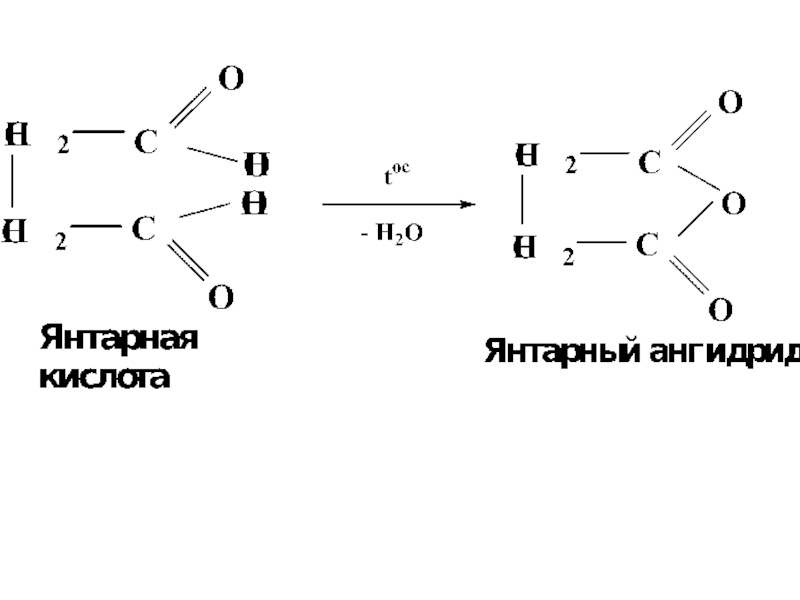
- 54. При декарбоксилировании янтарной и глутаровой кислот происходит
- 56. В биологических системах реакции декарбоксилирования протекают с
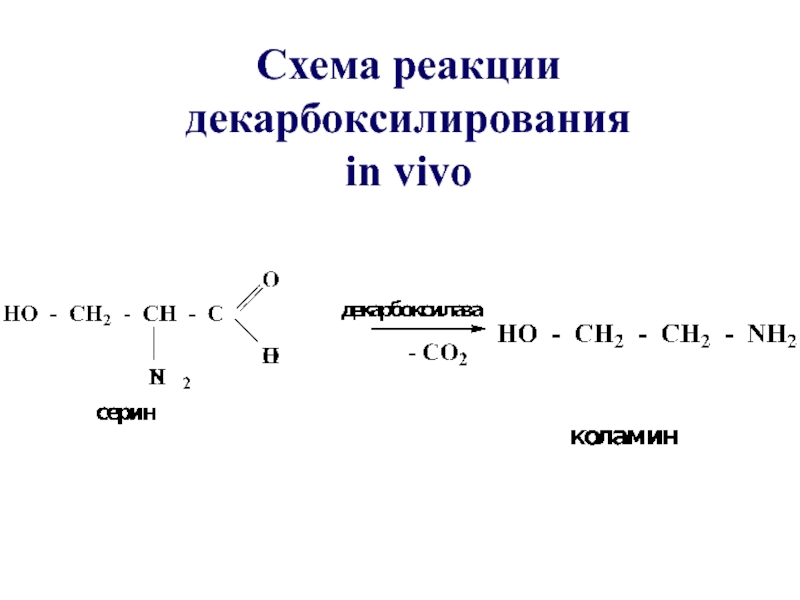
- 57. Схема реакции декарбоксилирования in vivo
- 58. В насыщенных алифатических кислотах в результате
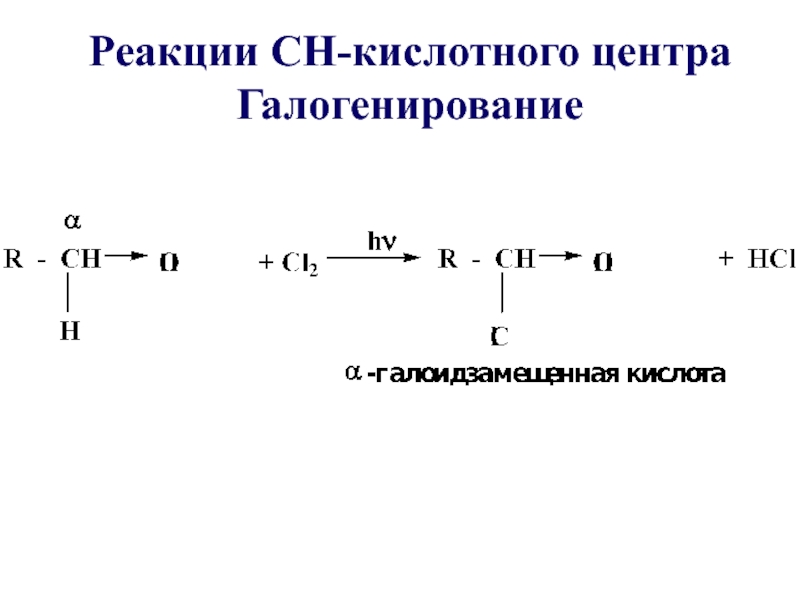
- 59. Реакции СН-кислотного центра Галогенирование
- 60. Спасибо
Слайд 2ПЛАН
9.1 Классификация и номенклатура карбоновых кислот
9.2. Электронное и пространственное строение карбоксильной
группы
9.3 Реакции нуклеофильного замещения (SN), их роль
9.3 Реакции нуклеофильного замещения (SN), их роль
Слайд 3
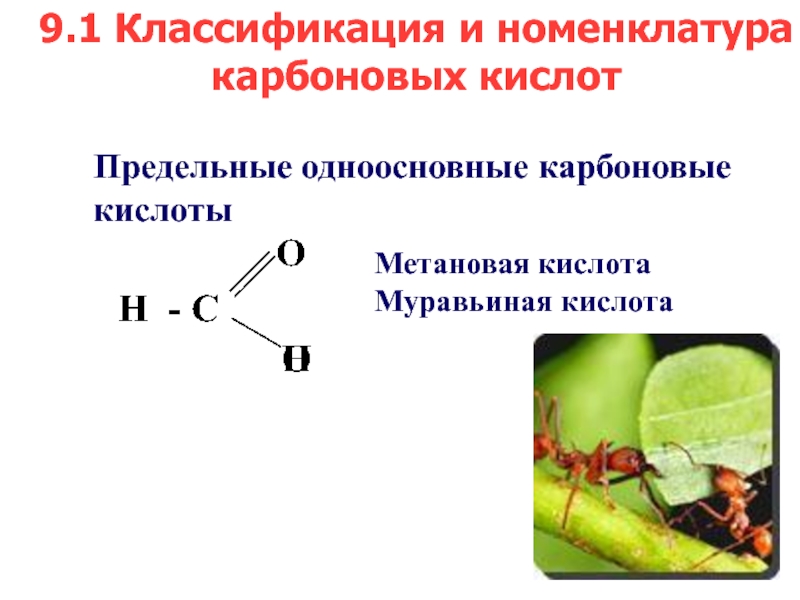
Предельные одноосновные карбоновые кислоты
Метановая кислота Муравьиная кислота
9.1 Классификация и
номенклатура карбоновых кислот
Слайд 6Гексановая кислота
Капроновая кислота
Козы являются источником капроновой, каприловой и каприновой кислот: CH3(CH2)nCOOH
n = 4, 6, 8
Слайд 8
ДВУХОСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫ
Этандиовая кислота
Щавелевая кислота
Пропандиовая кислота
Малоновая кислота
Слайд 16 Карбоксильная группа состоит из карбонильной и гидроксильной групп, взаимно влияющих
друг на друга, что приводит к новому качеству
9.2. Электронное и пространственное строение карбоксильной группы
Слайд 18Характеристика реакционной способности карбоновых кислот:
•У карбоновых кислот повышены основные свойства атома
кислорода по сравнению с оксосоединениями;
•За счет р,π-сопряжения в кар-боксильной группе кислотность по сравнению со спиртами сильно повышена;
•За счет р,π-сопряжения в кар-боксильной группе кислотность по сравнению со спиртами сильно повышена;
Слайд 19 •У карбоновых кислот частичный положительный заряд на карбоксильном атоме
углерода меньше, чем в оксосоединениях, т.е. кислоты менее активны к восприятию атаки нуклеофильным реагентом, поэтому для кислот характерны реакции SN, а не AN, как для оксосоединений
Слайд 20• За счет одновременного наличия и кислотных и основных центров, карбоновые
кислоты способны к ассоциации,существуют в виде димеров
Слайд 21
Реакционная способность производных карбоновых кислот в реакциях SN
Уменьшение реакционной способности
Слайд 229.3 Реакции нуклеофильного замещения (SN), их роль
Реакции SN характерны для карбоновых
кислот и их функциональных производных, что обусловлено полярностью связи С - Х Х - ОН; -Наl; ОR; -OCOR; -NH2
Слайд 24 Реакция протекает при наличии сильного нуклеофила Y- и хорошо уходящей
группы Х- Увеличение реакционной способности карбоновых кислот в SN реакциях осуществляется путем повышения электрофильности атома углерода карбоксильной группы, что достигается либо использованием кислотного катализа, либо введением в карбоксильную группу более сильных электроноакцепторов, чем ОН-группа, например галогена
Слайд 31Реакция этерификации протекает в присутствии минеральных кислот, т.к. спирт является слабым
нуклеофилом. Все стадии обратимы, поэтому образующиеся сложные эфиры являются нестойкими соединениями и гидролизуются в кислой среде
Слайд 35В щелочной среде гидролиз необратим, причиной этого является образование в щелочной
среде стабильного ацилат-иона
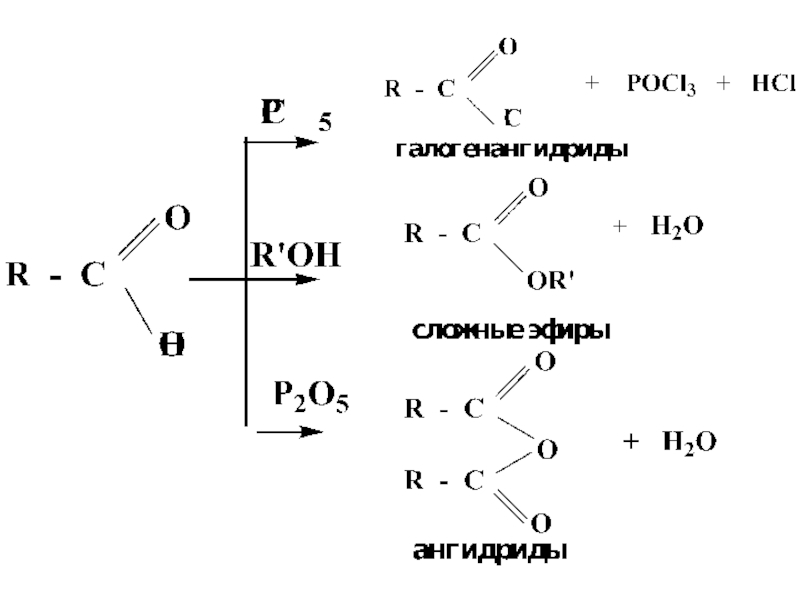
Слайд 38 Для практического получения сложных эфиров обычно используют реакцию ацилирования спиртов
галогенангидридами или ангидридами кислот, при этом выход эфиров составляет от 60 до 80 % ( в отличие от ацилирования кислотами, где выход составляет приблизительно 30 – 40 %)
Слайд 39Сложными эфирами являются жиры и липиды, в образовании которых принимают участие
многоатомные спирты и
ВЖК
Слайд 41 Многие лекарственные препараты являются сложными эфирами. Поэтому всегда следует учитывать
возможность их гидролиза в кислой среде желудка и щелочной – кишечника
Слайд 43Аспирин использовали при лечении зубной, головной боли и артритов на протяжении
100 лет. Но только в 1969 Джон Вейн пояснил механизм его действия
Слайд 45Сложные тиоэфиры наряду со сложными эфирами
являются наиболее распространенными в природе производными карбоновых кислот. В организме таким представителем биологически-активных тиоэфиров является ацетил КоА
Слайд 47Таким образом осуществляется превращение холина в ацетилхолин – нейромедиатор, посредник при
передаче нервного импульса
Слайд 50При передаче нервного импульса ацетилхолин синтезируется в окончаниях нервных волокон и
мигрирует к белковому рецептору следующей нервной клетки. Связывание ацетилхолина с белковым рецептором является причиной передачи сигнала далее, а ацетилхолин гидролизуется, оставляя клетку готовой для приема следующего сигнала
Слайд 51Схемы реакций декарбоксилирования
Реакции декарбоксилирования карбоновых кислот – энергетически выгодный процесс Декарбоксилирование
характерно для кислот у которых в α-положении имеется электроноакцепторный заместитель
Слайд 54При декарбоксилировании янтарной и глутаровой кислот происходит образование циклических ангидридов, что
обусловлено образованием пяти- или шестичленных гетероциклов, имеющих устойчивые конформации "полукресла” и “кресла”
Слайд 56В биологических системах реакции декарбоксилирования протекают с участием ферментов – декарбоксилаз
Декарбоксилирование аминокислот приводит к образованию биогенных аминов
Слайд 58 В насыщенных алифатических кислотах в результате ЭА-влияния карбоксильной группы появляется
СН - кислотный центр у α-углеродного атома