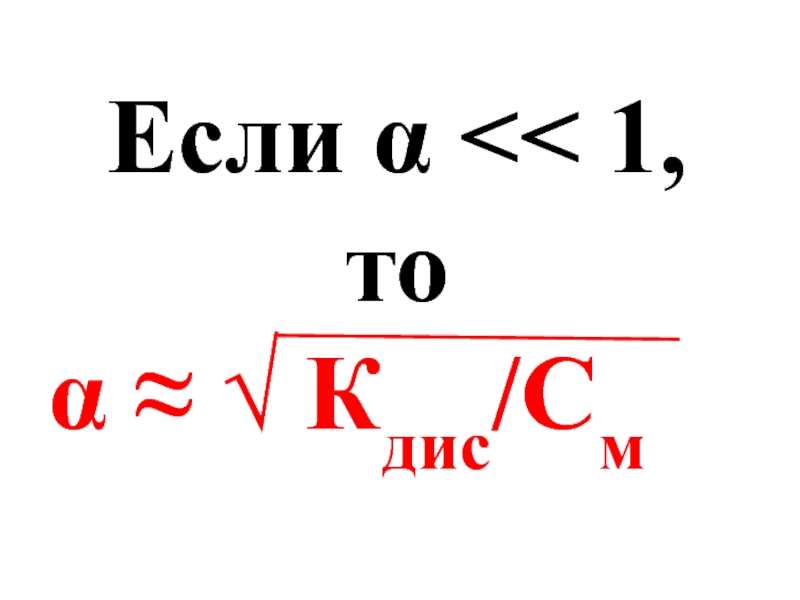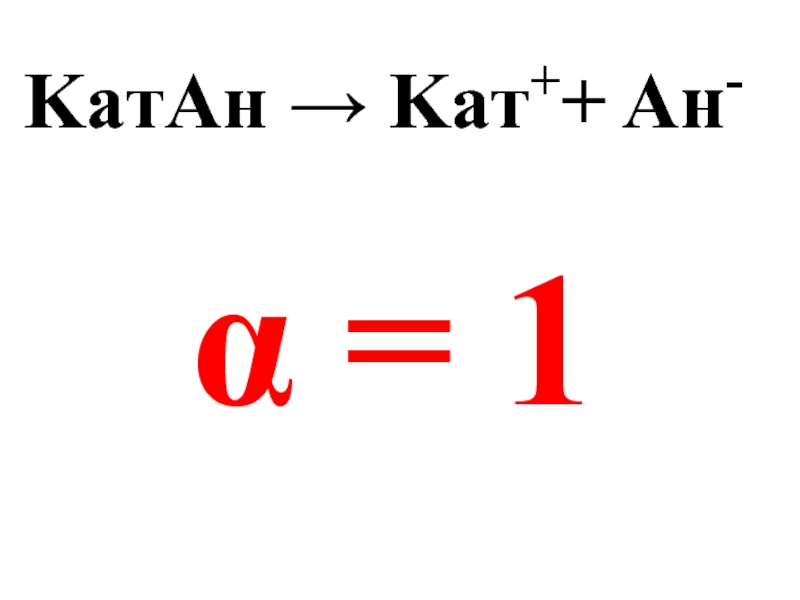- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 6. Растворы электролитов презентация
Содержание
- 1. Лекция 6. Растворы электролитов
- 2. План 6.1 Теория электролитической диссоциации С. Аррениуса
- 3. 6.1 Электролиты – это вещества, способные в
- 4. Самопроизвольный распад электролитов на ионы, протекающий под
- 5. Сванте Аррениус (1859-1927) Шведский физико-химик, основные работы
- 6. Основные положения теории С. Аррениуса
- 7. Степень диссоциации электролита (α) определяет электропроводность раствора:
- 8. 2. Осмотическое давление, температура кипения и плавления,
- 9. где n - число ионов, на которые
- 10. i – изотонический коэффициент (коэффициент Вант-Гоффа);
- 11. 3. Электролиты, в зависимости от степени их диссоциации, делятся на сильные и слабые.
- 12. Однако это деление условно, т.к. одно и
- 13. NaCl в воде – сильный электролит, NaCl
- 14. Современные воззрения на процесс электролитической диссоциации объединяют
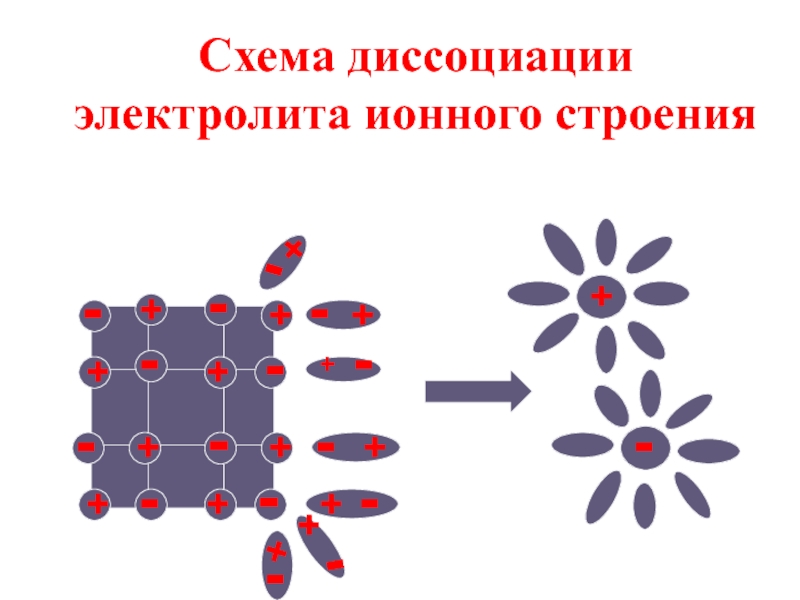
- 15. Схема диссоциации электролита ионного строения
- 16. Экспериментальным путем определяются числа гидратации, показывающие, сколько
- 17. Роль растворителя в процессе диссоциации описывается законом
- 18. где F – сила электростатического притяжения ионов,
- 19. ε – диэлектрическая постоянная растворителя, показывающая
- 20. ε(H2O)~81; ε(C2H5OH) ~ 24, для большинства орг. растворителей ε = 2-2,5.
- 21. В воде сила взаимодействия между ионами понижается
- 22. Вода является лучшей средой для диссоциации электролитов.
- 23. 6.2.1 Теория слабых электролитов К
- 24. К ним относятся: а) почти все
- 25. В растворах слабых электролитов устанавливается равновесие между
- 26. Данные равновесия описываются с помощью констант равновесия, называемых константами диссоциации (Кдис).
- 27. К дис = [Кaт]×[Aн] ____________ [KaтAн]
- 28. Частными случаями Кдис являются: константы
- 29. Слабые электролиты подчиняются закону разбавления Оствальда, получившего
- 30. При разбавление раствора водой степень электролитической диссоциации
- 31. Если α
- 32. 6.2.2 Теория сильных электролитов Дебая-Гюккеля (1923) Сильными
- 33. К сильным электролитам относятся: Некоторые неорганические кислоты:
- 34. KaтAн → Kaт++ Aн- α = 1
- 35. Из-за высокой концентрации ионов в растворе сильного
- 36. Пример. Рассчитайте ионную силу 0,1 М раствора
- 37. В растворе сильного электролита вокруг каждого иона
- 38. Во внешнем электрическом поле ион и его
- 39. Из-за уменьшения электропроводности, вызванной взаимным торможением ионов,
- 40. а = γ См где γ –
- 41. В растворах сильных электролитов ионы проявляют свои
- 42. 6.3 Растворы электролитов являются проводниками второго рода;
- 43. Электропроводность растворов при постоянной температуре
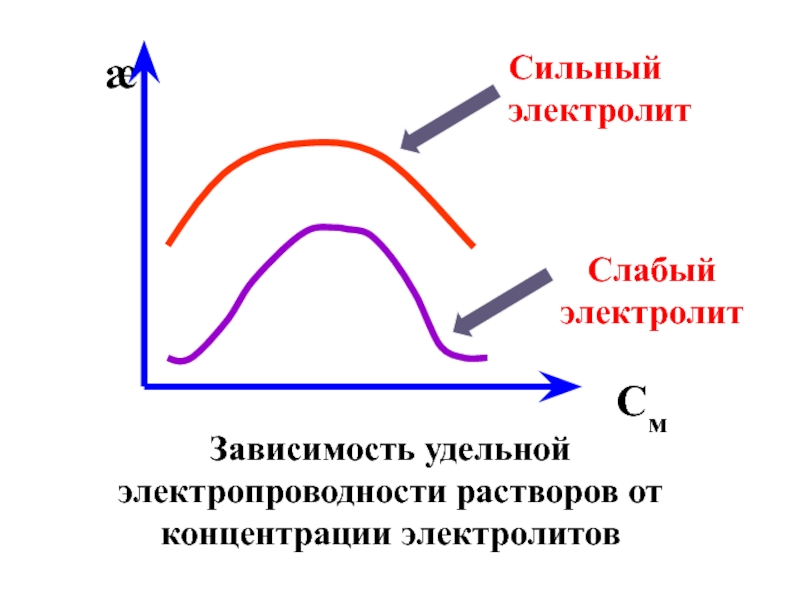
- 44. Зависимость удельной электропроводности растворов от концентрации электролитов См Сильный электролит Слабый электролит
- 45. В области разбавленных растворов
- 46. Для слабых электролитов данная зависимость обусловлена уменьшением
- 47. Органы и ткани организма электропроводны, т.к. содержат
- 48. Удельная электропроводность биологических тканей организма (370С)
- 49. При заболеваниях почек удельная электропроводность мочи может
- 50. При диабете электропроводность мочи также уменьшается из-за повышенного содержания сахара, являющегося неэлектролитом.
- 51. Электрическая проводимость тканей лежит в основе таких физиотерапевтических методов лечения как ионофорез, электростимуляция, ультравысокочастотная терапия.
- 52. Для физико-химических исследований широко применяется молярная электропроводность растворов (λ): λ = æ ____________________ См
- 53. λ = α (U+ + U-) При
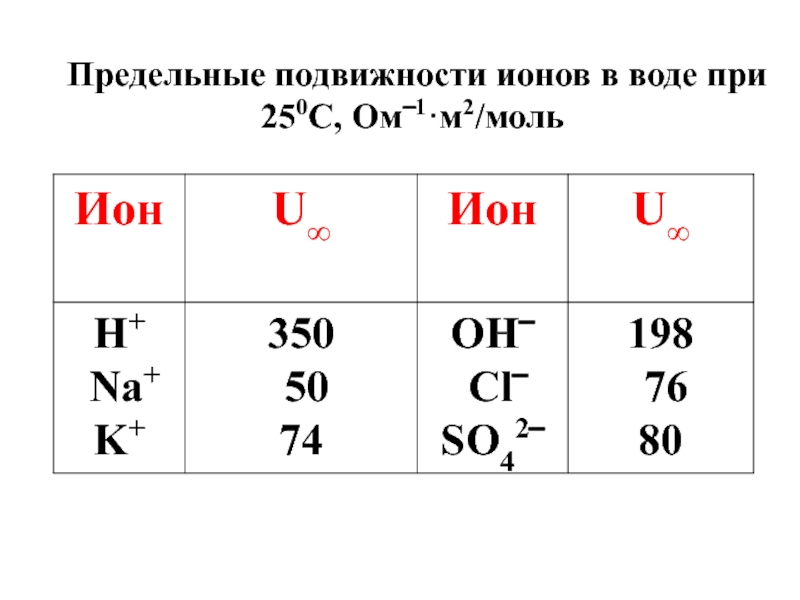
- 54. Предельные подвижности ионов в воде при 250С, Ом‾1·м2/моль
- 55. По данным электропроводности можно определить степень диссоциации
- 56. 6.4 Электролиты играют важную роль в жизнедеятельности
- 57. Общее содержание анионов в плазме ~154 ммоль/л.
- 58. Ионная сила плазмы крови составляет ~0,15 моль/л.
- 59. а) удерживают воду в виде гидратов; б)
- 60. в) влияют на растворимость газов, а также белков, аминокислот и других органических соединений.
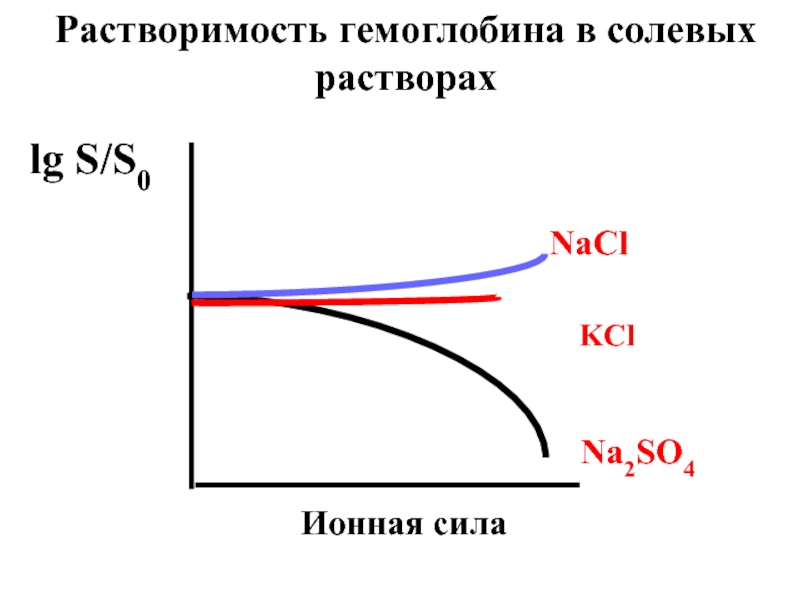
- 61. В разбавленных растворах наблюдается солевой эффект
- 62. В концентрированных растворах имеет место эффект
- 63. NaCl KCl Na2SO4 Ионная сила lg S/S0 Растворимость гемоглобина в солевых растворах
- 64. Благодарим за внимание!!!
Слайд 2План
6.1 Теория электролитической диссоциации С. Аррениуса
6.2 Теории слабых и сильных
6.3 Электропроводность растворов электролитов
6.4 Роль электролитов в жизнедеятельности организма
Слайд 36.1 Электролиты – это вещества, способные в растворах и расплавах диссоциировать
Слайд 4Самопроизвольный распад электролитов на ионы, протекающий под воздействием растворителя, называется электролитической
Слайд 5Сванте Аррениус (1859-1927)
Шведский физико-химик, основные работы которого посвящены учению о растворах
Слайд 6Основные положения теории
С. Аррениуса
1. В растворах электролитов происходит самопроизвольный распад
Слайд 7Степень диссоциации электролита (α) определяет электропроводность раствора:
число молекул, распавшихся на ионы
α
общее число молекул растворенного
вещества
Слайд 82. Осмотическое давление, температура кипения и плавления, а также другие свойства
α =
Слайд 9где n - число ионов, на которые распадается молекула электролита:
NaCl
Na2SO4 n = 3
Na3PO4 n = 4
Слайд 10i – изотонический коэффициент (коэффициент Вант-Гоффа);
в бесконечно разбавленных растворах если α →1, то i → n
Слайд 12Однако это деление условно, т.к. одно и тоже вещество, в зависимости
Слайд 13NaCl в воде – сильный электролит,
NaCl в бензоле – слабый электролит
В
Слайд 14Современные воззрения на процесс электролитической диссоциации объединяют идеи Аррениуса и учение
Слайд 16Экспериментальным путем определяются числа гидратации, показывающие, сколько молекул воды связано с
H+ Li+ Na+ NH4+ K+ Rb+ Cs+
1 120 66 17 16 14 13
Слайд 18где F – сила электростатического притяжения ионов,
q1 и q2 – заряды
r – расстояние между ними,
Слайд 19 ε – диэлектрическая постоянная растворителя, показывающая во сколько раз взаимодействие
Слайд 21В воде сила взаимодействия между ионами понижается в 80 раз, и
Слайд 236.2.1 Теория слабых электролитов
К слабым электролитам относятся ковалентные соединения, обратимо
Слайд 24К ним относятся:
а) почти все органические и многие неорганические кислоты:
б)труднорастворимыи основания, а также NH4OH
в) некоторые соли HgCl2, Fe(CNS)3;
г) вода.
Слайд 25В растворах слабых электролитов устанавливается равновесие между молекулами веществ и их
α < 1
Слайд 26
Данные равновесия описываются с помощью констант равновесия, называемых константами диссоциации (Кдис).
Слайд 28Частными случаями Кдис являются:
константы кислотности Ка,
константы основности Кb,
константы
Слайд 29Слабые электролиты подчиняются закону разбавления Оствальда, получившего Нобелевскую премию в 1909
Ф.В.Оствальд (1853-1932)
Слайд 30При разбавление раствора водой степень электролитической диссоциации электролита увеличивается :
α2
Кдис =
×См
Слайд 326.2.2 Теория сильных электролитов Дебая-Гюккеля (1923)
Сильными электролитами называются соединения с ионным
Слайд 33К сильным электролитам относятся:
Некоторые неорганические кислоты: HCl, HClO4, HNO3, H2SO4 и
Щелочи: NaOH, KOH, Ba(OH)2, Ca(OH)2 и др.,
Соли
Слайд 35Из-за высокой концентрации ионов в растворе сильного электролита создается собственное электромагнитное
I =
Слайд 36Пример. Рассчитайте ионную силу 0,1 М раствора азотной кислоты
HNO3 → H+
= 0,1M
I =
I (HNO3) =
0,1M
0,1M
0,1M
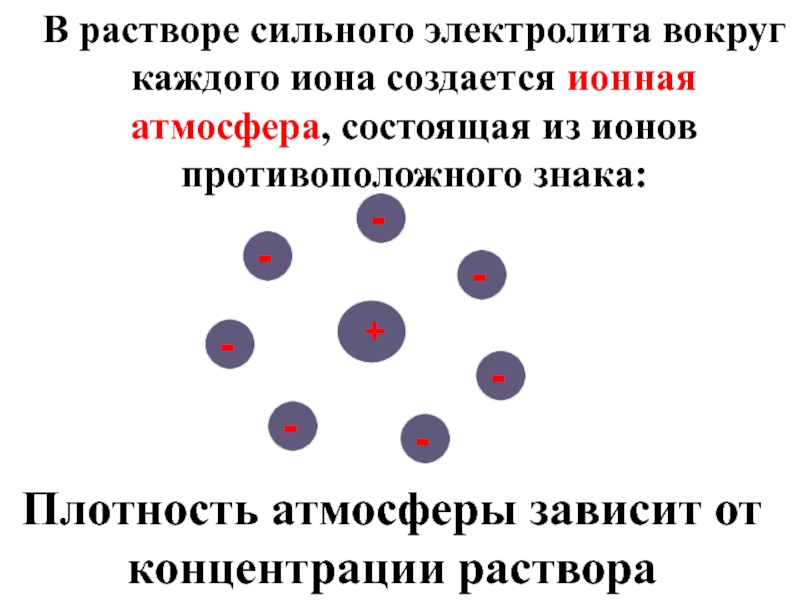
Слайд 37В растворе сильного электролита вокруг каждого иона создается ионная атмосфера, состоящая
+
-
-
-
-
-
-
-
Плотность атмосферы зависит от концентрации раствора
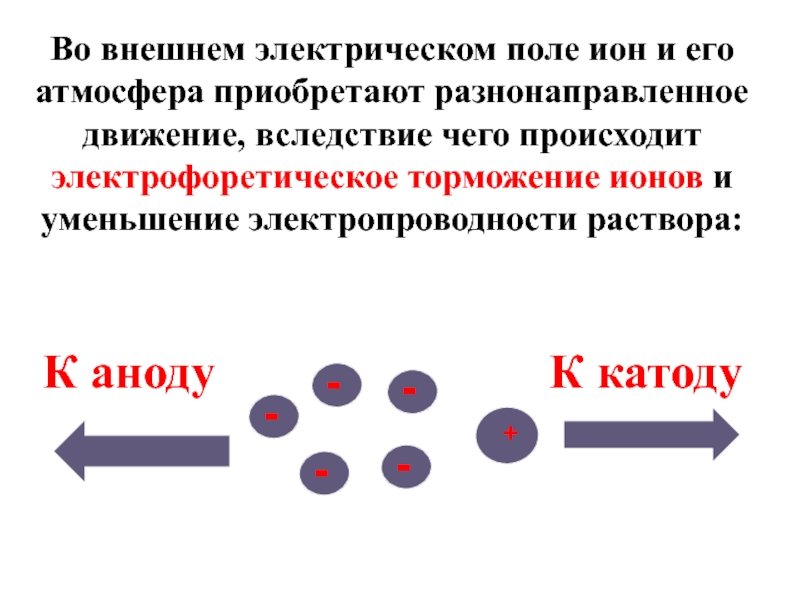
Слайд 38Во внешнем электрическом поле ион и его атмосфера приобретают разнонаправленное движение,
+
-
-
-
-
-
К катоду
К аноду
Слайд 39Из-за уменьшения электропроводности, вызванной взаимным торможением ионов, создается впечатление, что концентрация
Слайд 40а = γ См
где γ – коэффициент активности иона, характеризующий отклонение
Слайд 41В растворах сильных электролитов ионы проявляют свои свойства не в соответствии
Слайд 426.3 Растворы электролитов являются проводниками второго рода; тип проводимости ионный.
Если в
Слайд 43 Электропроводность растворов при постоянной температуре зависит от количества ионов
æ = α См ( U+ + U- ),
где æ – удельная электропроводность, Ом‾1 · м‾1.
Слайд 44Зависимость удельной электропроводности растворов от концентрации электролитов
См
Сильный электролит
Слабый электролит
Слайд 45 В области разбавленных растворов рост концентрации приводит к
Слайд 46Для слабых электролитов данная зависимость обусловлена уменьшением степени диссоциации (закон Оствальда);
Слайд 47Органы и ткани организма электропроводны, т.к. содержат растворенные электролиты. Изменение проводимости
Слайд 49При заболеваниях почек удельная электропроводность мочи может уменьшаться до 0,9 -1,4
Слайд 50При диабете электропроводность мочи также уменьшается из-за повышенного содержания сахара, являющегося
Слайд 51Электрическая проводимость тканей лежит в основе таких физиотерапевтических методов лечения как
Слайд 52Для физико-химических исследований широко применяется молярная электропроводность растворов (λ):
λ =
æ
____________________
См
Слайд 53λ = α (U+ + U-)
При бесконечно большом разбавлении раствора α
λ∞ = U∞+ + U∞-
где ∞ – знак бесконечного большого разбавления раствора.
Слайд 55По данным электропроводности можно определить степень диссоциации электролитов (α) и растворимость
λ æ – æ(H2O)
α = ----; S = ---------
λ∞ λ∞
Слайд 566.4 Электролиты играют важную роль в жизнедеятельности организма. Общее содержание катионов
Слайд 57Общее содержание анионов в плазме ~154 ммоль/л.
Слайд 58Ионная сила плазмы крови составляет ~0,15 моль/л. Каждый ион выполняет свои
Слайд 59а) удерживают воду в виде гидратов;
б) создают осмотическое давление биологических жидкостей.
Электролиты в организме:

























![К дис = [Кaт]×[Aн]____________[KaтAн]](/img/tmb/4/321573/c3bc2e969a22ae10dfa1232a794677f7-800x.jpg)