- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 4. Физико-химические свойства растворов презентация
Содержание
- 1. Лекция 4. Физико-химические свойства растворов
- 2. План 4.1 Растворы и их классификация.
- 3. 4.1 Растворы - это гомогенные устойчивые системы
- 4. С точки зрения термодинамики все компоненты
- 5. Если нельзя определить растворитель по этому признаку,
- 6. а) по агрегатному состоянию Газообразные :воздух, смесь
- 7. б) по размеру частиц растворенного вещества
- 8. 1) жизнь зародилась в мировом океане; современные
- 10. 2) усвоение питательных веществ и лекарственных препаратов
- 11. Вода - самое распространенное на земле
- 12. Содержание воды в организме: а)новорожденного 80%; б) мужчины 60%; в) женщины 55%.
- 13. Содержание воды в органах и тканях
- 14. Вода in vivo делится на два бассейна:
- 15. Потеря 2/3 объема внеклеточной жидкости смертельно опасна.
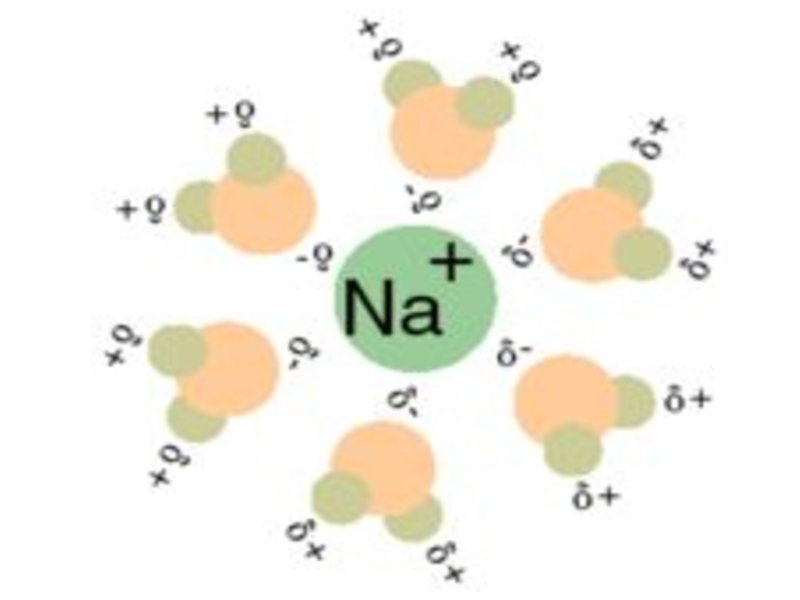
- 16. Вода, благодаря своим уникальным физико-химическим свойствам, выполняет многочисленные функции в организме человека
- 17. а) ее высокая полярность (молекулы воды являются
- 18. б) ее высокая теплоемкость обеспечивает температурный гомеостаз
- 19. г)способность воды диссоциировать на ионы позволяет ей
- 20. е) вода влияет на активность ферментов, регулируя скорость биохимических реакций.
- 21. Растворение - это самопроизвольный
- 22. Стадия атомизации- разрушение кристаллической решетки растворяемого о вещества; процесс эндотермический (ΔатН>О);
- 23. 2)стадия сольватации (гидратации) - образование сольватных (гидратных)
- 25. 3)стадия диффузии - равномерное распределение растворенного вещества
- 26. Таким образом, теплота растворения (ΔрН) является величиной
- 27. При растворении большинства твердых веществ ΔpH >
- 28. При растворении газов ΔpH < 0, т.к.
- 29. При растворении жидкостей друг в друге ΔpH
- 30. Как любой обратимый процесс, растворение доходит до
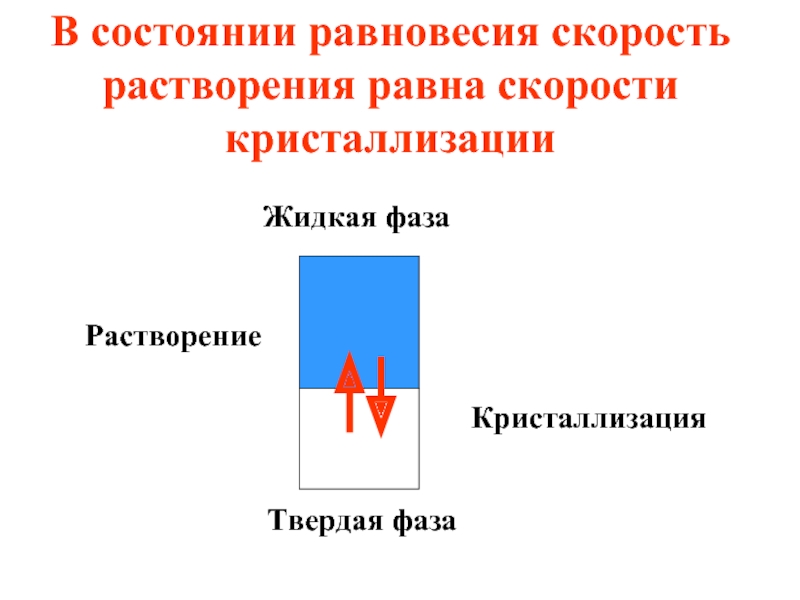
- 31. В состоянии равновесия скорость растворения равна скорости
- 32. Растворы Ненасыщенные: содержат меньше растворенного вещества, чем
- 33. 4.3 Растворимость (S) - это способность вещества
- 34. Растворимость зависит от природы веществ и термодинамических параметров системы. Факторы, влияющие на растворимость
- 35. Влияние природы веществ на растворимость описывается правилом: «Подобное растворяется в подобном».
- 36. Другими словами, полярные вещества хорошо растворяются в
- 37. Растворение газов в воде можно представить схемой: А(г) + Н2О ⇄ А(р-р) ΔрН
- 38. а) В соответствии с принципом Ле Шателье
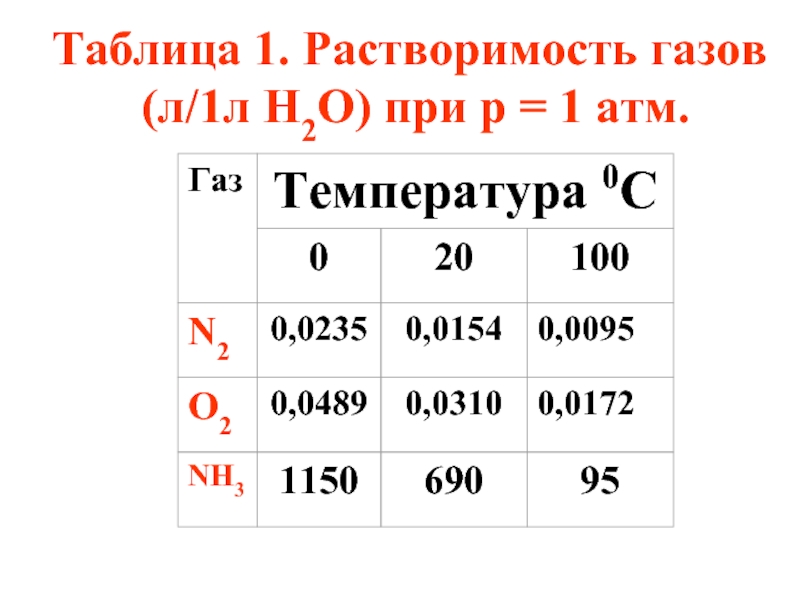
- 39. Таблица 1. Растворимость газов (л/1л Н2О) при р = 1 атм.
- 40. б) В соответствии с принципом Ле Шателье
- 41. Зависимость растворимости газа от давления описывается уравнением
- 42. Закон Генри позволяет вскрыть причины возникновения кессонной болезни.
- 43. Она возникает у водолазов, летчиков и представителей
- 44. В период пребывания человека в среде с
- 45. При быстром переходе человека в среду
- 46. Это приводит к закупорке и разрыву кровеносных
- 47. Симптомы: головокружение, зуд, мышечные и загрудинные боли, нарушение дыхания, паралич и смерть.
- 48. 29 июня 1971 от кессонной болезни погибли трое советских космонавтов, возвращающихся на Землю.
- 49. в) На растворимость газов влияет присутствие электролитов
- 50. Чем выше концентрация электролита в растворе, тем
- 51. Таблица 2. Растворимость газов в чистой воде и плазме крови при 38 0С
- 52. Растворение жидкости в воде можно представить схемой: А(ж) + Н2О ⇄ А(р-р)
- 53. Основной стадией растворения жидкости в жидкости является диффузия, скорость которой возрастает с увеличением температуры.
- 54. Соответственно, взаимная растворимость жидкостей усиливается с ростом температуры.
- 55. Различают три типа жидкостей: а)неограниченно растворимые друг
- 56. Если в систему из двух несмешивающихся жидкостей
- 57. Закон Нернста- Шилова Фаза 1
- 58. Закон Нернста-Шилова – теоретическая основа экстракции- одного из способов разделения смесей.
- 59. Растворение твердых веществ описывается схемой: А(к)
- 60. Гетерогенное равновесие между труднорастворимым электролитом (солью, основанием
- 61. Данное равновесие характеризуется при помощи константы растворимости
- 62. Для бинарных электролитов n = m
- 63. Например: BaSO4 (к) ⇄ Ba2+(aq)
- 64. Чем меньше Ks, тем ниже растворимость вещества и легче формируется осадок труднорастворимого электролита.
- 65. Осадок выпадает из насыщенных и пересыщенных растворов.
- 66. Одним из наиболее важных гетерогенных процессов in vivo является образование костной ткани.
- 67. Основным минеральным компонентом костной ткани является кальций
- 68. Формирование костной ткани В
- 69. КS (CаНРО4) = 2,7∙10–7,
- 70. 3СаНРО4 + Са2+ + 2ОН– ⇄
- 71. При избытке ионов Са2+ в
- 72. При недостатке Са2+ равновесие сдвигается влево, происходит
- 73. У больного остеопорозом позвонки деформированы и истончены
- 74. При недостатке кальция в костной ткани его
- 75. При попадании радиоизотопа Sr-90 в
- 76. Благодарим за внимание!!!
Слайд 2План
4.1 Растворы и их классификация.
4.2 Термодинамика растворения.
4.3 Растворимость газов, жидкостей
Слайд 34.1 Растворы - это гомогенные устойчивые системы переменного состава, состоящие минимум
Слайд 4
С точки зрения термодинамики все компоненты раствора равноценны;
Слайд 5Если нельзя определить растворитель по этому признаку,
Слайд 6а) по агрегатному состоянию
Газообразные :воздух, смесь О2 и СО2 (карбоген) для
Жидкие: биологические жидкости человека;
Твердые : сплавы металлов, растворы H2 в платиновых металлах
Классификация растворов
Слайд 7б) по размеру частиц растворенного вещества
Истинные (молекулярные) α < 10-9 м,
Коллоидные
Грубодисперсные α >10-7 м
где α - диаметр частицы растворенного вещества , м
Слайд 81) жизнь зародилась в мировом океане; современные животные и человек унаследовали
Растворы играют важнейшую роль в биосфере:
Слайд 102) усвоение питательных веществ и лекарственных препаратов происходит в растворенном виде;
3)
Слайд 11 Вода - самое распространенное на земле вещество. Общий объем воды
Считают, что большая часть воды имеет биогенное происхождение, т.е. проходит через метаболические превращения организмов.
Суточное потребление воды ~ 2л.
Слайд 13
Содержание воды в органах и тканях человека:
а) в печени 96%
б) в
в) в крови и почках 83%
г) в тканях мозга и мышечной ткани 75%
д)в костях 22%.
Слайд 14Вода in vivo делится на два бассейна:
внеклеточная жидкость
а) интерстициальная
б) внутрисосудистая (плазма крови)
в) трансцеллюлярная жидкость (в полых формах ЖКТ)
внутриклеточная
Слайд 15Потеря 2/3 объема внеклеточной жидкости смертельно опасна. Избыток воды также опасен
Слайд 16Вода, благодаря своим уникальным физико-химическим свойствам, выполняет многочисленные функции в организме
Слайд 17а) ее высокая полярность (молекулы воды являются диполями) делает воду одним
Слайд 18б) ее высокая теплоемкость обеспечивает температурный гомеостаз организма;
в) большая теплота испарения
Слайд 19г)способность воды диссоциировать на ионы позволяет ей участвовать в кислотно-основном равновесии;
д)
Слайд 21Растворение - это самопроизвольный обратимый физико-химический процесс, включающий
4.2 Термодинамика растворения
Слайд 22Стадия атомизации- разрушение кристаллической решетки растворяемого о вещества; процесс эндотермический
Слайд 232)стадия сольватации (гидратации) - образование сольватных (гидратных) оболочек вокруг частиц растворенного
Слайд 253)стадия диффузии - равномерное распределение растворенного вещества по всему объему раствора,
(Δдиф Н ≈ О).
Слайд 26Таким образом, теплота растворения (ΔрН) является величиной интегральной:
ΔpH = ΔатН
ΔpH - тепловой эффект растворения 1 моль вещества в бесконечно большом объеме растворителя.
Слайд 27При растворении большинства твердых веществ ΔpH > 0, т.к. теплота, поглощаемая
Слайд 28При растворении газов ΔpH < 0, т.к. при их растворении атомизация
Слайд 29При растворении жидкостей друг в друге ΔpH ≈ 0, т.к. главной
Слайд 30Как любой обратимый процесс, растворение доходит до равновесия. Раствор, находящийся в
Слайд 31В состоянии равновесия скорость растворения равна скорости кристаллизации
Жидкая фаза
Твердая фаза
Растворение
Кристаллизация
Слайд 32Растворы
Ненасыщенные: содержат меньше растворенного вещества, чем насыщенные
Насыщенные
Пересыщенные: содержат больше растворенного вещества,
Слайд 334.3 Растворимость (S) - это способность вещества растворяться в данном растворители.
Слайд 34Растворимость зависит от природы веществ и термодинамических параметров системы.
Факторы, влияющие на
Слайд 35Влияние природы веществ на растворимость описывается правилом: «Подобное растворяется в подобном».
Слайд 36Другими словами, полярные вещества хорошо растворяются в полярных растворителях, а неполярные
Например: NaCl хорошо растворим в воде и плохо в бензоле; I2 хорошо растворим в бензоле и плохо в воде.
Слайд 38а) В соответствии с принципом Ле Шателье при повышении температуры равновесие
Слайд 40б) В соответствии с принципом Ле Шателье при увеличении давления равновесие
Слайд 41Зависимость растворимости газа от давления описывается уравнением Генри (1803 г.):
S =
где k - константа Генри, p – давление газа над раствором.
Слайд 43Она возникает у водолазов, летчиков и представителей других профессий, которые по
Слайд 44В период пребывания человека в среде с высоким давлением его кровь
Слайд 45 При быстром переходе человека в среду с низким давлением происходит
Слайд 46Это приводит к закупорке и разрыву кровеносных капилляров, накоплению пузырьков газа
Слайд 47Симптомы: головокружение, зуд, мышечные и загрудинные боли, нарушение дыхания, паралич и
Слайд 4829 июня 1971 от кессонной болезни погибли трое советских космонавтов,
Слайд 49в) На растворимость газов влияет присутствие электролитов в растворе. Эта зависимость
S = S0 e-kc
где S и S0 - растворимость газа в растворе электролита и чистой воде, с - концентрация электролита, k - константа Сеченова
Слайд 50Чем выше концентрация электролита в растворе, тем ниже растворимость газов. Вот
Слайд 53Основной стадией растворения жидкости в жидкости является диффузия, скорость которой возрастает
Слайд 55Различают три типа жидкостей:
а)неограниченно растворимые друг в друге: Н2SO4/Н2О, С2Н5ОН/Н2О;
б) ограниченно
в) абсолютно нерастворимые: Hg/H2O.
Слайд 56Если в систему из двух несмешивающихся жидкостей добавить третий компонент, то
Слайд 58
Закон Нернста-Шилова – теоретическая основа экстракции- одного из способов разделения смесей.
Слайд 60Гетерогенное равновесие между труднорастворимым электролитом (солью, основанием или кислотой) и его
AnBm (к) ⇄ nA+(aq) + mB-(aq).
Слайд 61Данное равновесие характеризуется при помощи константы растворимости Ks, являющейся константой гетерогенного
Ks = [A+]n × [B-]m
Слайд 63Например:
BaSO4 (к) ⇄ Ba2+(aq) + SO42-(aq)
KS = [Ba 2+][SO42-] =
S = √ 1,1×10-10 = 1,05 ×10-5 M.
Слайд 64Чем меньше Ks, тем ниже растворимость вещества и легче формируется осадок
Слайд 65Осадок выпадает из насыщенных и пересыщенных растворов.
В насыщенном растворе
[A+]× [B-] = Ks
В пересыщенном растворе
[A+] ×[B-] > Ks
Условия образования осадка труднорастворимых электролитов
Слайд 66 Одним из наиболее важных гетерогенных процессов in vivo является образование
Слайд 67Основным минеральным компонентом костной ткани является кальций гидроксофосфат
Слайд 68Формирование костной ткани
В крови при рН= 7,4 в приблизительно
Слайд 69КS (CаНРО4) = 2,7∙10–7,
КS (Cа(Н2РО4)2) =1∙10–3
вследствие чего
Са 2+ + НРО4 2– ⇄ СаНРО4
Формирование костной ткани
Слайд 70
3СаНРО4 + Са2+ + 2ОН– ⇄
⇄ Са4Н(РО4)3 + 2Н2О
Са4Н(РО4)3 +
⇄ Са5(РО4)3ОН + Н2О
КS (Са5(РО4)3ОН) = 10 -58
Формирование костной ткани





















































![Закон Нернста- ШиловаФаза 1Фаза2[A][A]'[A]'[A]= KK – константа распределения](/img/tmb/1/3300/39b295f04ea911354bd81236b5d6f242-800x.jpg)

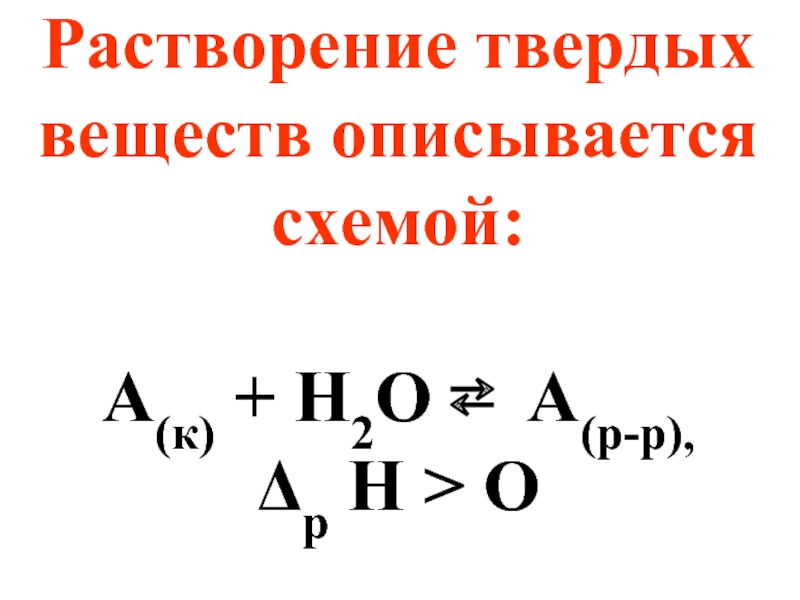

![Данное равновесие характеризуется при помощи константы растворимости Ks, являющейся константой гетерогенного равновесия :Ks = [A+]n](/img/tmb/1/3300/65bffc44b58c0b59e21b72f560b6ab78-800x.jpg)
![Для бинарных электролитов n = m = 1, Ks = [A+] × [B-]соответственно S2 =Кs](/img/tmb/1/3300/a91d5328616e7b89ad20cea11ba1717a-800x.jpg)
![Например: BaSO4 (к) ⇄ Ba2+(aq) + SO42-(aq)KS = [Ba 2+][SO42-] = 1,1×10-10,S = √ 1,1×10-10](/img/tmb/1/3300/82ec1395a8145a3acf9c999caf01a5a1-800x.jpg)

![Осадок выпадает из насыщенных и пересыщенных растворов. В насыщенном растворе [A+]× [B-] = KsВ пересыщенном](/img/tmb/1/3300/683ed69dab6dfba4c84745ee6c9bd014-800x.jpg)
















