- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
лекция 2 презентация
Содержание
- 1. лекция 2
- 2. ПРЕПАРАТЫ СОЕДИНЕНИЙ МАГНИЯ МАГНИЯ ОКСИД MgO
- 3. ПРЕПАРАТЫ СОЕДИНЕНИЙ КАЛЬЦИЯ Кальцит (мнл, известняк, мрамор)
- 4. р-элементы, VII группа Природные материалы йода –
- 5. КИСЛОТА ХЛОРИСТОВОДОРОДНАЯ HCl NaCl↔Na+ + Cl─
- 6. ПРЕПАРАТЫ ГАЛОГЕНИДОВ НАТРИЯ ХЛОРИД – это единственный
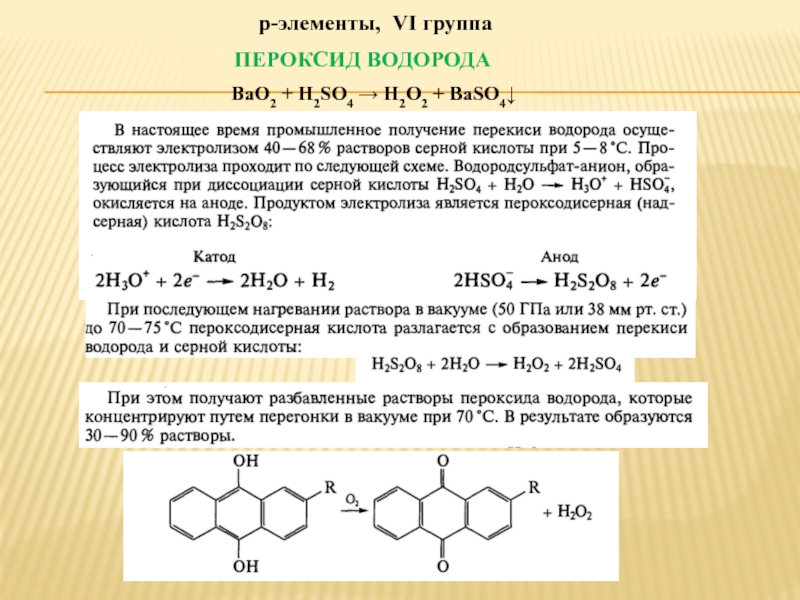
- 7. р-элементы, VI группа ПЕРОКСИД ВОДОРОДА BaO2 + H2SO4 → H2O2 + BaSO4↓
- 8. ПЕРЕКИСЬ МАГНИЯ MgO2 ·MgO 7-8◦C 500◦C СO(NH2)2
- 9. Препараты элементов VА группы Натрия нитрит NO
- 10. ПРЕПАРАТЫ СОЕДИНЕНИЙ ВИСМУТА ВИСМУТА НИТРАТ ОСНОВНОЙ
- 11. р-элементы, IV группа АКТИВИРОВАННЫЙ УГОЛЬ Carbo activatus
- 12. р-элементы, III группа Препараты соединений БОРА
- 13. d-элементы, II группа Препараты соединений цинка Сфалерит
- 14. d-элементы, I группа ПРЕПАРАТЫ СОЕДИНЕНИЙ МЕДИ Медный
- 15. d-элементы, VIII группа ПРЕПАРАТЫ СОЕДИНЕНИЙ ЖЕЛЕЗА Магнитный
Слайд 2ПРЕПАРАТЫ СОЕДИНЕНИЙ МАГНИЯ
МАГНИЯ ОКСИД MgO
Магнезит MgCO3, доломит MgCa(CO3)2, кизерит MgSO4·H2O,
эпсомит
MgCl2 + 2Са(OH)2 → СаCl2 + 2 Mg (OH)2
Mg(OH)2 → MgO + H2O
Mg(OH)2+ 2CO2 → Mg(НCO3)2
4Mg(НCO3)2 → 3MgCO3·Mg(OH)2·3H2O + 5CO2
4MgSO4+ 4Na2CO3+4H2O → 3MgCO3·Mg(OH)2·3H2O + 4 Na2SO4+ CO2
5MgCO3·2Mg(OH)2·7H2O → 7MgO + 5CO2 + 9H2O
3MgCO3·Mg(OH)2·3H2O → 4MgO + 3CO2 + 4H2O
MgCl2 + H2O → MgO + 2 HCl
MgCO3+ H2SO4 → MgSO4 + CO2 + H2O
s-элементы, II группа
500◦C
45-50◦C
70-80◦C
300◦C
900◦C
МАГНИЯ СУЛЬФАТ MgSO4
Magnesium oxydatum
мелкий легкий пушистый порошок
белого цвета. М.р. в воде, спирте. Р. в соляной, серной и уксусной кислотах.
Magnesium sulfas
Бесцветные призматические кристаллы, выветривающиеся на воздухе. Л.р.в воде, м.р.в спирте.
Слайд 3ПРЕПАРАТЫ СОЕДИНЕНИЙ КАЛЬЦИЯ
Кальцит (мнл, известняк, мрамор) СаCO3, ангидрит СаSO4,
гипс СаSO4·2H2O,
апатит Са5F(PO4 )3, плавиковый шпат CaF2
СаCO3 + 2HCl → CaCl2+ CO2 + H2O
2 FeCl3 + 3Са(OH)2 → 3СаCl2 + 2 Fe(OH)3
MgCl2+ Са(OH)2 → СаCl2 + Mg(OH)2
КАЛЬЦИЯ ХЛОРИД СаCl2·6H2O.
Барит (тяжелый шпат) ВаSO4 и Витерит ВаCO3
ПРЕПАРАТЫ СОЕДИНЕНИЙ БАРИЯ
БАРИЯ СУЛЬФАТ ВаSO4
ВаSO4 + 4С → BaS + 4CO
BaS +2HCl → BaCl2 + H2S
ВаCO3+2HCl → BaCl2 + H2О+ CO2
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Исходные растворы должны быть подогретыми и разбавленными.
Реакция проводится медленно. Раствор хлорида бария вливается в раствор сульфата натрия.
рН - нейтральная
прокаливание
Calcii chloridum
Бесцветные кристаллы без запаха, горько-соленого вкуса, очень гигроскопичные, расплываются на воздухе, переходя при 34°С в дигидрат.
Barii sulfas
Белый рыхлый тонкий порошок, без вкуса и запаха.
Слайд 4р-элементы, VII группа
Природные материалы йода – лаутарит Ca(IO3)2 и йодаргирит AgI,
ПРЕПАРАТЫ ЙОДА
2NaI + 2NaNO2 + 2H2SO4 → I2 + 2NO + 2H2O + 2Na2SO4
I2 +6 NaOH → 5NaI + NaIO3 + 3 H2O
I2 + Na2SO3+H2O → 2HI + Na2SO4
5NaI +Сl2 → I2 +2NaCl
Очистка буровых вод от примеси нефти и нафтеновых кислот, отстаивания от химических примесей, окисление йодид-ионов до свободного йода нитритом натрия в присутствии серной кислоты.
Iodum
Кристаллическое вещество серо-черного цвета с фиолетовым металлическим блеском.
Йодоформ Йодинол
Йодопирон
Слайд 5КИСЛОТА ХЛОРИСТОВОДОРОДНАЯ HCl
NaCl↔Na+ + Cl─
Катод:
2Na+ + 2e → 2Na
2Na
Анод:
2Cl─ - 2e → 2Cl
2Cl→Cl2
Суммарно:
NaCl + 2H2O → Cl2 + 2NaOH + H2
ИЗВЕСТЬ ХЛОРНАЯ
Реакцию проводят в особых полочных камерах при постоянном перемешивании, пропуская противотоком через тонкоизмельченный гидроксид кальция («пушонку») разбавленный воздухом газообразный хлор (30-60%) хлора. Насыщение хлором ведут до получения извести хлорной с содержанием активного хлора не менее 32%. Изб гидрокисда кальция делает ее боле устойчивой. Сушат ее при t 150-200◦С или под вакуумом 60-70◦С
Acidum hydrochloricum
Прозрачная , бесцветная летучая жидкость со своеобразным запахом.
Calcaria chlorata
Белый или слегка сероватый порошок с запахом хлора.
Слайд 6ПРЕПАРАТЫ ГАЛОГЕНИДОВ
НАТРИЯ ХЛОРИД – это единственный галогенид, который широко распространен в
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Na2HPO4 + BaCl2 → BaHPO4 + 2NaCl
MgCl2 + Na2CO3→ MgCO3 + 2NaCl
CaCl2 + Na2CO3→ CaCO3 + 2NaCl
BaCl2 + Na2CO3→ BaCO3 + 2NaCl
Na2CO3+HCl → CO2 +2NaCl+ H2O
Источники получения КАЛИЯ ХЛОРИДА – минералы сильвинит (KCl·NaCl) KCl·MgCl2·6H2O карналлит.
3Fe + 4Br2 → Fe3Br8 (FeBr2 ·2FeBr3)
Fe3Br8 + 4Na2CO3 + 4H2O → 8NaBr + 2Fe(OH)3 ↓+ 2Fe(OH)2 ↓+ 4CO2↑
3Fe + 4I2 → Fe3I8
Fe3I8 + 4Na2CO3 + 4H2O → 8NaI + 2Fe(OH)3 ↓+ 2Fe(OH)2 ↓+ 4CO2↑
Na2CO3 +2HCOONa + 2Br2 → 4NaBr + 2 CO2 + H2O
Natrii chloridum
Белые кристаллы или порошок без запаха, соленого вкуса.
Kalii chloridum
Бесцветные кристаллы или белый кристаллический порошок без запаха, соленого вкуса.
Natrii bromidi
Белые кристаллический порошок без запаха, соленого вкуса. Гигроскопичен.
Kalii bromidi
Бесцветные кристаллы или белый кристаллический порошок без запаха, соленого вкуса.
Слайд 8ПЕРЕКИСЬ МАГНИЯ MgO2 ·MgO
7-8◦C
500◦C
СO(NH2)2 + H2O2 → СO(NH2)2 · H2O2
ГИДРОПЕРИТ
MgO
2MgO + O2 → 2MgO2
НАТРИЯ ТИОСУЛЬФАТ
Впервые был получен в 1799 г кипячением смеси раствора сульфита натрия с серой:
Na2SO3 + S → Na2S2O3
2Na2S + 3SO2 → 2Na2S2O3 + S↓
2CaS2 + 3O2→ 2CaS2O3
CaS2O3 + Na2SO4→Na2S2O3 + CaSO4
Слайд 9Препараты элементов VА группы
Натрия нитрит
NO + NO2 + 2NaOH → 2
NaNO3 + Pb → PbO + NaNO2
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑
Natrii nitris
Б/цв или слегка желтоватые кристаллы, л.р. в воде, образуя растворы слабощелочной реакции. Препарат гигроскопичен
Слайд 10ПРЕПАРАТЫ СОЕДИНЕНИЙ ВИСМУТА
ВИСМУТА НИТРАТ ОСНОВНОЙ
Bismuthi subnitras – белый аморфный или
О=Bi─O─Bi
OH
NO3
4BiOCl + 2Na2CO3 + 3C → 4Bi + 4NaCl + 5CO2↑
Bi + 4HNO3 → 4Bi(NO3)3 +NO↑ + 2 H2O
4Bi(NO3)3 ·5H2O
2Bi(NO3)3+ 3H2O → 5HNO3 +
О=Bi─O─Bi
OH
NO3
BiONO3
Bi(OH)2(NO3)↓
Слайд 11р-элементы, IV группа
АКТИВИРОВАННЫЙ УГОЛЬ
Carbo activatus - легкий черный порошок высокой степени
НИТРИЯ ГИДРОКАРБОНАТ
Na2CO3·10H2O + CO2 → 2NaHCO3 + 9 H2O
Natrii hydrocarbonas - белый кристаллический порошок без запаха, солено-щелочного вкуса.
NH3+ H2O + CO2→ NH4HCO3
NH4HCO3 + NaCl → NH4Cl + NaHCO3
Слайд 12р-элементы, III группа
Препараты соединений БОРА
Бура или тинкал Na2B4O7·10H2O, кернит Na2B4O7·4H2O
B2O3·2MgO·H2O + 2H2SO4→ 2 Mg SO4 + 2H3BO3
Кислота борная и натрия тетраборат
100-110◦C
Na2B4O7·10H2O + 2HCl →4H3BO3 + 2NaCl + 5H2O
CaB4O7·4H2O + 2HCl+ H2O→4H3BO3 + CaCl2
4H3BO3 + Na2CO3 → Na2B4O7 + CO2 + 6H2O
CaB4O7 + Na2CO3 → Na2B4O7 + CaCO3↓
Слайд 13d-элементы, II группа
Препараты соединений цинка
Сфалерит (цинковая обманка) ZnS
Другие минералы считаются продуктами
Цинка оксид и цинка сульфат
Zn + H2SO4(разв) → ZnSO4 + H2↑
ZnO+ H2SO4 → ZnSO4 + H2O
5 ZnSO4 +5 Na2CO3 + 3H2O → 2ZnCO3·3Zn(OH)2 ↓ + 5 Na2SO4 + 3CO2↑
2ZnCO3·3Zn(OH)2 → 5ZnO + 2CO2↑+ 3H2O
300◦C
ZnCO3→ ZnO + CO2↑
Слайд 14d-элементы, I группа
ПРЕПАРАТЫ СОЕДИНЕНИЙ МЕДИ
Медный колчедан (халькопирит) CuFeS2 ,
медный блеск
азурит CuCO3·2Cu(OH)2
МЕДИ СУЛЬФАТ
2Cu + H2SO4(разб) + O2 → 2CuSO4 + 2H2O
3Cu + 3H2SO4 + 2HNO3 → 3CuSO4 + 4H2O + 2NO↑
ПРЕПАРАТЫ СОЕДИНЕНИЙ СЕРЕБРА
Аргентит Ag2S, кераргирит AgCl, бромаргирит AgBr, йодаргирит AgI
СЕРЕБРА НИТРАТ, КОЛЛАРГОЛ, ПРОТАРГОЛ
3Ag + 4HNO3 → 3AgNO3 + 2H2O + NO↑
AgNO3 +HCl → 3AgCl↓ + HNO3
3AgCl + Zn + H2SO4 → 2Ag↓ + ZnSO4 + 2HCl
AgNO3 + NaOH →AgOH + NaNO3
AgOH → Ag2O↓ + H2O
CuSO4 · 5H2O
Слайд 15d-элементы, VIII группа
ПРЕПАРАТЫ СОЕДИНЕНИЙ ЖЕЛЕЗА
Магнитный железняк Fe3O4 (магнетит), красный железняк Fe2O3
ВОССТАНОВЛЕННОЕ ЖЕЛЕЗО и ЖЕЛЕЗА (II) СУЛЬФАТ
Fe + H2SO4 → FeSO4 + H2↑
80◦C
Ferri (II) sulfas
Светло-зеленый кристаллический порошок или прозрачные кристаллы светло-зеленого цвета. Л.р. в воде, пр.нер. в спирте. Окисляется на воздухе, приобретая бурую окраску
Ferrum reductum
Мелкий серого или темно-серого цвета блестящий или матовый порошок. Притягивается магнитом
FeSO4 ·7H2O