- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 15. Аминокислоты презентация
Содержание
- 1. Лекция 15. Аминокислоты
- 2. П Л А Н 15.1 Аминокислоты,
- 3. 15.1 Аминокислоты, входящие в состав белков. Классификация.
- 4. Общая формула аминокислот, входящих в состав белков
- 5. Аминокислоты, входящие в состав белков проявляют
- 6. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ по структуре углеродной цепи
- 7. Классификация по кислотно-основным группам, наличию других
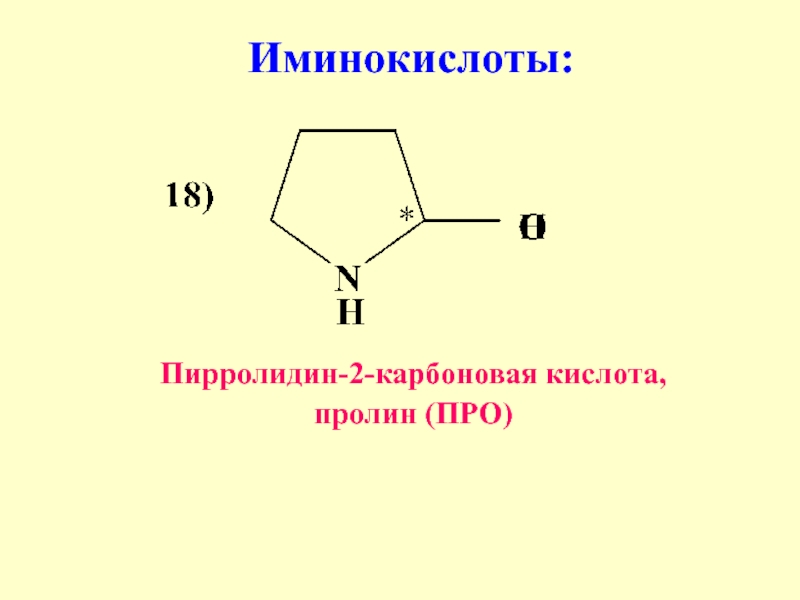
- 8. α-аминопропионовая кислота, 2-аминопропановая кислота, аланин ( АЛА)
- 9. α-амино-β-гидроксипропионовая кислота, 2-амино-3-гидроксипропановая кислота, серин ( СЕР)
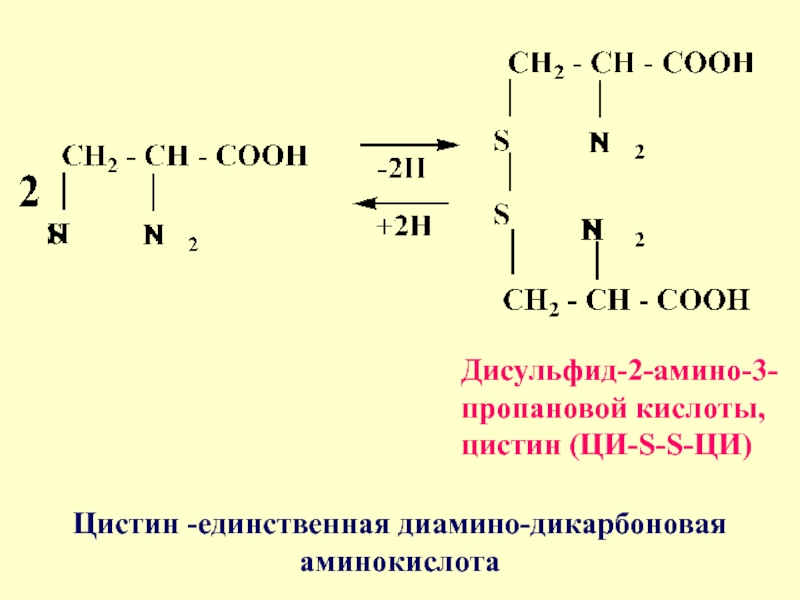
- 11. Дисульфид-2-амино-3-пропановой кислоты, цистин (ЦИ-S-S-ЦИ) Цистин -единственная диамино-дикарбоновая аминокислота
- 13. Метионин, цистеин и цистин относят к серусодержащим
- 14. α-аминоизовалериановая кислота, 2-амино-3-метилбутановая кислота,
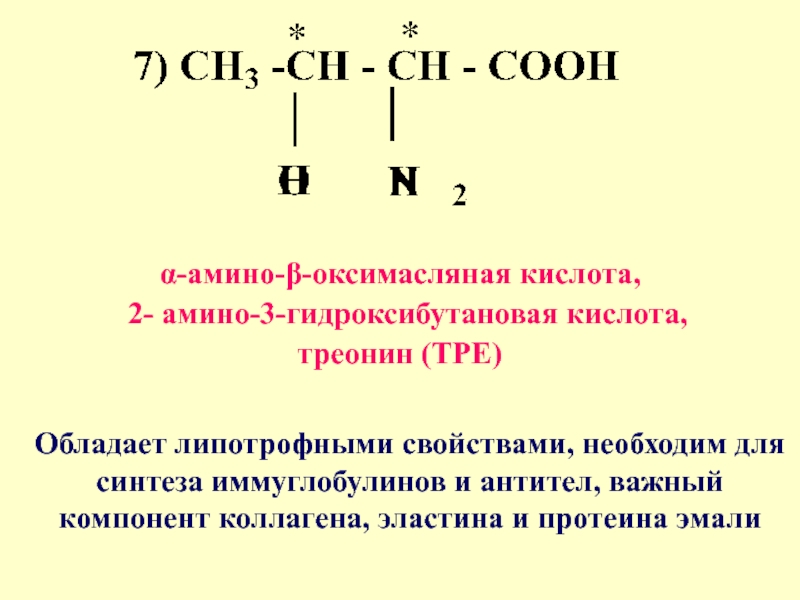
- 15. α-амино-β-оксимасляная кислота, 2- амино-3-гидроксибутановая
- 16. α-аминоизокапроновая кислота, 2-амино-4-метилпентановая кислота,
- 17. α-амино-β-метилвалериановая кислота, 2- амино-3-метилпентановая кислота, изолейцин (ИЛЕ)
- 18. Моноаминодикарбоновые (кислые) аминокислоты:
- 19. Моноаминодикарбоновые (кислые) аминокислоты:
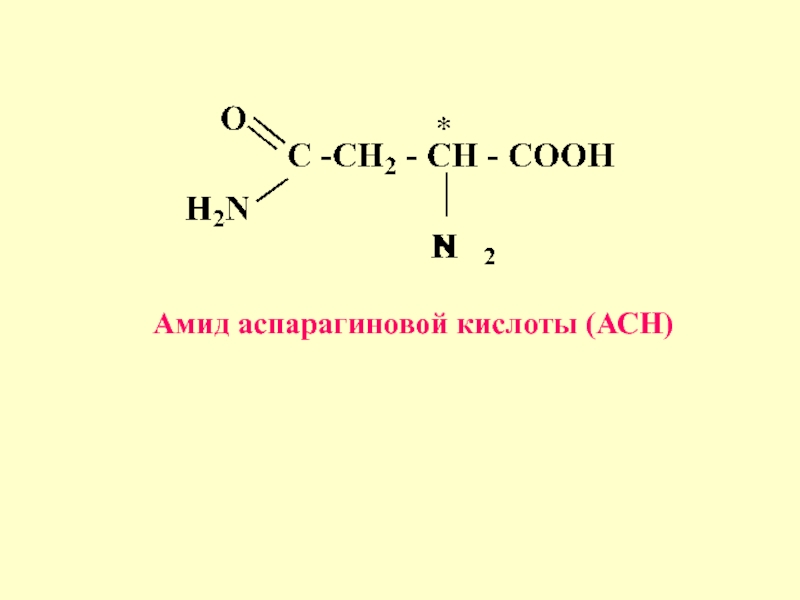
- 20. Амид аспарагиновой кислоты (АСН)
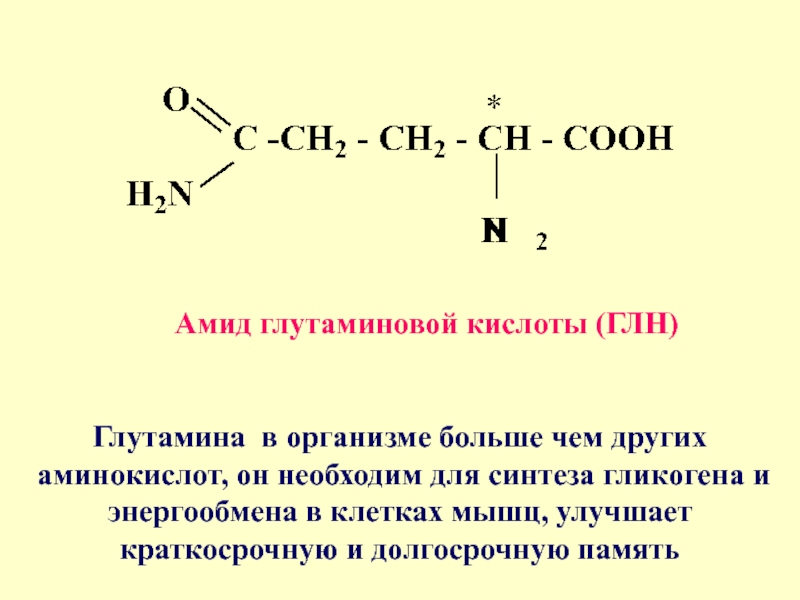
- 21. Глутамина в организме больше чем других аминокислот,
- 22. Диаминомонокарбоновые (основные) аминокислоты:
- 23. Диаминомонокарбоновые (основные) аминокислоты:
- 24. α-амино-β-фенилпропионовая кислота, 2- амино-3-фенилпропановая кислота,
- 25. α-амино-β-(n-оксифенил)-пропионовая кислота, 2- амино-3-(4-гидроксифенил)-пропановая кислота,
- 26. Гетероциклические аминокислоты: α-амино-β-имидазолилпропионовая кислота,
- 27. Гетероциклические аминокислоты: α-амино-β-индолилпропионовая кислота, 2-
- 28. Иминокислоты: Пирролидин-2-карбоновая кислота, пролин (ПРО)
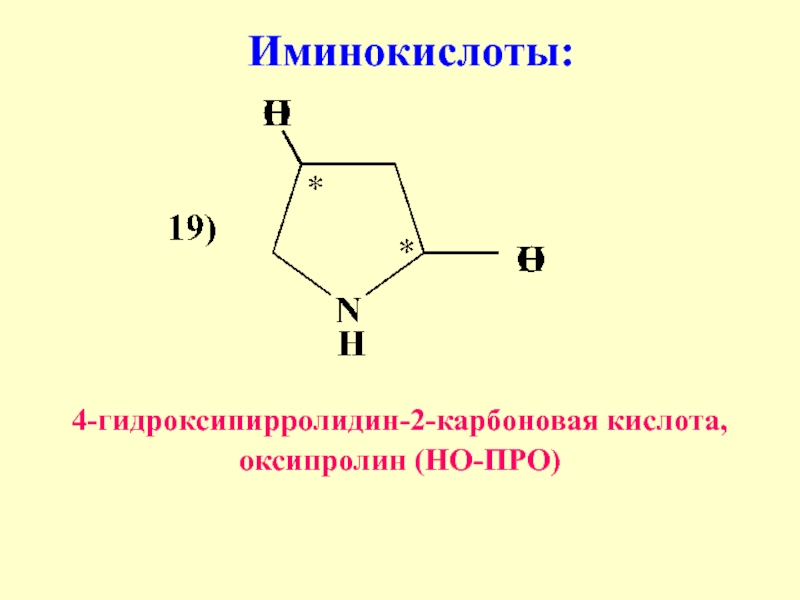
- 29. Иминокислоты: 4-гидроксипирролидин-2-карбоновая кислота, оксипролин (НО-ПРО)
- 30. Неполярные (гидрофобные)
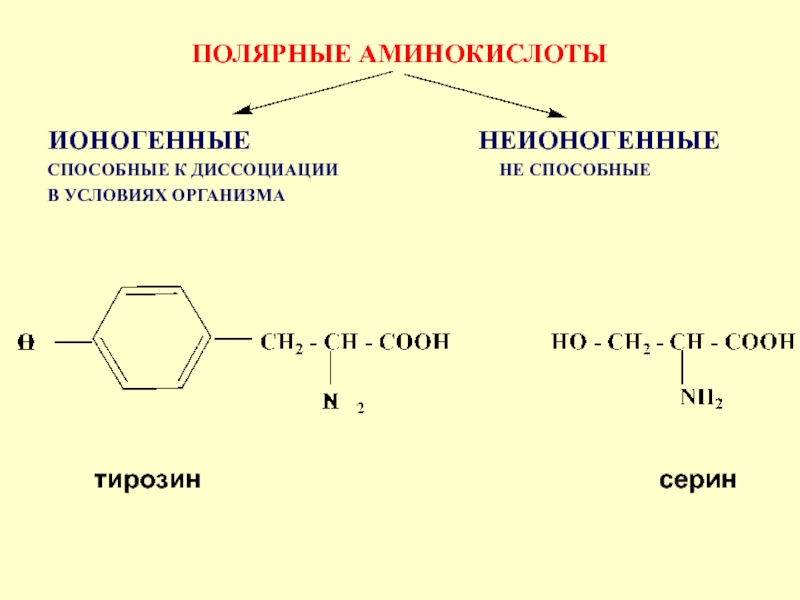
- 32. Полярные аминокислоты с ионогенными группами в
- 33. Полярные ионогенные радикалы располагаются как на поверхности,
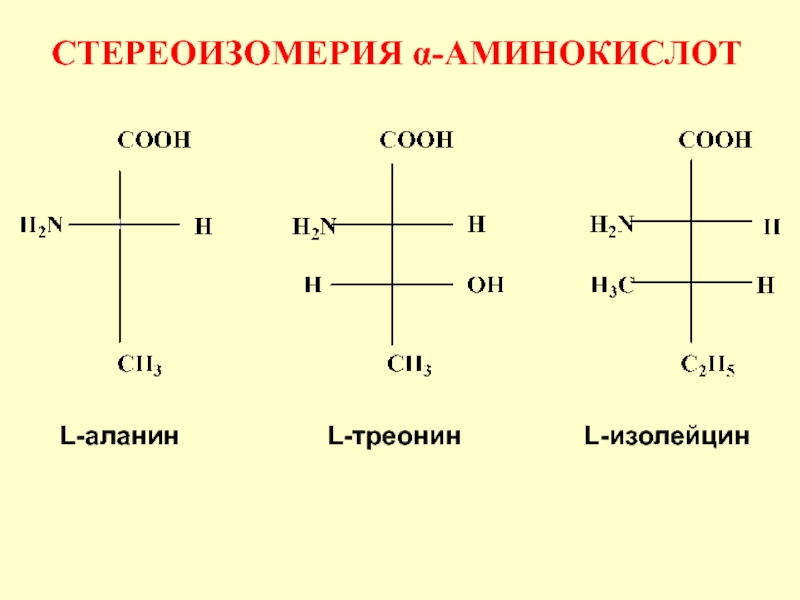
- 34. Все α-аминокислоты, за исключением глицина, имеют асимметрический
- 35.
- 37. Три аминокислоты имеют два центра хиральности
- 38. 15.2. БИОСИНТЕТИЧЕСКИЕ ПУТИ ОБРАЗОВАНИЯ АМИНОКИСЛОТ Биосинтез α-аминокислот
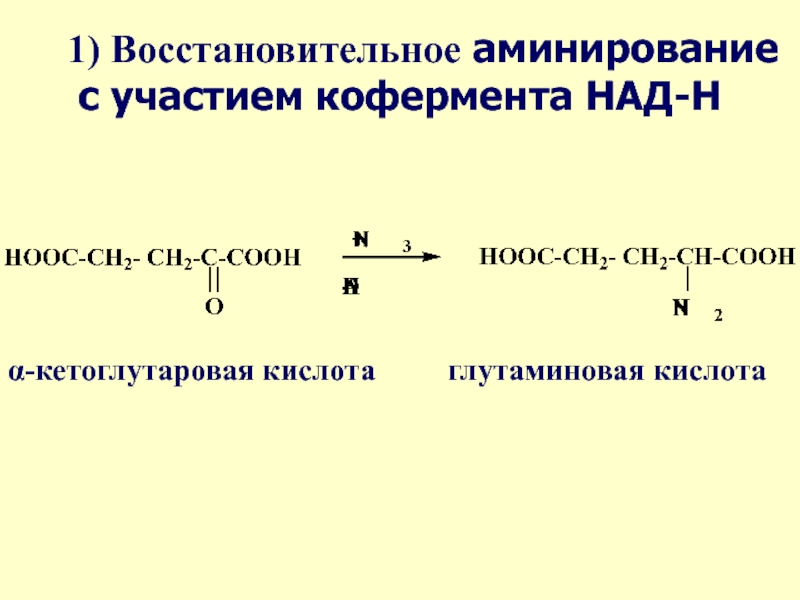
- 39. 1) 1) Восстановительное аминирование с
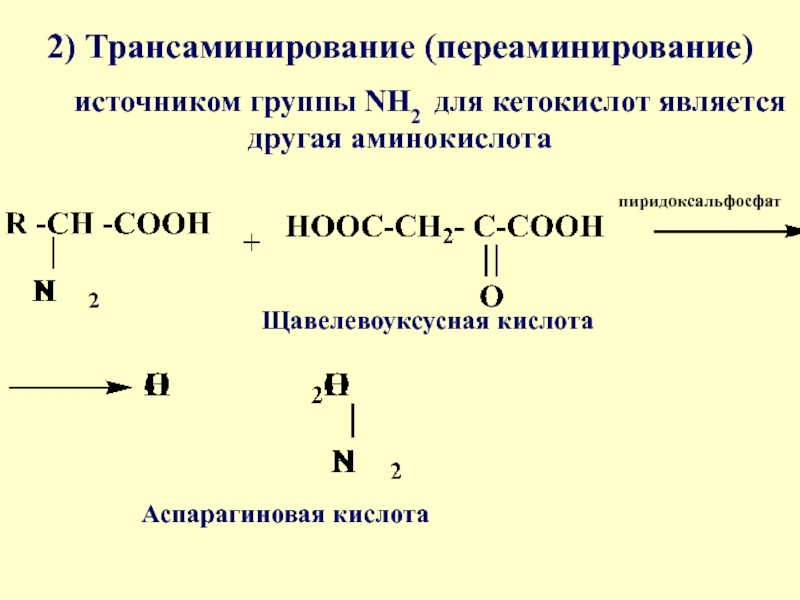
- 40. 2) Трансаминирование (переаминирование)
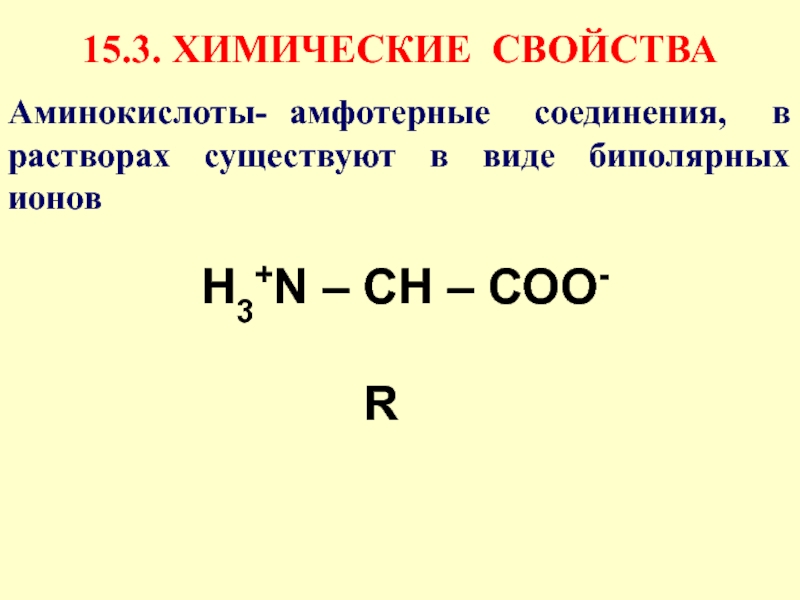
- 41. Н3+N – СН – СОО-
- 42. Аминокислотам присущи все свойства как карбоновых кислот,
- 43. Для аминокислот характерен целый ряд специфических реакций,
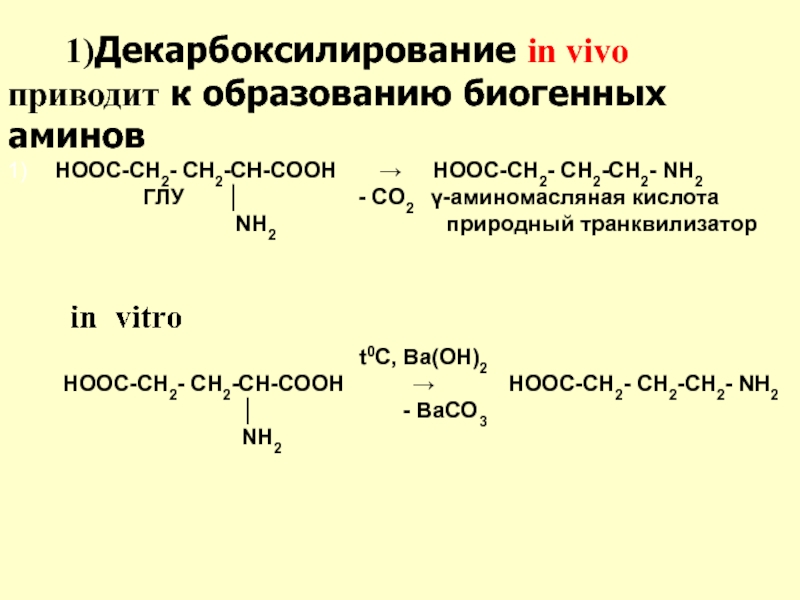
- 44. 1) HOOC-CH2- CH2-CH-COOH →
- 45. В результате реакции декарбоксилирования образуются биогенные амины (триптамин, гистамин, коламин, дофамин, серотонин)
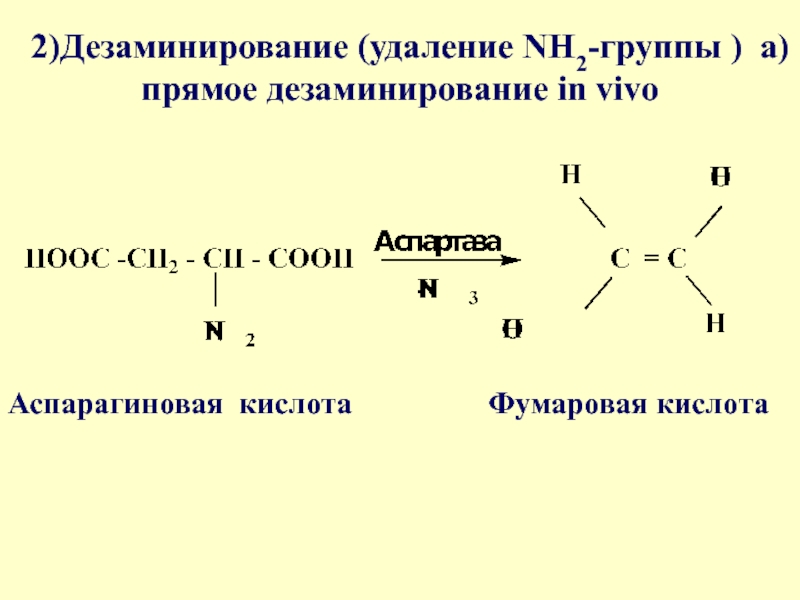
- 46. 2)Дезаминирование (удаление NH2-группы ) а)прямое дезаминирование
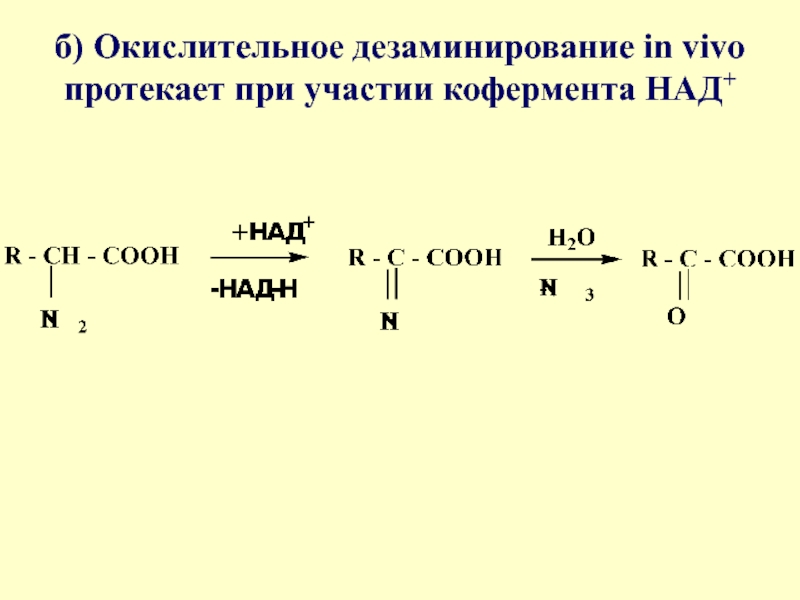
- 47. б) Окислительное дезаминирование in vivo
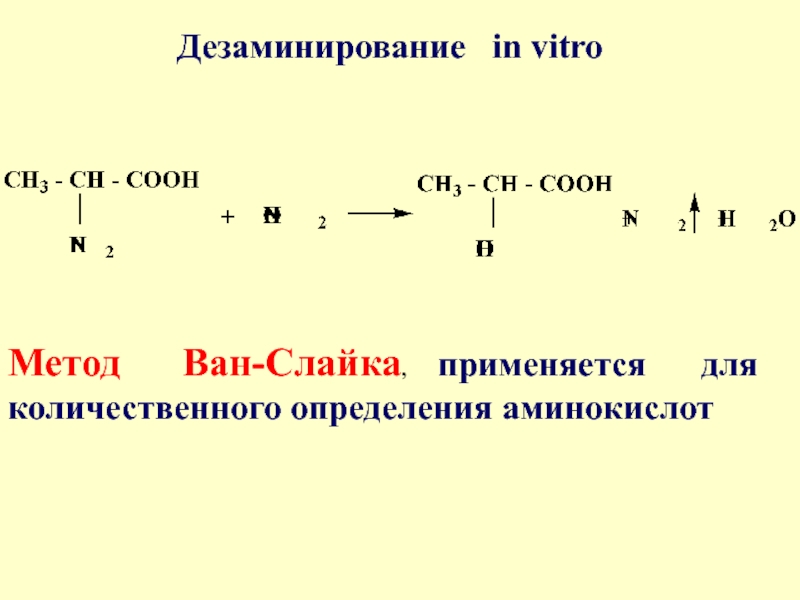
- 48. Дезаминирование in vitro
- 50. Благодарим за внимание ! Знания – сила!!!!
Слайд 2 П Л А Н
15.1 Аминокислоты, входящие в состав белков. Классификация.
15.2. Биосинтетические пути образования α-аминокислот
15.3. Химические свойства
Слайд 315.1 Аминокислоты, входящие в состав белков. Классификация. Стереоизомерия
Аминокислоты - это производные
Слайд 5 Аминокислоты, входящие в состав белков проявляют особые свойства
Все относятся
Являются L-стереоизомерами
Относятся к амфотерным соеди-нениям
Слайд 6КЛАССИФИКАЦИЯ АМИНОКИСЛОТ по структуре углеродной цепи
Ациклические (нециклические) Циклические
Ароматические Гетероциклические
Слайд 7
Классификация по кислотно-основным группам, наличию других функциональных групп и радикалов
Аминоуксусная кислота, 2-аминоэтановаякислота, глицин (ГЛИ)
Сладкая на вкус, широко распространена в растительном мире, входит в состав альбумина, используется как успокаивающее средство при нервных расстройствах
Слайд 8α-аминопропионовая кислота, 2-аминопропановая кислота, аланин ( АЛА)
Источник энергии для головного
Слайд 9α-амино-β-гидроксипропионовая кислота, 2-амино-3-гидроксипропановая кислота, серин ( СЕР)
Входит в состав белков растительного
Слайд 10
α-амино-β-тиопропионовая кислота,
2- амино-3-меркаптопропановая кислота,
цистеин (ЦИС)
Участвует в обмене
٭٭
Слайд 11Дисульфид-2-амино-3-пропановой кислоты, цистин (ЦИ-S-S-ЦИ)
Цистин -единственная диамино-дикарбоновая аминокислота
Слайд 12
α-амино-γ-метилтиомасляная кислота,
2-амино-4-метилтиобутановая кислота,
метионин (МЕТ)
Метионин имеет метильную группу, благодаря которой способствует предупреждению ожирения печени, участвует в синтезе гормонов, ферментов, за счет подвижной метильной группы способен удалять токсические вещества. Метионин используется в качестве лекарственного препарата для лечения и предупреждения заболеваний печени
Слайд 13Метионин, цистеин и цистин относят к серусодержащим аминокислотам, их особенно много
Слайд 14α-аминоизовалериановая кислота,
2-амино-3-метилбутановая кислота,
валин (ВАЛ)
Один из главных компонентов роста
Слайд 15
α-амино-β-оксимасляная кислота,
2- амино-3-гидроксибутановая кислота,
треонин (ТРЕ)
Обладает липотрофными свойствами, необходим
Слайд 16α-аминоизокапроновая кислота,
2-амино-4-метилпентановая кислота,
лейцин (ЛЕЙ)
Слайд 18Моноаминодикарбоновые (кислые) аминокислоты:
α-аминоянтарная кислота,
2-аминобутадиовая кислота,
аспарагиновая
Принимает участие в реакциях переаминирования, в работе иммунной системы и синтезе нуклеиновых кислот
Слайд 19Моноаминодикарбоновые (кислые) аминокислоты:
α-аминоглутаровая кислота,
2-аминопентандиовая кислота,
Источник аминогруппы в метаболических процессах
Слайд 21Глутамина в организме больше чем других аминокислот, он необходим для синтеза
Амид глутаминовой кислоты (ГЛН)
Слайд 22Диаминомонокарбоновые (основные) аминокислоты:
α,ε-диаминокапроновая кислота,
2,6-диаминогексановая кислота,
Обеспечивает усвоение кальция, участвует в образовании коллагена, выработке антител, гормонов, ферментов
Слайд 23Диаминомонокарбоновые (основные) аминокислоты:
α-амино-Δ-гуанидилвалериановая кислота,
2-амино-5-гуанидилпентановая кислота,
Вызывает замедление развития опухолей, укрепляет иммунную систему, способствует приросту мышечной массы
Слайд 24
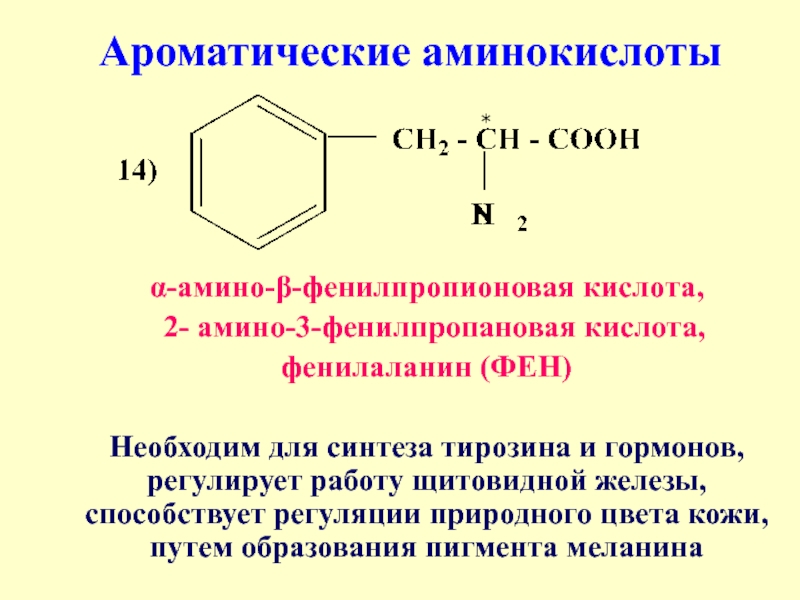
α-амино-β-фенилпропионовая кислота,
2- амино-3-фенилпропановая кислота,
фенилаланин (ФЕН)
Необходим для синтеза тирозина и
Ароматические аминокислоты
*
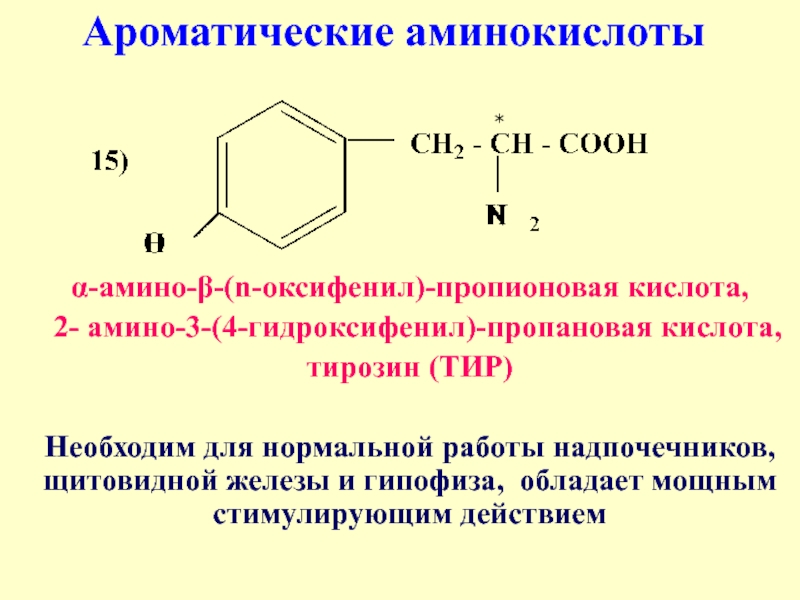
Слайд 25α-амино-β-(n-оксифенил)-пропионовая кислота,
2- амино-3-(4-гидроксифенил)-пропановая кислота,
тирозин (ТИР)
Необходим для нормальной работы надпочечников,
Ароматические аминокислоты
*
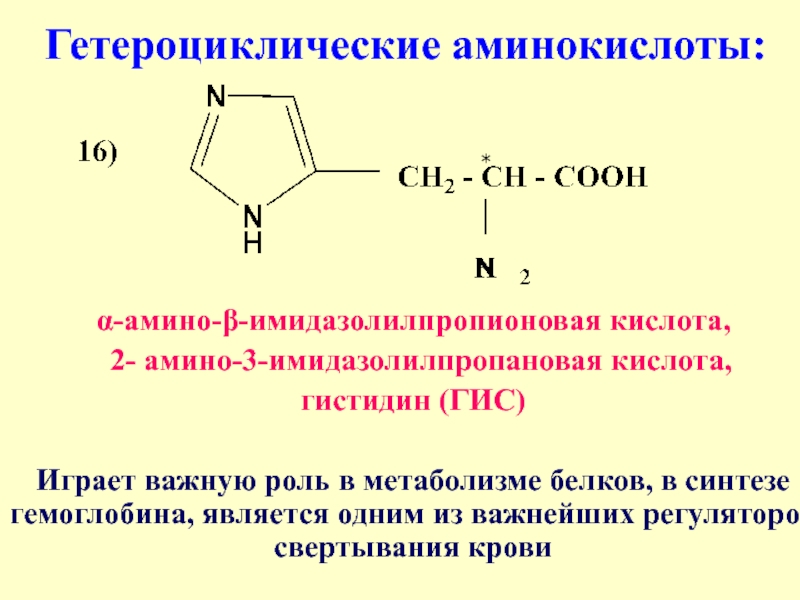
Слайд 26 Гетероциклические аминокислоты:
α-амино-β-имидазолилпропионовая кислота,
2- амино-3-имидазолилпропановая кислота,
гистидин (ГИС)
Играет важную роль
*
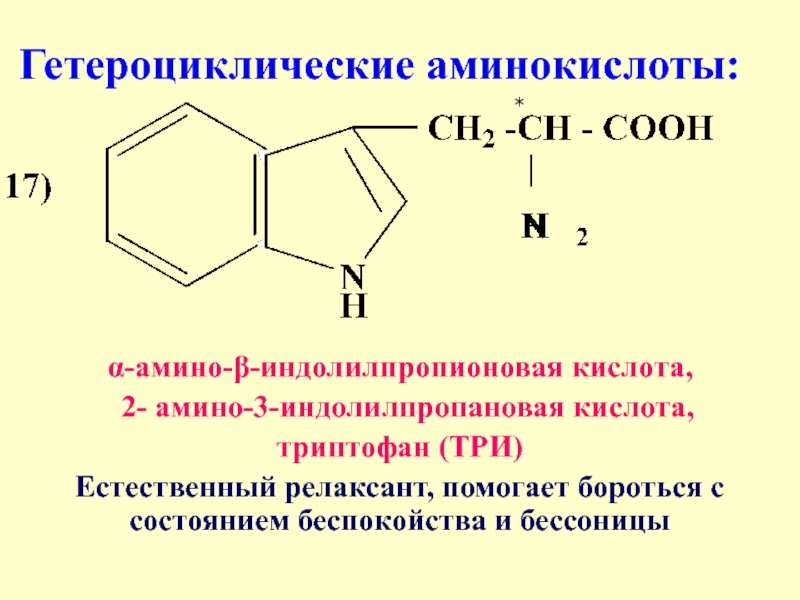
Слайд 27 Гетероциклические аминокислоты:
α-амино-β-индолилпропионовая кислота,
2- амино-3-индолилпропановая кислота,
триптофан (ТРИ)
Естественный релаксант, помогает
*
Слайд 30
Неполярные (гидрофобные) Полярные(гидрофильные)
Классификация аминокислот в зависимости
Слайд 31
ПОЛЯРНЫЕ АМИНОКИСЛОТЫ
ИОНОГЕННЫЕ НЕИОНОГЕННЫЕ
СПОСОБНЫЕ К ДИССОЦИАЦИИ НЕ СПОСОБНЫЕ
В УСЛОВИЯХ ОРГАНИЗМА
Слайд 32 Полярные аминокислоты с ионогенными группами в условиях организма могут находиться
В виде анионов В виде катионов
Асп Лиз
Глу Арг
Тир Гис
Цис
Слайд 33Полярные ионогенные радикалы располагаются как на поверхности, так и внутри белковых
Слайд 34Все α-аминокислоты, за исключением глицина, имеют асимметрический атом углерода и существуют
Слайд 3815.2. БИОСИНТЕТИЧЕСКИЕ ПУТИ ОБРАЗОВАНИЯ АМИНОКИСЛОТ
Биосинтез α-аминокислот осуществляется из α-кетокислот -
продуктов
Слайд 391)
1) Восстановительное аминирование с участием кофермента НАД-Н
α-кетоглутаровая кислота
глутаминовая
Слайд 402) Трансаминирование (переаминирование)
источником группы NH2 для кетокислот является другая аминокислота
пиридоксальфосфат
Щавелевоуксусная кислота
Аспарагиновая кислота
Слайд 41Н3+N – СН – СОО-
R
15.3. ХИМИЧЕСКИЕ СВОЙСТВА
Аминокислоты- амфотерные соединения, в растворах существуют в виде биполярных ионов
Слайд 42Аминокислотам присущи все свойства как карбоновых кислот, так и аминов
Реакции карбоксильной
Реакции аминогруппы - образование солей с сильными кислотами, образование N-ацилированных производных
Слайд 43Для аминокислот характерен целый ряд специфических реакций, обусловленных наличием в их
Слайд 441) HOOC-CH2- CH2-CH-COOH → HOOC-CH2- CH2-CH2-
ГЛУ │ - CO2 γ-аминомасляная кислота
NH2 природный транквилизатор
t0C, Ва(ОН)2
HOOC-CH2- CH2-CH-COOH → HOOC-CH2- CH2-CH2- NH2
│ - ВаCO3
NH2
1)Декарбоксилирование in vivo приводит к образованию биогенных аминов
Слайд 45В результате реакции декарбоксилирования образуются биогенные амины (триптамин, гистамин, коламин, дофамин,
Слайд 46 2)Дезаминирование (удаление NH2-группы ) а)прямое дезаминирование in vivo
Аспарагиновая кислота
Слайд 48
Дезаминирование in vitro
Метод Ван-Слайка, применяется для
Слайд 49
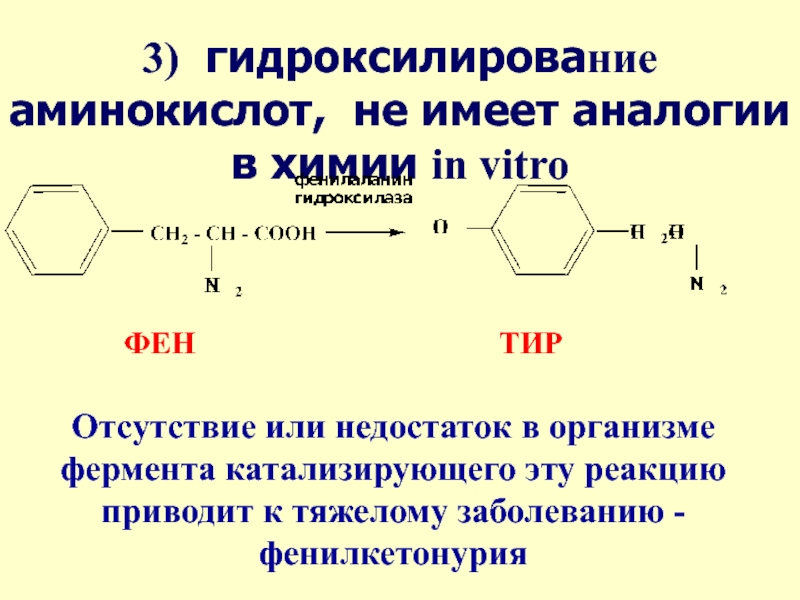
3) гидроксилирование аминокислот, не имеет аналогии в химии in vitro
Отсутствие или недостаток в организме фермента катализирующего эту реакцию приводит к тяжелому заболеванию - фенилкетонурия