- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 1. Введение в биоорганическую химию презентация
Содержание
- 1. Лекция 1. Введение в биоорганическую химию
- 2. План 1.1. Введение 1.2.Классификация органических соединений 1.3. Номенклатура органических соединений
- 3. 1.1 Введение
- 4. Биоорганическая химия изучает строение и реакционную способность
- 5. Научную основу биоорганической химии
- 6. Целью биоорганической химии как самостоятельной дисциплины
- 7. История развития органической химии
- 8. История развития органической химии Эмпирический -накопление экспериментальных данных
- 9. Теофраст Парацельс (1493–1541) Швейцарский врач -эмпирик,
- 10. История развития органической химии 2.Аналитический Основное внимание
- 11. История развития органической химии 3. Структурный
- 12. 4. Особенно быстрое раз-витие органическая химия получила
- 13. Органическая химия- химия углерода и его соединений Определение А.М.Бутлерова (1828-1886)
- 14. Определение К.Шорлеммера Органическая химия – это
- 15. 1.2 Классификация органических соединений Для описания
- 16. Наиболее полную информацию о строении молекулы
- 18. полуструктурные формулы
- 19. Классификация органических соединений Органические соединения Ациклические Циклические Карбоциклические Гетероциклические Алициклические Ароматические
- 21. Предельные или насыщенные углеводороды (алканы, парафины)
- 22. Непредельные или ненасыщенные углеводороды
- 23. Алкены (олефины, этиленовые углеводороды) Содержат одну
- 24. Алкины (ацетиленовые углеводороды) имеют тройную
- 25. Алкадиены (диолефины, диеновые углеводороды) содержат
- 26. Алкадиены с изолированными двойными связями
- 27. Алкадиены с кумулированными двойными связями
- 28. Алкадиены с сопряженными двойными связями
- 29. Алкенины соединения с одной
- 30. Алкадиины соединения с двумя тройными связями
- 31. Полиены (полиолефины) соединения
- 32. Алициклические углеводороды (циклоалканы, циклопара-фины, полиметилены, цик-ланы)
- 33. циклопропан циклобутан циклопентан циклогексан
- 34. Циклоалкены (циклоолефины, циклены) циклические соединения, содержащие
- 35. Циклоалкадиены циклические соединения, содержащие две двойные
- 36. Алициклические соединения могут содержать один, два
- 37. Конденсированные Спирановые Спиро-[2,5]-октан Бицикло-[4,2,0]-октан
- 38. Мостиковые Бицикло-[3,2,1]-октан
- 39. Ароматические соединения (арены) – группа карбоциклов, характеризующихся
- 40. Бензоидные ароматические соединения обязательной
- 41. Небензоидные ароматические соединения структуры, отвечающие требованиям ароматич-ности, но лишенные шестичленных бензольных колец
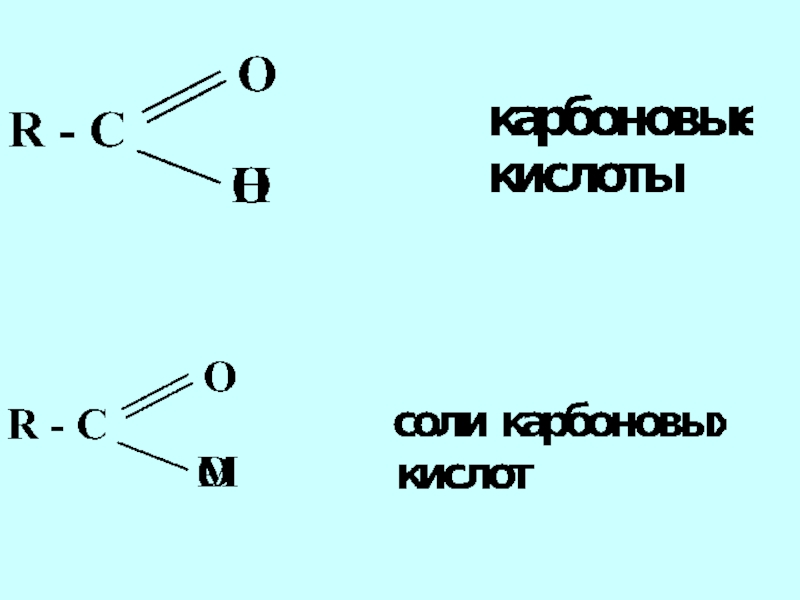
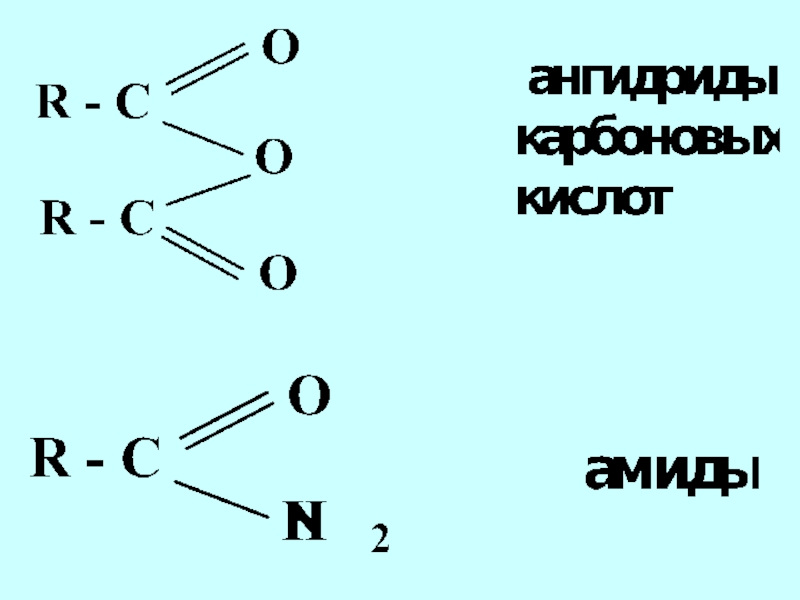
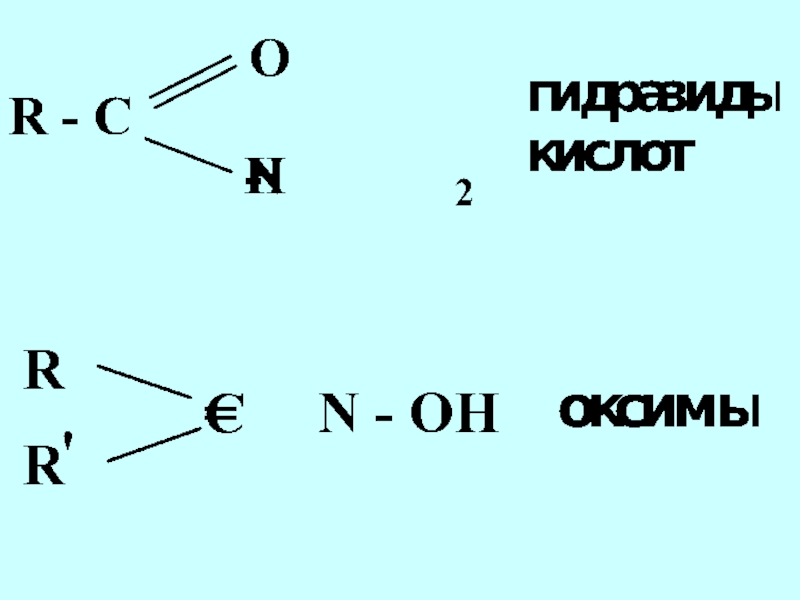
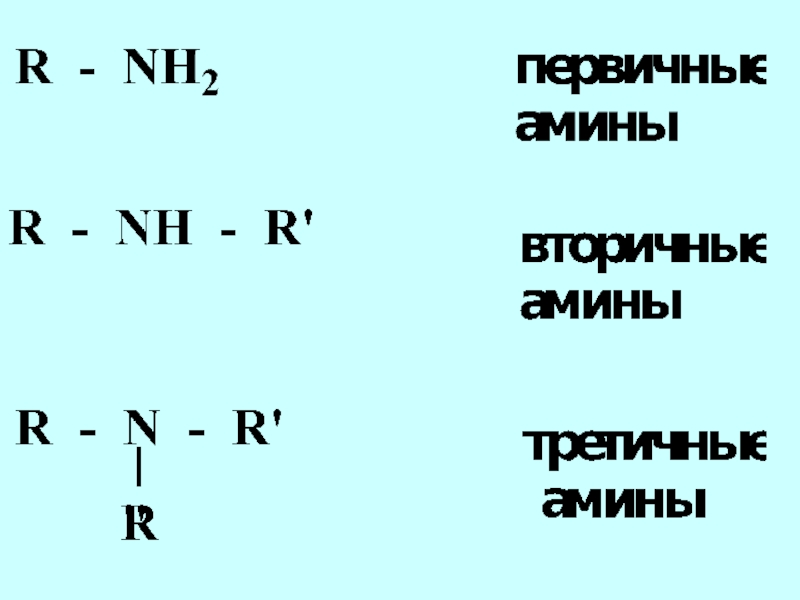
- 42. Функциональная группа структурный фрагмент молекулы, определяющий её химические свойства
- 44. альдегиды кетоны
- 51. 1.3 Номенклатура органических соединений Номенклатура – это
- 52. Тривиальная Названия соединений случайные, обусловленные различными
- 53. 1.Источники выделения 2. Отличительные свойства
- 54. Рациональная все соединения в данном
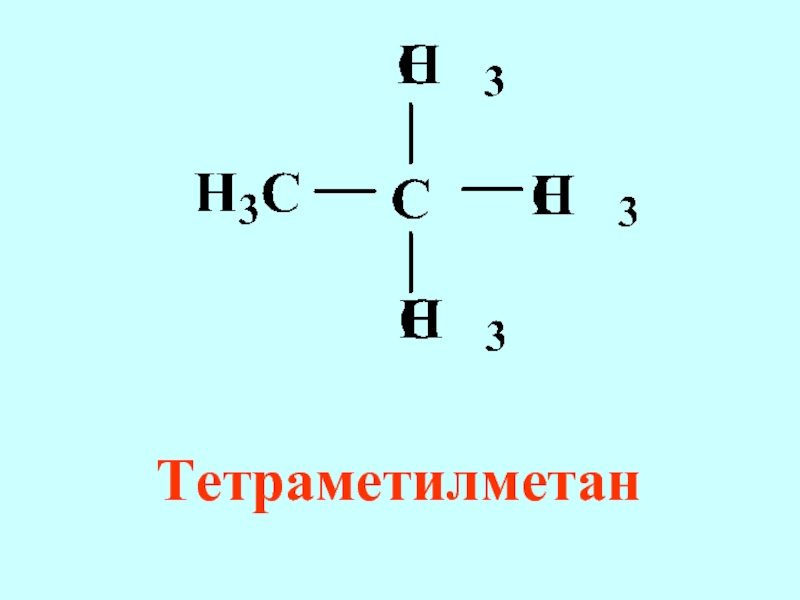
- 55. Тетраметилметан
- 56. Диметилэтилэтилен
- 57. Радикально-функциональная номенклатура Применяется для названий моно-
- 58. В названии старшей характеристической группы не применяются
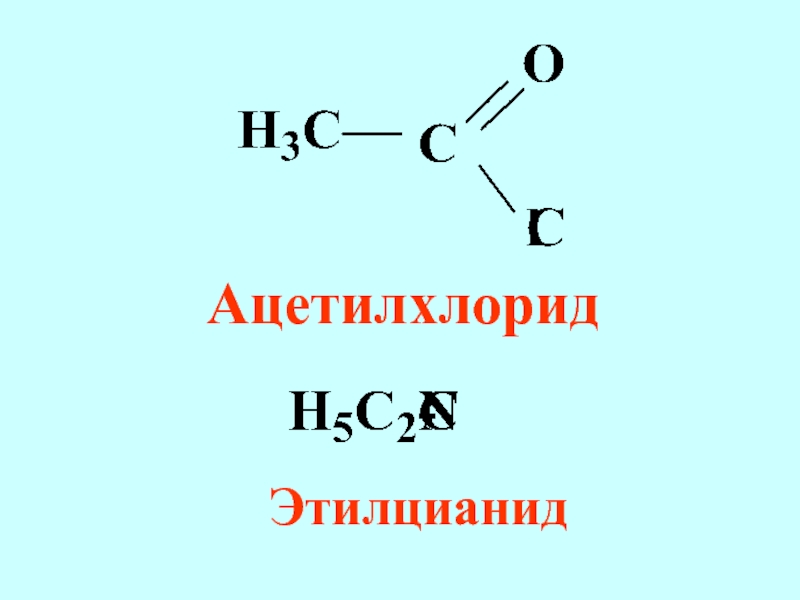
- 59. Ацетилхлорид Этилцианид
- 60. Изобутиловый спирт Винилхлорид
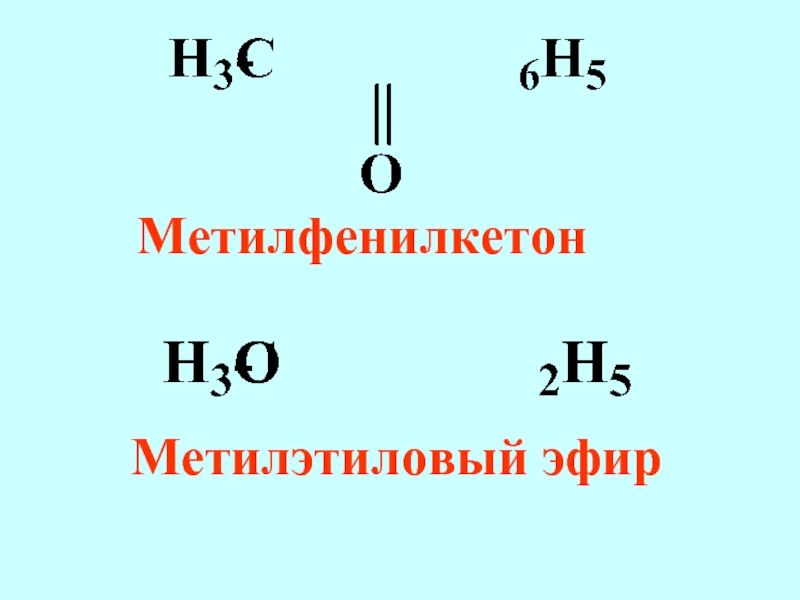
- 61. Метилфенилкетон Метилэтиловый эфир
- 62. В настоящее время признанной во всём мире
- 63. Её ещё называют международной, систематической, Женевской
- 64. Название IUPAC номенклатура получила на ХIХ конгрессе
- 65. Общая схема составления названий
- 66. Только в префиксе Cl, Br,
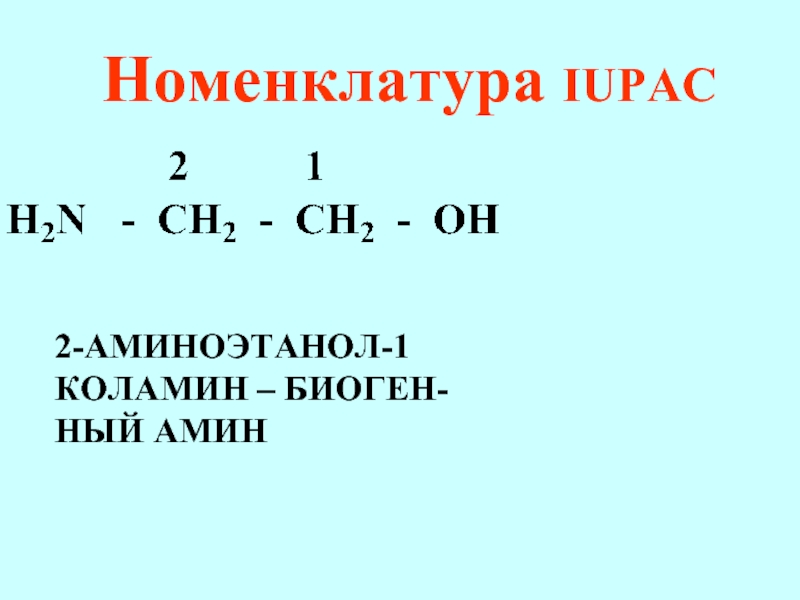
- 67. Номенклатура IUPAC 2-АМИНОЭТАНОЛ-1 КОЛАМИН – БИОГЕН- НЫЙ АМИН
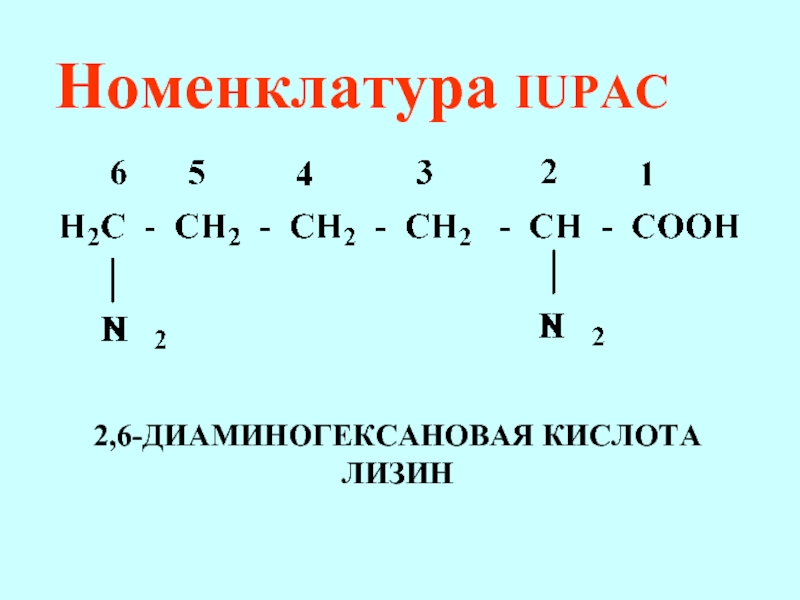
- 68. Номенклатура IUPAC 2,6-ДИАМИНОГЕКСАНОВАЯ КИСЛОТА ЛИЗИН
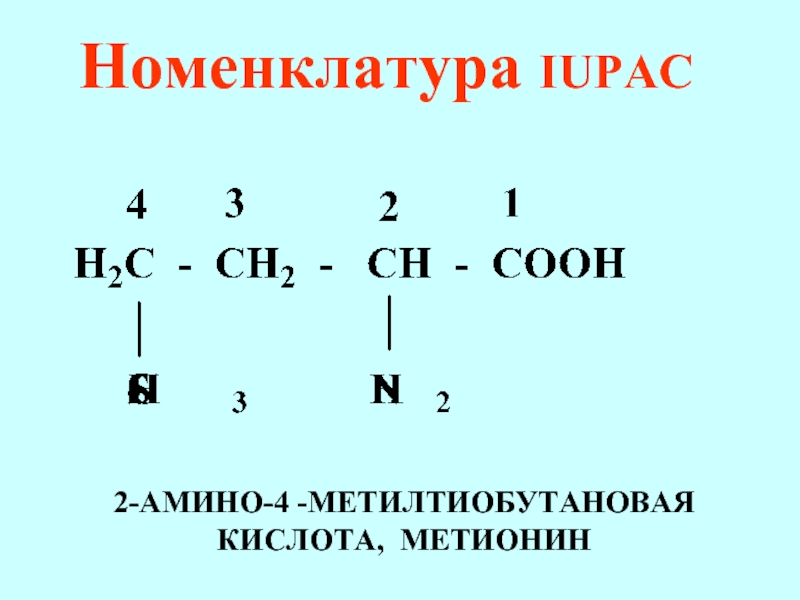
- 69. Номенклатура IUPAC 2-АМИНО-4 -МЕТИЛТИОБУТАНОВАЯ КИСЛОТА, МЕТИОНИН
- 70. Номенклатура IUPAC 3-ГИДРОКСИ-3-КАРБОКСИПЕНТАНДИОВАЯ КИСЛОТА, ЛИМОННАЯ КИСЛОТА
- 71. Названия некоторых углеводородных радикалов Метил; этил Изопропил
- 72. Названия некоторых углеводородных радикалов Изобутил Втор. бутил
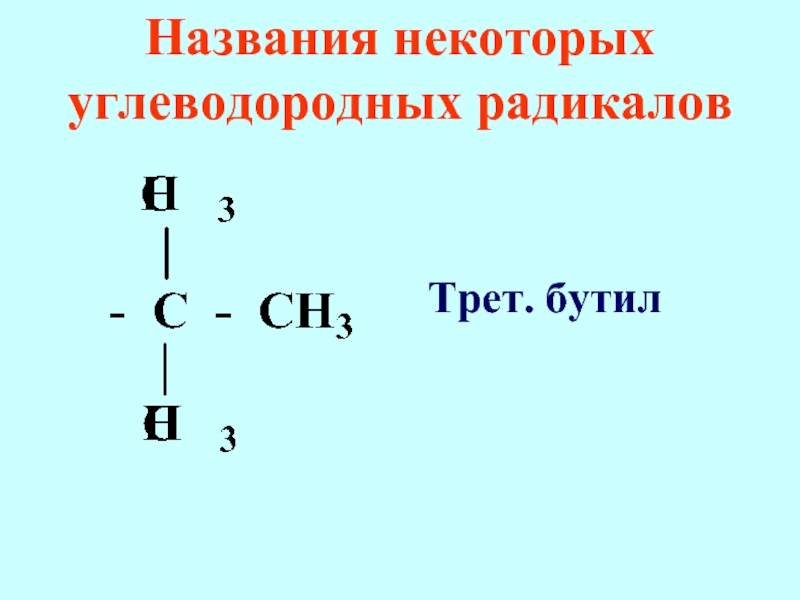
- 73. Названия некоторых углеводородных радикалов Трет. бутил
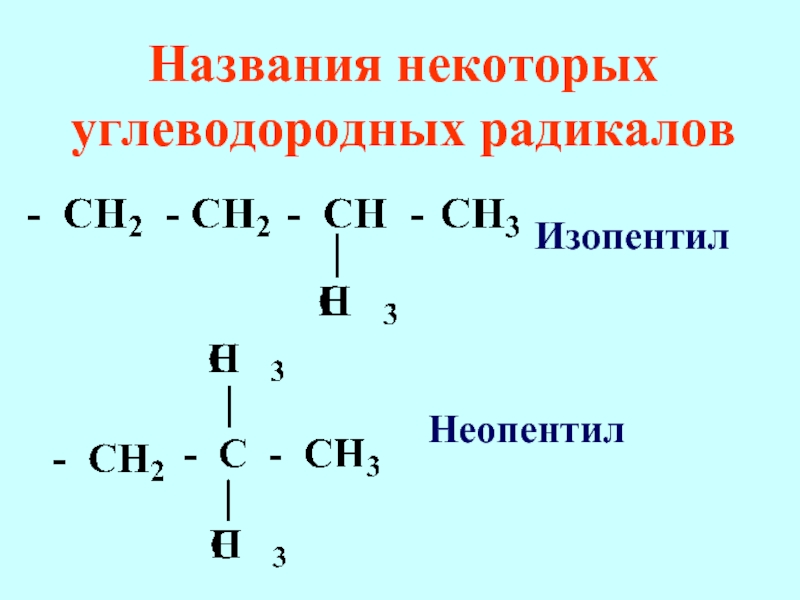
- 74. Названия некоторых углеводородных радикалов Изопентил Неопентил
- 75. Названия некоторых углеводородных радикалов Винил Этинил
- 76. Названия некоторых углеводородных радикалов Аллил
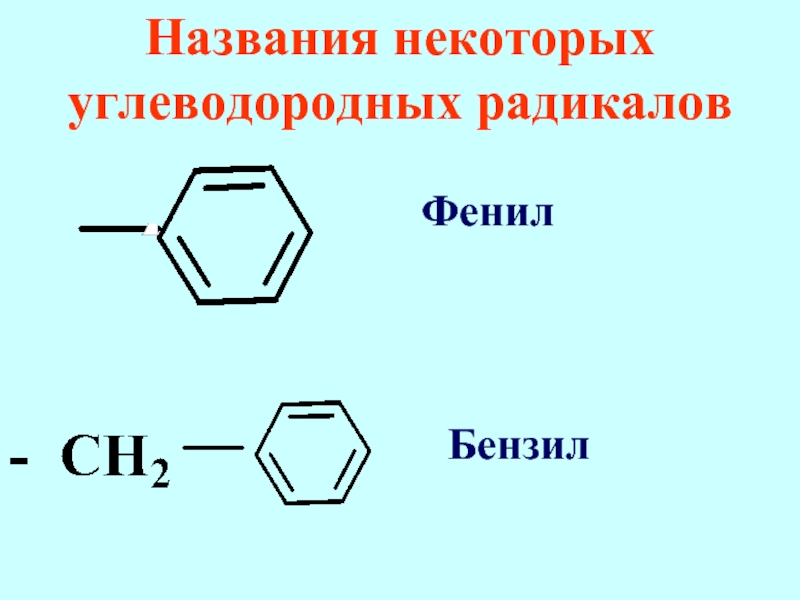
- 77. Названия некоторых углеводородных радикалов Фенил Бензил
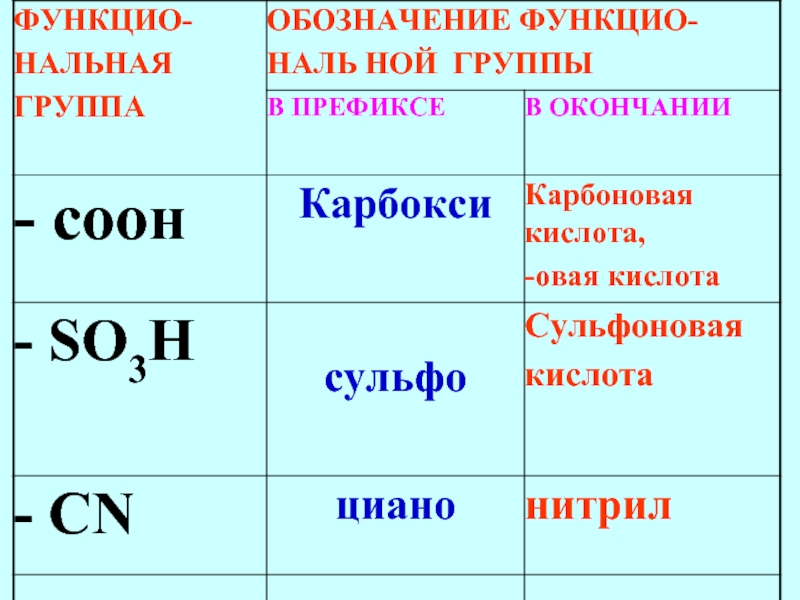
- 78. Важнейшие функциональные группы, расположенные в порядке убывания старшинства
- 81. Спасибо за внимание
Слайд 2План
1.1. Введение
1.2.Классификация органических соединений
1.3. Номенклатура органических соединений
Слайд 4Биоорганическая химия изучает строение и реакционную способность органических веществ, лежащих в
в непосредственной связи с познанием их биологической функции
Слайд 5Научную основу
биоорганической химии
составляют закономерности во взаимосвязи строения и реакционной
Слайд 6Целью биоорганической химии
как самостоятельной дисциплины
является формирование знаний о взаимосвязи
строения и химических свойств биологически-
активных соединений
Слайд 7История развития органической химии
Органическая химия в своем развитии
Эмпирический
2. Аналитический
3. Структурный
4. Современный
Слайд 9Теофраст Парацельс (1493–1541)
Швейцарский врач -эмпирик, естество-испытатель и ал-химик эпохи Воз-рождения.
Слайд 10История развития органической химии
2.Аналитический
Основное внимание исследователей направлено на выяснение состава органических
Слайд 11История развития органической химии
3. Структурный
Созданы соединения не существующие в природе,
Слайд 124. Особенно быстрое раз-витие органическая химия получила в начале 20 века,
История развития органической химии
Слайд 14Определение К.Шорлеммера
Органическая химия – это химия углеводородов и их производных,
Слайд 151.2 Классификация органических соединений
Для описания структуры молекул органических соединений используют различные
Слайд 16Наиболее полную информацию
о строении молекулы содержит структурная (графическая) фор-мула,которая отражает
состав молекулы,
их число и последовательность
связывания, а также тип связей
между атомами
Слайд 19Классификация органических соединений
Органические соединения
Ациклические
Циклические
Карбоциклические
Гетероциклические
Алициклические
Ароматические
Слайд 21Предельные или насыщенные углеводороды (алканы, парафины)
содержат только простые углерод-углеродные связи,
Общая формула СnН2n+2
Родоначальник ряда – метан СН4
Слайд 22Непредельные или ненасыщенные
углеводороды
Имеют кратные (двойные или тройные) углерод –
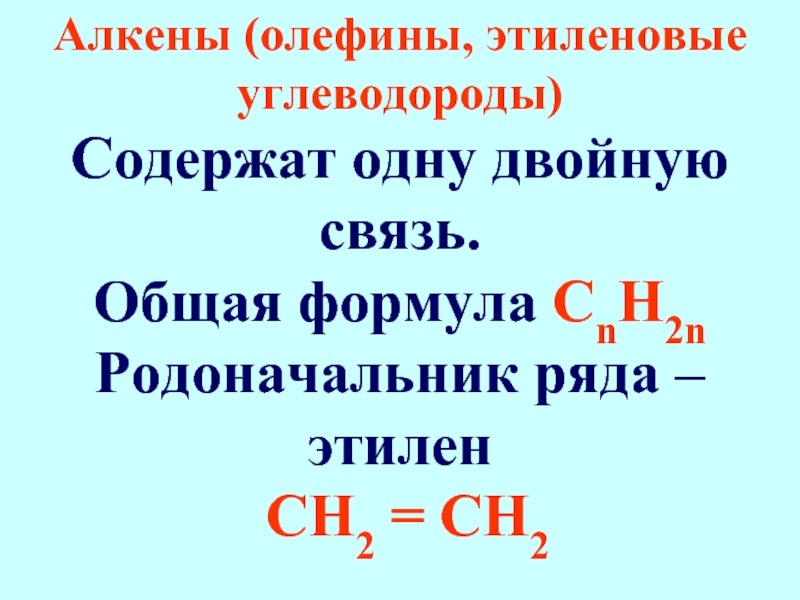
Слайд 23Алкены (олефины, этиленовые углеводороды)
Содержат одну двойную связь.
Общая формула СnН2n
Родоначальник
СН2 = СН2
Слайд 24Алкины
(ацетиленовые углеводороды)
имеют тройную связь
Общая формула СnН2n-2
Родоначальник ряда
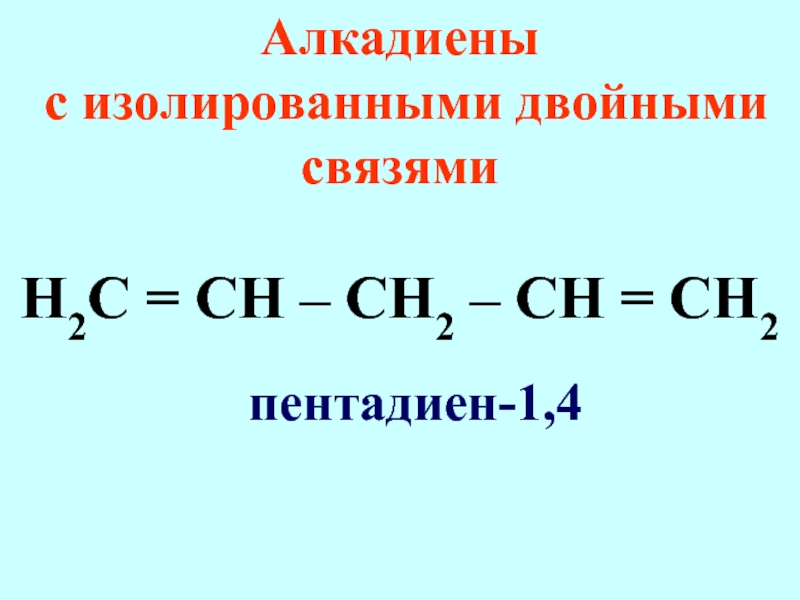
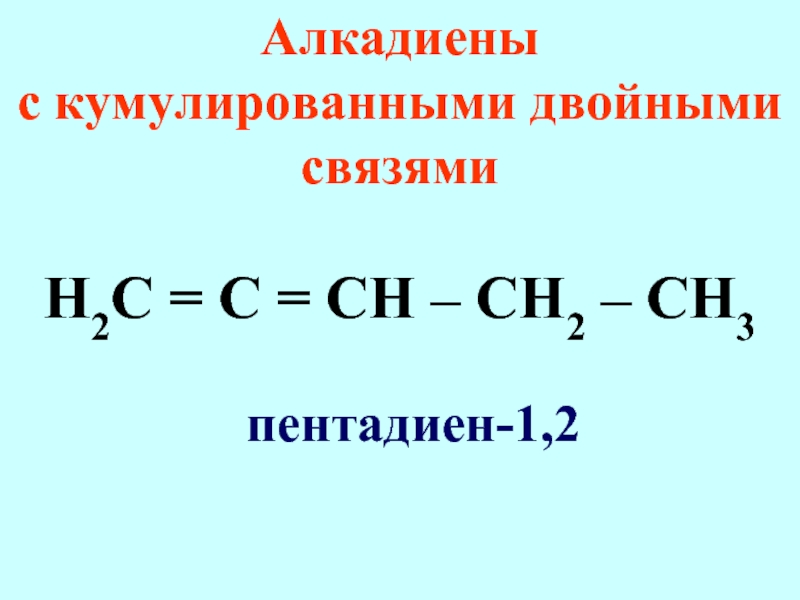
Слайд 25Алкадиены (диолефины, диеновые углеводороды)
содержат две двойные связи
Общая формула
Слайд 31 Полиены
(полиолефины)
соединения со многими двойными связями
Н2С = СН
гептатриен-1,3,5
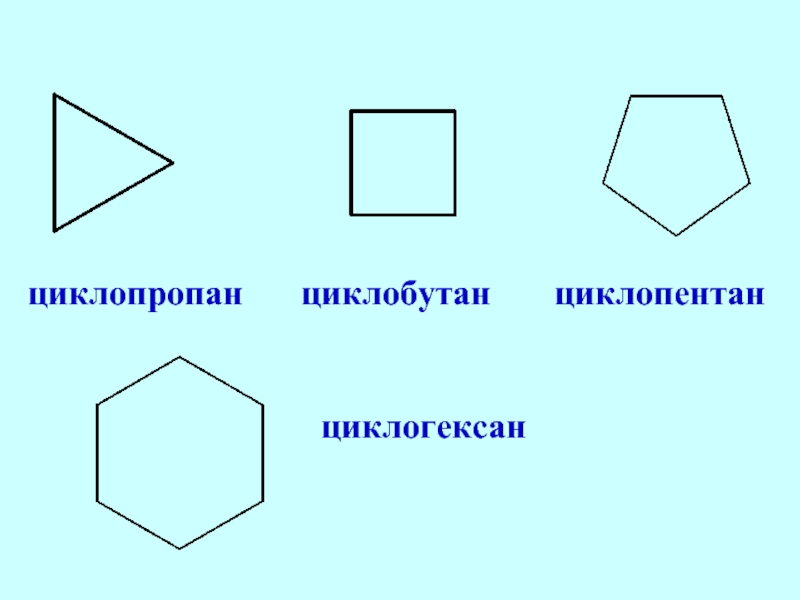
Слайд 32Алициклические углеводороды
(циклоалканы, циклопара-фины, полиметилены, цик-ланы) – циклические соединения содержащие только простые
Общая формула - СnН2n
Слайд 34Циклоалкены (циклоолефины, циклены)
циклические соединения, содержащие двойную связь
Общая формула -
циклопропен циклогексен
Слайд 35Циклоалкадиены
циклические соединения, содержащие две двойные связи.
Общая формула – СnН2n-4
Слайд 36Алициклические соединения
могут содержать один, два и более циклов.
Бициклические соединения
2.Конденсированные
3. Мостиковые
Слайд 39Ароматические соединения (арены) – группа карбоциклов, характеризующихся наличием ароматической системы. Ароматические
Слайд 40Бензоидные ароматические соединения
обязательной составной
частью молекулы
является бензольное ядро
Слайд 41Небензоидные ароматические соединения
структуры, отвечающие требованиям ароматич-ности, но лишенные шестичленных бензольных
Слайд 511.3 Номенклатура органических соединений
Номенклатура – это совокуп-ность названий веществ, их групп
Слайд 52Тривиальная
Названия соединений случайные,
обусловленные различными обстоятельствами
(в основе лежат различные отличительные
Слайд 531.Источники выделения
2. Отличительные свойства
3. Способы выделения (получения).
4. Область
Слайд 54Рациональная
все соединения в данном
гомологическом ряду
рассматриваются как
производные простейшего
ряда
Слайд 57Радикально-функциональная номенклатура
Применяется для названий моно- и бифункциональных соединений некоторых классов
соединений (терпены, стероиды, алкалоиды и другие)
Слайд 58В названии старшей характеристической группы не применяются суффиксы, называется радикал
Слайд 62В настоящее время признанной во всём мире является номенклатура IUPAC
International
Applied Chemistry
(Международный союз чистой и
прикладной химии).
Слайд 63Её ещё называют международной,
систематической, Женевской (т.к. основы заложены в 1892
Слайд 64Название IUPAC номенклатура получила на ХIХ конгрессе Международного союза чистой и
Слайд 65Общая схема составления названий
Префикс + корень + суффикс + окончание
Боковые цепи
и
функцио-нальные
группы в едином
алфавитном порядке
Родона-чальная
структура;
углерод-ная цепь
или цикл
Степень
насы-щенности
ан, ен, ин
Старшая
характе-рис-
тическая
группа
Слайд 66Только в префиксе
Cl, Br, I, F
- SR алкилтио
арилтио
- NO2 нитро
- NO нитрозо
- N = N- азо






























![КонденсированныеСпирановыеСпиро-[2,5]-октанБицикло-[4,2,0]-октан](/img/tmb/2/134796/f09f10558a9363b83177e5e098bac200-800x.jpg)
![МостиковыеБицикло-[3,2,1]-октан](/img/tmb/2/134796/e877adbb3cdc80a08aa0db3bacafdf7d-800x.jpg)