- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс лекций по химии презентация
Содержание
- 1. Курс лекций по химии
- 2. Общая характеристика элементов подгруппы азота. Азот. Аммиак.
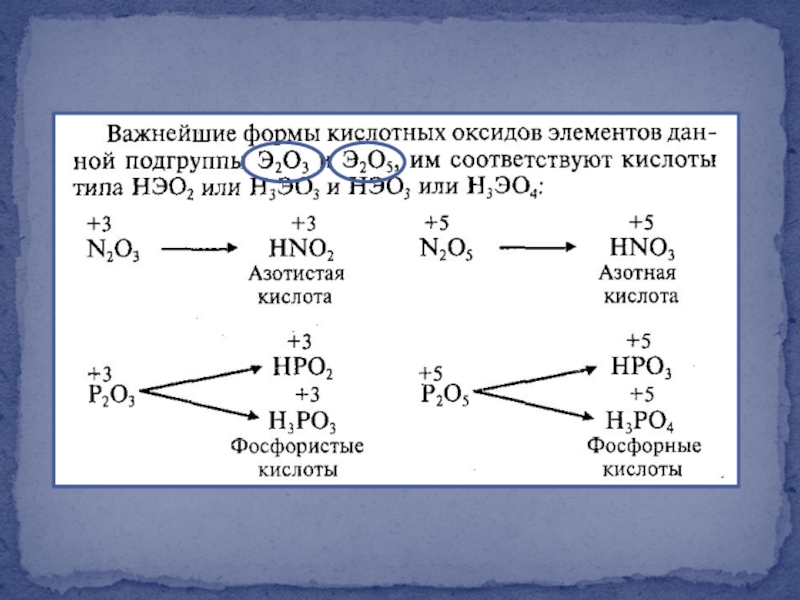
- 3. Азот, фосфор и
- 7. Аммиак Фосфин Арсин Стибин Висмутин
- 8. Водные растворы аммиака и фосфина представляют собой слабые основания
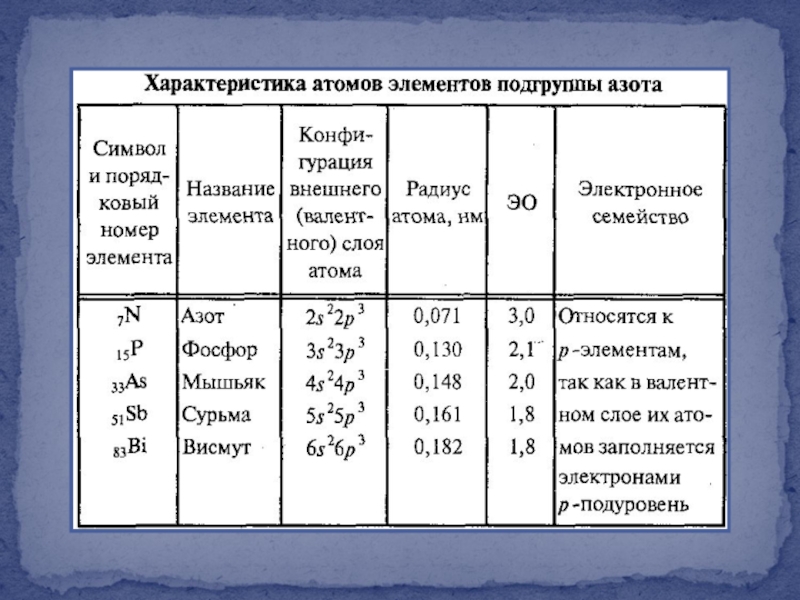
- 9. Неметалл главной подгруппы пятой группы Порядковый номер
- 10. Способы получения Промышленные Лабораторные
- 11. Физические свойства
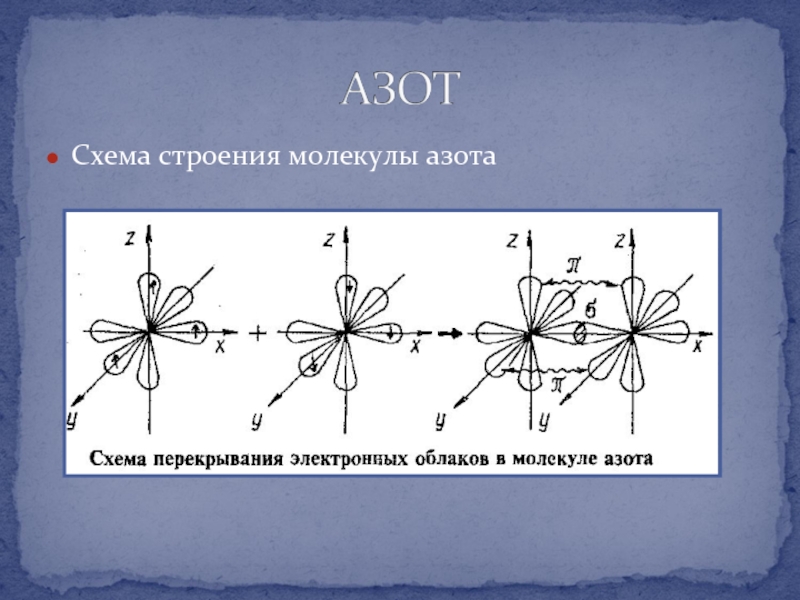
- 12. Схема строения молекулы азота
- 13. В химических реакциях азот может быть как окислителем, так и восстановителем Азот как окислитель
- 14. Азот как восстановитель
- 15. Получение В промышленности Лабораторные способы
- 16. Физические свойства
- 17. Кислотно-основные свойства
- 19. Окислительно-восстановительные свойства
- 21. Термическое разложение солей аммония
- 23. Бесцветный газ Со слабым запахом
- 24. Бесцветный газ Без запаха Малорастворим
- 25. Ядовитый газ Бурого цвета Хорошо
- 26. При растворении в щелочах образуются две
- 27. Темно-синяя жидкость Кислотный оксид
- 28. Физические свойства Бесцветная жидкость Имеет резкий запах
- 29. Химические свойства Кислотно-основные свойства
- 30. Окислительно-восстановительные свойства Азотная кислота –
- 35. Получение В промышленности – процесс идет в три стадии
- 36. В лаборатории
- 39. Характерные степени окисления
- 40. Получение
- 41. Физические свойства Несколько аллотропных модификаций
- 43. Химические свойства Окислительно-восстановительные свойства
- 48. Получение Физические свойства
- 49. Химические свойства Кислотно-основные свойства
- 50. Окислительно-восстановительные
- 51. Бесцветный порошок Без запаха Кислотный оксид При растворении в воде дает следующие кислоты
- 53. Бесцветное кристаллическое вещество Хорошо растворима
- 54. Получение В промышленности – экстракционный метод
- 56. Гидролиз солей фосфорной кислоты
Слайд 2Общая характеристика элементов подгруппы азота. Азот. Аммиак. Соли аммония.
Оксиды азота. Азотная
кислота.
Фосфор и его соеднения.
Фосфор и его соеднения.
Слайд 3
Азот, фосфор и мышьяк – неметаллы
Сурьма и висмут металлы
Характерная валентность равна III
Фосфор, мышьяк, сурьма и висмут могут проявлять валентность V, азот только III
Характерные степени окисления от -3 до +5
Слайд 9Неметалл главной подгруппы пятой группы
Порядковый номер 7
Относительная атомная масса 14
Простое вещество
состоит из двухатомных молекул
Валентность III, IV
Степени окисления
Валентность III, IV
Степени окисления
Слайд 11Физические свойства
Химические свойства
Азот малоактивное вещество
Энергия связи в
молекуле азота 945 кДж/моль
Азот вступает в реакции только при высоких температурах и давлении
Азот вступает в реакции только при высоких температурах и давлении
Слайд 13В химических реакциях азот может быть как окислителем, так и восстановителем
Азот
как окислитель
Слайд 16Физические свойства
Химические свойства
Атом азота в аммиаке имеет неподеленную
электронную пару эта пара может участвовать в образовании донорно-акцепторной связи
Аммиак обладает основными свойствами
Аммиак обладает основными свойствами
Слайд 20
Все соли аммония хорошо растворимы в
воде
Имеют общие свойства солей (взаимодействие со щелочами, гидролиз)
Особые свойства – термическое разложение
Имеют общие свойства солей (взаимодействие со щелочами, гидролиз)
Особые свойства – термическое разложение
Слайд 23
Бесцветный газ
Со слабым запахом и сладковатым вкусом
Хорошо растворим в воде,
но не взаимодействует с ней
При высокой температуре разлагается по схеме:
Получение – термическое разложение нитрата аммония
При высокой температуре разлагается по схеме:
Получение – термическое разложение нитрата аммония
Слайд 24
Бесцветный газ
Без запаха
Малорастворим в воде
Образуется при сильных электрических разрядах или
при высокой температуре
Получение
В промышленности – каталитическим окислением аммиака
В лаборатории – действием 50% азотной кислоты на металлы
На воздухе легко окисляется
Получение
В промышленности – каталитическим окислением аммиака
В лаборатории – действием 50% азотной кислоты на металлы
На воздухе легко окисляется
Слайд 25
Ядовитый газ
Бурого цвета
Хорошо растворим в воде
Смешанный оксид, которому соответствует две
кислоты
При взаимодействии с водой в присутствии кислорода (на воздухе ) образуется только азотная кислота
При взаимодействии с водой в присутствии кислорода (на воздухе ) образуется только азотная кислота
Слайд 26 При растворении в щелочах образуются две соли:
В избытке
кислорода образуется только нитрат
Получение
В промышленности – путем окисления NO
В лаборатории – взаимодействием концентрированной азотной кислотой с тяжелыми металлами
Получение
В промышленности – путем окисления NO
В лаборатории – взаимодействием концентрированной азотной кислотой с тяжелыми металлами
Слайд 28Физические свойства
Бесцветная жидкость
Имеет резкий запах
Легко испаряется
Кипит при температуре 83°С
Смешивается с водой
в любых отношениях
Концентрированной считается 63% азотная кислота
При хранении довольно легко (особенно на свету) разлагается
Концентрированной считается 63% азотная кислота
При хранении довольно легко (особенно на свету) разлагается
Слайд 30Окислительно-восстановительные свойства
Азотная кислота – один из сильнейших окислителей
Взаимодействует практически
со всеми металлами (кроме золота и платины)
Слайд 53
Бесцветное кристаллическое вещество
Хорошо растворима в воде
Трехосновная, средней силы
Диссоциация
ступенчато
Слайд 54Получение
В промышленности – экстракционный метод
В лаборатории – окислением фосфора
разбавленной азотной кислотой