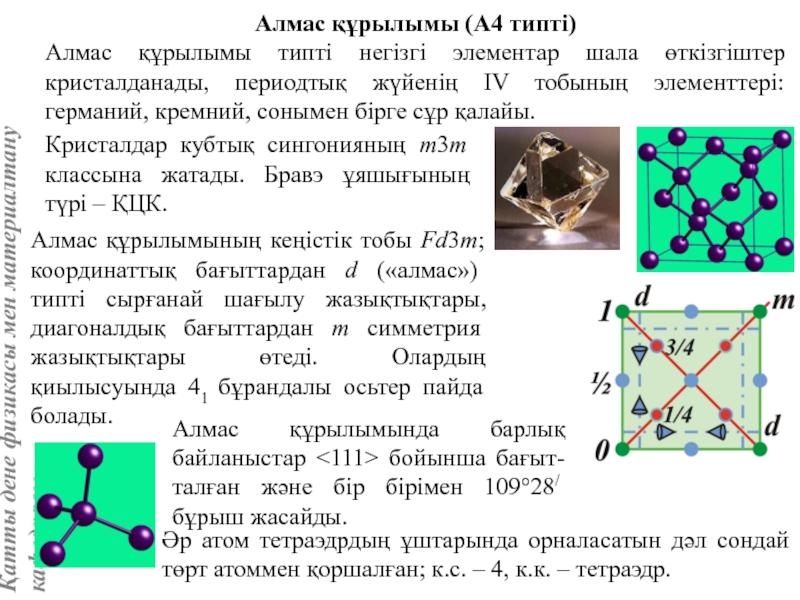
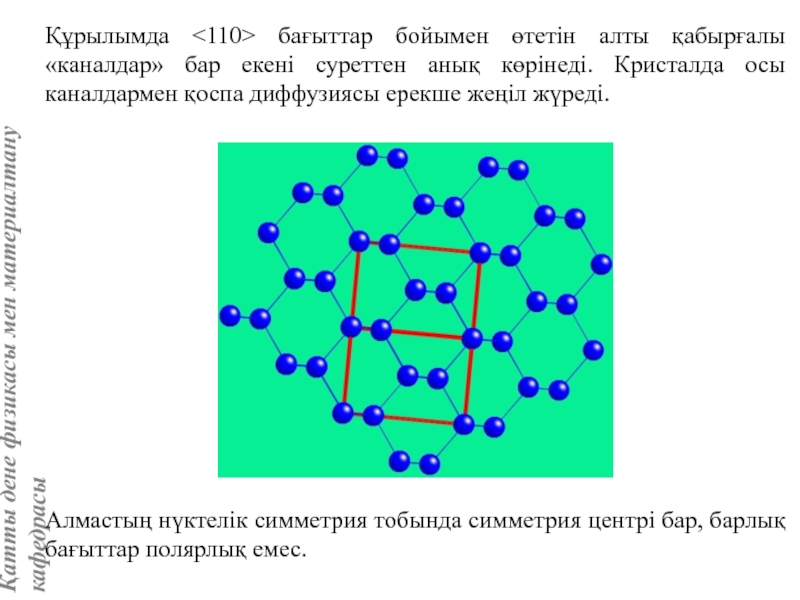
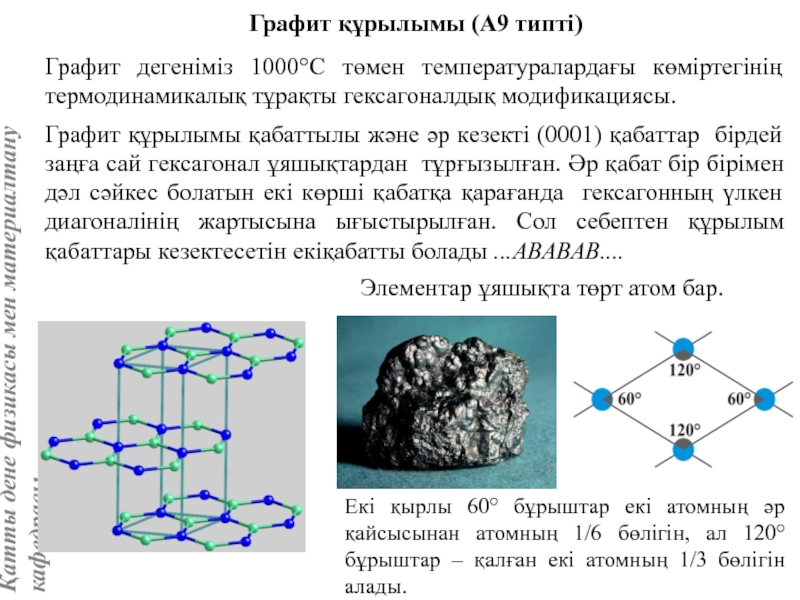
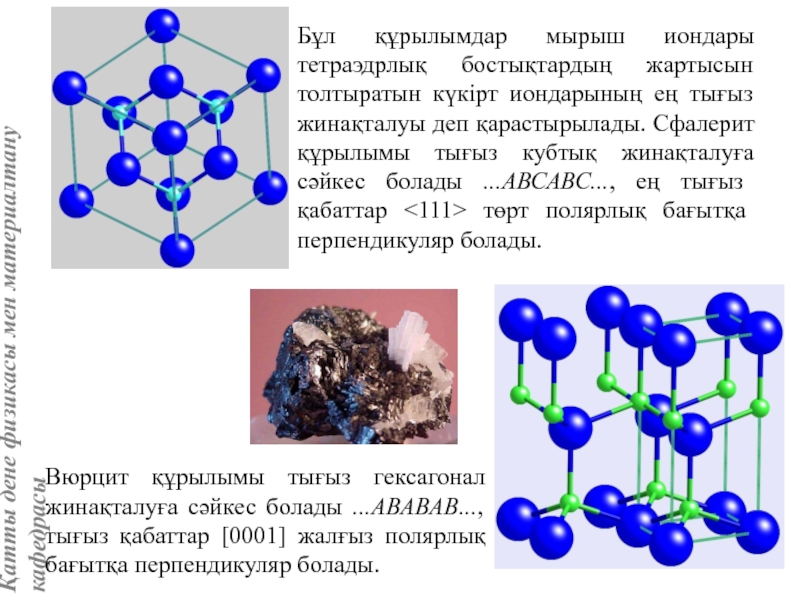
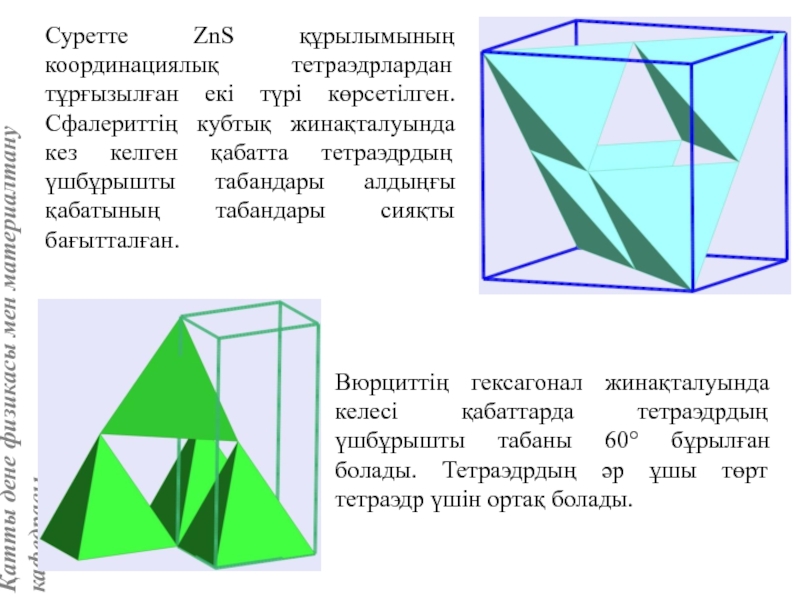
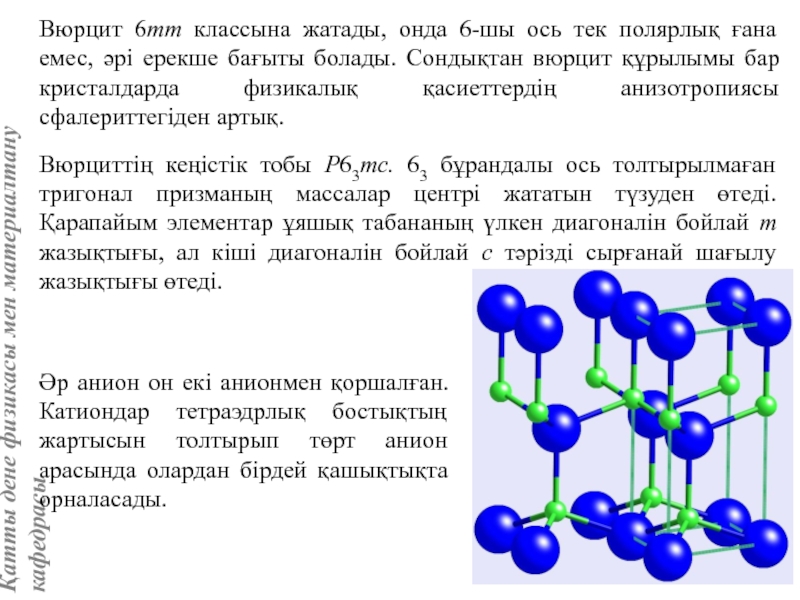
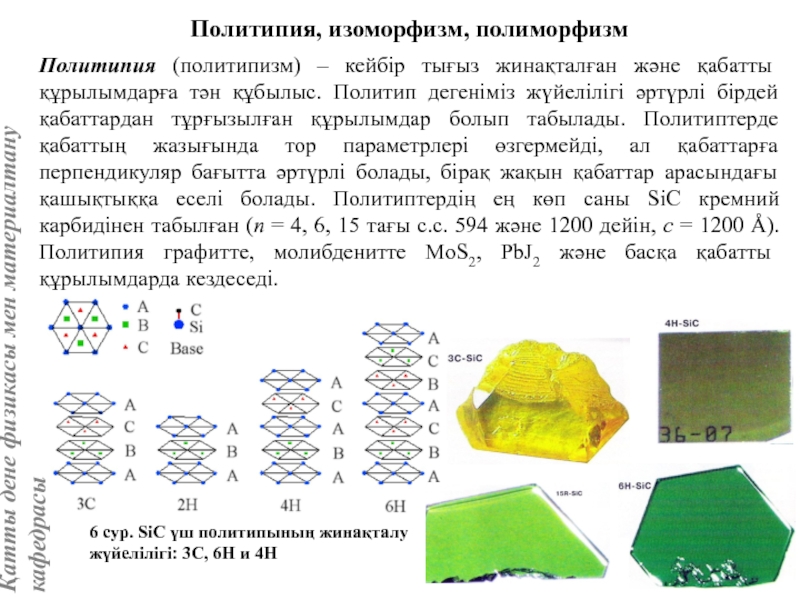
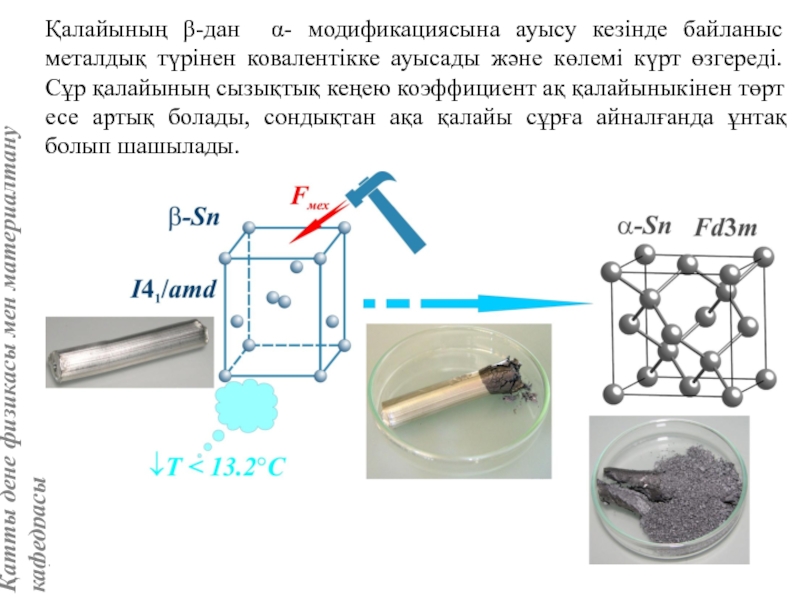
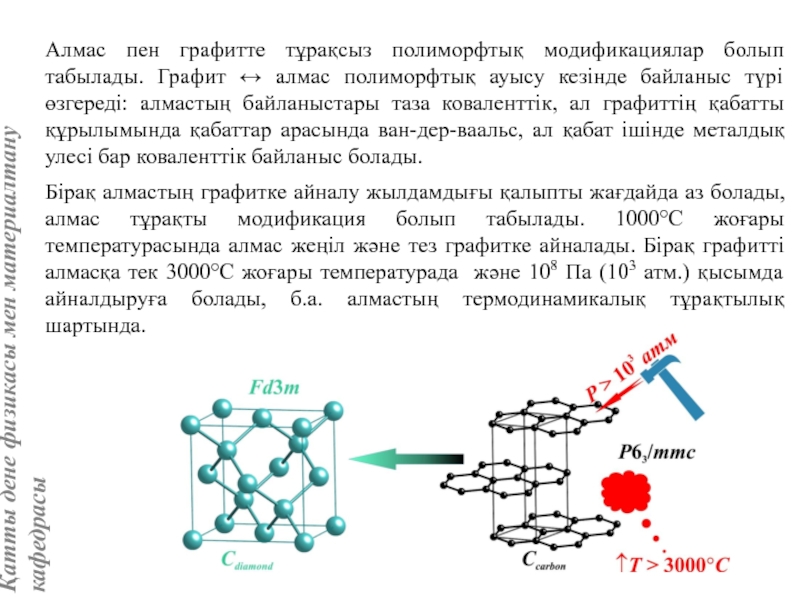
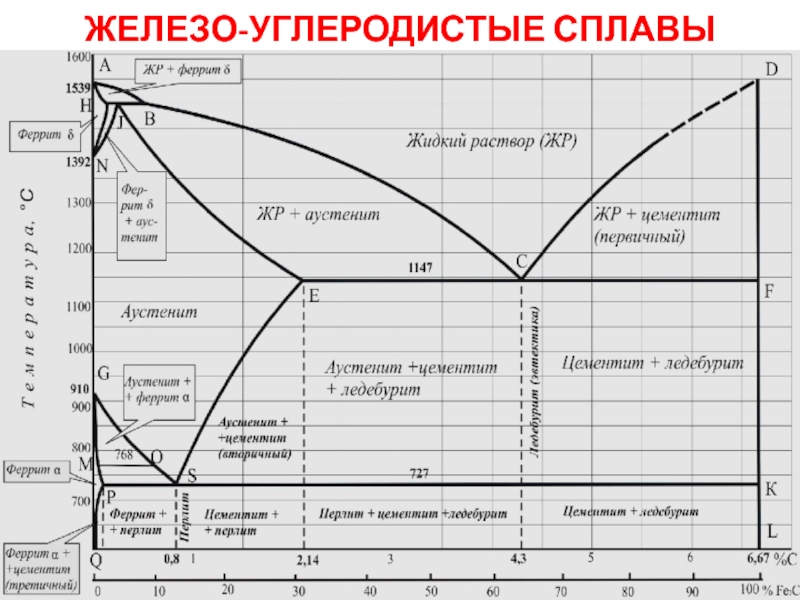
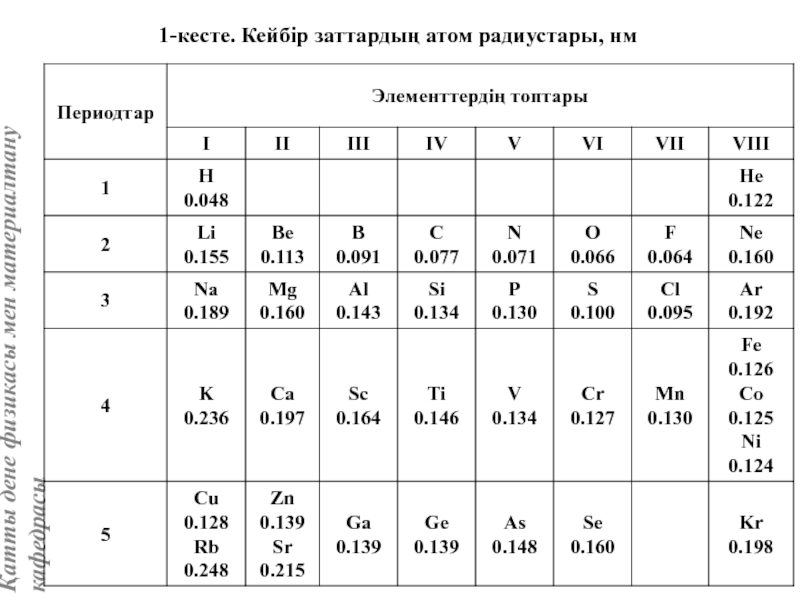
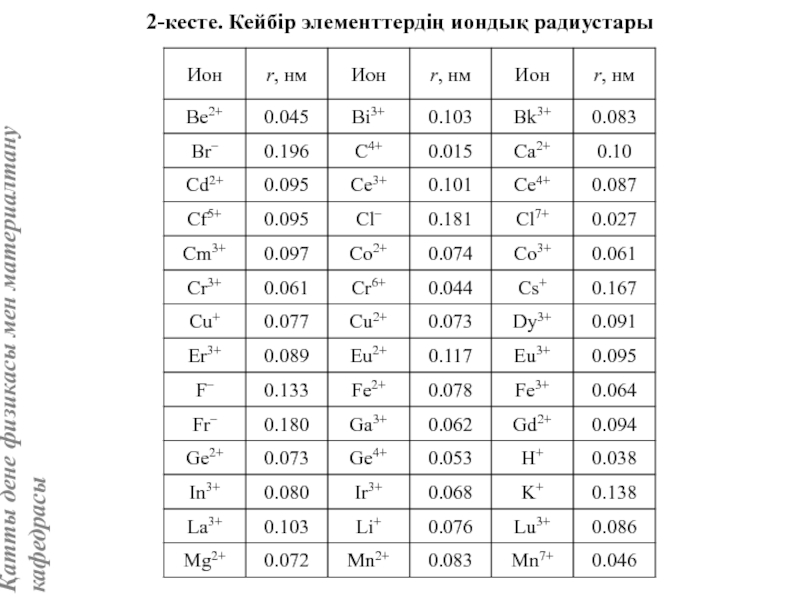
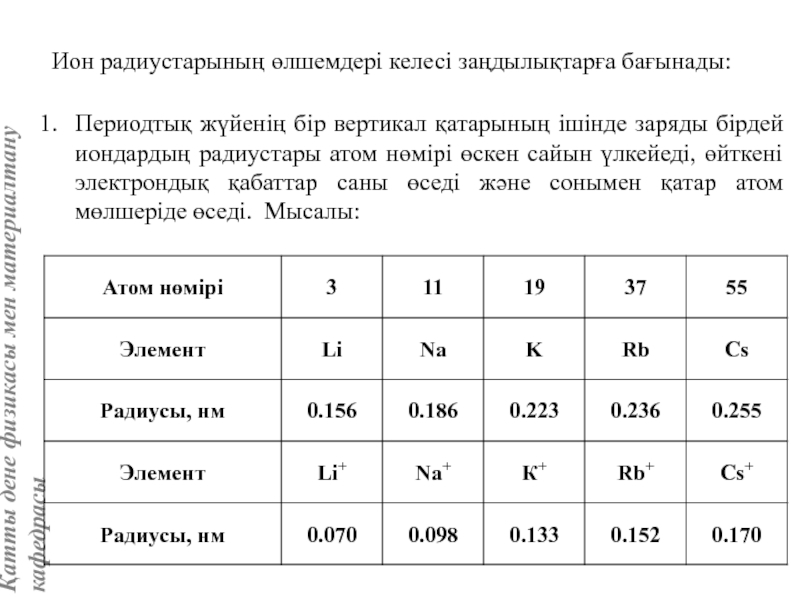
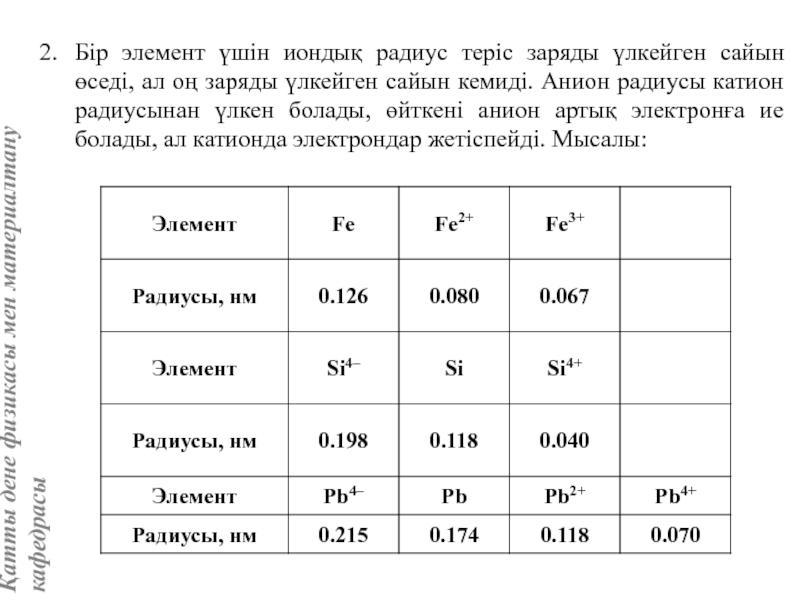
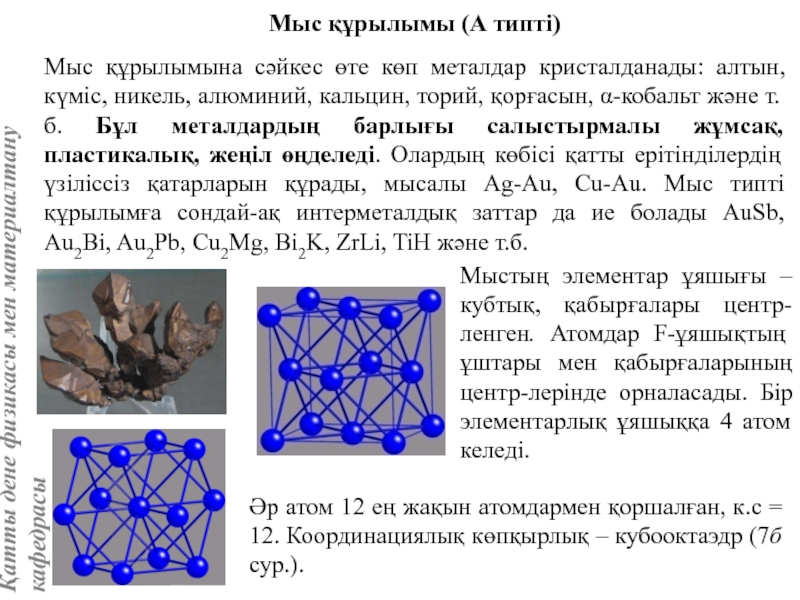
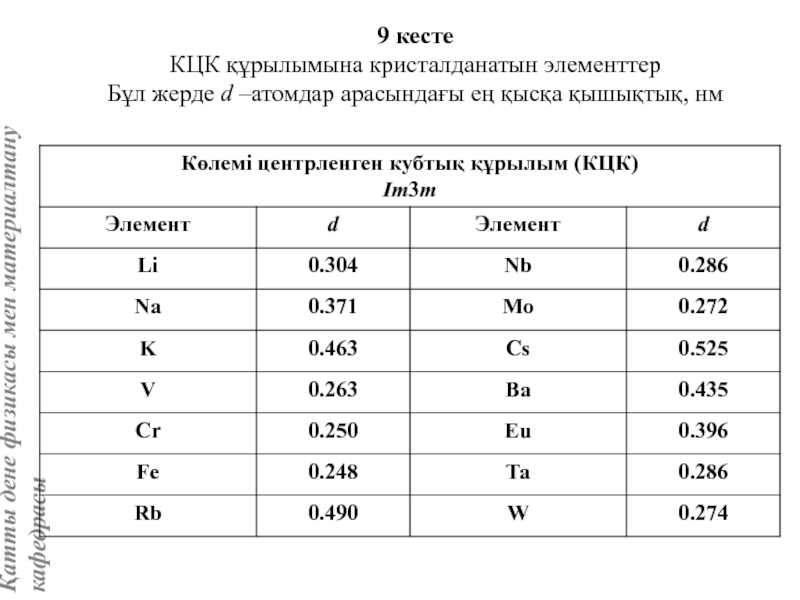
жатады: хром, ванадий, молибден, ниобий, тантал, β-кобальт, α-темір (900° төмен және 1400°С жоғары, ал 910°-1400°С аралығында темір ҚЦК-құрылымға ие болады), титан, цирконий, гафний, сілтілі элементтер – литий, натрий, калий, рубидий, цезий, сілтілік жер элементтері – кальций, стронций, барин, актинидтер – уран, нептуний, плутоний. Интерметалдық заттардан КЦК-құрылымда кристалданатындар AgZn, Cu3Al, CoAl, Cu5Sn, LiAg, LiAl және т.б.
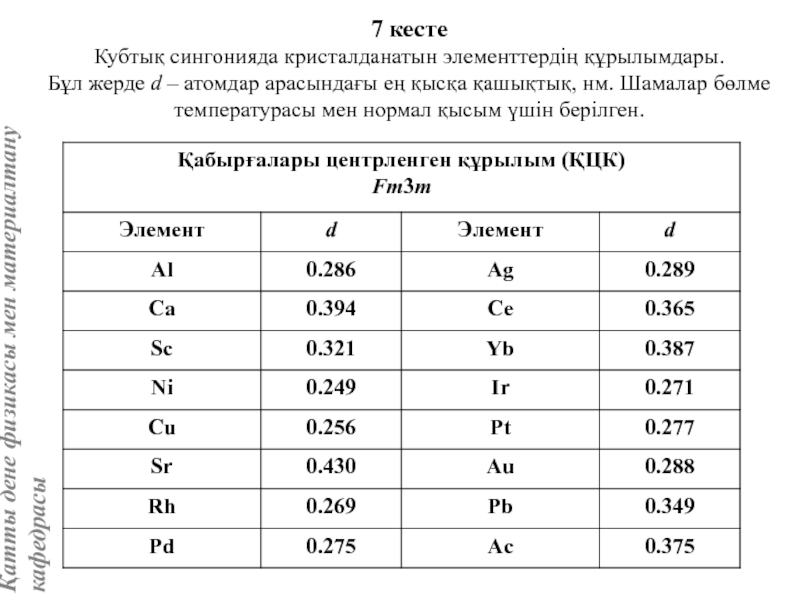
Вольфрам құрылымы көлемі центрленген кубтық КЦК ұяшығымен сипатталады. Атомдар ұяшықтың ұштары мен центрінде орналасады, яғни ұяшыққа екі атом келеді.
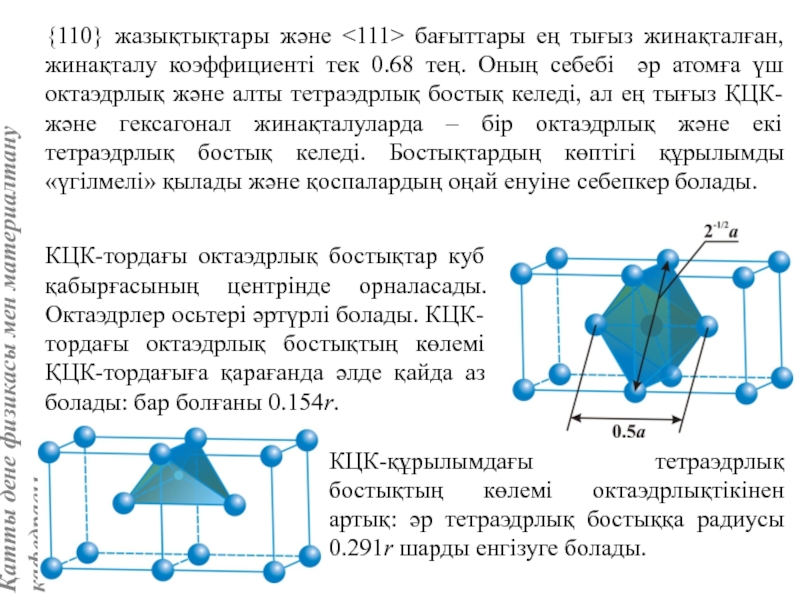
Айналық шағылу жазықтықтары элементар ұяшықтың қабырғасы мен қабырғалар диагональдеріне параллель өтеді. Ұяшық базисы атомдарының координаттары: [[000]], [[1/2, 1/2, 1/2]].



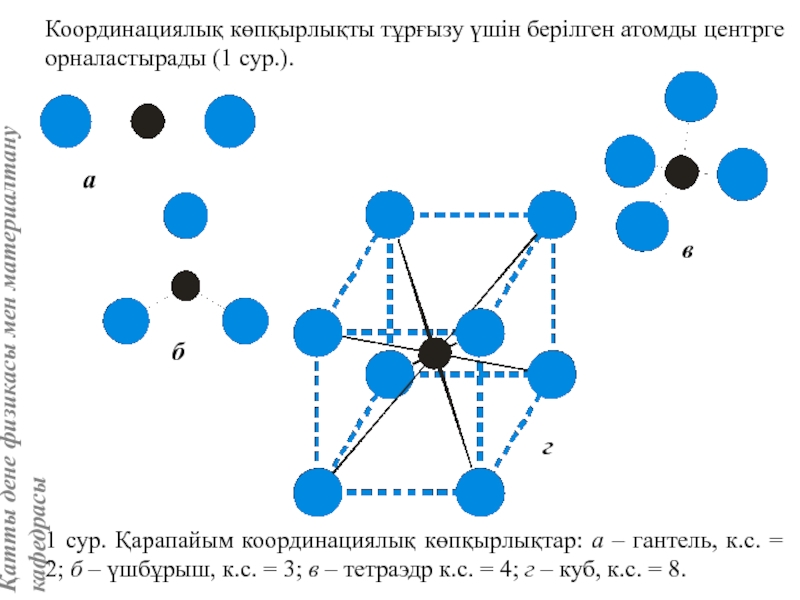
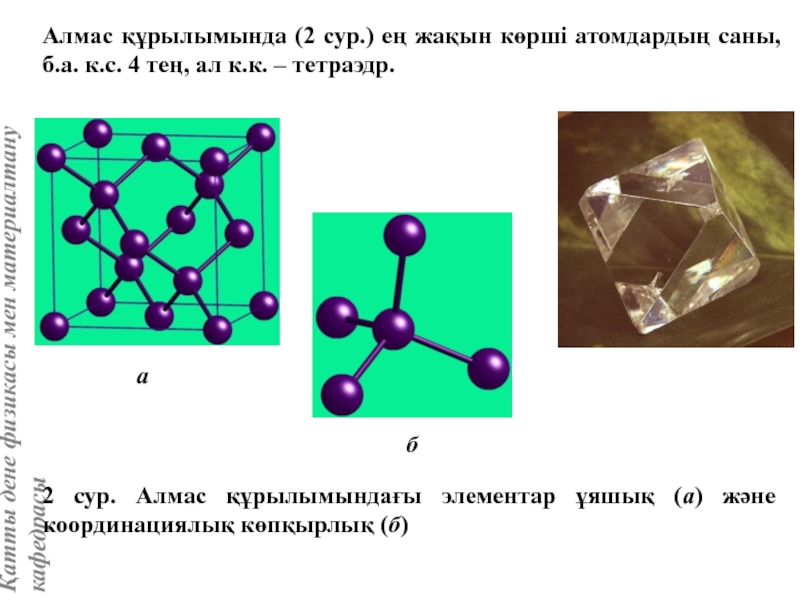
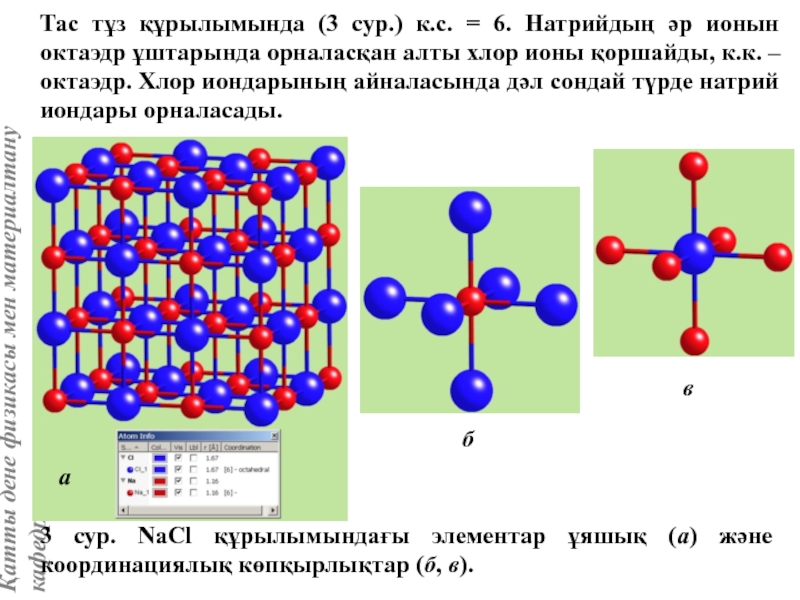
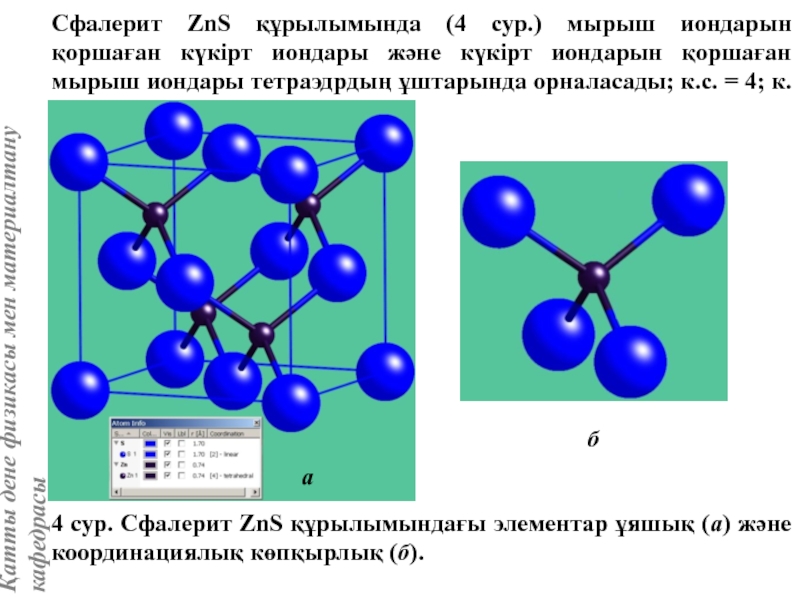
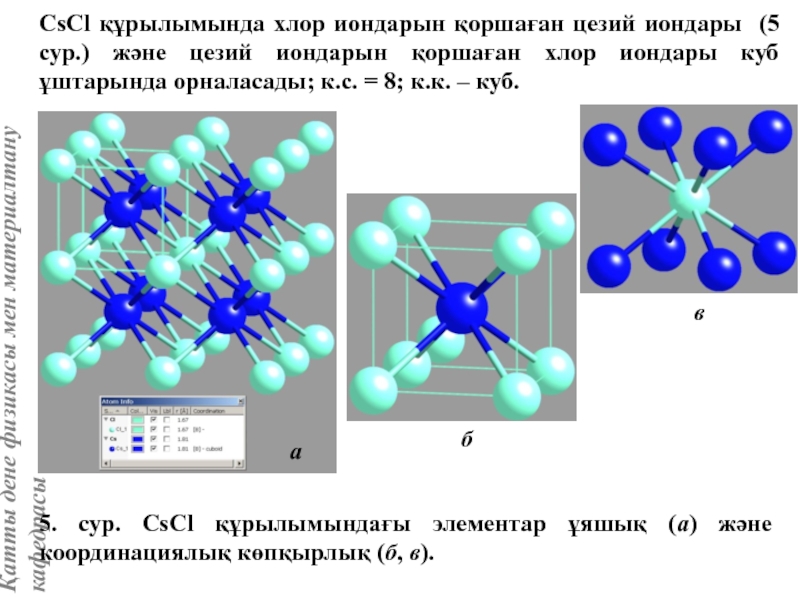
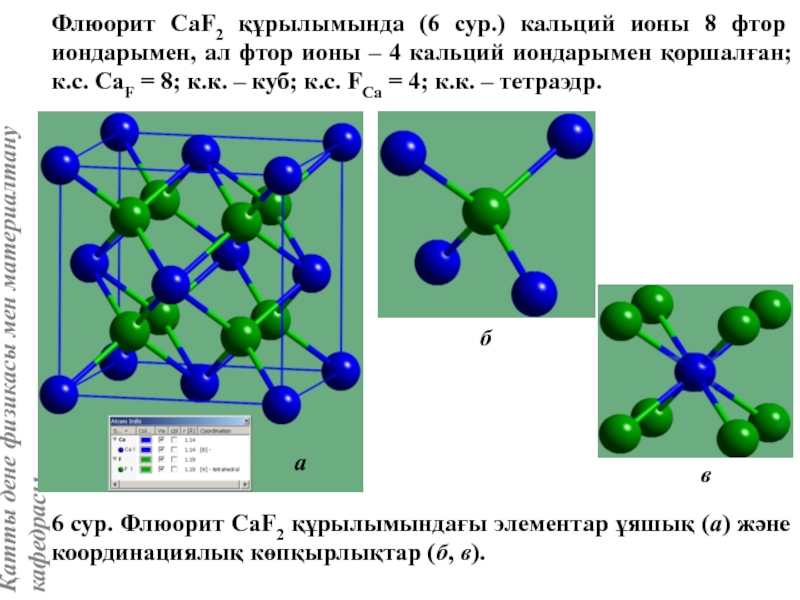
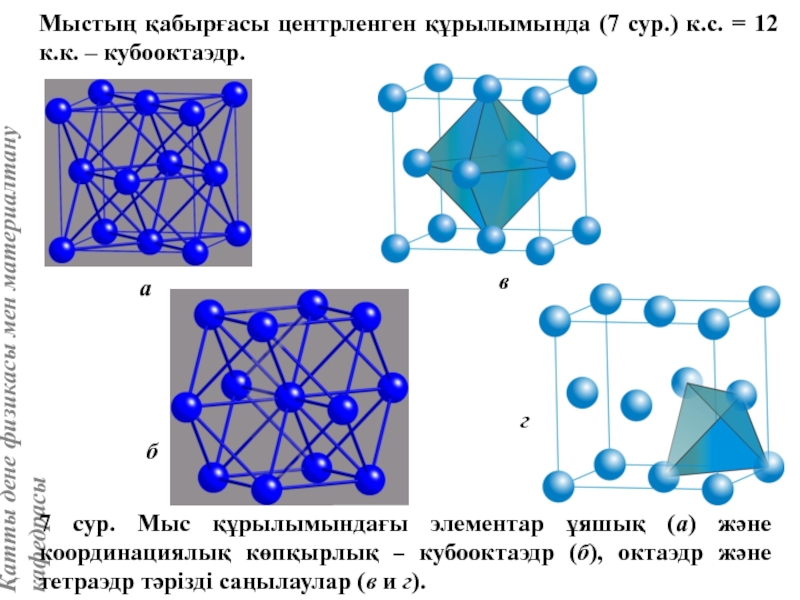
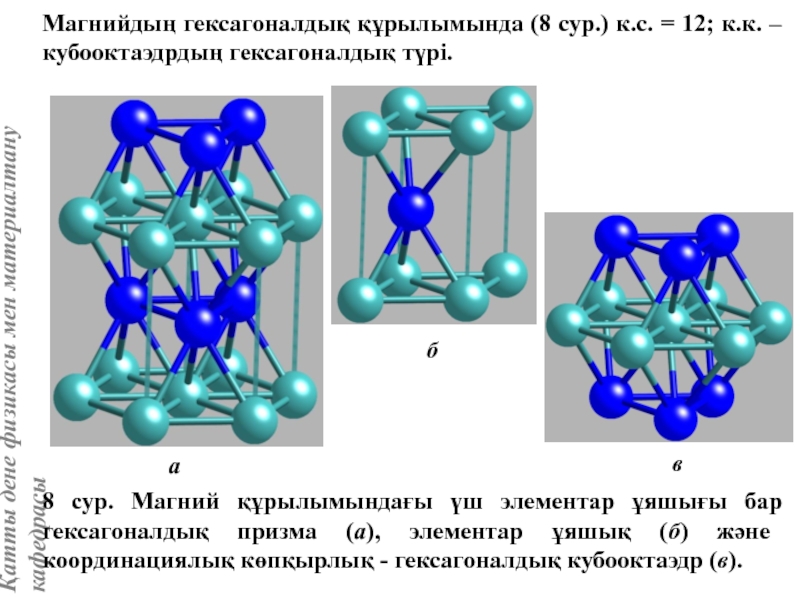

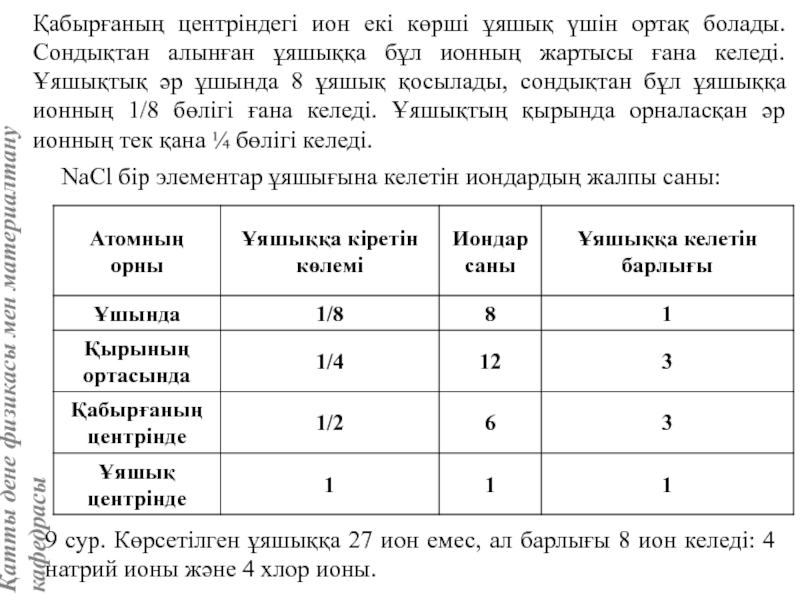
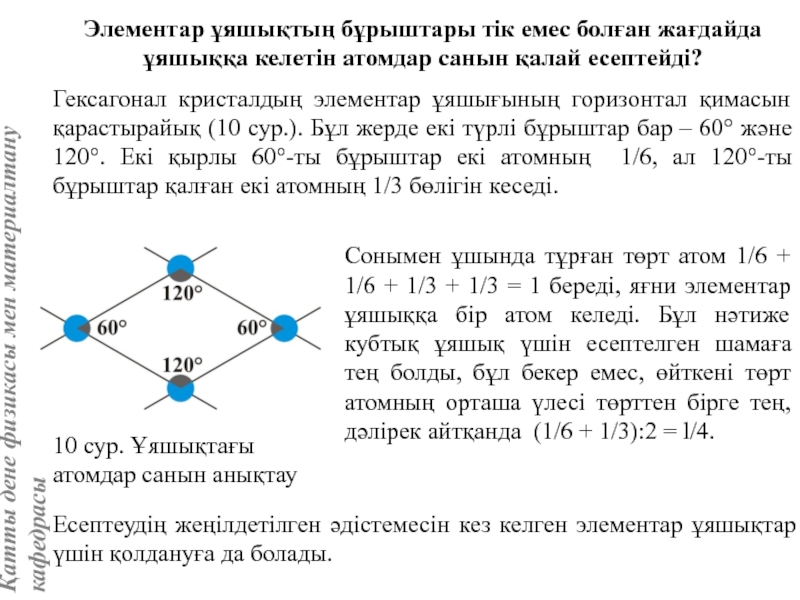
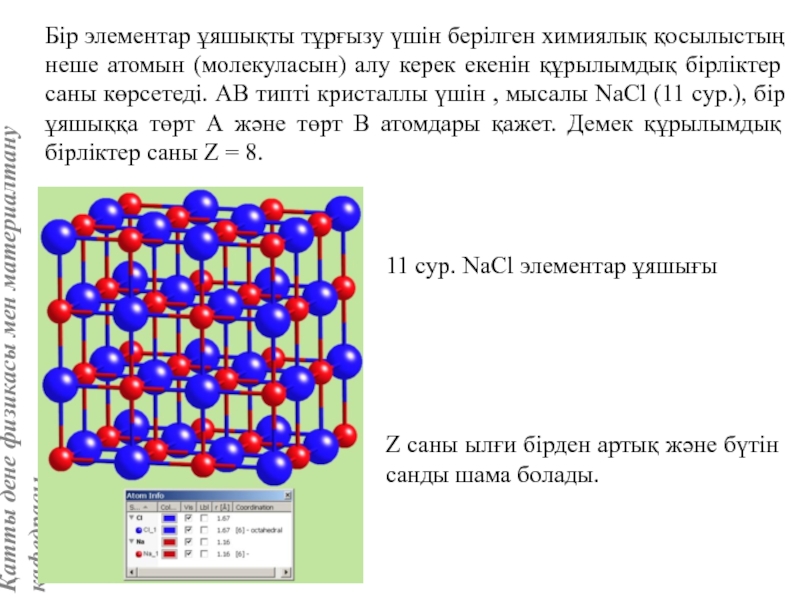
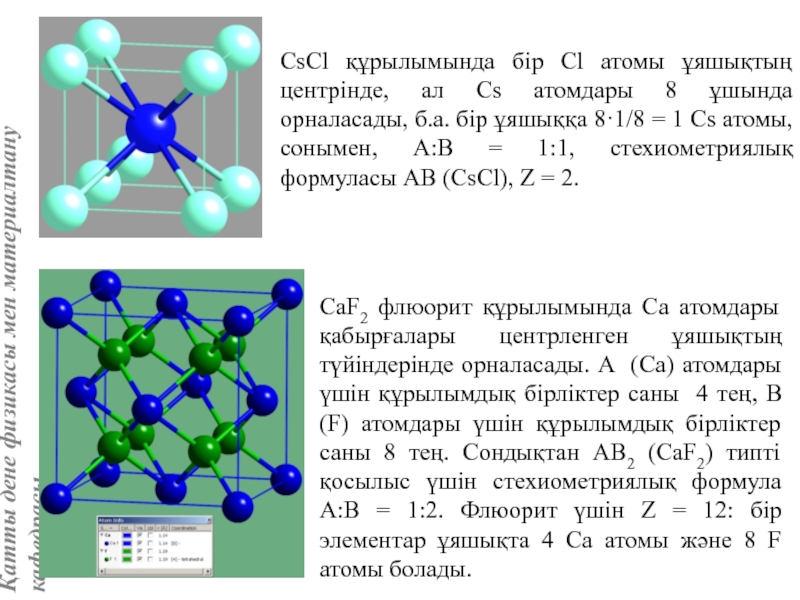


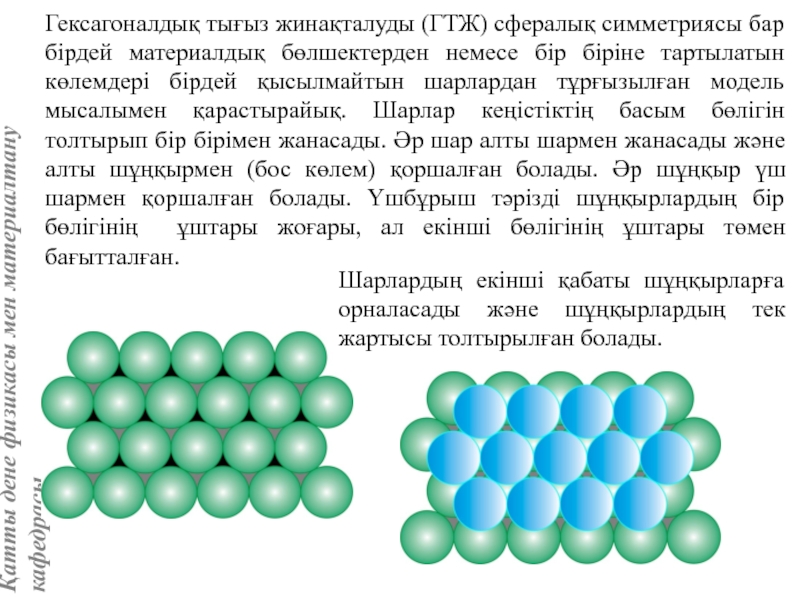

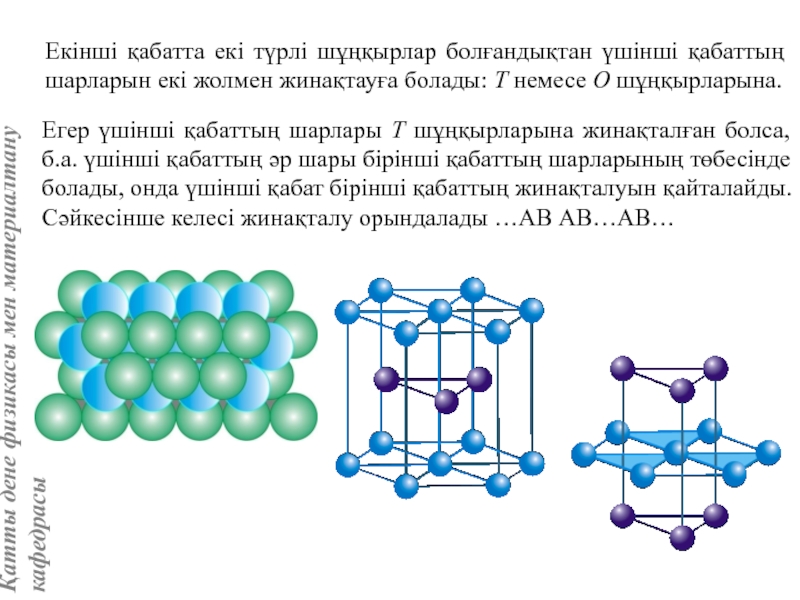
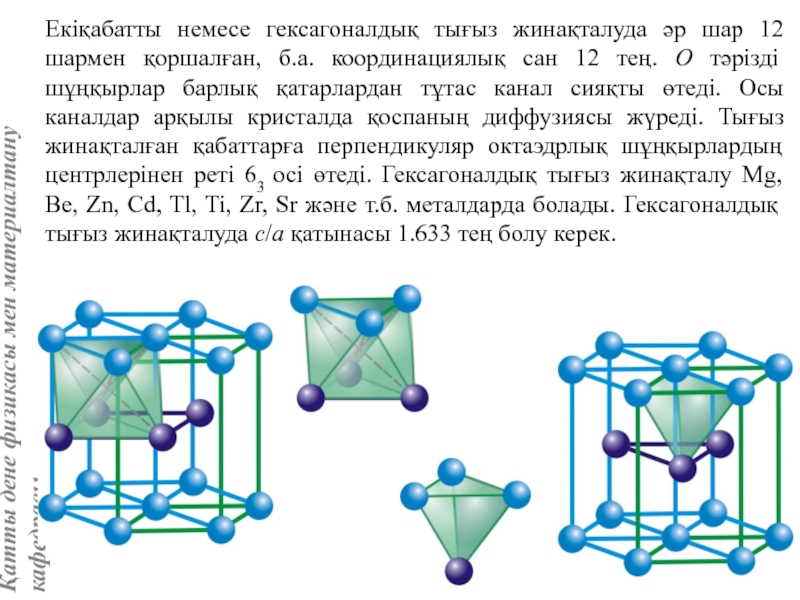
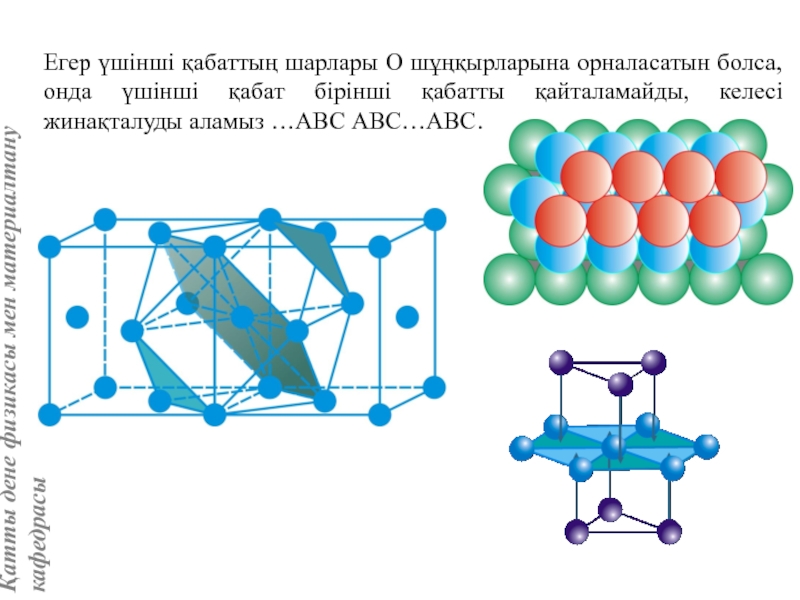
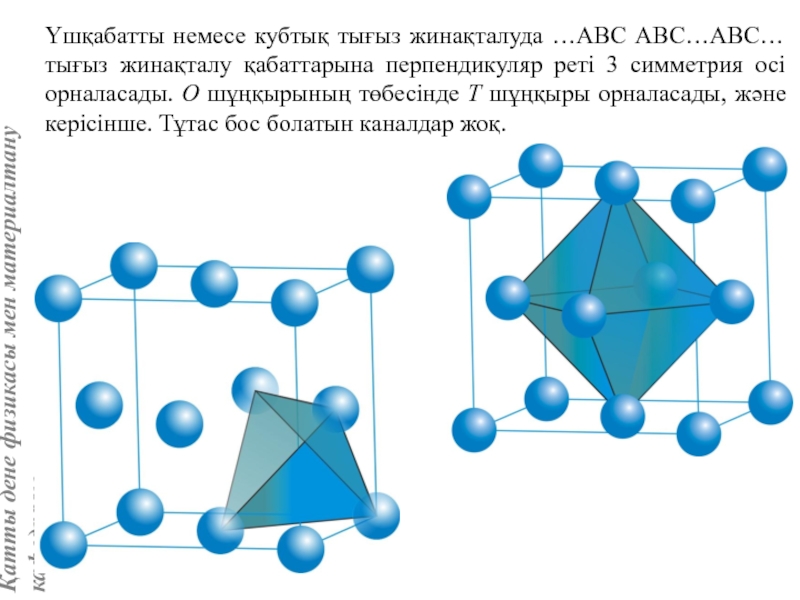







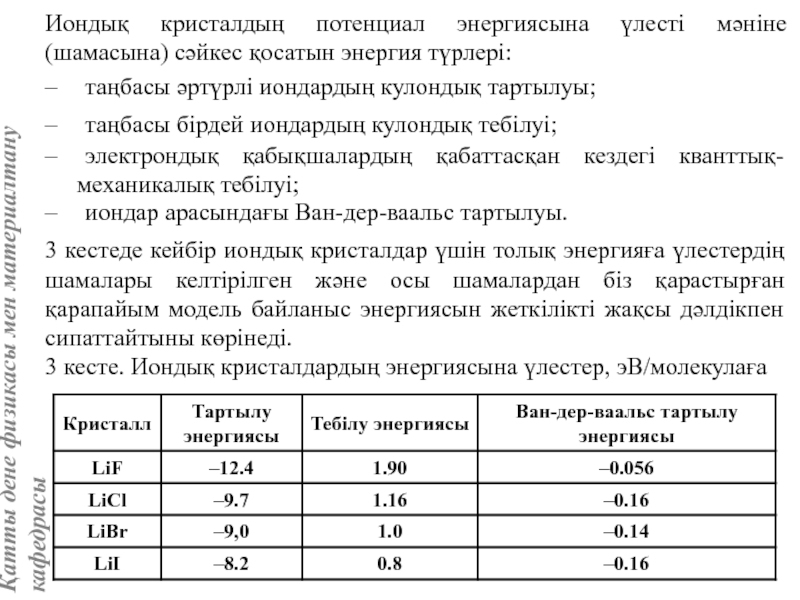


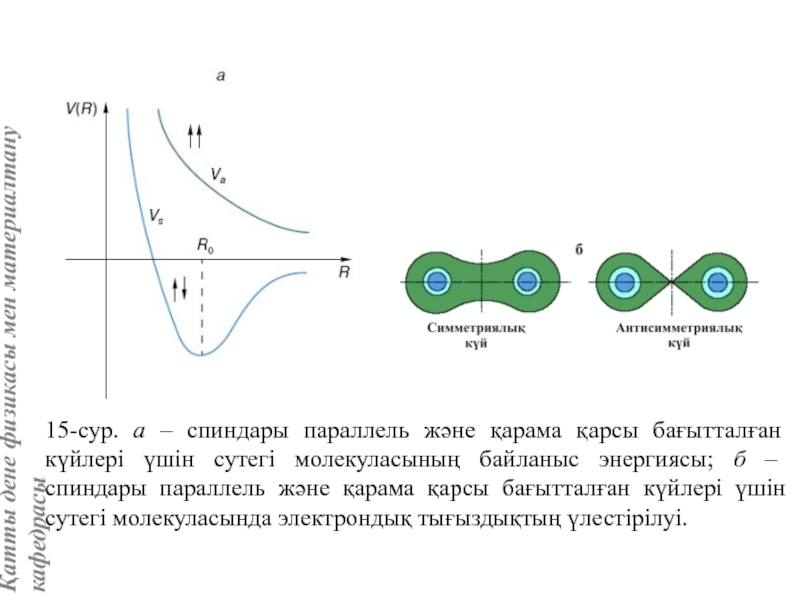




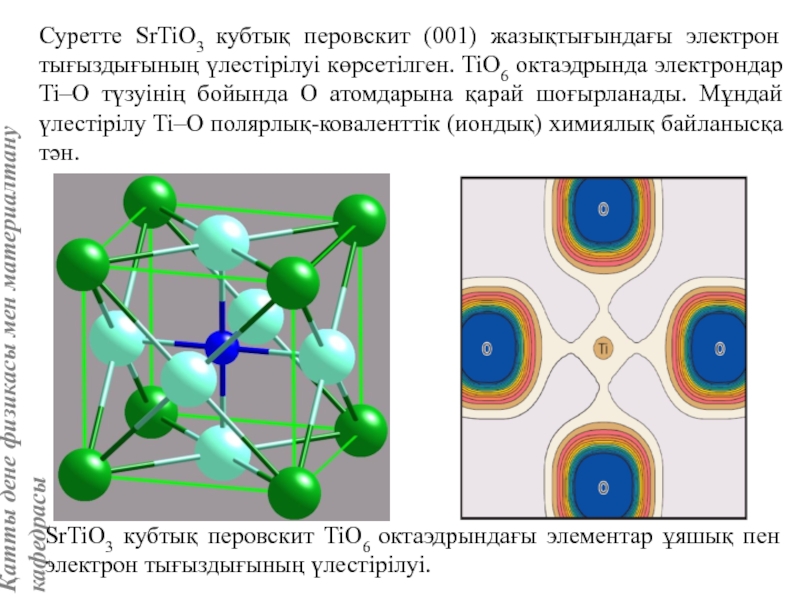








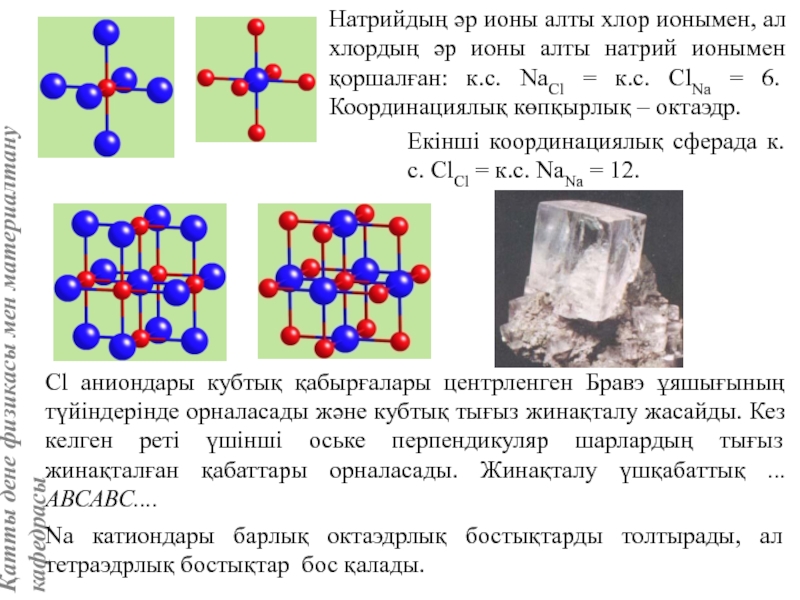
![Тас тұзы құрылымы (В1 типті)NaCl құрылымын бір ұяшықтың [[000]] түйіні екінші ұяшықтың [[1/2,1/2,1/2]] түйінімен сәйкес](/img/tmb/5/415344/27464ea94246a0c12aa20353b7ef52c1-800x.jpg)