- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коррозия металлов презентация
Содержание
- 1. Коррозия металлов
- 2. Коррозия металлов и защита от нее.
- 3. Коррозия – самопроизвольно протекающий процесс разрушения металлов
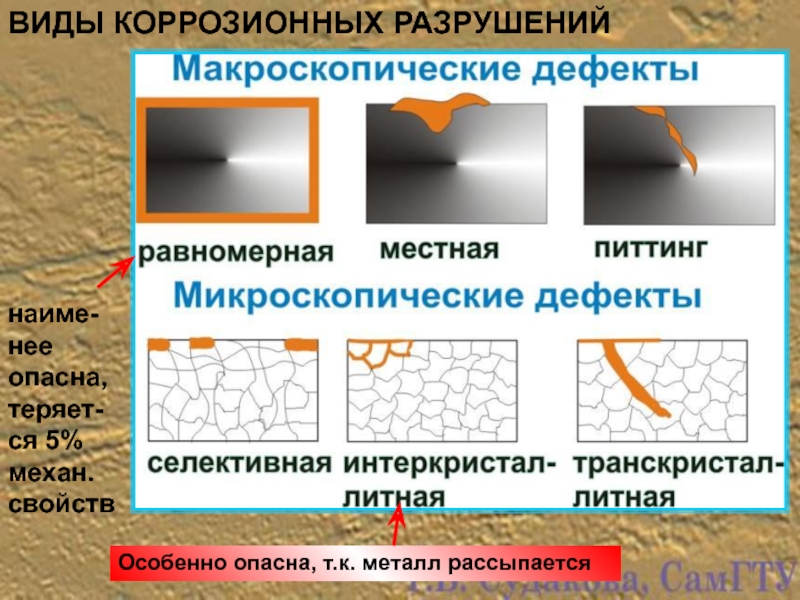
- 4. ВИДЫ КОРРОЗИОННЫХ РАЗРУШЕНИЙ Особенно опасна, т.к. металл рассыпается наиме-нее опасна, теряет-ся 5% механ. свойств
- 5. Например, питтинг образуется при литье по
- 6. ТИПЫ КОРРОЗИОННЫХ ПРОЦЕССОВ: Химическая коррозия: обмен электронами
- 7. Газовая коррозия: в среде агрессивных газов (О2,
- 8. Все металлы окисляются кислородом воздуха:
- 9. Газовая коррозия углеродистой стали, чугуна:
- 10. Электрохимическая коррозия может возникать: - при контакте
- 11. По степени термодинамической неустойчивости к электрохимической коррозии:
- 12. 3. Металлы промежуточной термодинамической стабильности: Bi, Sb,
- 13. Коррозия железа с примесями меди: В кислой
- 14. коррозия углеродистой стали в различных средах: в
- 15. Различные содержания кислорода также приводят к образованию
- 16. Во всех вариантах для появления катодно-анодных участков
- 17. Нержавеющая сталь – сплав, содержащий как минимум
- 18. ЗАЩИТА ОТ КОРРОЗИИ Изоляция металлов от агрессивной
- 19. Защитные слои от высокотемпературной коррозии могут
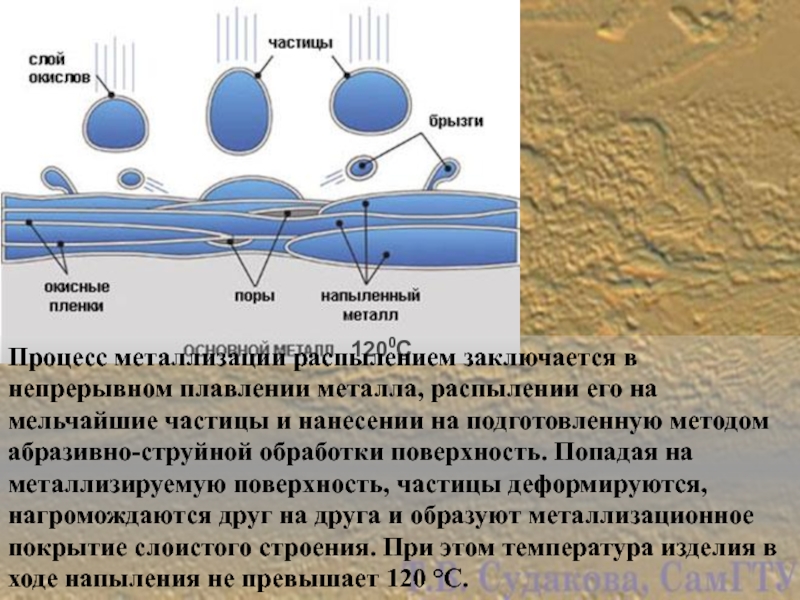
- 20. 1200С Процесс металлизации распылением заключается в непрерывном
- 21. При металлизации сцепление частиц с основанием происходит
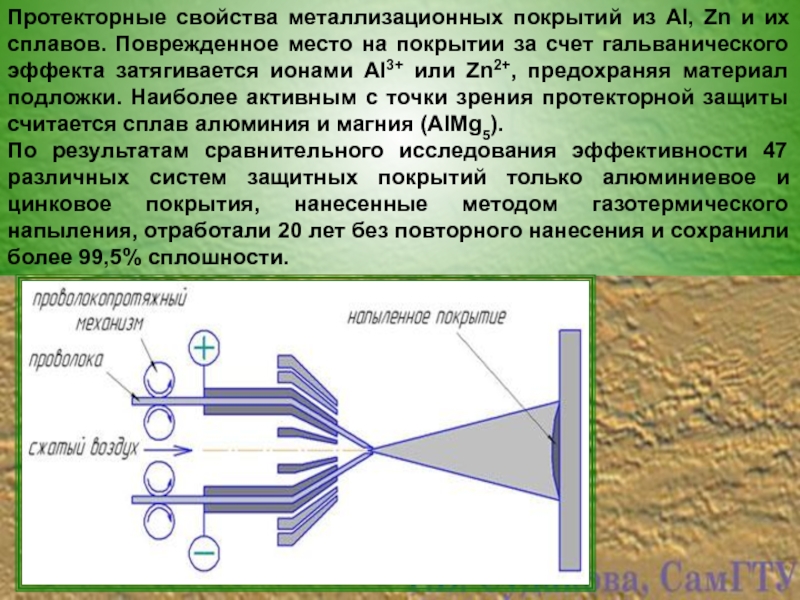
- 22. Протекторные свойства металлизационных покрытий из Al, Zn
- 23. Сплавы Zn и Al (Zn/Al15, Zn/Al5) создают
- 24. Zn и Al образуют плотный слой продуктов
- 25. металлические неметаллические Zn, Al, Sn, Cd,
- 26. Ингибирование коррозионно-активной среды. Ингибиторы – вещества,
- 27. Пример: для защиты стальных трубопроводов используют Са(НСО3)2.
- 28. Катодная защита: потенциал металла специально сдвигают из
- 29. Основные протекторы для стали: Mg, Al, Zn
- 30. Схема расположения анодов на автомобилях ГАЗель (рекомендуемое
- 31. Метод внешнего потенциала – защищаемое изделие или
- 32. Коррозия трубопроводов в грунте за счет неодно-родности
- 33. Цветная нержавеющая сталь Под воздействием различных электрохимических
- 34. Ионноплазменное напыление нитрида титана на лист нержавеющей
Слайд 2Коррозия металлов и защита от нее.
1. Введение. Виды коррозионных разрушений.
2. Типы коррозионных процессов: химическая коррозия, электрохимическая коррозия.
3. Защита металлов от коррозии.
Слайд 3Коррозия – самопроизвольно протекающий процесс разрушения металлов в результате взаимодействия с
Me0 – nē → Men+ ΔG < 0, ΔS > 0
ЭНЕРГИЯ ВЫДЕЛЯЕТСЯ И РАССЕИВАЕТСЯ В ОКРУЖАЮЩЕЙ СРЕДЕ
ΔG < 0
ПРОДУКТЫ КОРРОЗИИ РАССЕИВАЮТСЯ В ОКРУЖАЮЩЕЙ СРЕДЕ
ΔS > 0
процесс самопроизвольный и необратимый !!!
МЕТАЛЛ ОКИСЛЯЕТСЯ
Слайд 4ВИДЫ КОРРОЗИОННЫХ РАЗРУШЕНИЙ
Особенно опасна, т.к. металл рассыпается
наиме-нее опасна, теряет-ся 5% механ.
Слайд 5
Например, питтинг образуется при литье по выплавляемым моделям отливок из легированных
Слайд 6ТИПЫ КОРРОЗИОННЫХ ПРОЦЕССОВ:
Химическая коррозия: обмен электронами непосредственно между металлом и окислителем
m
Электрохимическая коррозия – происходит в электролитной среде под действием внутренних микро- или макрогальванических пар или под действием внешней разности потенциалов:
Me → Me+z + zē (1)
n ox + zē → m red (2),
где ox - окислитель, а red - восстановленная форма его.
Слайд 7Газовая коррозия: в среде агрессивных газов (О2, F2, Cl2, SO2, NO2
Высокотемпературная
Коррозия в жидкой среде (электролитной и неэлектролитной)
Атмосферная (во влажной атмосфере)
Почвенная
Блуждающими токами
Фреттинг – коррозия при трении.
ПО ТИПУ ГЕТЕРОГЕННОГО КОНТАКТА С ОКРУЖАЮЩЕЙ СРЕДОЙ:
Слайд 8Все металлы окисляются кислородом воздуха:
оксидная пленка тормозит окисление
Чем плотнее оксидная пленка на поверхности металла, тем лучше она защищает от коррозии!!!
Наиболее стойкие пленки образуют: Cd, Al, Cr, Ni, Sn, Zn, Ti.
Практически не защищены оксидными пленками при высоких температурах d-металлы с высокими степенями окисления, образующие летучие оксиды: Mо, W, Nb, Ta, Re.
Слайд 9Газовая коррозия углеродистой стали, чугуна:
окалина
Одновременно протекает обезуглероживание поверхностного слоя металла за счет превращения цементита
Fe3C + O2 → Fe + CO2
Fe3C + H2 → Fe + CH4 (напр. при литье по выплавляемым моделям в месте контакта металлического изделия с оболочковой формой)
2Zn + O2 → 2ZnO
6Li + N2 → 2Li3N
Fe + CO2 + H2O → FeCO3 + H2 2Fe + Cl2 → 2FeCl3
химическая коррозия
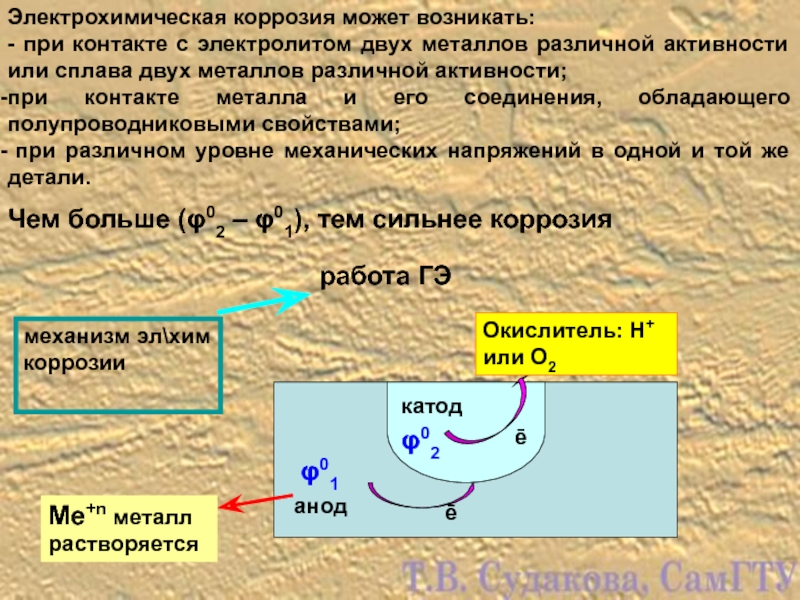
Слайд 10Электрохимическая коррозия может возникать:
- при контакте с электролитом двух металлов различной
при контакте металла и его соединения, обладающего полупроводниковыми свойствами;
при различном уровне механических напряжений в одной и той же детали.
механизм эл\хим коррозии
работа ГЭ
катод
анод
ē
ē
Окислитель: Н+ или О2
Ме+n металл растворяется
φ01
φ02
Чем больше (φ02 – φ01), тем сильнее коррозия
Слайд 11По степени термодинамической неустойчивости к электрохимической коррозии:
1. Металлы повышенной термодинамической
φ0 < - 0,413В
на катоде могут происходить реакции восстановления:
2Н2О + 2ē = 2ОН-- + Н2, φН2/2Н+ = - 0,413 В рН=7
2Н+ + 2ē = Н2, φН2/2Н+ = 0 В рН=0
О2 + Н2О + 4ē = 4ОН--, φ = 0,816 В рН=7
О2 + 4Н+ + 4ē = 2Н2О, φ = 1,229 В рН=0.
2. Металлы термодинамически нестабильные: Cd, In, Tl, Co, Ni, Mo, Pb, W
-0,413В <φ0 < 0В
Слайд 123. Металлы промежуточной термодинамической стабильности: Bi, Sb, Re, Tc, Cu, Ag,
0В <φ0 < 0,816В
4. Металлы высокой стабильности: Hg, Pd, Ir, Pt
0,816В <φ0 < 1,229В
О2 + 4Н+ + 4ē = 2Н2О, φ = 1,229 В рН=0.
5. Металлы полной стабильности:
Au
1,229В <φ0
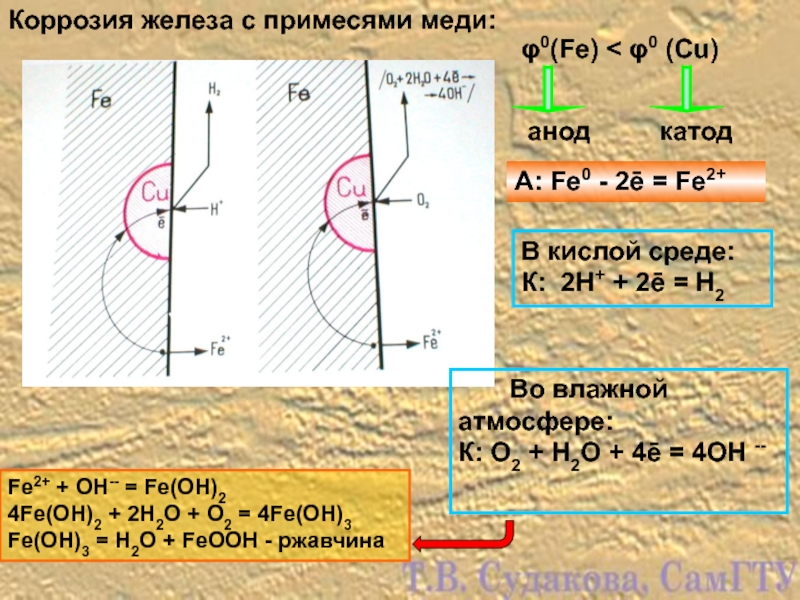
Слайд 13Коррозия железа с примесями меди:
В кислой среде:
К: 2Н+ + 2ē =
Fe2+ + OH-- = Fe(OH)2
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Fe(OH)3 = H2O + FeOOH - ржавчина
φ0(Fe) < φ0 (Cu)
анод
катод
А: Fe0 - 2ē = Fe2+
Во влажной атмосфере:
К: О2 + Н2О + 4ē = 4ОН --
Слайд 14коррозия углеродистой стали в различных средах:
в этой паре катодными (пассивными) участками
а) кислая среда рН< 7
анод: Fe0 - 2ē = Fe 2+
катод: 2Н+ + 2ē = Н2
б) нейтральная или слабощелочная среда рН ≥ 7 (природные воды, влажная атмосфера)
анод: Fe0 - 2ē = Fe2+
катод: О2 + Н2О + 4ē = 4ОН─
Fe2+ + OH─ = Fe(OH)2
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Fe(OH)3 = H2O + FeOOH – ржавчина.
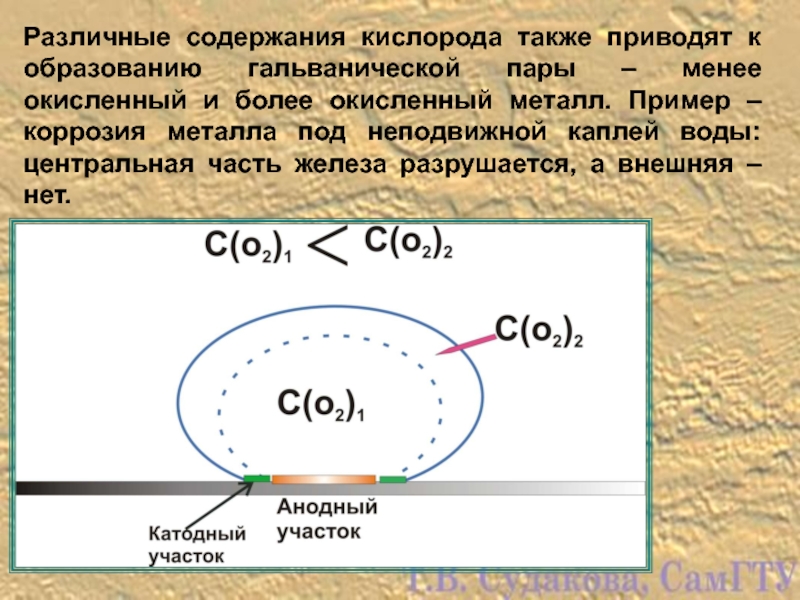
Слайд 15Различные содержания кислорода также приводят к образованию гальванической пары – менее
Слайд 16Во всех вариантах для появления катодно-анодных участков необходимо условие неравномерности запаса
Слайд 17Нержавеющая сталь – сплав, содержащий как минимум 12% Cr, который создает
Слайд 18ЗАЩИТА ОТ КОРРОЗИИ
Изоляция металлов от агрессивной среды:
Металлические покрытия (от высокотемпературной коррозии)
2)
органические (лаки, краски, смазки), съемные полимерные;
неорганические (оксидные, фосфатирование);
Металлические (анодные и катодные;
3) Ингибирование.
Электрохимическая защита:
Катодная (метод протекторов, метод внешнего потенциала)
Анодная (пассивирование).
Слайд 19
Защитные слои от высокотемпературной коррозии могут быть созданы из тугоплавких соединений,
Современные технологии газотермического напыления - Газоплазменная и электродуговая металлизация распылением
Слайд 201200С
Процесс металлизации распылением заключается в непрерывном плавлении металла, распылении его на
Слайд 21При металлизации сцепление частиц с основанием происходит вследствие шероховатости поверхности и
Слайд 22Протекторные свойства металлизационных покрытий из Al, Zn и их сплавов. Поврежденное
По результатам сравнительного исследования эффективности 47 различных систем защитных покрытий только алюминиевое и цинковое покрытия, нанесенные методом газотермического напыления, отработали 20 лет без повторного нанесения и сохранили более 99,5% сплошности.
Слайд 23Сплавы Zn и Al (Zn/Al15, Zn/Al5) создают покрытия, стойкие к любым
Слайд 24Zn и Al образуют плотный слой продуктов коррозии, по объему значительно
сталь
Покрытие, заполненное продуктами коррозии
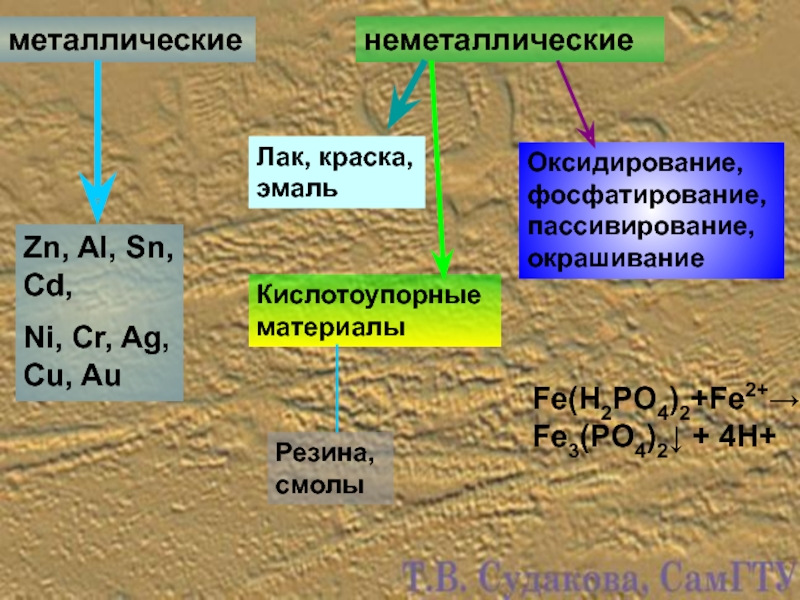
Слайд 25металлические
неметаллические
Zn, Al, Sn, Cd,
Ni, Cr, Ag, Cu, Au
Лак, краска,
Кислотоупорные материалы
Резина, смолы
Оксидирование, фосфатирование, пассивирование, окрашивание
Fe(H2PO4)2+Fe2+→ Fe3(PO4)2↓ + 4H+
Слайд 26Ингибирование коррозионно-активной среды.
Ингибиторы – вещества, которые будучи введены в коррозионную
Адсорбированные на поверхности металлов ингибиторы избирательно тормозят катодный или анодный процессы коррозии. В кислых средах адсорбция ингибиторов приводит к преимущественному замедлению катодного процесса восстановления водорода; в нейтральных средах большинство ингибиторов тормозит анодный процесс, вызывая наступление пассивного состояния.
Слайд 27Пример: для защиты стальных трубопроводов используют Са(НСО3)2. На катодных участках происходит
О2 + 2Н2О + 4ē = 4ОН─ .
Вода у поверхности металла защелачивается, гидрокарбонат превращается в карбонат
Са2+ +2НСО3─ + ОН─ → Н2О + СаСО3 + НСО3─
Пленка СаСО3 отлагается на поверхности стали и затрудняет дальнейшее протекание катодного процесса, что приводит к торможению всего коррозионного процесса.
Классификация ингибиторов:
1) ингибиторы атмосферной коррозии;
2) ингибиторы коррозии для нейтральных и водно-солевых систем;
3) ингибиторы для двухфазных систем (углеводород-вода);
4) ингибиторы кислотной коррозии;
5) ингибиторы коррозии для нефтепродуктов (масел, смазочно-охлаждающих жидкостей, смазок, топлива).
Слайд 28Катодная защита: потенциал металла специально сдвигают из области активного растворения в
метод протекторов- к изделию, подвергающемуся коррозии подключают деталь – протектор из еще более активного металла, чем металл изделия. Протектор будет разрушаться, а изделие останется неизменным. Метод изобретен и впервые применен в Англии для защиты обшивки кораблей.
бронзовый подшипник и шейка вала гребного винта корабля создают коррозионную пару, в которой корродирует поверхность стального вала, что может привести к потере винта. Если в непосредственной близости к корпусу прикрепить цинковую пластину, то она будет разрушаться, а не поверхность вала.
Слайд 29Основные протекторы для стали: Mg, Al, Zn и их сплавы.
Протекторные сплавы:
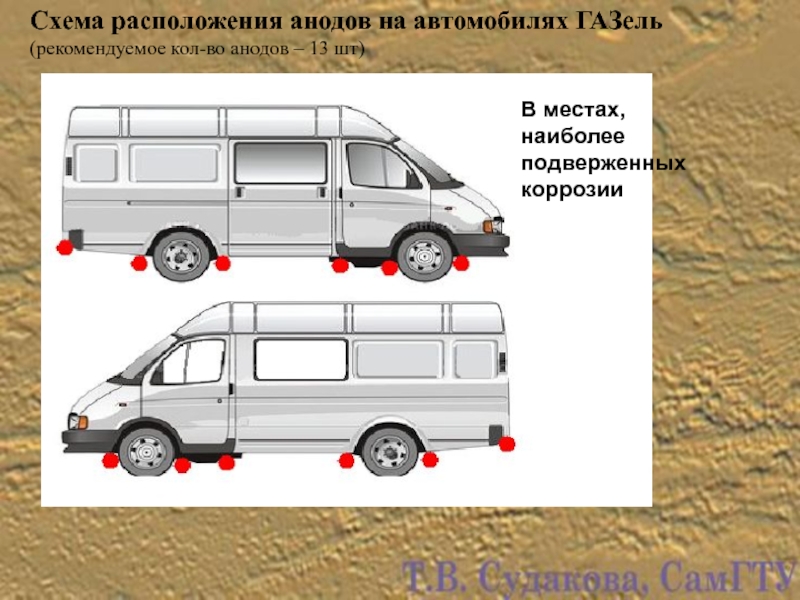
Слайд 30Схема расположения анодов на автомобилях ГАЗель
(рекомендуемое кол-во анодов – 13 шт)
В местах, наиболее подверженных коррозии
Слайд 31Метод внешнего потенциала – защищаемое изделие или конструкция подключаются к отрицательному
Катодную защиту, как правило, совмещают с нанесением защитных покрытий; необходимо учитывать возможность отслаивания покрытия.
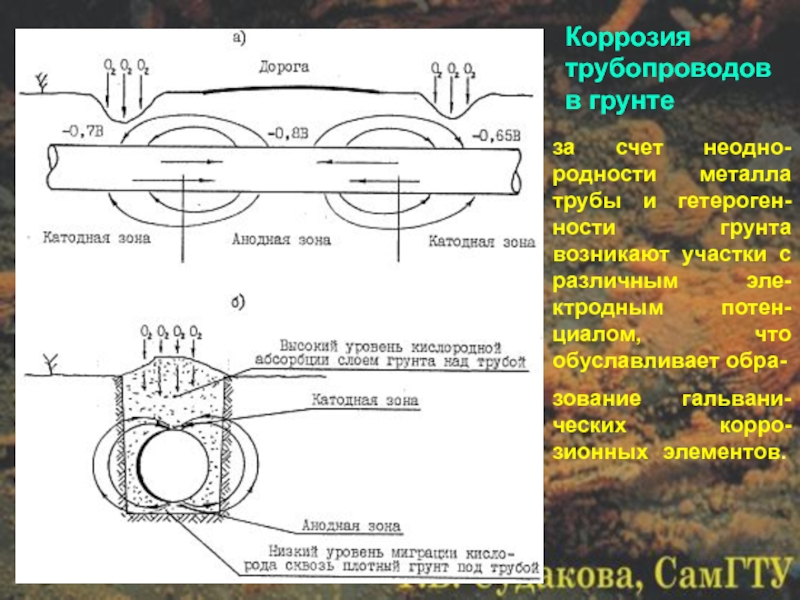
Слайд 32Коррозия трубопроводов в грунте
за счет неодно-родности металла трубы и гетероген-ности грунта
зование гальвани-ческих корро-зионных элементов.