- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коррозия металлов презентация
Содержание
- 1. Коррозия металлов
- 3. Химическая коррозия Химическая коррозия – процесс разрушения
- 4. Электрохимическая коррозия металлов Электрохимическая коррозия металлов –
- 5. Катодные процессы при протекании коррозии по электрохимическому механизму
- 6. Причины электрохимической коррозии
- 7. Так как то контакт двух разных металлов
- 8. Образующийся гидроксид железа (II) подвергается последующему
- 9. Например, сталь содержит кристаллы цементита (Fe3C), которые
- 10. Электродный потенциал окисленного участка выше, чем
- 11. Коррозия под действием «блуждающих токов» Вследствие плохого
- 12. Защита от коррозии
- 13. Все методы защиты металлов от коррозии
- 14. Изоляция поверхности металла от окружающей среды
- 15. Конверсионные защитные покрытия получают в результате химической реакции непосредственно на поверхности металла. Конверсионные защитные покрытия
- 16. Металлические защитные покрытия. Катодные покрытия Катодные
- 17. Электрохимическая защита. Анодные металлические покрытия
- 18. Протекторная защита Схема протекторной защиты
- 20. Ингибиторы коррозии Для снижения агрессивности среды
Слайд 3Химическая коррозия
Химическая коррозия – процесс разрушения металла в результате протекания гетерогенных
Газовая коррозия:
Жидкостная коррозия:
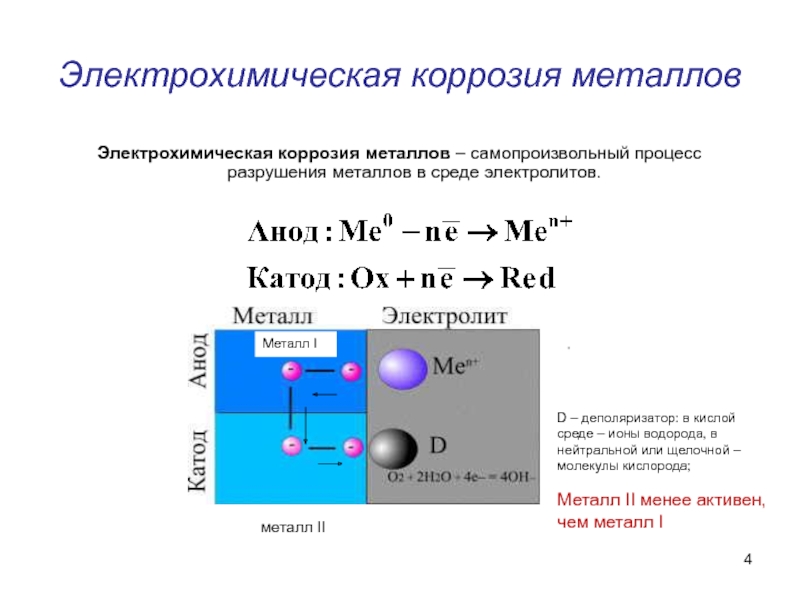
Слайд 4Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – самопроизвольный процесс разрушения металлов в
металл II
D – деполяризатор: в кислой среде – ионы водорода, в нейтральной или щелочной – молекулы кислорода;
Металл II менее активен, чем металл I
Металл I
Слайд 7Так как
то контакт двух разных металлов приводит к тому, что разрушаться
Контакт двух разных металлов (в кислой среде)
Слайд 8
Образующийся гидроксид железа (II) подвергается
последующему окислению:
Контакт двух разных металлов (щелочная и
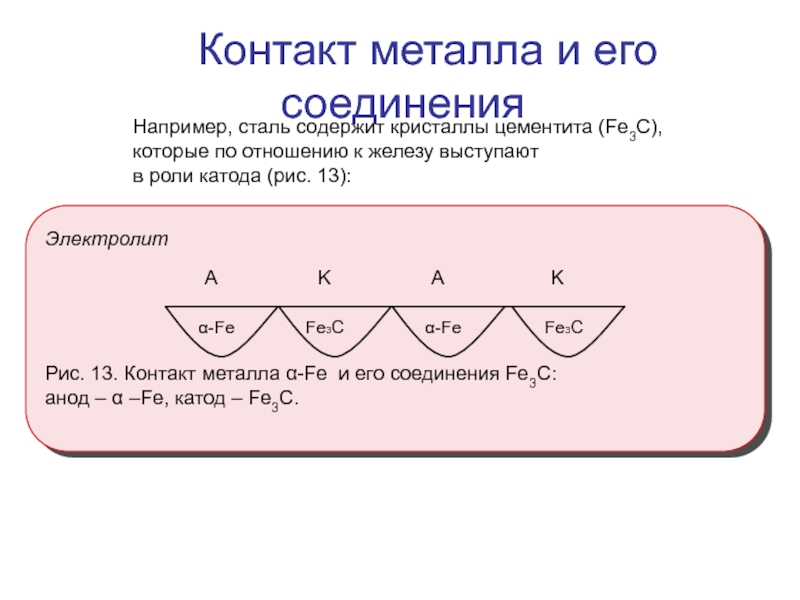
Слайд 9Например, сталь содержит кристаллы цементита (Fe3C), которые по отношению к железу выступают в
Контакт металла и его соединения
Слайд 10
Электродный потенциал окисленного участка выше, чем неокисленного.
Окисленные участки выполняют функцию катода.
Неодинаковый доступ воздуха (кислорода) к участкам поверхности металла (неравномерная аэрация)
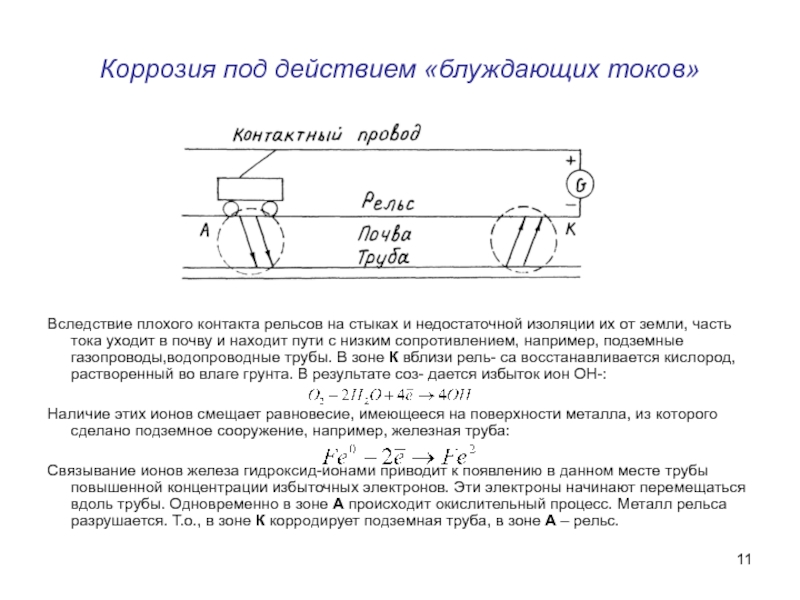
Слайд 11Коррозия под действием «блуждающих токов»
Вследствие плохого контакта рельсов на стыках и
Наличие этих ионов смещает равновесие, имеющееся на поверхности металла, из которого сделано подземное сооружение, например, железная труба:
Связывание ионов железа гидроксид-ионами приводит к появлению в данном месте трубы повышенной концентрации избыточных электронов. Эти электроны начинают перемещаться вдоль трубы. Одновременно в зоне А происходит окислительный процесс. Металл рельса разрушается. Т.о., в зоне К корродирует подземная труба, в зоне А – рельс.
Слайд 13
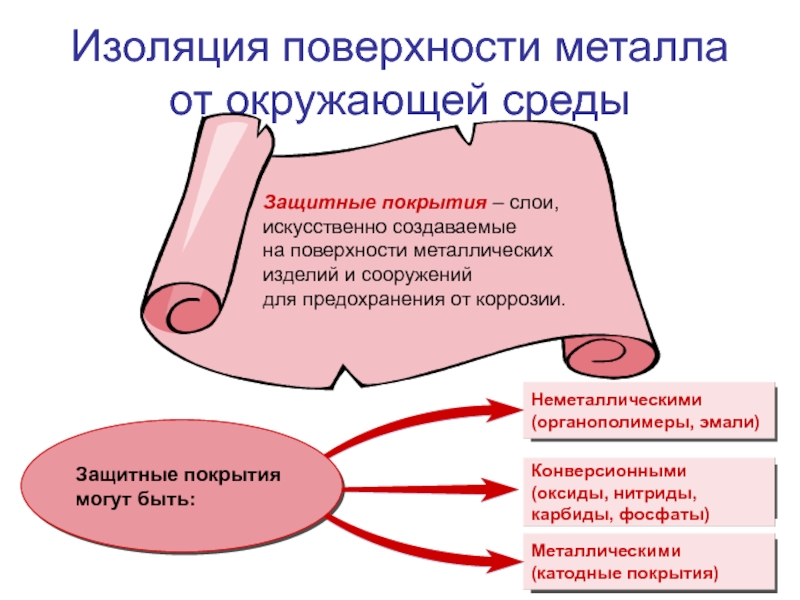
Все методы защиты металлов от коррозии условно
делят на следующие группы:
изоляция поверхности
электрохимическая защита;
применение конструкционных металлических материалов
с повышенной коррозионной стойкостью;
ингибиторы коррозии.
Защита от коррозии
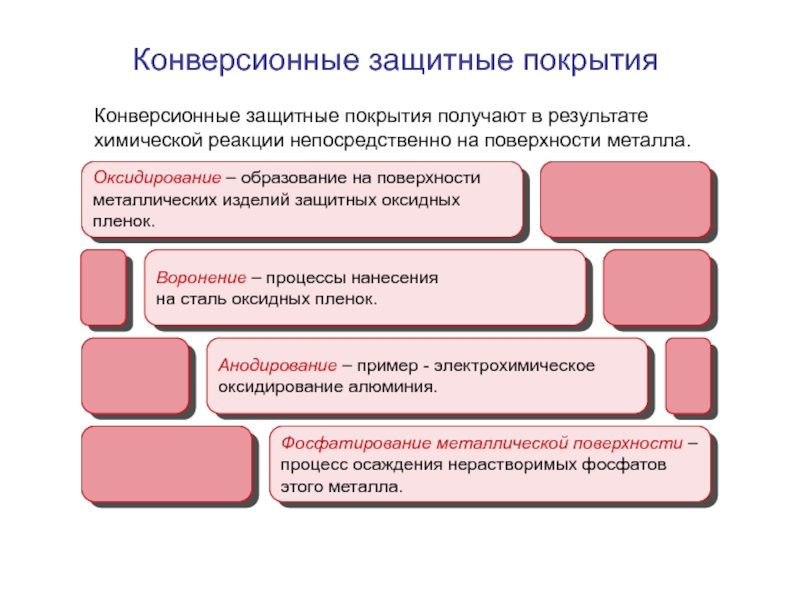
Слайд 15Конверсионные защитные покрытия получают в результате
химической реакции непосредственно на поверхности металла.
Конверсионные
Слайд 16Металлические защитные покрытия.
Катодные покрытия
Катодные защитные покрытия – это покрытия металлом,
электродный потенциал
Слайд 18Протекторная защита
Схема протекторной защиты
Анод (Ме-протектор):
Катод (Ме трубы) :
( среда – кислая )
анод - более
активный ме
катод – менее
активный металл
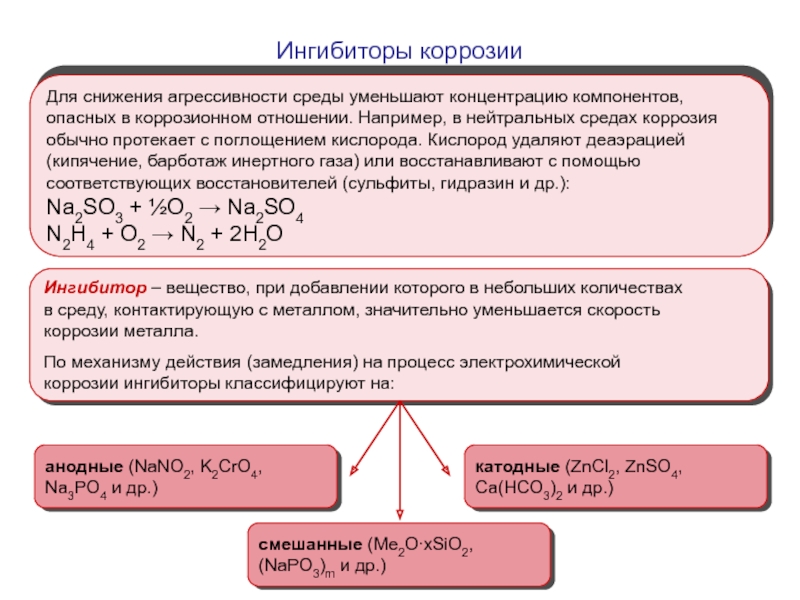
Слайд 20Ингибиторы коррозии
Для снижения агрессивности среды уменьшают концентрацию компонентов,
опасных в коррозионном отношении.
Na2SO3 + ½O2 → Na2SO4
N2H4 + O2 → N2 + 2H2O
Ингибитор – вещество, при добавлении которого в небольших количествах
в среду, контактирующую с металлом, значительно уменьшается скорость
коррозии металла.
По механизму действия (замедления) на процесс электрохимической
коррозии ингибиторы классифицируют на:
анодные (NaNO2, K2CrO4,
Na3PO4 и др.)
катодные (ZnCl2, ZnSO4,
Ca(HCO3)2 и др.)
смешанные (Me2O∙xSiO2,
(NaPO3)m и др.)