- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения презентация
Содержание
- 1. Комплексные соединения
- 2. П Л А Н 7.1 Основные
- 3. 7.1 Комплексными (координационными) называют соединения, в структурных
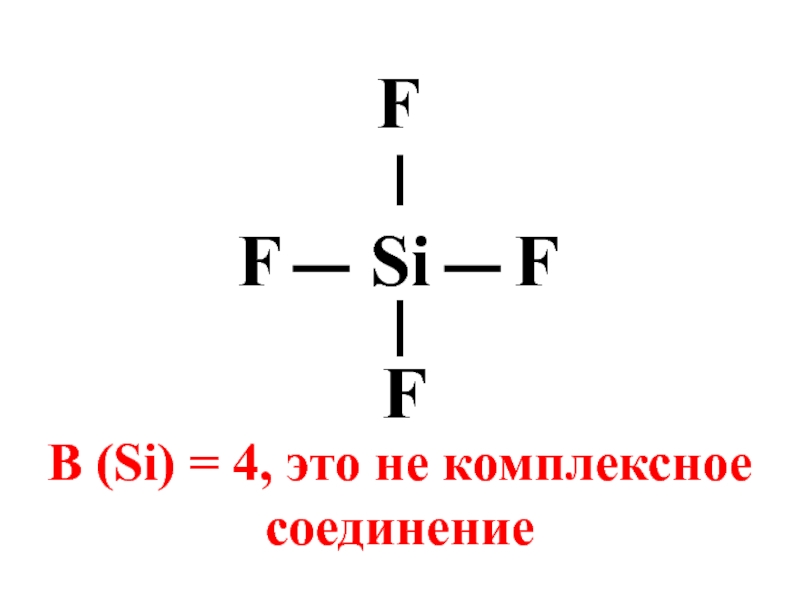
- 4. Si F F F F В (Si) = 4, это не комплексное соединение
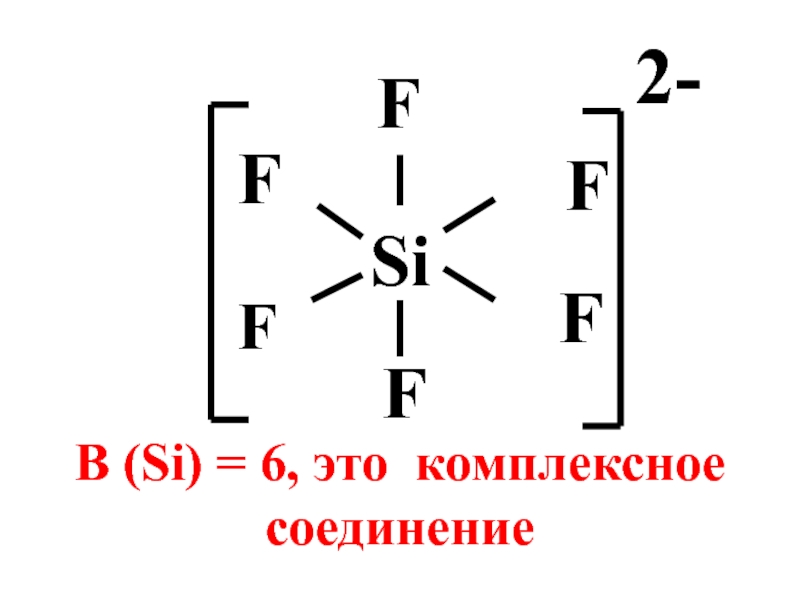
- 5. Si F F F F В
- 6. Альфред Вернер 1866-1919 Швейцарский химик, выдвинувший и
- 7. Комплексные соединения состоят из: комплексообразователей (Ме,
- 8. лиганды [Fe(CO)5] комплексообразователь лиганды
- 9. Важнейшей характеристикой комплексообразователя является его координационное число (к.ч.), т.е. число связей, образованных им с лигандами.
- 10. Степень
- 11. Важнейшей характеристикой лиганда является его дентантность – число связей, образованных с комплексообразователем.
- 12. Классификация лигандов монодентантные лиганды: а) анионы: OH‾,
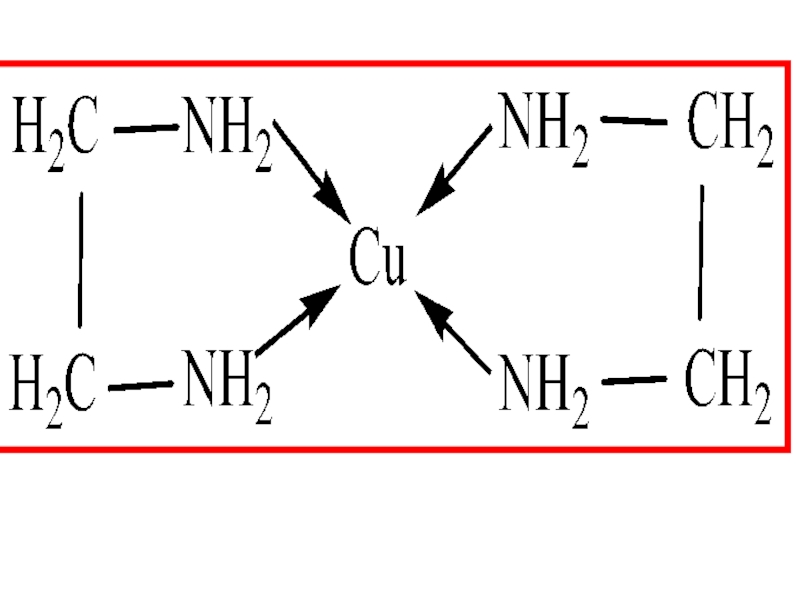
- 13. бидентантные лиганды а)анионы: SO42‾, C2O42‾, CO32‾;
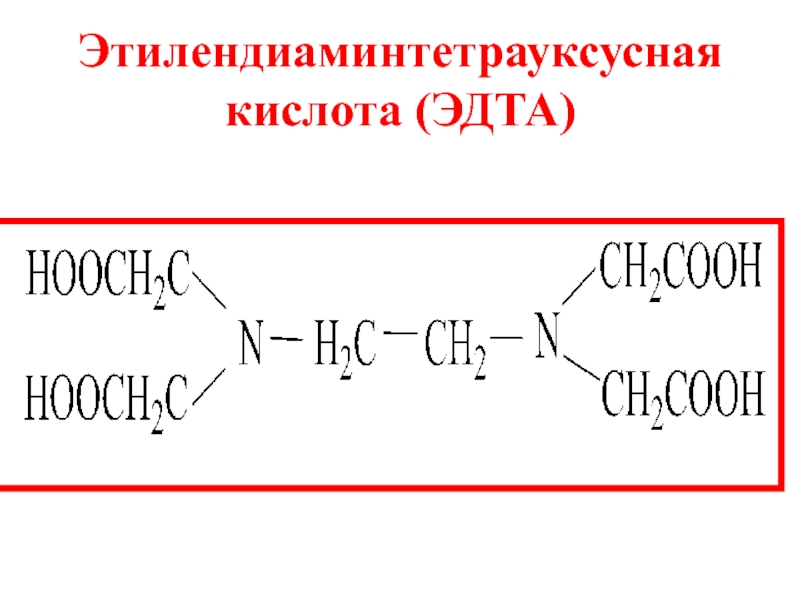
- 14. полидентантные лиганды. Важнейшими из них являются комплексоны – аминополикарбоновые кислоты и их соли.
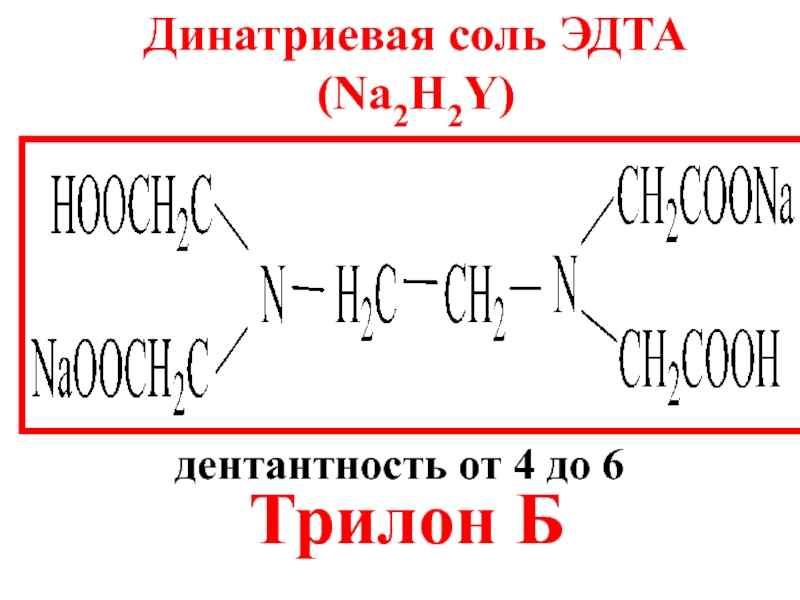
- 15. Этилендиаминтетрауксусная кислота (ЭДТА)
- 16. Динатриевая соль ЭДТА (Na2H2Y) Трилон Б дентантность от 4 до 6
- 17. по природе лигандов Классификация комплексных соединений 1)КС
- 18. 2) КС с би- и полидентантными лигадами
- 20. Наиболее устойчивыми хелатами являются внутрикомплексные соединения, в
- 21. Тетацин Na2[CaY]
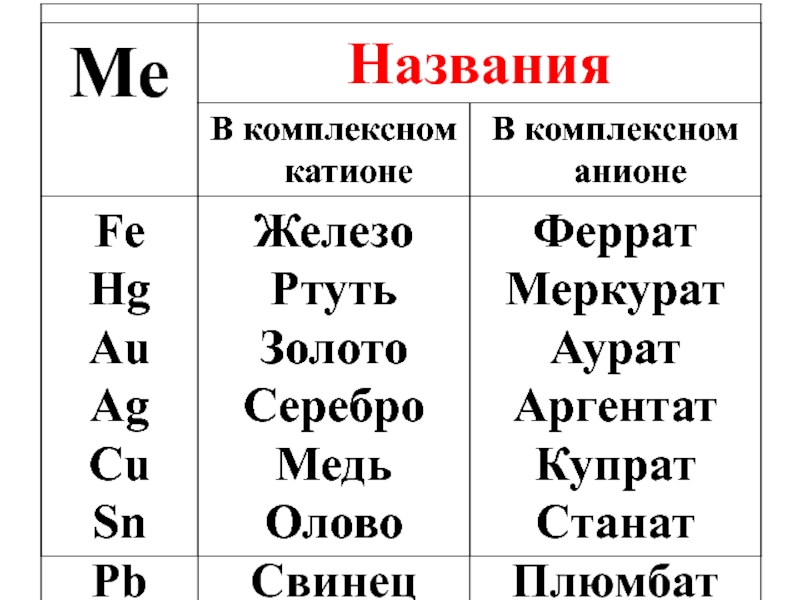
- 22. НОМЕНКЛАТУРА КС (1960, ИЮПАК) 1)
- 23. 2) В комплексном ионе сначала называют лиганды-анионы,
- 24. Названия лигандов-анионов заканчиваются на – о: OH‾
- 26. Na3[Al(OH)6] натрий гексагидроксоалюминат [Cu(NH3)4]SO4
- 27. 7.2 Комплексные соединения Электролиты
- 28. Различают первичную (необратимую) диссоциацию: K4[Fe(CN)6] → 4
- 29. Константа равновесия, описывающая вторичную диссоциацию КС, называется константой нестойкости (Кн): Кн
- 30. Чем меньше Кн, тем устойчивее комплексное соединение
- 31. Устойчивости КС зависит от их строения: а)
- 32. s-Me p-Me d-Me
- 33. б) чем выше дентантность лиганда, тем устойчивее
- 34. Самыми устойчивыми комплексными соединениями являются хелаты. Это явление получило название эффекта хелатирования.
- 35. 7.3 Строение комплексных соединений описывается в рамках
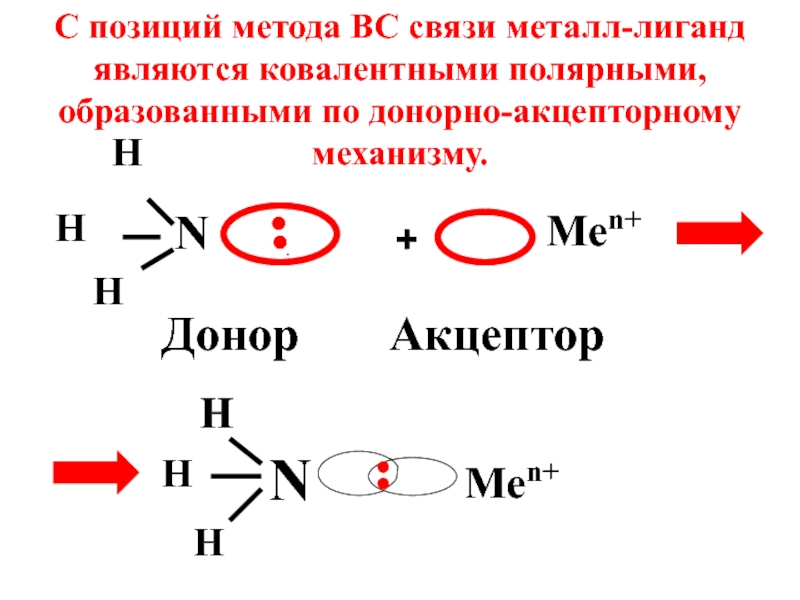
- 36. N H H H .●● Донор +
- 37. Конфигурация комплексного иона определяется типом гибридизации АО комплексообразователя.
- 38. К.ч. Тип гибридизации Конфигурация Примеры
- 39. К.ч. Тип гибридизации Конфигурация Примеры
- 40. Теория кристаллического поля описывает магнитные свойства комплексов.
- 41. Свободный ион У катиона металла под
- 42. Величина энергии расщепления (∆) зависит от природы
- 43. В поле слабых лигандов энергия расщепления (∆)
- 44. В поле сильных лигандов энергия расщепления (∆)
- 45. Пример:
- 46. Координационное число Fe3+ равно 6, так как
- 48. Ион [FeF6]3- парамагнитен, так как содержит неспаренные
- 49. 7.4 В организме человека все металлы, кроме
- 50. Важнейшими являются комплексы с белками.
- 51. В организме непрерывно происходит образование и разрушение
- 52. Нарушение сложившегося равновесия ведет к ряду патологических явлений: металлоизбыточным и металлодефицитным состояниям.
- 53. При недостатке железа – анемия, при его
- 54. По данным ВОЗ дефицит железа в организме
- 55. Выведение ионов тяжелых металлов из организма под
- 56. Комплексоны применяются для лечения мочекаменной болезни CaC2O4
- 57. Комплексы Pt используются как противоопухолевые препараты.
- 58. Комплексы Au применяют для лечения артритов и туберкулеза Na3[Au(S2O3)2].
- 59. Строение, свойства и биологическая роль КС металлов
- 60. Благодарим за внимание!!!
Слайд 2П Л А Н
7.1 Основные понятия химии комплексных соединений (КС).
7.2
7.3 Строение комплексных соединений
7.4 Биологическая роль КС.
Слайд 37.1 Комплексными (координационными) называют соединения, в структурных единицах которых число связей,
Слайд 6Альфред Вернер
1866-1919
Швейцарский химик, выдвинувший и развивший координационную теорию строения комплексных соединений.
Слайд 7Комплексные соединения состоят из:
комплексообразователей (Ме, реже неметаллы: Si, P и
лигандов (ионов или полярных молекул);
ионов внешней сферы (могут отсутствовать).
Слайд 9Важнейшей характеристикой комплексообразователя является его координационное число (к.ч.), т.е. число связей,
Слайд 11Важнейшей характеристикой лиганда является его дентантность – число связей, образованных с
Слайд 12Классификация лигандов
монодентантные лиганды: а) анионы: OH‾, H‾, F‾, Cl‾, Br‾, I‾,
б) молекулы: NH3, H2O, CO;
в) катионы: NH2NH3+.
Слайд 13 бидентантные лиганды
а)анионы: SO42‾, C2O42‾, CO32‾;
б)молекулы:
NH2 – CH2 – CH2
NH2 – CH2 – COOH(глицин)
Слайд 14полидентантные лиганды. Важнейшими из них являются комплексоны –
аминополикарбоновые кислоты и
Слайд 17по природе лигандов
Классификация комплексных соединений
1)КС с монодентантными лигандами:
аммиакаты
аквакомплексы [Cu(H2O)4]SO4
гидроксокомплексы Na3[Al(OH)6]
ацидокомплексы Na[Ag(CN)2]
со смешанными [Pt(NH3)2Cl2]
лигандами
Слайд 182) КС с би- и полидентантными лигадами
Слайд 20Наиболее устойчивыми хелатами являются внутрикомплексные соединения, в которых часть связей Me-Lig
Слайд 22НОМЕНКЛАТУРА КС (1960, ИЮПАК)
1) вначале называют катионы, затем анионы.
Слайд 232) В комплексном ионе сначала называют лиганды-анионы, затем лиганды-молекулы, затем лиганды-катионы:
NH3
H2O – аква
СО – карбонил
Слайд 24Названия лигандов-анионов заканчиваются на – о:
OH‾ –гидроксо
NO2‾ – нитро
NO3‾ –нитрато
CN‾ –
СNS‾ – родано
SO42‾ –сульфато
Названия некоторых комплексообразователей зависит от их положения в КС.
Слайд 26Na3[Al(OH)6]
натрий гексагидроксоалюминат
[Cu(NH3)4]SO4
тетраамминмедь(II) сульфат
NH4[Co(NH3)2(NO2)4]
аммоний тетранитродиамминкобальтат(III)
[Pt(NH3)2Cl2] дихлородиамминплатина
Слайд 27
7.2 Комплексные соединения
Электролиты Неэлектролиты
Кислоты
Основания
Соли
H2[PtCl4]
[Ag(NH3)2]OH
[Pt(NH3)2Cl2]
K4[Fe(CN)6]
Слайд 28Различают первичную (необратимую) диссоциацию:
K4[Fe(CN)6] → 4 K+ + [Fe(CN)6]4‾
и вторичную (обратимую)
[Fe(CN)6]4‾ ⇄ Fe2+ + 6 CN‾
Слайд 29Константа равновесия, описывающая вторичную диссоциацию КС, называется константой нестойкости (Кн):
Кн
Слайд 30Чем меньше Кн, тем устойчивее комплексное соединение
[Ag(NO2)2]‾ [Ag(NH3)2]+
1,3∙10‾3 6,8·10‾8 1,0∙10‾21
увеличение устойчивости КС
Слайд 31Устойчивости КС зависит от их строения:
а) чем меньше ионный радиус комплексообразователя
Слайд 32s-Me p-Me d-Me
Уменьшение ионных радиусов и увеличение комплексообразующей
Металлы d- блока являются лучшими комплексообразователями.
Слайд 33б) чем выше дентантность лиганда, тем устойчивее КС:
КC
[Co(NH3)4]2+ 1,0·10‾5
[Co(Гли)2] 3,3∙10‾9
[CoY]2‾ 1,0∙10‾16
Слайд 34Самыми устойчивыми комплексными соединениями являются хелаты. Это явление получило название эффекта
Слайд 357.3 Строение комплексных соединений описывается в рамках метода валентных связей (ВС)
Слайд 36N
H
H
H
.●●
Донор
+
Men+
Акцептор
N
H
H
H
Men+
С позиций метода ВС связи металл-лиганд являются ковалентными полярными, образованными по
.●●
●●
Слайд 38К.ч. Тип гибридизации Конфигурация Примеры
2 sp
Lig
Lig
●
[Ag(NH3)2]+
4 sp3
[Zn(NH3)4]2+
Линейная
Lig
Lig
Lig
Lig
●
Тетраэдрическая
dsp2
●
Lig
Lig
Lig
Lig
Квадратно-плоскостная
[AuCl4]-
Слайд 39К.ч. Тип гибридизации Конфигурация Примеры
sp3d2
Lig
Lig
Lig
Lig
Lig
Lig
[CoF6]3-
[Co(NH3)6]3+
Октаэдрическая
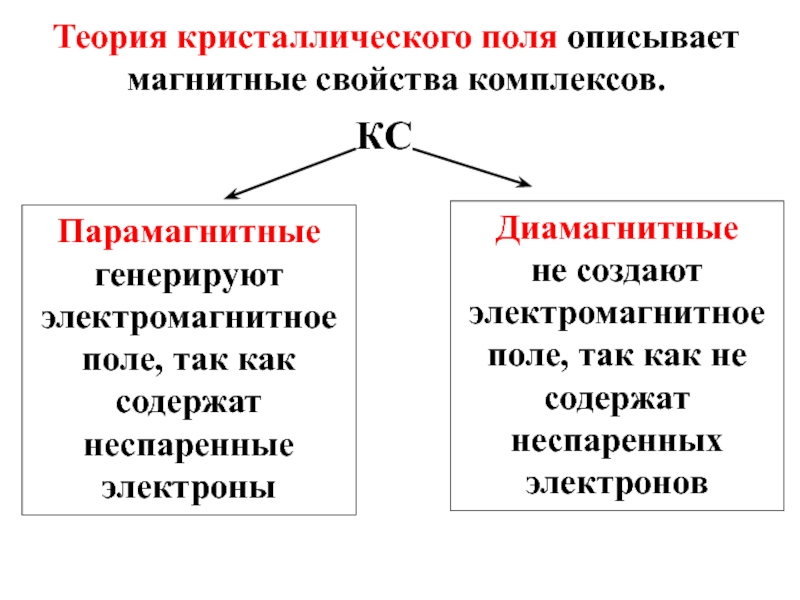
Слайд 40Теория кристаллического поля описывает магнитные свойства комплексов.
КС
Парамагнитные
генерируют электромагнитное поле, так как
Диамагнитные
не создают электромагнитное поле, так как не содержат неспаренных электронов
Слайд 41
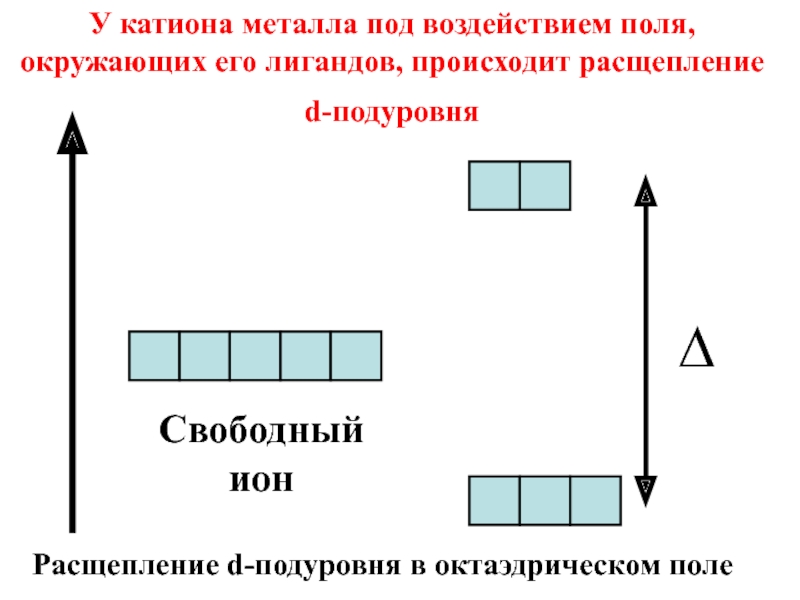
Свободный ион
У катиона металла под воздействием поля, окружающих его лигандов, происходит
∆
Расщепление d-подуровня в октаэдрическом поле
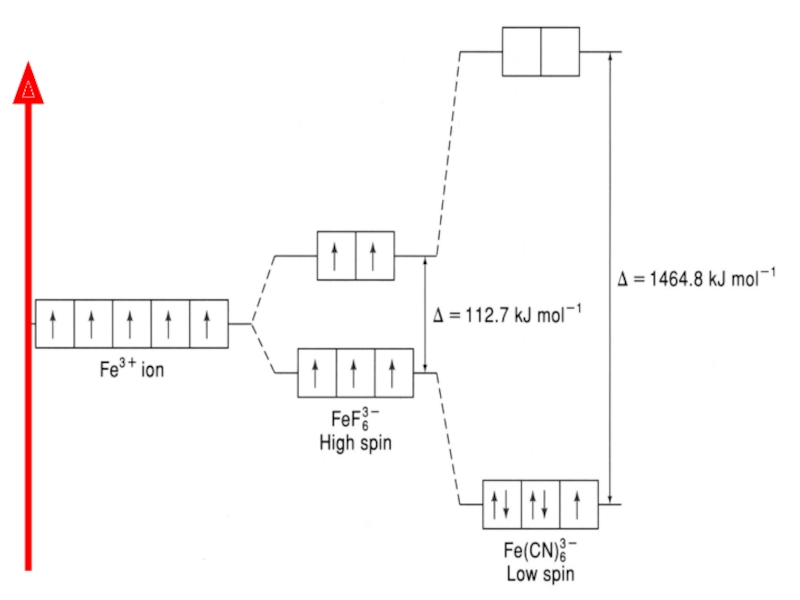
Слайд 42Величина энергии расщепления (∆) зависит от природы лиганда.
Спектрохимический ряд лигандов
I‾,Cl‾,F‾,
Слабые Lig Сильные Lig
Увеличение энергии расщепления ∆
Слайд 43В поле слабых лигандов энергия расщепления (∆) не велика, поэтому электроны
Слайд 44В поле сильных лигандов энергия расщепления (∆) имеет большое значение, в
Слайд 46Координационное число Fe3+ равно 6, так как он связан с шестью
Слайд 48Ион [FeF6]3- парамагнитен, так как содержит неспаренные электроны на внешнем уровне
3-
Слайд 497.4 В организме человека все металлы, кроме щелочных и, частично, щелочноземельных
Слайд 50Важнейшими являются комплексы с белками. К ним
Слайд 51В организме непрерывно происходит образование и разрушение комплексов, состоящих из катионов
Слайд 52Нарушение сложившегося равновесия ведет к ряду патологических явлений: металлоизбыточным и металлодефицитным
Слайд 53При недостатке железа – анемия, при его избытке – сидероз. Недостаток
Слайд 54По данным ВОЗ дефицит железа в организме человека является одной из
Слайд 55Выведение ионов тяжелых металлов из организма под действием хелатирующих лигандов называется
Hg + [CaY] → Ca + [HgY]
+2
-2
+2
-2





![лиганды[Fe(CO)5]комплексообразовательлиганды](/img/tmb/5/405290/7b2abd4c985c5d1a3334e9c6dbbab757-800x.jpg)






![по природе лигандовКлассификация комплексных соединений1)КС с монодентантными лигандами: аммиакаты [Cu(NH3)4]Cl2 аквакомплексы](/img/tmb/5/405290/f0138b28595b5b848576bf452217db9d-800x.jpg)


![ТетацинNa2[CaY]](/img/tmb/5/405290/721d9e8d2fbe2633388922a4d44fc034-800x.jpg)



![Na3[Al(OH)6] натрий гексагидроксоалюминат[Cu(NH3)4]SO4 тетраамминмедь(II) сульфатNH4[Co(NH3)2(NO2)4] аммоний тетранитродиамминкобальтат(III)[Pt(NH3)2Cl2] дихлородиамминплатина](/img/tmb/5/405290/d872b991d0107fb3930de4b32516e9e4-800x.jpg)
![7.2 Комплексные соединенияЭлектролиты Неэлектролиты КислотыОснованияСолиH2[PtCl4][Ag(NH3)2]OH[Pt(NH3)2Cl2]K4[Fe(CN)6]](/img/tmb/5/405290/18374e6cf4197a96c20ab772cc0e40a0-800x.jpg)
![Различают первичную (необратимую) диссоциацию:K4[Fe(CN)6] → 4 K+ + [Fe(CN)6]4‾и вторичную (обратимую) диссоциацию КС:[Fe(CN)6]4‾ ⇄ Fe2+](/img/tmb/5/405290/b2b7f27d1af36acf8ba75329769c8382-800x.jpg)

![Чем меньше Кн, тем устойчивее комплексное соединение[Ag(NO2)2]‾ [Ag(NH3)2]+ [Ag(CN)2]‾ 1,3∙10‾3 6,8·10‾8](/img/tmb/5/405290/bdf8629ee8f0a63853f8e81f1db972fd-800x.jpg)


![б) чем выше дентантность лиганда, тем устойчивее КС: КC Кн[Co(NH3)4]2+ 1,0·10‾5[Co(Гли)2]](/img/tmb/5/405290/cdb495848325e77bb540f5b1e7aa1117-800x.jpg)



![К.ч. Тип гибридизации Конфигурация Примеры2 sp LigLig●[Ag(NH3)2]+4 sp3[Zn(NH3)4]2+ЛинейнаяLigLigLigLig●Тетраэдрическаяdsp2●LigLigLigLigКвадратно-плоскостная[AuCl4]-](/img/tmb/5/405290/f76494f786fb35d843f11676d09734ac-800x.jpg)
![К.ч. Тип гибридизации Конфигурация Примеры sp3d2 LigLigLigLigLigLig[CoF6]3-[Co(NH3)6]3+Октаэдрическая](/img/tmb/5/405290/786e3f6559003e9474d21f30e4622039-800x.jpg)



![Пример: [FeF6]3‾ [Fe(CN)6] х – 6 = –](/img/tmb/5/405290/f7e51cd721f85e15eb5b69d65f5ac6d0-800x.jpg)

![Ион [FeF6]3- парамагнитен, так как содержит неспаренные электроны на внешнем уровне (высокоспиновый комплекс). Ион [Fe(СN)6]](/img/tmb/5/405290/979c3e90f66eeb2483d7c579f71e3b66-800x.jpg)







![Комплексоны применяются для лечения мочекаменной болезниCaC2O4 + Na2H2Y ⮀ ⮀[CaY]2‾ + Na2C2O4 + +](/img/tmb/5/405290/93c9b8821c8364b24f10425efd78eb73-800x.jpg)
![Комплексы Pt используются как противоопухолевые препараты. Например, соль Пейроне [Pt(NH3)2Cl2] (синтезирована в 1850, используется как](/img/tmb/5/405290/52067f1f73efcc8043821edbdb83bbb6-800x.jpg)
![Комплексы Au применяют для лечения артритов и туберкулеза Na3[Au(S2O3)2].](/img/tmb/5/405290/6502180471647aab16f0ad4a18d7ef03-800x.jpg)