- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения презентация
Содержание
- 1. Комплексные соединения
- 2. Комплексные соединения – сложные соединения, в узлах
- 3. Образование комплексного соединения Реакция присоединения: Fe(CN)2
- 4. K4[Fe(CN)6] Fe2+ - комплексообразователь CN- - лиганд
- 5. [Pt(NH3)2Cl4] Pt4+ - комплексообразователь NH3 и Cl-
- 6. [Cu(NH3)4]SO4 Cu2+ - комплексообразователь NH3 - лиганд
- 7. МЕХАНИЗМ ОБРАЗОВНИЯ К.С. Теория ВС: гибридизация центрального
- 10. КЛАССИФИКАЦИЯ К.С. 1. По заряду внутренней сферы а) катионные [Cu(NH3)4]2+ б) анионные [Fe(CN)6]3- в) нейтральные [Pt(NH3)2Cl]
- 11. КЛАССИФИКАЦИЯ К.С. 2. По природе лигандов а)
- 12. НОМЕНКЛАТУРА Катионные комплексы Анион + лиганд
- 13. НОМЕНКЛАТУРА 2. Анионные комплексы Лиганды с
- 14. НОМЕНКЛАТУРА 3. Нейтральные комплексы Лиганды с учетом
- 15. НОМЕНКЛАТУРА 4. Смешаннолигандные комплексы Анионы
- 16. ИЗОМЕРИЯ 1. Координационная [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6]
- 17. ИЗОМЕРИЯ 2. Ионизационная [Co(NH3)5Cl]SO4 [Co(NH3)5SO4]Cl
- 18. ИЗОМЕРИЯ 3. Гидратная [Co(H2O)6]Cl3 [Co(H2O)4Cl2]Cl⋅2H2O
- 19. ИЗОМЕРИЯ 4. Геометрическая (цис - транс) [Pt(NH3)2Cl2] [Cr(NH3)6][Co(CN)6]
- 20. ДИССОЦИАЦИЯ К.С. 1. Если есть внешняя
- 21. ДИССОЦИАЦИЯ К.С. 2. Внутренняя сфера –
- 22. ДИССОЦИАЦИЯ К.С. 3. Константа диссоциации –
- 23. ДИССОЦИАЦИЯ К.С. 4. Величина обратная kнест
- 24. ХЕЛАТНЫЕ СОЕДИНЕНИЯ
- 25. Лиганды занимают 2 или более координационных мест
- 26. Правила циклов
- 28. Полидентантными лигандами являются: Этилендиаминтетраацетат натрия (комплексон
- 29. Полидентантными лигандами являются: 4. Металлоцены – образуются
- 31. ХЕЛАТОТЕРАПИЯ - применение антидотов-лигандов для выведения токсичных d- и p-элементов из организма.
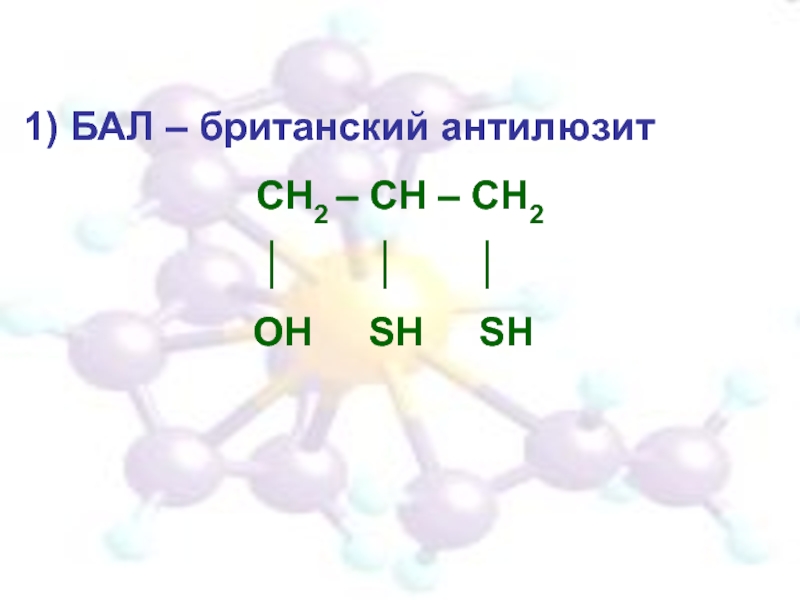
- 32. 1) БАЛ – британский антилюзит СН2 –
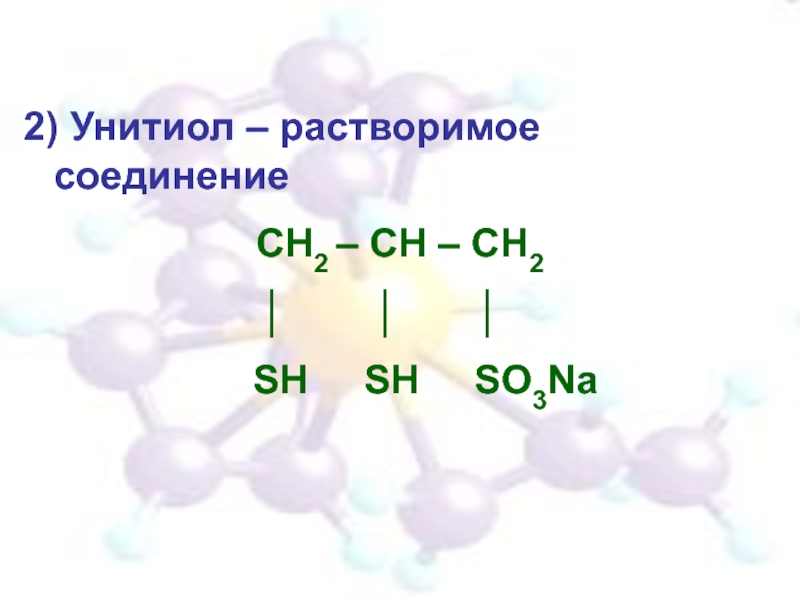
- 33. 2) Унитиол – растворимое соединение СН2 –
- 34. 3) Тетацин кальций Na2 СaЭДТА 4) Цис-изомер дихлородиаммин платины [Pt(NH3)2Cl2]
- 35. В биолигандах 2 вида комплексов: 1. Роль
- 36. В организме осуществляется металл-лигандный гомеостаз – поддержание их концентрации на постоянном уровне.
- 37. Причины нарушения гомеостаза: 1. Поступление из окружающей
- 38. Причины нарушения гомеостаза: 4. Поступление в организм
- 39. Принципы хелатотерапии Эффект связывать ионы-токсиканты с
- 40. ТОКСИЧНЫЕ ИОНЫ: Cd2+, Hg2+, Pb2+, U, As, Cr, Bi, РЗЭ, плутоний, радиоактивные металлы
Слайд 2Комплексные соединения – сложные соединения, в узлах кристаллов которых находятся наряду
с простыми ионами и сложные ионы, способные существовать также в растворах.
Комплексные соединения – сложные соединения, образованные центральным атомом (ионом) и лигандами ионами (молекулами), которые образуют единую частицу, существующие как целое в твердом виде и а растворах.
Комплексные соединения – сложные соединения, образованные центральным атомом (ионом) и лигандами ионами (молекулами), которые образуют единую частицу, существующие как целое в твердом виде и а растворах.
Слайд 3Образование комплексного соединения
Реакция присоединения:
Fe(CN)2 + 4KCN = K4[Fe(CN)6]
2. Реакция внедрения
CuSO4
+ 4NH3 = [Cu(NH3)4]SO4
Слайд 4K4[Fe(CN)6]
Fe2+ - комплексообразователь
CN- - лиганд
6 – координационное число
[Fe(CN)6]4- - внутренняя сфера
К+
- внешняя сфера
Слайд 5[Pt(NH3)2Cl4]
Pt4+ - комплексообразователь
NH3 и Cl- - лиганды
6=2+4 – координационное число
Внешней сферы
нет
Слайд 6[Cu(NH3)4]SO4
Cu2+ - комплексообразователь
NH3 - лиганд
4 – координационное число
[Cu(NH3)4]2+ - внутренняя сфера
SO42-
- внешняя сфера
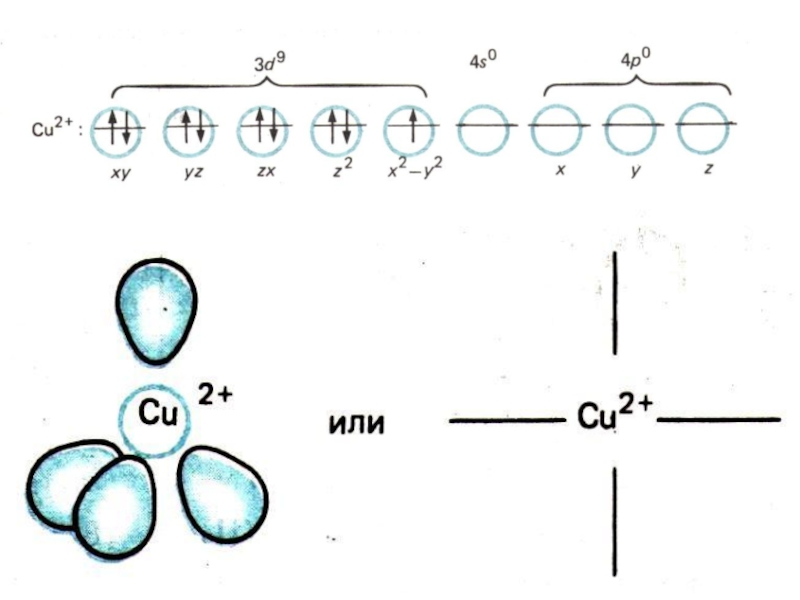
Слайд 7МЕХАНИЗМ ОБРАЗОВНИЯ К.С.
Теория ВС: гибридизация центрального атома и донорно-акцепторный механизм.
Центральный ион
– акцептор электронов (электронный дефицит).
Лиганды – доноры электронной пары за счет неподеленной электронной пары (атома N, O, S, галогенов).
Сu2+ 3d94s04p0 → sp3-гибридизация
Лиганды – доноры электронной пары за счет неподеленной электронной пары (атома N, O, S, галогенов).
Сu2+ 3d94s04p0 → sp3-гибридизация
Слайд 10КЛАССИФИКАЦИЯ К.С.
1. По заряду внутренней сферы
а) катионные [Cu(NH3)4]2+
б) анионные [Fe(CN)6]3-
в) нейтральные [Pt(NH3)2Cl]
Слайд 11КЛАССИФИКАЦИЯ К.С.
2. По природе лигандов
а) ацедокомплексы
[HgCl4]2-; [Fe(CN)6]4-; [Ag(S2O3)2]3- и др.
б) амминные комплексы
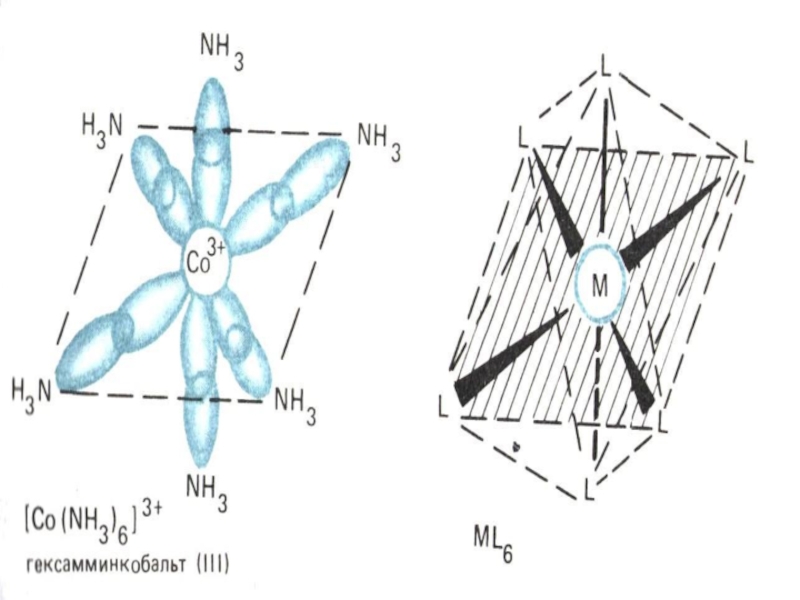
[Cu(NH3)4]2+; [Co(NH3)6]3+ и др.
в) гидроксокомплексы
[Al(OH)4]-; [Cr(OH)6]3- и др.
г) аквокомплексы
[Cu(H2O)4]2+; [Co(H2O)6]3+ и др.
д) внутрикомплексные соединения - хелаты
е) смешаннолигандные комплексы
Слайд 12НОМЕНКЛАТУРА
Катионные комплексы
Анион + лиганд с учетом его числа +
+ комплексообразователь и его степень окисления
[Cu(NH3)4]SO4 – сульфат тетраамин меди (II)
[Co(H2O)6]Cl2 – хлорид гексааквокобальта (II)
[Cu(NH3)4]SO4 – сульфат тетраамин меди (II)
[Co(H2O)6]Cl2 – хлорид гексааквокобальта (II)
Слайд 13НОМЕНКЛАТУРА
2. Анионные комплексы
Лиганды с учетом их числа + комплексообразователь (латинское
название с окончанием «–ат») + степень окисления комплексообразователя + внешняя сфера
K3[Fe(CN)6] – гексацианоферрат (III) калия
Na3[Co(NO2)6] – гексанитрокобальтат (III) натрия
K2[HgJ4] – тетрайодогидраргират (II) калия
K3[Fe(CN)6] – гексацианоферрат (III) калия
Na3[Co(NO2)6] – гексанитрокобальтат (III) натрия
K2[HgJ4] – тетрайодогидраргират (II) калия
Слайд 14НОМЕНКЛАТУРА
3. Нейтральные комплексы
Лиганды с учетом их числа +
+ комплексообразователь
[Fe(Co)5] – пентакарбония железа
[Fe(Co)5] – пентакарбония железа
Слайд 15НОМЕНКЛАТУРА
4. Смешаннолигандные комплексы
Анионы + лиганды с учетом его числа
+ комплексообразователь и его степень окисления
Если лиганды – два аниона или две нейтральные молекулы, то по алфавиту
[Pt(NH3)2Cl4] – тетрахлородиаммин платина
[CoBr(H2O)5]SO4 – сульфат бромопентааквокобальта (III)
[Cr(NH3)6][Co(CN)6] – гексацианокобальтат (III) гексааммин хрома (III)
Если лиганды – два аниона или две нейтральные молекулы, то по алфавиту
[Pt(NH3)2Cl4] – тетрахлородиаммин платина
[CoBr(H2O)5]SO4 – сульфат бромопентааквокобальта (III)
[Cr(NH3)6][Co(CN)6] – гексацианокобальтат (III) гексааммин хрома (III)
Слайд 20ДИССОЦИАЦИЯ К.С.
1. Если есть внешняя сфера – первичная диссоциация как
сильного электролита
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl-
Слайд 21ДИССОЦИАЦИЯ К.С.
2. Внутренняя сфера – вторичная диссоциация как слабого электролита
обратимо.
Применим З.Д.М.
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
Применим З.Д.М.
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
Слайд 22ДИССОЦИАЦИЯ К.С.
3. Константа диссоциации – константа нестойкости (константа неустойчивости) –
количественная характеристика прочности комплекса.
Чем меньше kнест, тем прочнее комплекс.
Чем меньше kнест, тем прочнее комплекс.
Слайд 23ДИССОЦИАЦИЯ К.С.
4. Величина обратная kнест называется константой устойчивости (константа образования).
Чем больше kуст, тем прочнее комплекс.
Величина kнест или kуст определяются экспериментально и приводятся в таблицах и справочниках
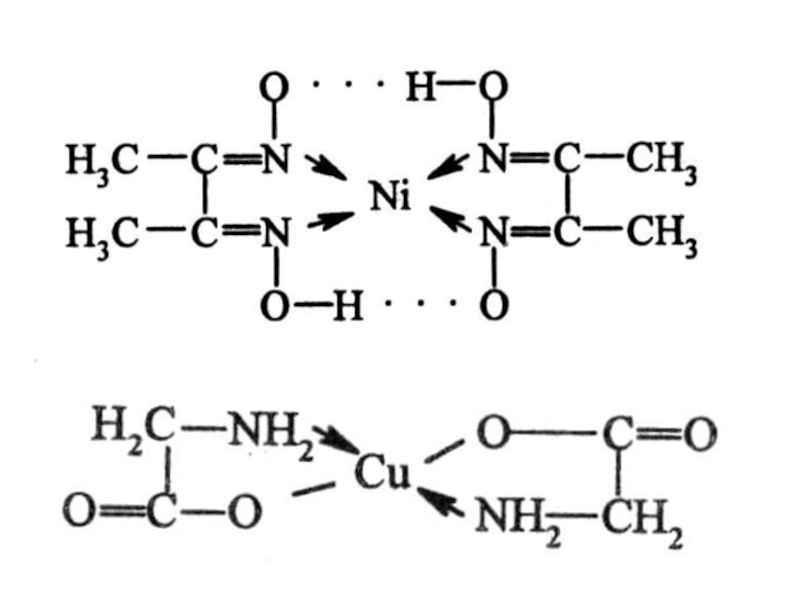
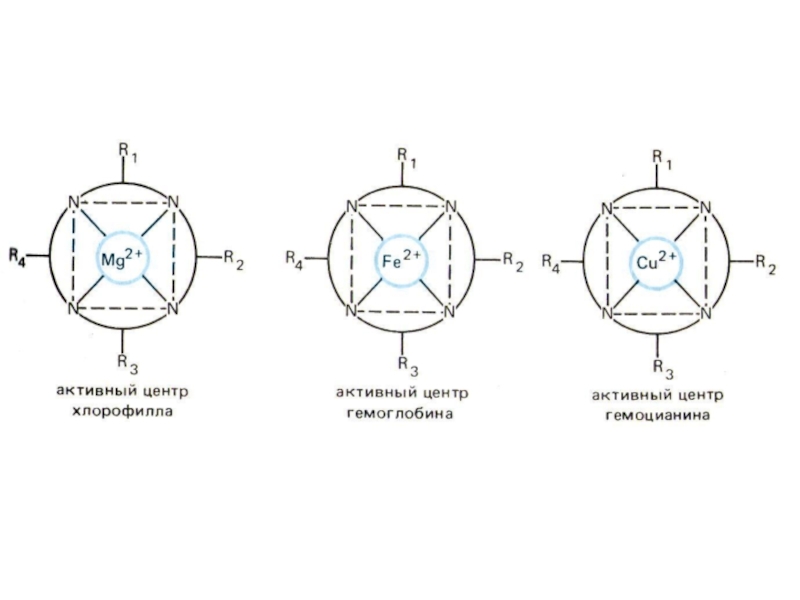
Слайд 25Лиганды занимают 2 или более координационных мест (полидентантные лиганды)
Все биокомплексы –
хелатные соединения. Биолиганды – аминокислоты, белки, нуклеиновые кислоты, ферменты и др.
Гемоглобин, металлоферменты, витамин В-12, хлорофилл – хеоатные соединения.
Гемоглобин, металлоферменты, витамин В-12, хлорофилл – хеоатные соединения.
Слайд 26Правила циклов
Л.А. ЧУГАЕВА
1) Наиболее устойчивы и прочны 5- и 6-членные циклы с участием комплексообразователя.
2) Чем больше циклов с участием комплексообразователя, тем более прочный комплекс.
1) Наиболее устойчивы и прочны 5- и 6-членные циклы с участием комплексообразователя.
2) Чем больше циклов с участием комплексообразователя, тем более прочный комплекс.
Слайд 28Полидентантными лигандами являются:
Этилендиаминтетраацетат натрия (комплексон III, Трилон Б).
Валиномицин (антибиотик)
– 18-краун-6 с К+
Макроциклические соединения «гость-хозяин»
Макроциклические соединения «гость-хозяин»
Слайд 29Полидентантными лигандами являются:
4. Металлоцены – образуются за счет взаимодействия вакантных орбиталей
центрального атома с π-электронами ароматических или сопряженных систем (ферроцен)
5. Гемоглобин – комплекс гем, белок – глобин. Это металлопорфириновый комплекс Fe2+. Лиганд – порфин, центральный ион – Fe2+.
5. Гемоглобин – комплекс гем, белок – глобин. Это металлопорфириновый комплекс Fe2+. Лиганд – порфин, центральный ион – Fe2+.
Слайд 31ХЕЛАТОТЕРАПИЯ
- применение антидотов-лигандов для выведения токсичных d- и p-элементов из организма.
Слайд 35В биолигандах 2 вида комплексов:
1. Роль Ме высокоспецифична. Замена его даже
на близкий ион приводит к полной утрате физиологической активности (гемоглобин)
2. Малопрочные комплексы образуются только на то время, которое нужно для выполнения их функций (например, металлоферменты – катализ).
2. Малопрочные комплексы образуются только на то время, которое нужно для выполнения их функций (например, металлоферменты – катализ).
Слайд 36В организме осуществляется металл-лигандный гомеостаз – поддержание их концентрации на постоянном
уровне.
Слайд 37Причины нарушения гомеостаза:
1. Поступление из окружающей среды ионов-токсикантов.
2. Поступление микроэлементов, необходимых
для жизни, в значительно больших количествах, чем нужно (Ni – Урал, Cu – Башкирия).
3. Недостаточное поступление необходимых микроэлементов (Cu – Тюмень)
3. Недостаточное поступление необходимых микроэлементов (Cu – Тюмень)
Слайд 38Причины нарушения гомеостаза:
4. Поступление в организм токсичных лигандов (средства бытовой химии
и химические средства защиты растений).
5. Образование «фальшивых лигандов». «Красная волчанка» - незапланированный гидролиз пептидаз с образованием лигандов, конкурирующих с ферментами за Cu2+.
5. Образование «фальшивых лигандов». «Красная волчанка» - незапланированный гидролиз пептидаз с образованием лигандов, конкурирующих с ферментами за Cu2+.
Слайд 39Принципы хелатотерапии
Эффект связывать ионы-токсиканты с антидотами должен быть более прочным,
чем в организме.
Не разрушать жизненно важные комплексные соединения, т.е. соединения антидота или иона-токсиканта должны быть менее прочными, чем комплексы с жизненно важными комплексными соединениями.
Не разрушать жизненно важные комплексные соединения, т.е. соединения антидота или иона-токсиканта должны быть менее прочными, чем комплексы с жизненно важными комплексными соединениями.


![Образование комплексного соединения Реакция присоединения:Fe(CN)2 + 4KCN = K4[Fe(CN)6]2. Реакция внедренияCuSO4 + 4NH3 = [Cu(NH3)4]SO4](/img/tmb/4/383021/1798ca90e6d32b1493221093b1ec1efa-800x.jpg)
![K4[Fe(CN)6]Fe2+ - комплексообразовательCN- - лиганд6 – координационное число[Fe(CN)6]4- - внутренняя сфераК+ - внешняя сфера](/img/tmb/4/383021/2167ea6e140ae51199c759c79f73c051-800x.jpg)
![[Pt(NH3)2Cl4]Pt4+ - комплексообразовательNH3 и Cl- - лиганды6=2+4 – координационное числоВнешней сферы нет](/img/tmb/4/383021/879d070dd7f81198a724bf2017e51b8b-800x.jpg)
![[Cu(NH3)4]SO4Cu2+ - комплексообразовательNH3 - лиганд4 – координационное число[Cu(NH3)4]2+ - внутренняя сфераSO42- - внешняя сфера](/img/tmb/4/383021/ef702032bfffa2f04430fa7b5d634b38-800x.jpg)

![КЛАССИФИКАЦИЯ К.С.1. По заряду внутренней сферы а) катионные [Cu(NH3)4]2+ б) анионные [Fe(CN)6]3- в) нейтральные [Pt(NH3)2Cl]](/img/tmb/4/383021/5cd5cd4a430d6e19f93173fd7bcfabdc-800x.jpg)
![КЛАССИФИКАЦИЯ К.С.2. По природе лигандов а) ацедокомплексы [HgCl4]2-; [Fe(CN)6]4-; [Ag(S2O3)2]3- и др. б) амминные комплексы [Cu(NH3)4]2+;](/img/tmb/4/383021/cd554233e70c77c2fe482ab78c1f6c8a-800x.jpg)




![ИЗОМЕРИЯ 1. Координационная [Co(NH3)6][Cr(CN)6][Cr(NH3)6][Co(CN)6]](/img/tmb/4/383021/312cd61136ad83ecc114d6673fd08179-800x.jpg)
![ИЗОМЕРИЯ 2. Ионизационная [Co(NH3)5Cl]SO4[Co(NH3)5SO4]Cl](/img/tmb/4/383021/c236bbd14bc1b3bb062f613d172298fa-800x.jpg)
![ИЗОМЕРИЯ 3. Гидратная [Co(H2O)6]Cl3 [Co(H2O)4Cl2]Cl⋅2H2O](/img/tmb/4/383021/f5090cc9ca695c27a34cf74051e155db-800x.jpg)
![ИЗОМЕРИЯ 4. Геометрическая (цис - транс) [Pt(NH3)2Cl2][Cr(NH3)6][Co(CN)6]](/img/tmb/4/383021/d43570abc778ddc599ec4407f6e87f42-800x.jpg)
![ДИССОЦИАЦИЯ К.С. 1. Если есть внешняя сфера – первичная диссоциация как сильного электролита[Ag(NH3)2]Cl → [Ag(NH3)2]+](/img/tmb/4/383021/b9440a88fedcf2598100744bc6d1b1a6-800x.jpg)
![ДИССОЦИАЦИЯ К.С. 2. Внутренняя сфера – вторичная диссоциация как слабого электролита обратимо. Применим З.Д.М.[Ag(NH3)2]+ ↔](/img/tmb/4/383021/9c2ba95a50d1cdefba87da5391785b7a-800x.jpg)








![3) Тетацин кальцийNa2 СaЭДТА 4) Цис-изомер дихлородиаммин платины[Pt(NH3)2Cl2]](/img/tmb/4/383021/c0789f451d40c7660c0d4e8511d92736-800x.jpg)











