- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация неорганических веществ. Оксиды и основания презентация
Содержание
- 1. Классификация неорганических веществ. Оксиды и основания
- 2. Неорганические вещества простые сложные
- 3. Простые вещества Простые вещества Металлы (М;
- 4. Сложные вещества Оксиды Основания Кислоты Соли
- 5. Оксиды Оксиды – это соединения двух элементов,
- 6. Классификация оксидов Оксиды Несолеобразующие* Солеобразующие* Основные*
- 7. Номенклатура оксидов Название оксида = «Оксид» +
- 8. Водородные соединения Водородные соединения гидриды Гидриды — соединения
- 9. Основания Основания – это сложные вещества,
- 10. Классификация оснований Основания растворимые (щелочи) нерастворимые Таблица растворимости растворимость в воде
- 11. Классификация оснований Основания однокислотные (одна гидроксидная
- 12. Номенклатура оснований Название гиороксида = «Гидроксид» +
- 13. Амфотерные гидроксиды Амфотерные гидроксиды – это сложные
- 14. Качественными реакциями называют такие реакции, которые позволяют
- 15. Соли металлов в огне
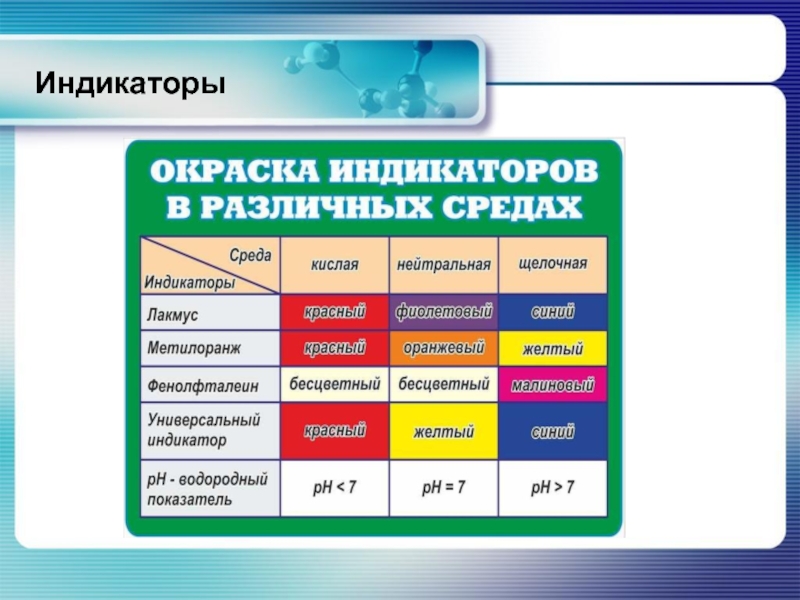
- 16. Индикаторы
Слайд 5Оксиды
Оксиды – это соединения двух элементов, один из которых кислород со
степенью окисления -2.
Общая формула
ЭmОn
m – число атомов элемента Э, n – число атомов кислорода
Примеры: Na2O – оксид калия; CaO - оксид кальция; SO2 –оксид серы.
Общая формула
ЭmОn
m – число атомов элемента Э, n – число атомов кислорода
Примеры: Na2O – оксид калия; CaO - оксид кальция; SO2 –оксид серы.
Слайд 6Классификация оксидов
Оксиды
Несолеобразующие*
Солеобразующие*
Основные*
Кислотные*
Амфотерные
* - Выписать определения и примеры
(с. 248, 250)
Слайд 7Номенклатура оксидов
Название оксида = «Оксид» + Название элемента в родит. падеже
+ Валентность элемента (римскими цифрами).
Пример: СО – оксид углерода (II)
Графическая формула: С=О
Пример: СО – оксид углерода (II)
Графическая формула: С=О
Слайд 8Водородные соединения
Водородные соединения
гидриды
Гидриды — соединения водорода с металлами и с имеющими меньшую
электроотрицательность, чем водород, неметаллами.
летучие водородные соединения
Летучее водородное соединение -это общее название бинарных соединений неметаллов с водородом, например галогеноводородов, халькогеноводородов.
летучие водородные соединения
Летучее водородное соединение -это общее название бинарных соединений неметаллов с водородом, например галогеноводородов, халькогеноводородов.
Слайд 9Основания
Основания – это сложные вещества, молекулы которых состоят из атома
металла и одной или нескольких гидроксидных групп (ОН).
Общая формула
Ме(ОН)y
у- число гидроксидных групп, равное валентности (а так же степени окисления) металла Ме, ОН – гидроксид-ион
Примеры: NaOH – гидроксид калия; Ca(OH)2 - гидроксид кальция; Fe(OH)3 – гидроксид железа.
Общая формула
Ме(ОН)y
у- число гидроксидных групп, равное валентности (а так же степени окисления) металла Ме, ОН – гидроксид-ион
Примеры: NaOH – гидроксид калия; Ca(OH)2 - гидроксид кальция; Fe(OH)3 – гидроксид железа.
Слайд 10Классификация оснований
Основания
растворимые (щелочи)
нерастворимые
Таблица растворимости
растворимость в воде
Слайд 11Классификация оснований
Основания
однокислотные
(одна гидроксидная группа)
двухкислотные
(две гидроксидные группы)
Трехкислотные
(три гидроксидные группы)
по числу
гидроксидных
групп
групп
Слайд 12Номенклатура оснований
Название гиороксида = «Гидроксид» + Название металла в родит. падеже
+ Валентность элемента (римскими цифрами), если металл имеет переменную валентность.
Пример: NaOH – гидроксид натрия
Ni(OH)2 – гидроксид никеля (II)
Пример: NaOH – гидроксид натрия
Ni(OH)2 – гидроксид никеля (II)
Слайд 13Амфотерные гидроксиды
Амфотерные гидроксиды – это сложные вещества, которые имеют свойства как
оснований так и кислот
Слайд 14Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от
других, а также узнать качественный состав неизвестных веществ.