- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислотність твердих тіл. Основні методи дослідження. Суперкислотність презентация
Содержание
- 1. Кислотність твердих тіл. Основні методи дослідження. Суперкислотність
- 2. Гілберт Ньютон Льюїс (23.10.1875(23.10.1875 — 23.03.(23.10.1875
- 3. Кислоти та основи Льюїса
- 4. Взаємний перехід Льюїсових та Бренcтедових центрів Ls+
- 5. Міра кислотності твердих речовин Сила
- 6. Кислотність поверхні каталізаторів для реакції гідратації пропілену
- 7. Попередня оцінка кислотності поверхні
- 8. Кислотність Бренстеда за Гамметом
- 9. Індикатори Гаммета - спеціальний набір основ В,
- 10. Індикатори Гаммета Гамметом було введено функцію H0:
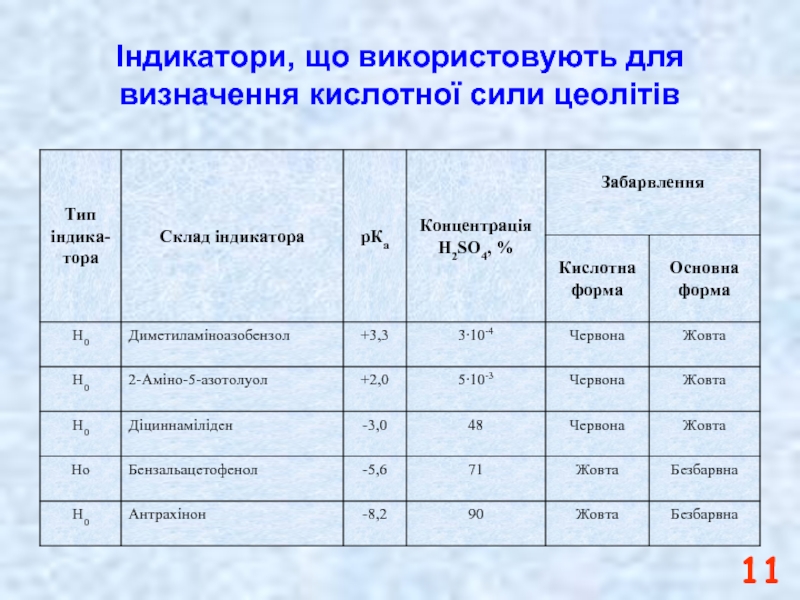
- 11. Індикатори, що використовують для визначення кислотної сили цеолітів
- 12. Кислотність Льюїса за Гамметом L –
- 13. За допомогою індикаторів Гаммета можна встановити: Перехід
- 14. Кислотність за Гамметом різних твердих речовин
- 15. 20 18 16 14
- 16. Спектри ТПД аміаку каталізаторів різного приготування
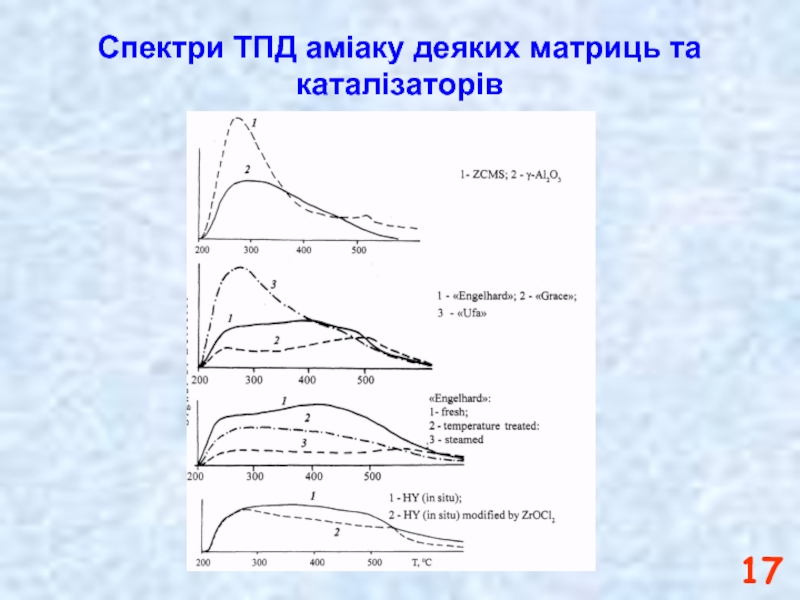
- 17. Спектри ТПД аміаку деяких матриць та каталізаторів
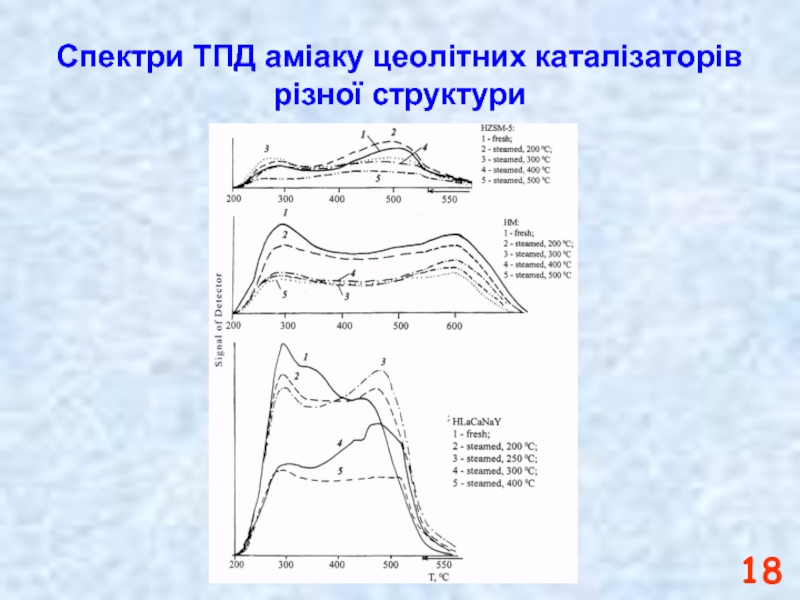
- 18. Спектри ТПД аміаку цеолітних каталізаторів різної структури
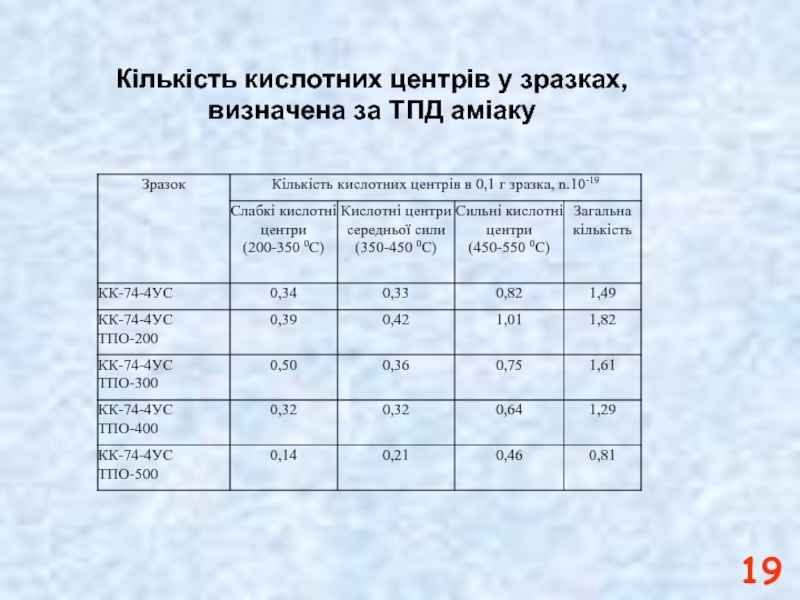
- 19. Кількість кислотних центрів у зразках, визначена за ТПД аміаку
- 20. Метод термопрограмованої десорбції Рівняння Анемонія-Цвєтановича
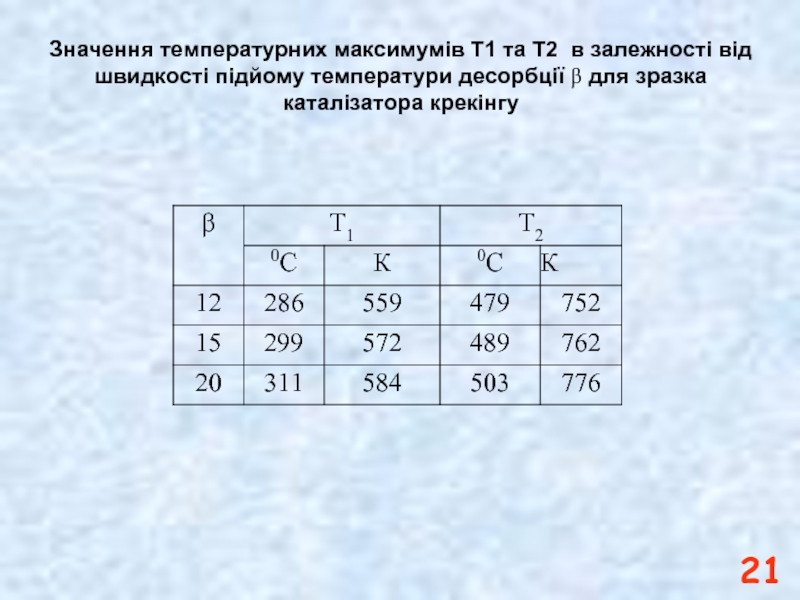
- 21. Значення температурних максимумів Т1 та Т2 в
- 22. Розрахунок енергії активації десорбції для різних типів
- 23. Інфрачервоний спектр адсорбції піридину на: NaY
Слайд 2Гілберт Ньютон Льюїс
(23.10.1875(23.10.1875 — 23.03.(23.10.1875 — 23.03.1946) —
видатний американський
Йоханнес-Ніколаус Бренстед (22.02 (22.02.1879 (22.02.1879 — 17.12. (22.02.1879 — 17.12.1947 (22.02.1879 — 17.12.1947) — датський фізикохімік
Слайд 4Взаємний перехід Льюїсових та Бренcтедових центрів
Ls+ + Н2О = (L:OH) +
Кислотний поверхневий центр Льюїса (Ls+ ) – це такий центр
на поверхні, який має вільну орбіталь з високою енергією спорідненості до пари електронів, тобто є акцептором електронної пари.
Основні центри Льюїса (L-OH). Ці центри мають електронні пари на орбіталях з високою енергією, тобто є донорами електронної пари.
Кислотні центри Бренстеда (Нs+) мають здатність віддавати протон, а основні центри Бренстеда виступають в ролі акцепторів протона.
Слайд 5Міра кислотності твердих речовин
Сила кислотних центрів
Число кислотних центрів
Сила
Слайд 6Кислотність поверхні каталізаторів для реакції гідратації пропілену
Fe2(SO4)3 > Al2(SO4)3 >
Слайд 7Попередня оцінка кислотності поверхні
де а – кислотна функція, ra - радіус аніона, rc - радіус катіона, Z - формальний заряд катіона.
Слайд 8Кислотність Бренстеда за Гамметом
До поняття твердої кислоти Бренстеда (H+) та
поняття відповідної цій основі (спряженої до цієї основи) кислоти BH+
Слайд 9Індикатори Гаммета -
спеціальний набір основ В, які розташовуються у певній послідовності
При [BH+] = [В] - перехід забарвлення індикатора Гаммета.
Слайд 10Індикатори Гаммета
Гамметом було введено функцію H0:
де Kа- константа рівноваги дисоціації
В момент зміни забарвлення індикатора Гаммета функція
Для кожної ж основи згаданого набору відома величина -рКа.
Слайд 12Кислотність Льюїса за Гамметом
L – Льюїсовий кислотний центр, В –
при якій електронна пара узагальнена
За аналогічною до розглянутої вище схемою доходимо до рівняння
Слайд 13За допомогою індикаторів Гаммета можна встановити:
Перехід забарвлення індикатора Гаммета з певною
Чим більша за абсолютним значенням величина рКа, тим вища сила кислотних центрів.
Індикаторний метод Гаммета дає суму кислотності Бренстеда та Льюїса даної сили.
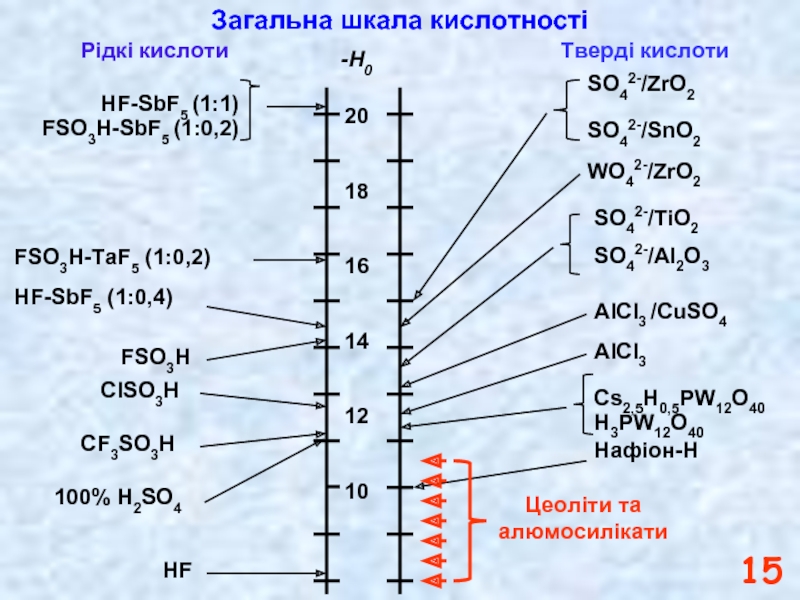
Слайд 1520
18
16
14
12
10
-H0
WO42-/ZrO2
AlCl3 /CuSO4
AlCl3
Нафіон-Н
HF-SbF5 (1:1)
FSO3H-SbF5 (1:0,2)
FSO3H-TaF5 (1:0,2)
FSO3H
HF-SbF5 (1:0,4)
ClSO3H
CF3SO3H
100% H2SO4
HF
Загальна шкала кислотності
Рідкі кислоти
Тверді кислоти
Слайд 20Метод термопрограмованої десорбції
Рівняння Анемонія-Цвєтановича
ln (β/Tp2) = A – (E/RTp),
де Е – енергія активації десорбції, А – константа.
Або в іншому вигляді
2lnT – ln β = Eд/RT + ln EдVm/Rk0,
де Т – температура максимуму піка, К;
β – швидкість нагріву, град/хв;
Eд – енергія активації десорбції, Дж/моль;
Vm – кількість десорбованого аміаку;
R – універсальна газова постійна, Дж/град.моль;
k0 – константа.
y = a + bx,
де y = 2lnT – ln β; a = ln Eд Vm /R k0; b = Eд /R; x = 1/T.
Слайд 21Значення температурних максимумів Т1 та Т2 в залежності від швидкості підйому
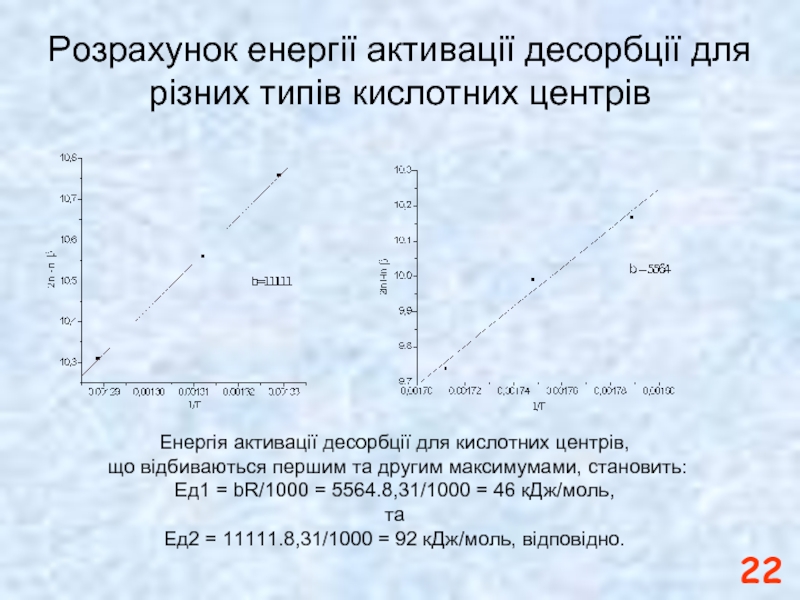
Слайд 22Розрахунок енергії активації десорбції для різних типів кислотних центрів
Енергія активації десорбції
що відбиваються першим та другим максимумами, становить:
Ед1 = bR/1000 = 5564.8,31/1000 = 46 кДж/моль,
та
Ед2 = 11111.8,31/1000 = 92 кДж/моль, відповідно.
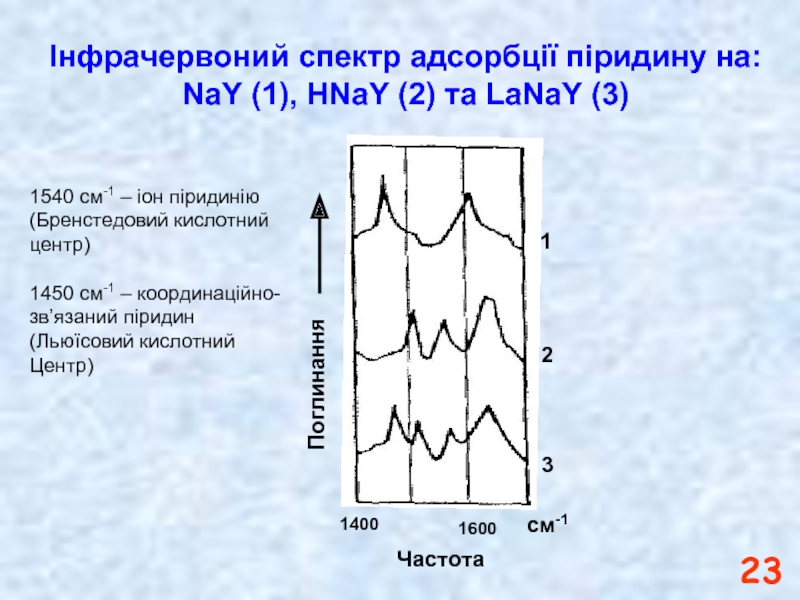
Слайд 23Інфрачервоний спектр адсорбції піридину на: NaY (1), HNaY (2) та
1600
1540 см-1 – іон піридинію
(Бренстедовий кислотний
центр)
1450 см-1 – координаційно-
зв’язаний піридин
(Льюїсовий кислотний
Центр)