- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислотные и основные свойства органических соединений презентация
Содержание
- 1. Кислотные и основные свойства органических соединений
- 2. Кислотные и основные свойства являются важными аспектами
- 3. Существует несколько концепций кислот и оснований: Теория
- 4. Для оценки кислотных и основных свойств органических соединений наибольшее значение имеют теории Бренстеда-Лоури и Льюиса.
- 5. Кислоты Бренстеда – это нейтральные молекулы и
- 6. A- H + B кислота основание
- 7. H Cl + H2O кислота основание
- 8. Понятия «кислотность» и «основность» относительны: в зависимости
- 9. + H2O + H3O+ кислота основание + H2SO4 + HSO4- основание кислота .. :
- 10. Кислоты Бренстеда
- 11. Так как в биохимических процессах растворителем обычно
- 12. Сила кислоты количественно выражается константой равновесия реакции
- 13. Учитывая, что концентрация воды практически не изменяется,
- 14. Величины Ka органических соединений малы (например Ka
- 15. Примеры кислот Бренстеда Обратите внимание! Кислотами могут
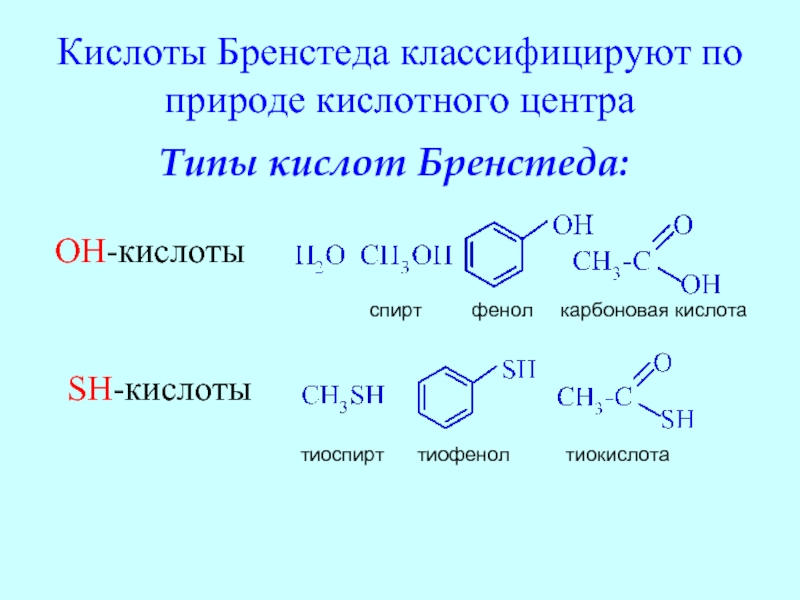
- 16. Кислоты Бренстеда классифицируют по природе кислотного центра
- 17. Типы кислот Бренстеда NH-кислоты аммиак
- 18. Типы кислот Бренстеда OH-кислоты
- 19. Образующийся в результате отщепления протона водорода анион
- 20. Стабильность аниона определяется
- 21. Природа атома кислотного центра Чем более электроотрицателен
- 22. Электроотрицательность атомов (способность удерживать электроны) можно сравнить,
- 23. Природа атома кислотного центра Электроотрицательность C
- 24. C2H5-OH + NaOH этанол C2H5-SH + NaOH
- 25. При сравнении кислотных свойств различных типов кислот
- 26. Сравнение кислотных свойств спиртов и фенолов
- 27. Фенол проявляет слабые кислотные свойства: он взаимодействует
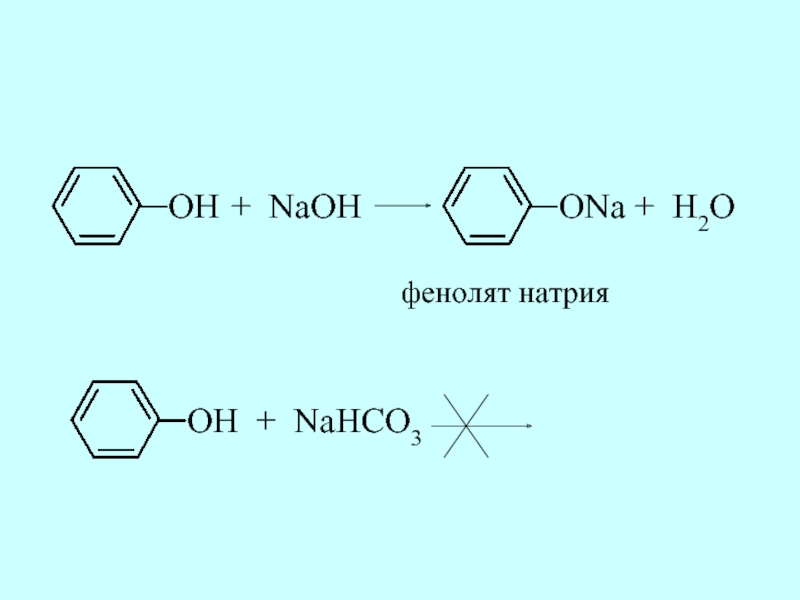
- 28. OH + NaOH ONa + H2O фенолят натрия OH + NaHCO3
- 29. Карбоновые кислоты являются более сильными кислотами, чем
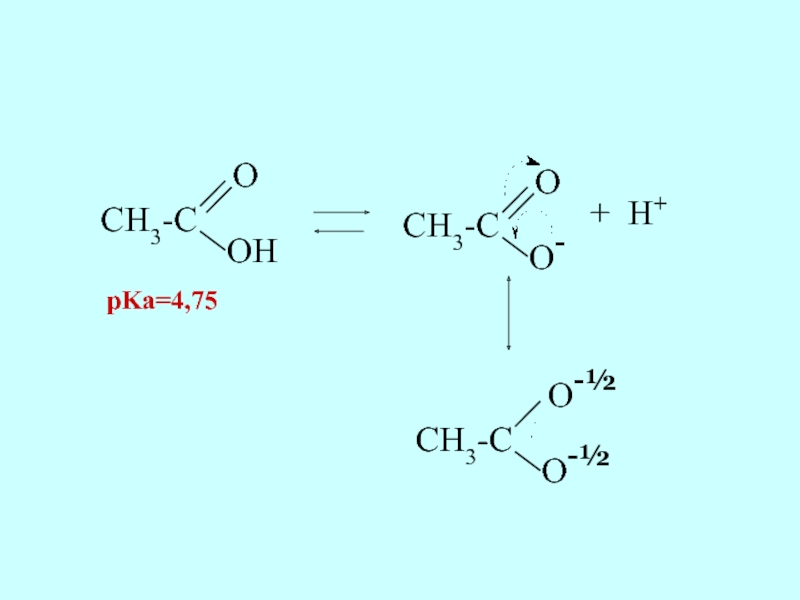
- 30. CH3-C O OH CH3-C O O- + H+ CH3-C O-½ O-½ pKa=4,75
- 31. Карбоновые кислоты взаимодействуют со щелочами, а также
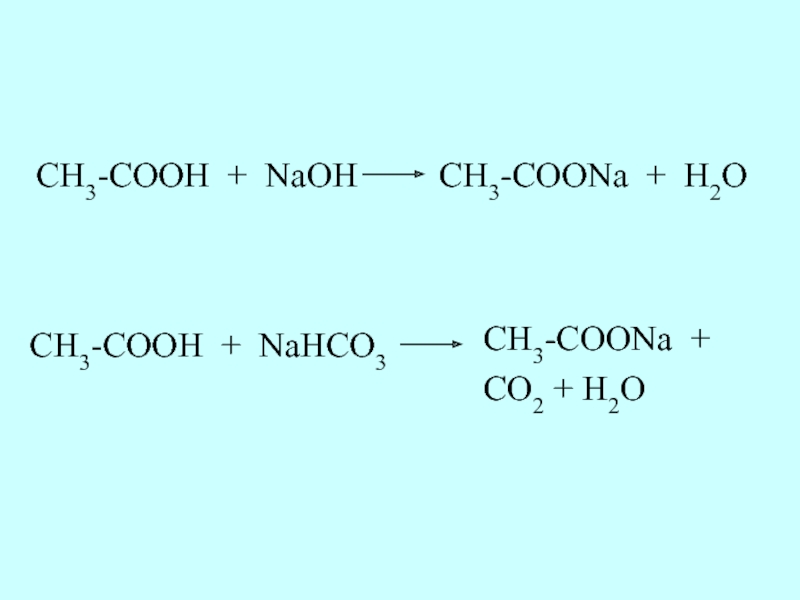
- 32. CH3-COOH + NaOH CH3-COONa + H2O CH3-COOH + NaHCO3 CH3-COONa + CO2 + H2O
- 33. Влияние заместителей в радикале на кислотные свойства
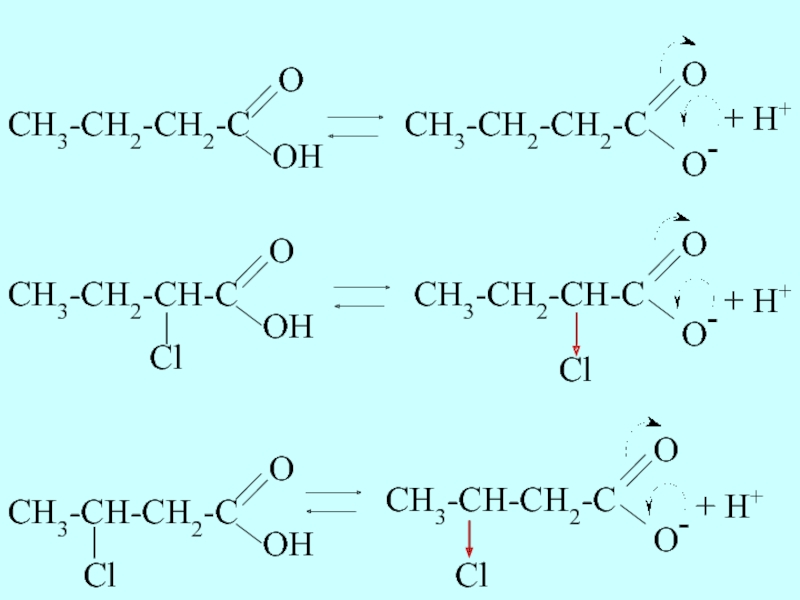
- 34. Сравним кислотные свойства масляной (бутановой), α-хлормасляной (2-хлорбутановой)
- 35. + H+ + H+ O- O CH3-CH2-CH-C Cl + H+ O- O CH3-CH-CH2-C Cl
- 36. Хлор из-за высокой электроотрицательности проявляет отрицательный индуктивный
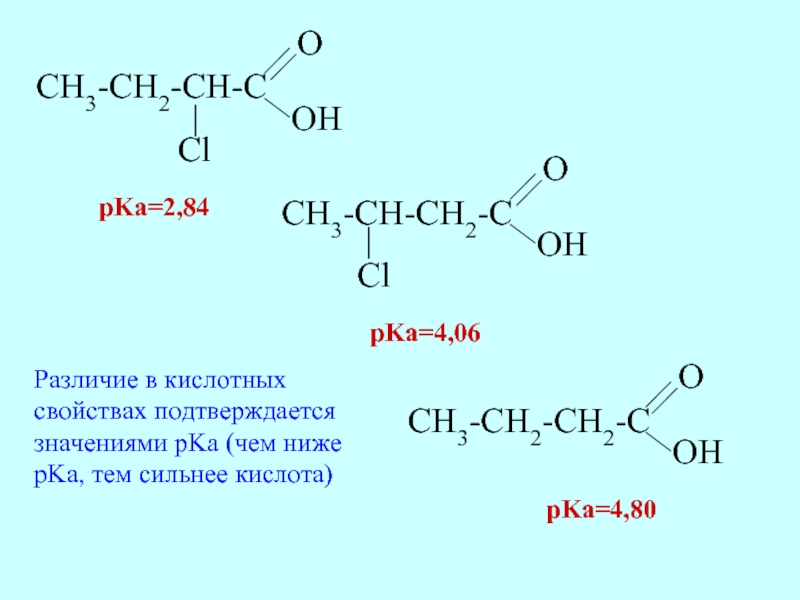
- 37. pKa=4,80 pKa=2,84 pKa=4,06 Различие в кислотных свойствах
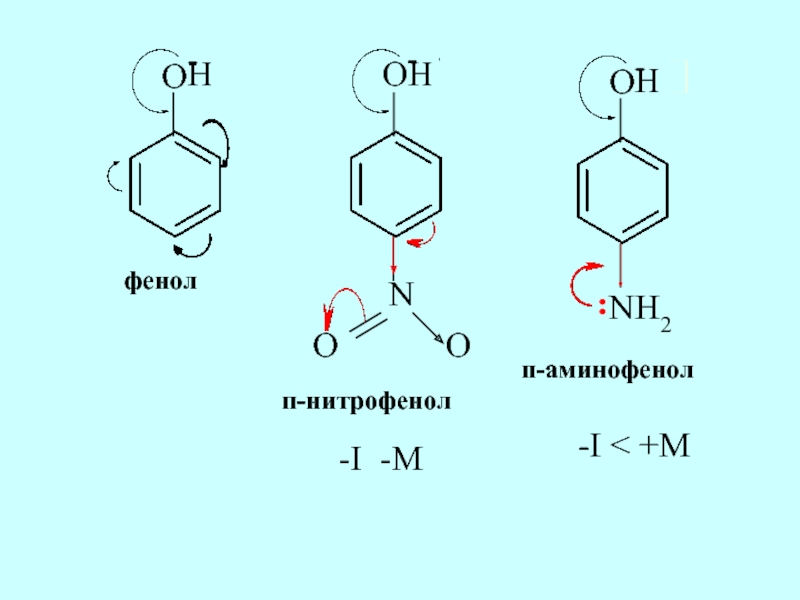
- 38. Сравним кислотные свойства фенола, п-нитрофенола и п-аминофенола.
- 39. O- H+ O- H+ N O O
- 40. Нитро-группа проявляет отрицательный индуктивный эффект и отрицательный
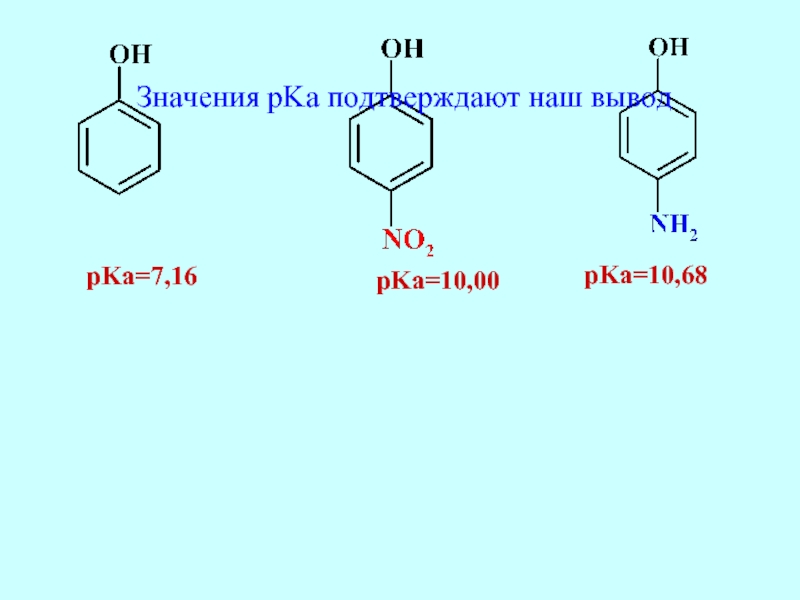
- 41. pKa=10,00 pKa=7,16 pKa=10,68 Значения pKa подтверждают наш вывод
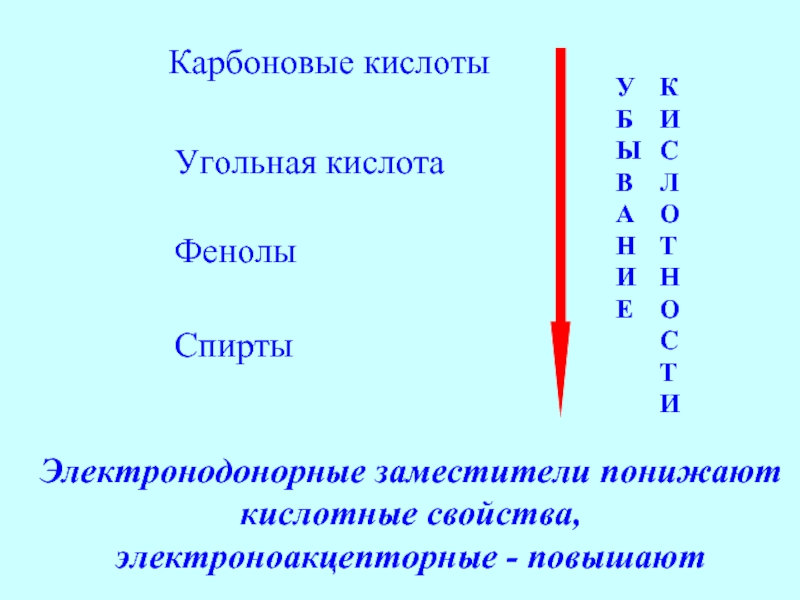
- 42. Итак, мы сравнили силу различных OH-кислот и пришли к следующему выводу:
- 43. Карбоновые кислоты Угольная кислота Фенолы Спирты
- 44. Основания Бренстеда
- 45. Основания Бренстеда – это нейтральные молекулы и
- 46. Нейтральные молекулы могут присоединять протон водорода за
- 47. Классификация оснований Бренстеда оксониевые основания
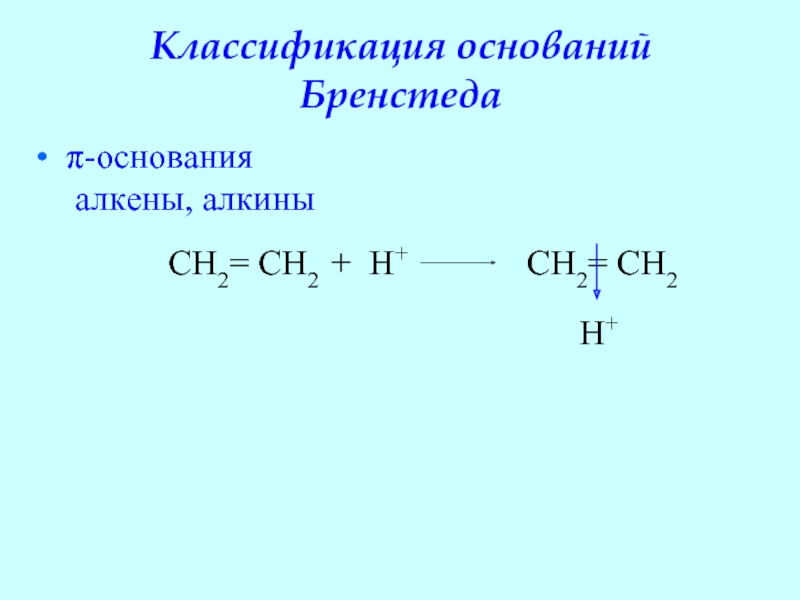
- 48. Классификация оснований Бренстеда π-основания
- 49. π-основания – слабые, т.к. протонирование происходит не
- 50. Сила основания выражается величиной pKBH+ .
- 51. Факторы, влияющие
- 52. CH3-CH2-NH2 + H2O CH3-CH2-NH3 + OH -
- 53. Факторы, влияющие
- 54. Факторы, влияющие
- 55. Сравнение основных свойств алифатических и ароматических аминов
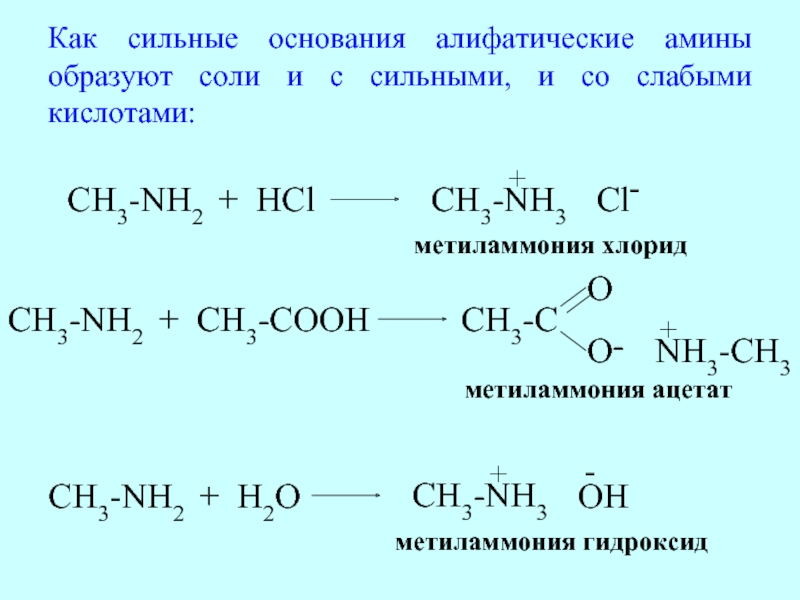
- 56. Как сильные основания алифатические амины образуют соли
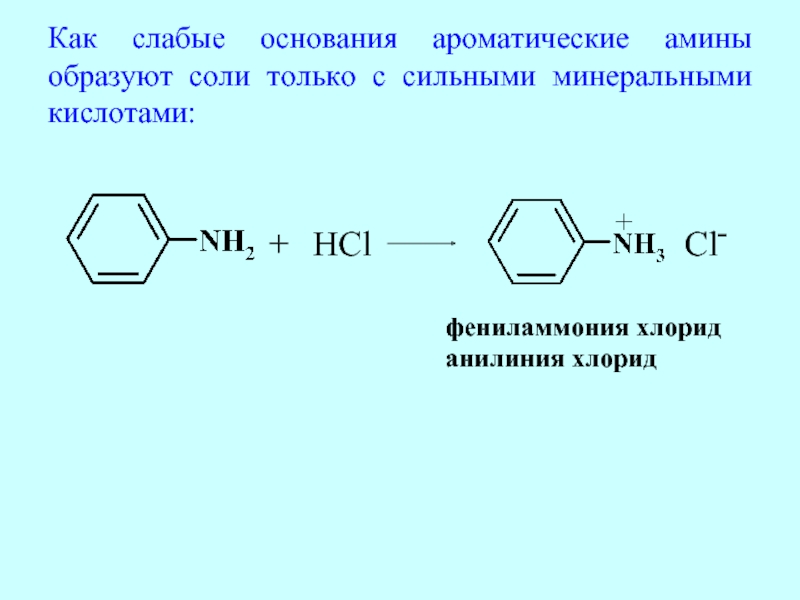
- 57. Как слабые основания ароматические амины образуют соли
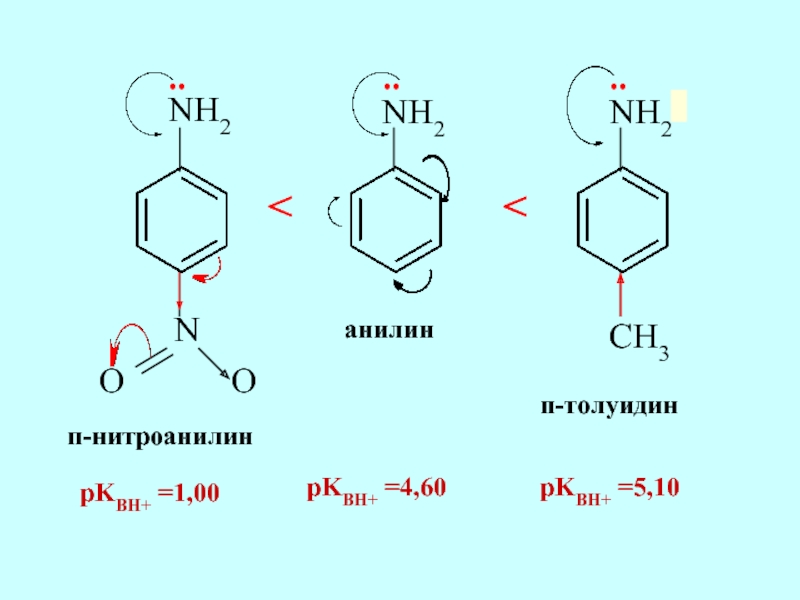
- 58. Электронодонорные заместители в кольце повышают основные свойства, электроно-акцепторные - понижают
- 59. NH2 NH2 N O O NH2 CH3 анилин п-нитроанилин п-толуидин .. .. ..
- 60. Учебное пособие составлено доцентом И.В. Зубковой
Слайд 1Кислотные и основные
свойства
органических соединений
учебное пособие для студентов фармацевтического факультета
Слайд 2Кислотные и основные свойства являются важными аспектами реакционной способности органических соединений.
Важную роль в химических процессах также играет кислотный или основный катализ.
Многие биохимические процессы
протекают с переносом протона водорода
Слайд 3Существует несколько концепций кислот и оснований:
Теория Аррениуса. Кислоты – соединения, при
Более универсальной является теория Бренстеда-Лоури, согласно которой кислотность и основность соединений связывается с переносом протона водорода H+ (поэтому теорию называют ещё протолитической).
Еще более общей теорией, касающейся и апротонных соединений (не имеющих протона водорода), является теория Льюиса.
Слайд 4Для оценки кислотных и основных свойств органических соединений наибольшее значение имеют
Слайд 5Кислоты Бренстеда – это нейтральные молекулы и ионы, способные отщепить протон
Основания Бренстеда – это нейтральные молекулы и ионы, способные присоединить протон водорода (акцепторы протонов).
Слайд 6A-
H
+
B
кислота
основание
A -
+
B+-H
сопряженные
основание
кислота
Взаимодействие кислоты и основания может быть представлено схемой:
Кислота
основание B присоединяет протон и превращается в
катион BH+. Исходя из определения кислот и оснований
Бренстеда, анион A- является основанием (может присое-
динить протон), катион BH+ - кислотой (может отщепить
протон). Их называют сопряженными основанием и
кислотой.
Слайд 7H
Cl
+
H2O
кислота
основание
Cl -
+
H3O+
сопряженные
основание
кислота
Кислотные и основные свойства взаимосвязаны: кислотные свойства проявляются
Слайд 8Понятия «кислотность» и «основность» относительны: в зависимости от условий одно и
Например, в присутствии воды как основания уксусная кислота проявляет кислотные свойства, а в присутствии серной кислоты она является основанием.
Слайд 11Так как в биохимических процессах растворителем обычно является вода, то кислотные
A-H + H2O
A- + H3O+
A-H + B
A- + B+H
вместо основания B подставим воду:
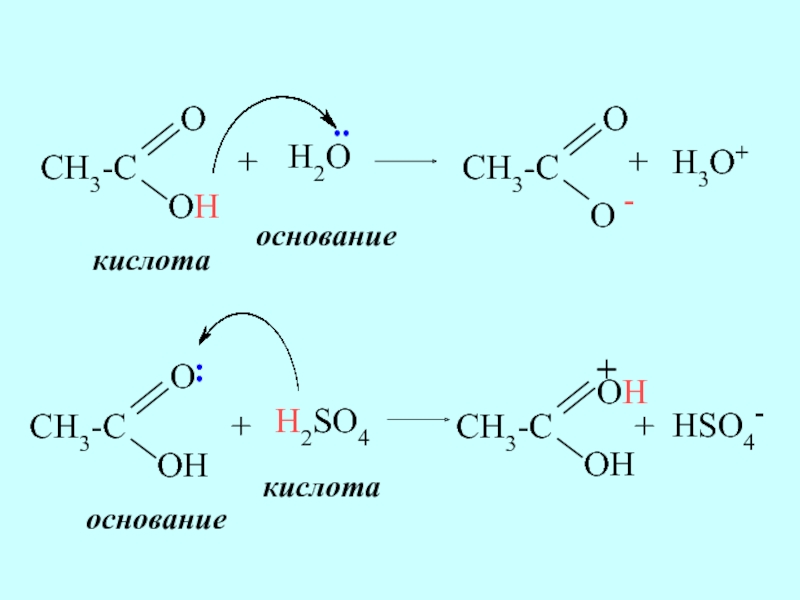
Слайд 12Сила кислоты количественно выражается константой равновесия реакции (K):
A-H + H2O
A- +
K=
[A-] [H3O+]
[A-H] [H2O]
Слайд 13Учитывая, что концентрация воды практически не изменяется, можно определить произведение K[H2O]
Ka = K [H2O] =
[A-] [H3O+]
[A-H]
Чем выше константа кислотности Ka, тем сильнее
кислота
Слайд 14Величины Ka органических соединений малы (например Ka уксусной кислоты равна 1,75·10-5),
pKa = - lg Ka
Например, pKa (CH3COOH) = 4,75
Чем выше показатель константы кислотности pKa, тем слабее кислота
Слайд 15Примеры кислот Бренстеда Обратите внимание! Кислотами могут быть не только нейтральные молекулы,
Нейтральные молекулы:
H2O CH3-OH
H2S CH3-SH
NH3 CH3-NH2
CH4
Катионы
H3O+ NH4+
Слайд 16Кислоты Бренстеда классифицируют по природе кислотного центра
Типы кислот Бренстеда:
OH-кислоты
спирт
SH-кислоты
тиоспирт тиофенол тиокислота
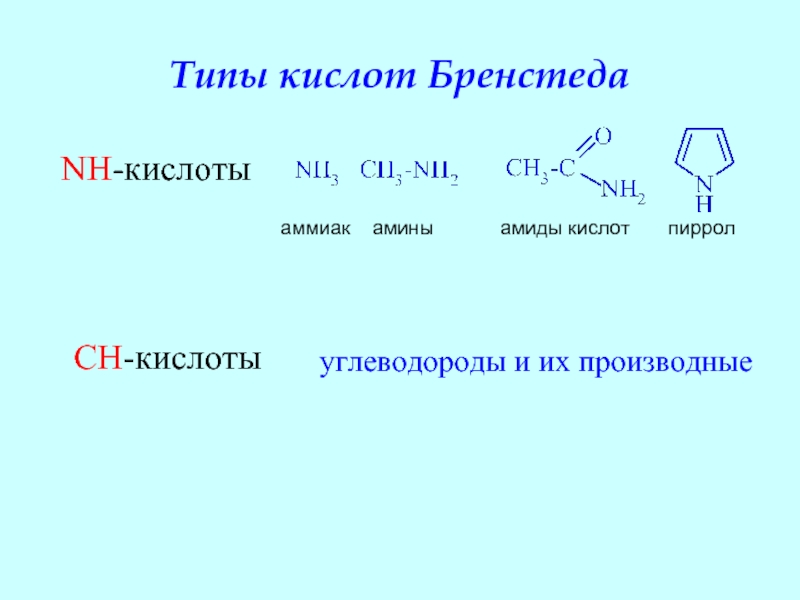
Слайд 17Типы кислот Бренстеда
NH-кислоты
аммиак амины
CH-кислоты
углеводороды и их производные
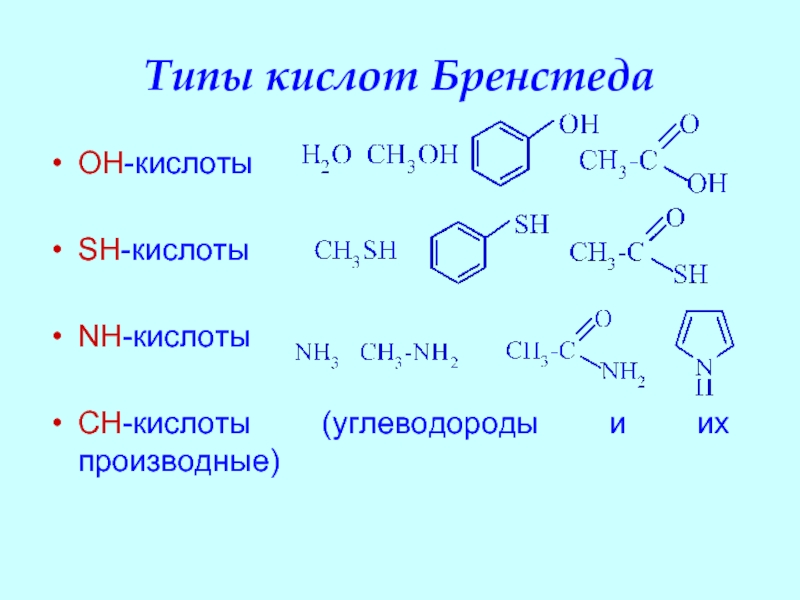
Слайд 18Типы кислот Бренстеда
OH-кислоты
SH-кислоты
NH-кислоты
CH-кислоты (углеводороды и их производные)
Слайд 19Образующийся в результате отщепления протона водорода анион может вновь присоединить протон,
Чем стабильнее сопряженное основание (анион кислоты), тем сильнее кислота
A-H + H2O
A- + H3O+
Слайд 20 Стабильность аниона определяется
степенью делокализации заряда, которая зависит
природа атома кислотного центра
влияние заместителя (особенно сопряженной системы)
сольватация
Слайд 21Природа атома кислотного центра
Чем более электроотрицателен атом, тем сильнее он удерживает
Чем выше поляризуемость атома, тем легче отрицательный заряд рассредоточивается (делокализуется), тем труднее протону присоединиться к аниону кислоты, тем сильнее проявятся кислотные свойства.
Слайд 22Электроотрицательность атомов (способность удерживать электроны) можно сравнить, используя таблицу Менделеева: она
Поляризуемость (способность рассредоточивать заряд) зависит от размера атома: чем больше радиус атома, тем выше поляризуемость. Радиусы атомов увеличиваются с увеличением номера периода.
Слайд 23Природа атома кислотного центра
Электроотрицательность C N
возрастает
Кислотные свойства :
OH > NH > CH
Поляризуемость
п е р и о д
O
S
г
р
у
п
п
а
в
о
з
р
а
с
т
а
е
т
SH > OH
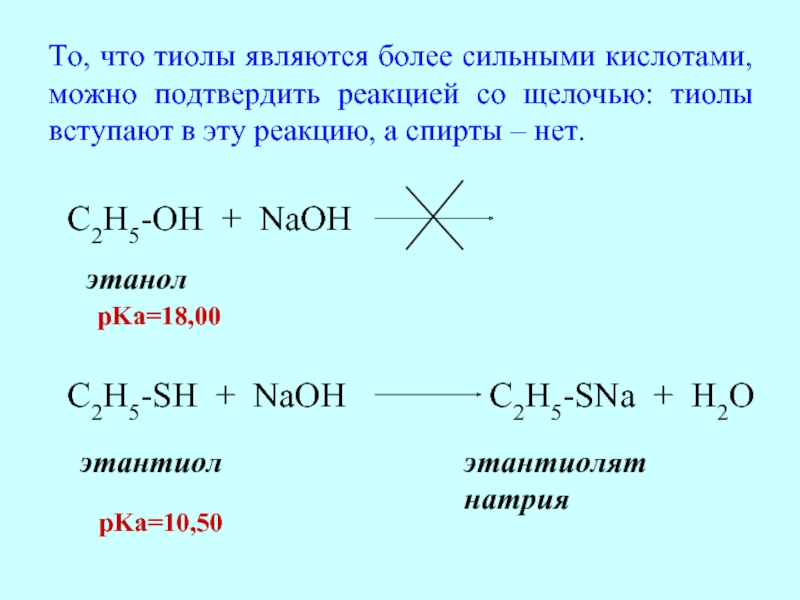
Слайд 24C2H5-OH + NaOH
этанол
C2H5-SH + NaOH
C2H5-SNa + H2O
этантиол
этантиолят
натрия
pKa=18,00
pKa=10,50
То, что тиолы являются более
Слайд 25При сравнении кислотных свойств различных типов кислот Бренстеда необходимо рассматривать фактор
Сравним, например кислотные свойства метанола и фенола
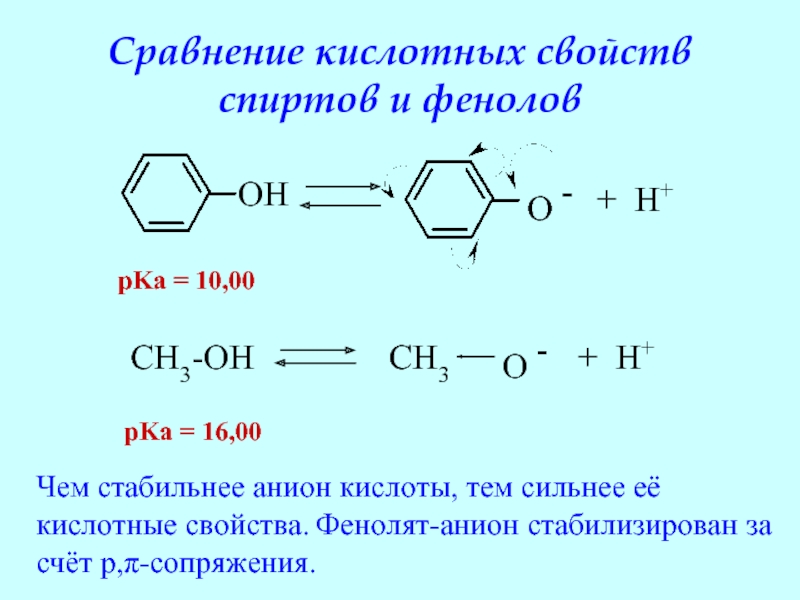
Слайд 26Сравнение кислотных свойств
спиртов и фенолов
OH
O -
+ H+
CH3-OH
CH3
O -
+ H+
pKa =
pKa = 16,00
Чем стабильнее анион кислоты, тем сильнее её
кислотные свойства. Фенолят-анион стабилизирован за счёт p,π-сопряжения.
Слайд 27Фенол проявляет слабые кислотные свойства: он взаимодействует с сильным основанием (щелочью),
Слайд 29Карбоновые кислоты являются более сильными кислотами, чем фенолы. Это связано с
Слайд 31Карбоновые кислоты взаимодействуют со щелочами, а также с солями угольной кислоты.
Слайд 33Влияние заместителей в радикале на кислотные свойства
Электроноакцепторные заместители способствуют делокализации заряда
Электронодонорные заместители препятствуют делокализации заряда в анионе, следовательно, понижают кислотные свойства
Слайд 34Сравним кислотные свойства масляной (бутановой), α-хлормасляной (2-хлорбутановой) и β-хлормасляной (3-хлорбутановой) кислот. Запишем
Слайд 36Хлор из-за высокой электроотрицательности проявляет отрицательный индуктивный эффект, он смещает электронную
Слайд 37pKa=4,80
pKa=2,84
pKa=4,06
Различие в кислотных
свойствах подтверждается
значениями pKa (чем ниже
pKa, тем сильнее кислота)
Слайд 38Сравним кислотные свойства фенола, п-нитрофенола и п-аминофенола. Запишем формулы соединений, покажем
Слайд 40Нитро-группа проявляет отрицательный индуктивный эффект и отрицательный мезомерный эффект, значит, является
Слайд 43Карбоновые кислоты
Угольная кислота
Фенолы
Спирты
У
Б
Ы
В
А
Н
И
Е
К
И
С
Л
О
Т
Н
О
С
Т
И
Электронодонорные заместители понижают кислотные свойства, электроноакцепторные
Слайд 45Основания Бренстеда – это нейтральные молекулы и ионы, способные присоединить протон
Слайд 46Нейтральные молекулы могут присоединять протон водорода за счет неподелённой электронной пары
n-основания
π-основания
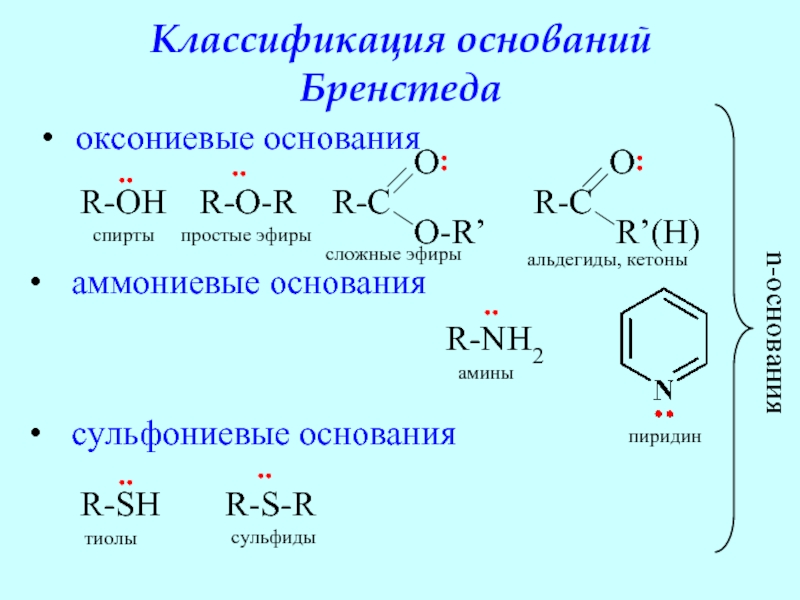
Слайд 47Классификация оснований Бренстеда
оксониевые основания
аммониевые основания
сульфониевые основания
n-основания
спирты
простые
сложные эфиры
альдегиды, кетоны
амины
пиридин
тиолы
сульфиды
Слайд 49π-основания – слабые, т.к. протонирование происходит не за счет свободной пары
Слайд 50Сила основания выражается величиной pKBH+ .
pKBH+ - это pKa сопряженной с
Чем больше pKBH+ , тем сильнее основание
Слайд 51Факторы, влияющие
на основные свойства
С увеличением
Слайд 52CH3-CH2-NH2
+
H2O
CH3-CH2-NH3
+
OH
-
этиламмония гидроксид
..
CH3-CH2-O-H
..
+
H2SO4
CH3-CH2-O-H
H
+
HSO4
-
этилоксония гидросульфат
Спирты образуют соли только при взаимодействии с сильными кислотами
Алифатические амины взаимодействуют даже с такой
слабой кислотой как вода:
Слайд 53
Факторы, влияющие
на основные свойства
С увеличением
Поэтому оксониевые основания сильнее сульфониевых.
Слайд 54
Факторы, влияющие
на основные свойства
Влияние заместителей,
Электронодонорные заместители повышают основность, а электроноакцепторные – понижают (чем выше электронная плотность на основном центре, тем легче он предоставит свою электронную пару протону)
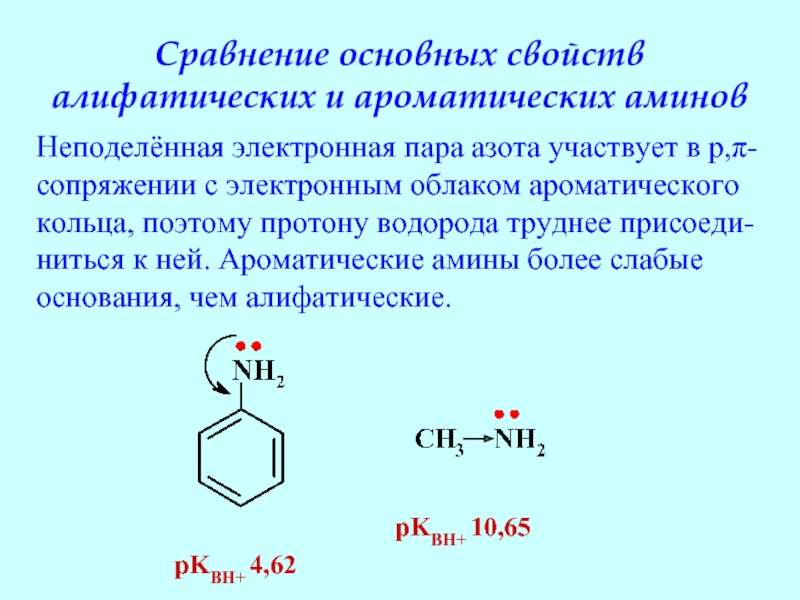
Слайд 55Сравнение основных свойств алифатических и ароматических аминов
pKBH+ 4,62
pKBH+ 10,65
Неподелённая электронная пара
сопряжении с электронным облаком ароматического
кольца, поэтому протону водорода труднее присоеди-
ниться к ней. Ароматические амины более слабые
основания, чем алифатические.
Слайд 56Как сильные основания алифатические амины образуют соли и с сильными, и
CH3-NH2
+
HCl
CH3-NH3
+
Cl
-
метиламмония хлорид
CH3-NH2
+
CH3-COOH
O
-
NH3-CH3
+
метиламмония ацетат
CH3-NH2
+
H2O
CH3-NH3
+
OH
-
метиламмония гидроксид
Слайд 57Как слабые основания ароматические амины образуют соли только с сильными минеральными
+
HCl
+
Cl
-
фениламмония хлорид
анилиния хлорид










![Сила кислоты количественно выражается константой равновесия реакции (K):A-H + H2OA- + H3O+K=[A-] [H3O+][A-H] [H2O]](/img/tmb/1/86525/4591c622b263bc2e67cd99400cf595b3-800x.jpg)
![Учитывая, что концентрация воды практически не изменяется, можно определить произведение K[H2O] – константу кислотности Ka](/img/tmb/1/86525/a3b4213951719ae2e2fe4c73dba23d55-800x.jpg)