- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислотность органических соединений. Типы химических реакций презентация
Содержание
- 1. Кислотность органических соединений. Типы химических реакций
- 2. 3. Кислотность органических соединений Кислотно-основные
- 3. Основные
- 4. 2. Основание – частица (молекула или ион),
- 5. Протолитическая теория
- 6. 3. Кислота и основание связаны в сопряженную
- 7. Основание
- 8. 4. Сильной сопряженной кислоте соответствует слабое сопряженной
- 9. Протолитическая теория кислот и оснований. 5. Кислоты-протолиты
- 10. Основания-протолиты также делятся на 3 класса:
- 11. Кислота Сопряж. осн-е Основание Сопряж. К-та
- 12. 7. Количественно сила кислот-протолитов оценивается величиной константы
- 13. Пример:
- 14. Таким образом, чем выше
- 15. На практике используют показатель константы кислотности (pKa):
- 16. Кислотным центром называется элемент (С, S, O,
- 17. Формулы и названия веществ
- 18. На стабильность аниона оказывают влияние следующие
- 19. кислород более электроотрицательный элемент связь О-Н
- 20. б) поляризуемость элемента в кислотном центре. Сравним
- 21. Благодаря большему радиусу и
- 22. 2.Влияние сопряжения на стабильность аниона. Пример: Этанол
- 23. В молекуле фенола под
- 24. Фенол проявляет более выраженные кислотные свойства, чем одноатомные спирты.
- 25. 3. Влияние заместителей на стабильность аниона.
- 26. Наличие в радикале кислоты ЭА заместителя –ОН-группы
- 27. 4. Влияние растворителя на стабильность аниона.
- 28. Спасибо за внимание!
Слайд 23. Кислотность органических соединений
Кислотно-основные свойства органических веществ рассматривают, основываясь
Слайд 3
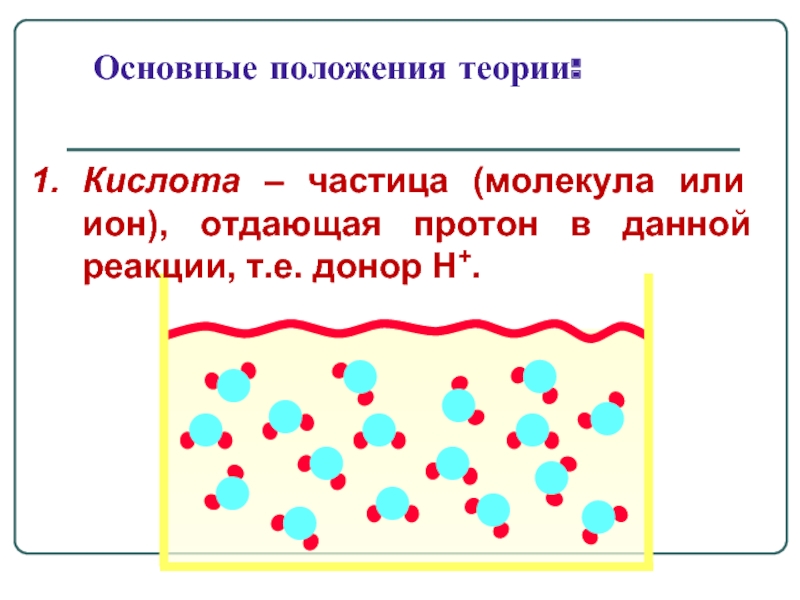
Основные положения теории:
Кислота – частица (молекула или ион), отдающая протон в
Слайд 42. Основание – частица (молекула или ион), присоединяющая протон в данной
Слайд 5
Протолитическая теория кислот и оснований
Основание – частица (молекула или ион), присоединяющая
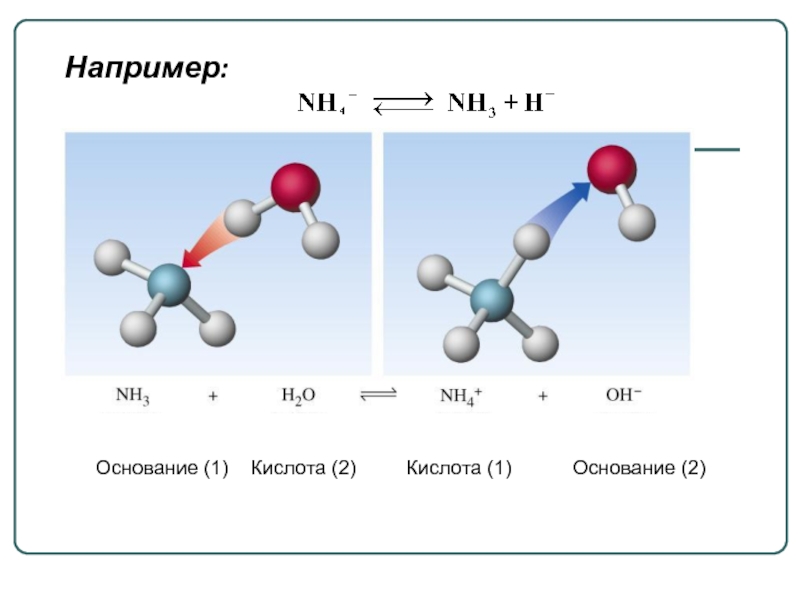
Слайд 63. Кислота и основание связаны в сопряженную пару протолитов, частицы которой
кислота основание + Н+
кислота
основание
сопряжённое
основание
сопряжённая
кислота
Например:
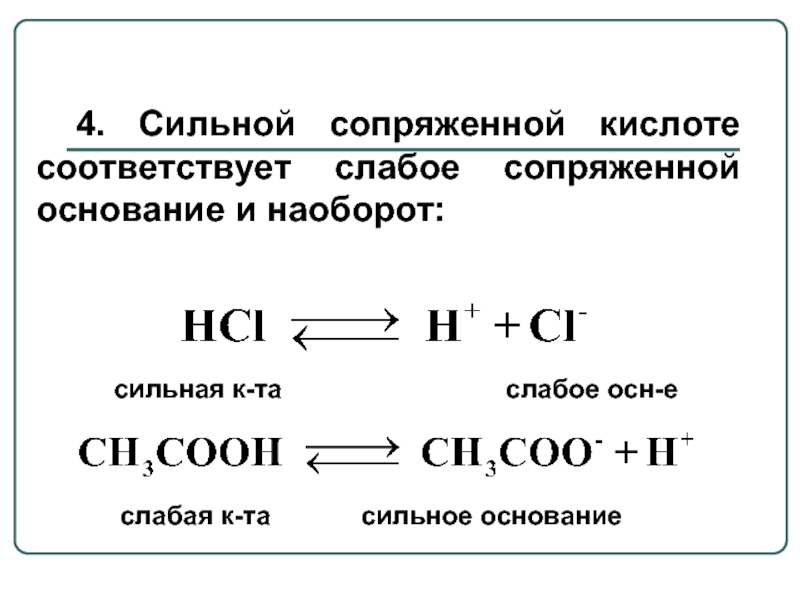
Слайд 84. Сильной сопряженной кислоте соответствует слабое сопряженной основание и наоборот:
сильная к-та слабое осн-е
слабая к-та сильное основание
Слайд 9Протолитическая теория кислот и оснований.
5. Кислоты-протолиты делят на 3 класса:
А) нейтральные
В) катионные
С) анионные
Слайд 10Основания-протолиты также делятся на 3 класса:
Нейтральные
B) Катионные FeOH+
C) Анионные Сl-, CH3COO-
СН3СОО- + Н+ СН3СООН
Слайд 11Кислота
Сопряж. осн-е
Основание
Сопряж. К-та
6. Амфолиты – протолиты, способные как принимать, так и
Кислота Основание
Основание Кислота
Слайд 127. Количественно сила кислот-протолитов оценивается величиной константы кислотности (Ка).
Ка характеризует момент
Слайд 14 Таким образом, чем выше концентрация сопряженных частиц продуктов
Слайд 15На практике используют показатель константы кислотности (pKa):
Чем меньше значение pKa, тем
Слайд 16Кислотным центром называется элемент (С, S, O, N) и связанный с
Органические кислоты соответственно классифицируются по кислотному центру на
О-Н; S-H; N-H; C-H кислоты.
Слайд 17 Формулы и названия веществ
рКа
18
10,5 С2Н5SH этантиол
30 С2Н5NH2 этанамин
9,9 С6Н5ОН фенол
Чем больше значение рКа, тем слабее кислота.
Слайд 18 На стабильность аниона оказывают влияние следующие факторы:
1. Природа элемента в
а) электроотрицательность элемента
Сравним кислотные свойства веществ с одинаковыми радикалами:
СН3–СН2 –ОН (рКа=18)
СН3–СН2 –NH2 (рКа=30).
Слайд 19кислород более электроотрицательный элемент
связь О-Н более полярна, чем N-H, что
Амины более слабые кислоты, чем спирты.
Слайд 20б) поляризуемость элемента в кислотном центре.
Сравним кислотные свойства веществ с одинаковыми
СН3–СН2 –ОН (рКа=18)
СН3–СН2 –SH (рКа=10,5).
Слайд 21 Благодаря большему радиусу и более высокой поляризуемости атома
Это обусловливает более высокую стабильность меркаптид-иона по сравнению с алкоксид-ионом.
Этантиол является более сильной кислотой, чем этанол.
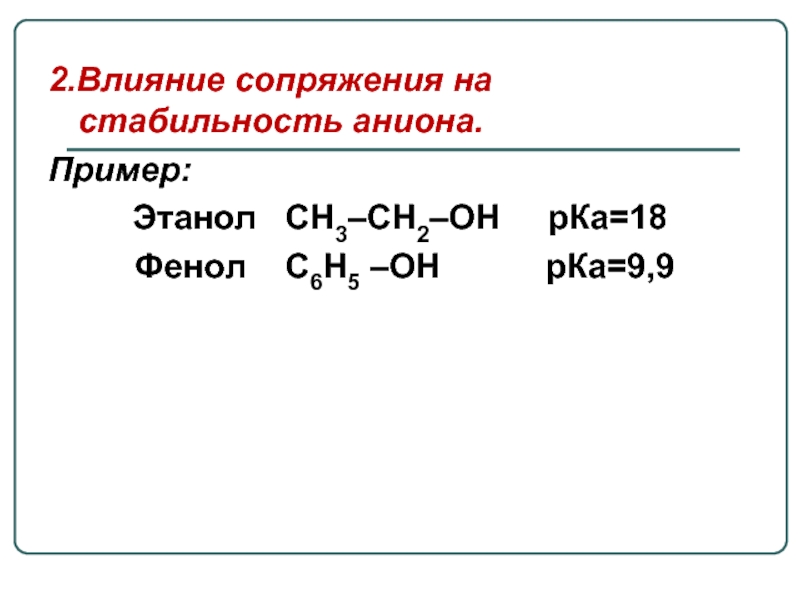
Слайд 222.Влияние сопряжения на стабильность аниона.
Пример:
Этанол СН3–СН2–ОН рКа=18
Фенол
Слайд 23 В молекуле фенола под влиянием
Образующийся при отщеплении иона Н+ феноксид-ион С6 Н5–О- , является р, π-сопряжённой системой и обладает высокой стабильностью.
Слайд 253. Влияние заместителей на стабильность аниона.
СН3–СН2–СООН
СН3–СН (ОН)–СООН рКа=3,83
2-оксипропановая к-та
Слайд 26Наличие в радикале кислоты ЭА заместителя –ОН-группы способствует делокализации отрицательного заряда
ЭА-заместители усиливают кислотность, а ЭД - снижают.
Слайд 274. Влияние растворителя на стабильность аниона.
Муравьиная кислота рКа=3,7
Уксусная кислота рКа=4,76
Пропионовая кислота рКа=4,90
Так как формиат-ион имеет малые размеры, он наиболее гидратирован и стабилен, по сравнению с ацетат-ионом и пропионат- ионом.