- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона презентация
Содержание
- 1. Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
- 2. Электролитическая теория первая научная ионная теория кислот
- 3. Амфотерность А. Ганч в 1917-1927 годах ввел
- 4. Теории кислот и оснований протолитическая (И. Бренстед
- 5. В протолитической теории Вода принята за своеобразный
- 6. Почему вода? Вода - одно из самых
- 7. Количественная мера кислотности и основности Кислотность соединений
- 8. Принцип ЖМКО Пирсона (1963) Кислоты и основания
- 9. Жесткие кислоты Жесткие основания -низкая
- 10. Мягкие кислоты Мягкие основания -высокая
- 11. Классификация кислот и оснований в рамках принципа ЖМКО
- 12. Помимо условного деления на три типа, можно
- 13. Ж. кис.+ Ж. осн. = Зарядовый контроль
- 14. Зарядовый контроль
- 15. Применение в органической химии В органической химии
- 16. Принцип Пирсона также полезен для предсказания реакционной
- 17. Алкилирование енолят-ионов С-изомер
- 18. Амбидентные субстраты и реагенты -0.31 +0.09 -0.79
- 19. Амбидентность нитрит – иона O- – N
- 20. Амбидентность енолят-аниона (С2H5)3OF (фторид триэтилоксония) – очень
- 21. Алкилирование енолят-ионов С-изомер
- 22. Me-OH + H-I
Слайд 2Электролитическая теория
первая научная ионная теория кислот и оснований (Оствальд, Аррениус, 1890
Слайд 3Амфотерность
А. Ганч в 1917-1927 годах ввел понятие об амфотерности - способности
Как оказалось позже, соединений, проявляющих амфотерность, подавляющее большинство. В зависимости от природы партнера по взаимодействию кислота может выступать в роли основания, и наоборот.
Слайд 4Теории кислот и оснований
протолитическая (И. Бренстед и Т. Лоури) и электронная
По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон. Кислота – понятие относительное.
CH3COOH + H2O = H3O+ + CH3COO-
H2SO4 + CH3COOH = CH3C(OH)2+ + HSO4-
Слайд 5В протолитической теории
Вода принята за своеобразный стандарт для оценки кислотно-основных свойств
Если в аналогичных условиях рассматриваемое вещество способно отдавать протон легче, чем вода, то его относят к группе кислот. Если вещество по способности присоединять (связывать) протон превосходит воду - это основание (основность выше, чем у воды).
Слайд 6Почему вода?
Вода - одно из самых распространенных на Земле соединений.
Ее
Вода хорошо растворяет многие полярные и диссоциирующие на ионы вещества.
По физическим характеристикам вода хорошо сольватирует как недиссоциированные молекулы, так и свободные ионы.
Кроме того, молекулы воды способны к автопротолизу - передаче протона между молекулами одного и того же вещества:
H2O + H2O = H3O+ + OH-
Слайд 7Количественная мера кислотности и основности
Кислотность соединений количественно оценивается долей ионизированной формы
Слайд 8Принцип ЖМКО Пирсона (1963)
Кислоты и основания Льюиса делятся на жёсткие и
Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ковалентного характера
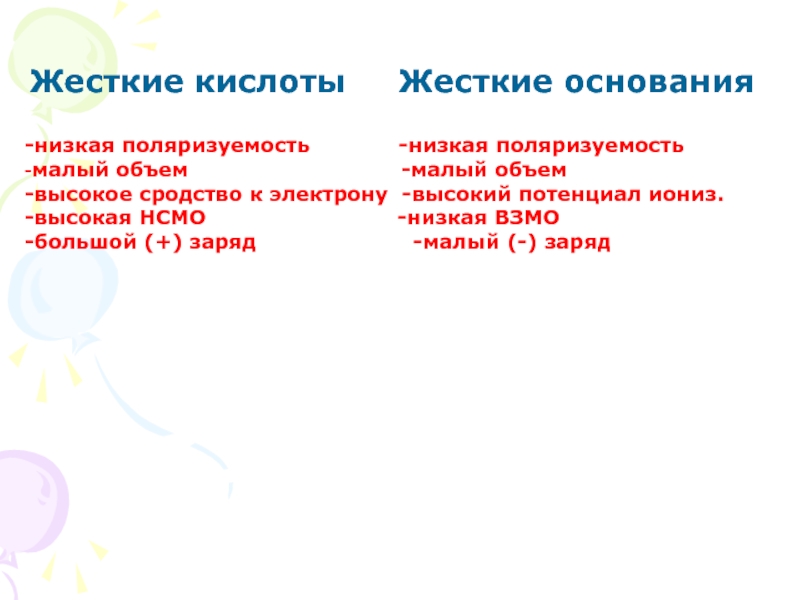
Слайд 9Жесткие кислоты Жесткие основания
-низкая поляризуемость
-малый объем -малый объем
-высокое сродство к электрону -высокий потенциал иониз.
-высокая НСМО -низкая ВЗМО
-большой (+) заряд -малый (-) заряд
Слайд 10Мягкие кислоты Мягкие основания
-высокая поляризуемость -высокая поляризуемость
-большой объем -большой объем -низкая НСМО -высокая ВЗМО
-малое сродство к электрону -малый потенциал иониз.
-малый (+) заряд -большой (-)заряд
Поляризуемость мягких кислот и оснований:
в большом атоме (или ионе с малым эффективным зарядом ядра)
относительно легко «искажается» электронное облако
(частица поляризуется)
Слайд 12Помимо условного деления на три типа, можно также проследить зависимость жёсткости
При движении по группе сверху вниз жёсткость кислот тоже уменьшается :
Li+ > Na+ > K+; Zn2+ > Cd2+ > Hg2+
Для изоэлектронных соединений жёсткость возрастает при движении по группе слева направо: СH3- < NH2- < OH- < F-
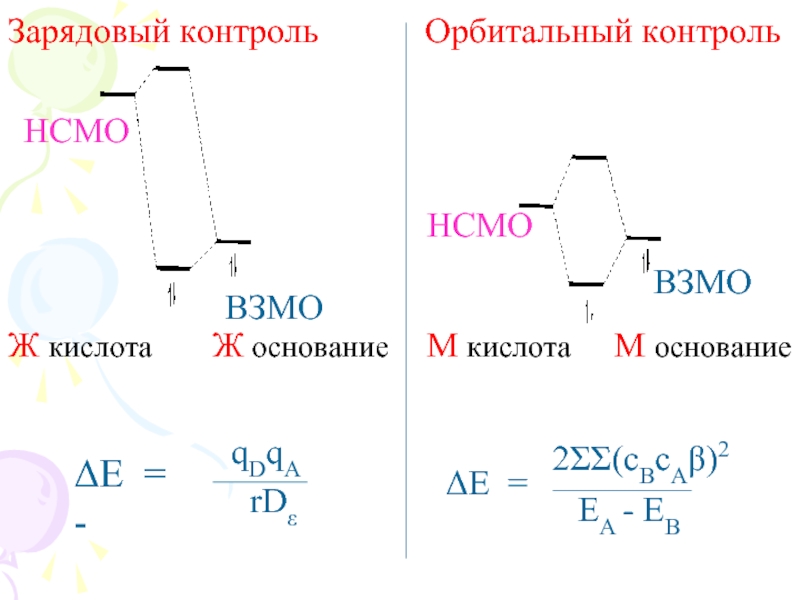
Слайд 13Ж. кис.+ Ж. осн. = Зарядовый контроль
Высоколежащая НСМО к-ты + низколежащая
М. кис.+ М. осн. = Орбитальный контроль
Низколежащая НСМО к-ты + высоколежащая ВЗМО основания. Определяющая роль – возмущение I порядка, орбитальное взаимодействие
Слайд 14Зарядовый контроль Орбитальный контроль
ВЗМО
НСМО
НСМО
ВЗМО
ΔE = -
qDqA
rDε
ΔE
2ΣΣ(cBcAβ)2
EA - EB
Ж кислота
М кислота
Ж основание
М основание
Слайд 15Применение в органической химии
В органической химии принцип ЖМКО широко применяется для
Например, реакцию между тиоэфиром CH3COSR и алкоголят-ионом RO– можно представить как переход ацильного катиона CH3CO+ (жёсткой кислоты Льюиса) от мягкого основания Льюиса RS– к жёсткому основанию Льюиса RO–. Согласно принципу ЖМКО, аддукт жёсткой кислоты и жёсткого основания более устойчив, поэтому равновесие в реакции сдвинуто вправо.
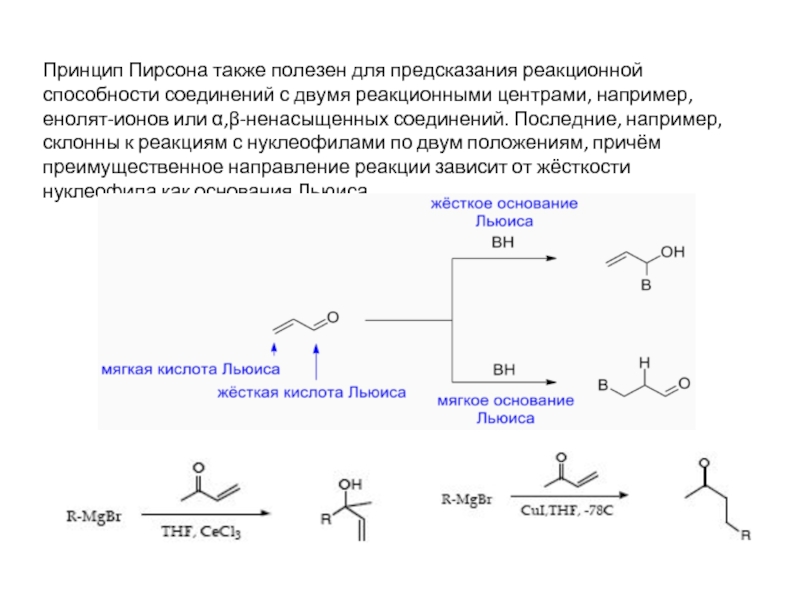
Слайд 16Принцип Пирсона также полезен для предсказания реакционной способности соединений с двумя
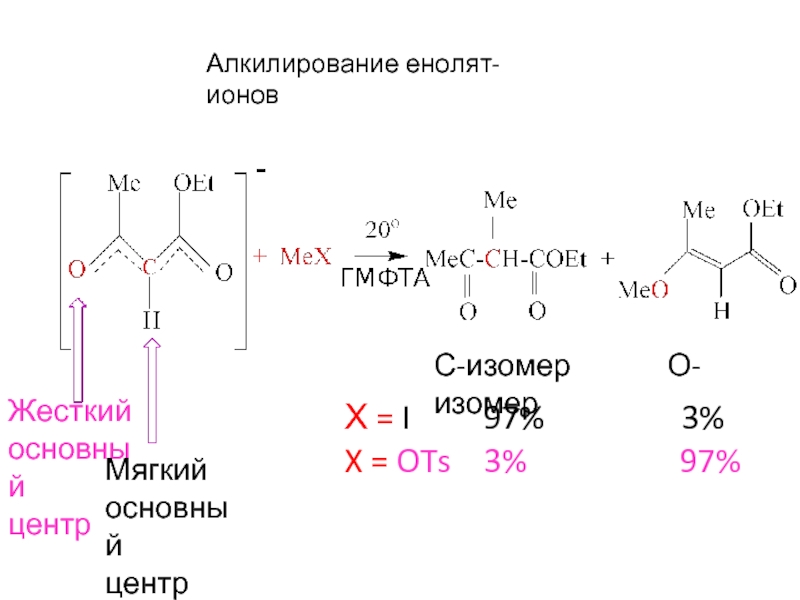
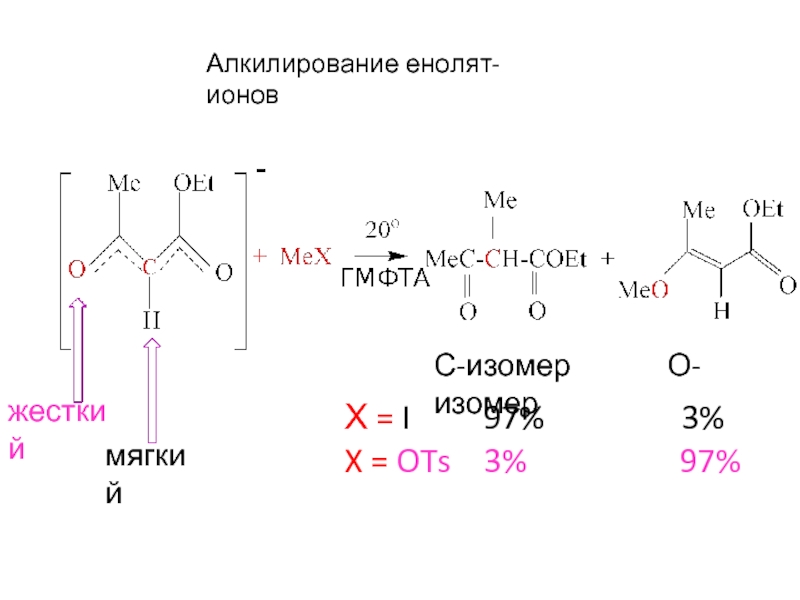
Слайд 17Алкилирование енолят-ионов
С-изомер О-изомер
Х = I
X = OTs 3% 97%
Жесткий
основный
центр
Мягкий
основный
центр
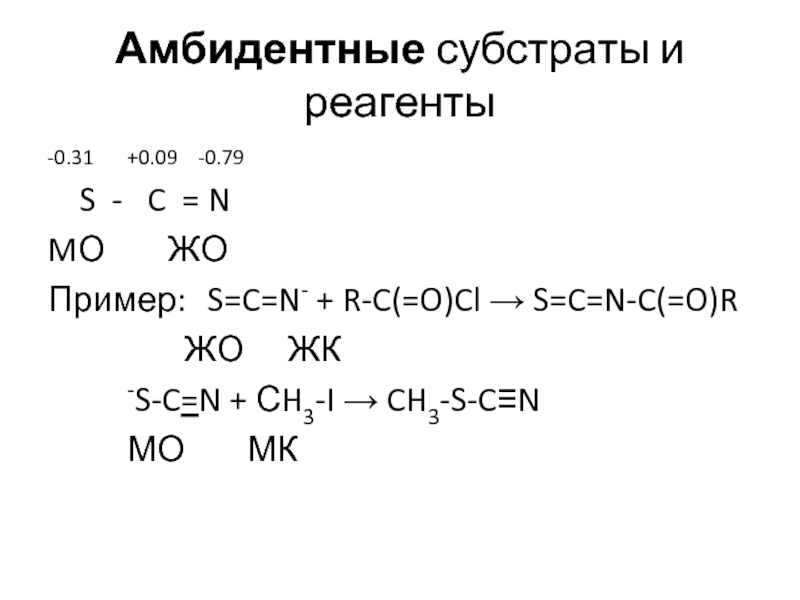
Слайд 18Амбидентные субстраты и реагенты
-0.31 +0.09 -0.79
S - C
MО ЖО
Пример: S=C=N- + R-C(=O)Cl → S=C=N-C(=O)R
ЖО ЖК
-S-C=N + СH3-I → CH3-S-C≡N
МО МК
Слайд 19Амбидентность нитрит – иона
O- – N = O
ЖО
С8H17Br + AgNO2 → C8H17O-N=O + AgBr
Мягкая кислота Ag+ координируется с мягким основанием N и освобождает O
С8H17Br + NaNO2 → C8H17NO2 + NaBr
Жесткая кислота Na+ координируется с жестким основанием О и освобождает N
Слайд 20Амбидентность енолят-аниона
(С2H5)3OF (фторид триэтилоксония) – очень жесткий реагент – алкилирует енолят
С2Н5I – очень мягкий реагент – алкилирует енолят-анион по атому С (мягкому основному центру)
Слайд 22Me-OH + H-I
В газовой фазе:
Kp =
[H2O] [MeI]
[HI] [MeOH]
Kp > 109
М-Ж Ж-М М-М Ж-Ж
Симбиоз лигандов во внутренней сфере комплекса
[Co(NH3)5F]2+ более стабилен, чем [Co(NH3)5I]2+
[Co(CN)5I]2+ более стабилен, чем [Co(CN)5F]2+















![Me-OH + H-I MeI + H-OHВ газовой фазе:Kp =[H2O] [MeI][HI] [MeOH]Kp](/img/tmb/1/32055/95deda6907bcd3ddf8a7d4298c9a5e9a-800x.jpg)