- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислородные соединения азота презентация
Содержание
- 1. Кислородные соединения азота
- 2. Какие соединения азота вы знаете?
- 3. Оксидов у азота
- 4. Оксид азота (I) монооксид диазота «веселящий
- 5. Оксид азота (II) – монооксид азота
- 6. Оксид азота (III) Жидкость
- 7. Оксид азота (IV) – диоксид азота, «бурый
- 8. Оксид азота (V) Кислотный оксид.
- 9. HNO2
- 10. Промышленный способ получения азотной
Слайд 2 Какие соединения азота вы знаете?
Определите степени окисления азота в соединениях.
N2
NH3
N2O
N2O3
NO2
HNO2
NO
N2O5
MeN
HNO3
Слайд 3
Оксидов у азота – пять.
И нам давно пора
Их нравы, вкусы, настроение,
Манеру жизни, поведение.
Слайд 4Оксид азота (I)
монооксид диазота
«веселящий газ»
Бесцветный газ со слабым приятным запахом
В смеси с воздухом он действует на людей по-разному – кого «веселит», а кого погружает в сон.
Применяют в медицине, обеспечивая безопасный наркоз.
Несолеобразующий оксид.
Можно получить термическим разложением нитрата аммония.
Данный оксид неустойчив и легко разлагается на азот и кислород.
N2O
Слайд 5 Оксид азота (II) – монооксид азота
Легко окисляется кислородом воздуха до
NO
Напишите уравнения упомянутых реакций
Слайд 6Оксид азота (III)
Жидкость темно-синего цвета.
Кислотный оксид.
Получают охлаждением смеси оксидов
При взаимодействии с водой образуется азотистая кислота.
Оксид взаимодействует со щелочью.
N2O3
Составьте уравнения реакций
Слайд 7Оксид азота (IV) – диоксид азота,
«бурый газ», «лисий хвост»
Газ с резким
!!! Токсичен.
Получают окислением NO и взаимодействием концентрирован-ной азотной кислоты с медью.
Если это кислотный оксид, то с какими веществами он будет взаимодействовать?
Напишите уравнения реакций.
NO2
Слайд 8 Оксид азота (V)
Кислотный оксид.
Белое твердое вещество, хорошо растворимое в
Получают осторожным обезвоживанием азотной кислоты с помощью оксида фосфора (V) или действием озона на оксид азота (IV).
Взаимодействует с водой и щелочами.
Очень неустойчив, разлагается со взрывом на кислород и оксид азота (IV).
Напишите уравнения
реакций.
N2O5
Слайд 9 HNO2
Какая из кислот более сильная?
Как называются соли данных кислот?
Окислителем или восстановителем могут быть данные кислоты?
В чем заключается особая опасность азотной кислоты?
С какими веществами реагируют эти кислоты?
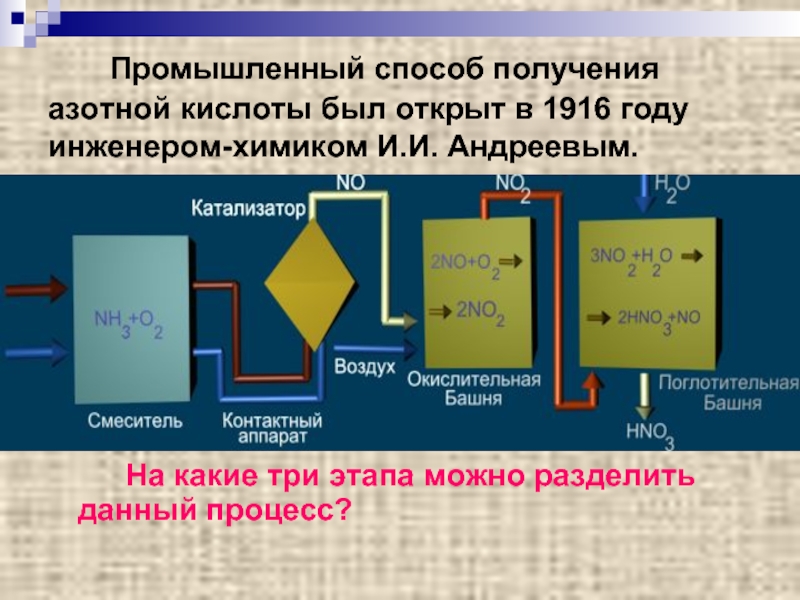
Слайд 10 Промышленный способ получения азотной кислоты был открыт в
На какие три этапа можно разделить данный процесс?