- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Катализ. Модели катализа презентация
Содержание
- 1. Катализ. Модели катализа
- 2. Что такое катализатор? Свойства: Селективность.
- 3. Модели катализа Геометрическая
- 4. Модели катализа Геометрическая
- 5. Модели катализа Электронные теории исходят из
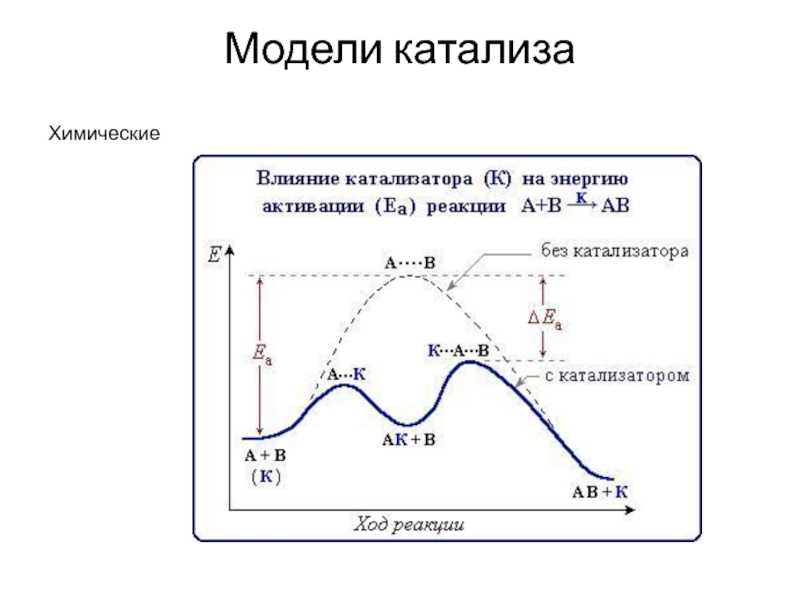
- 6. Модели катализа Химические
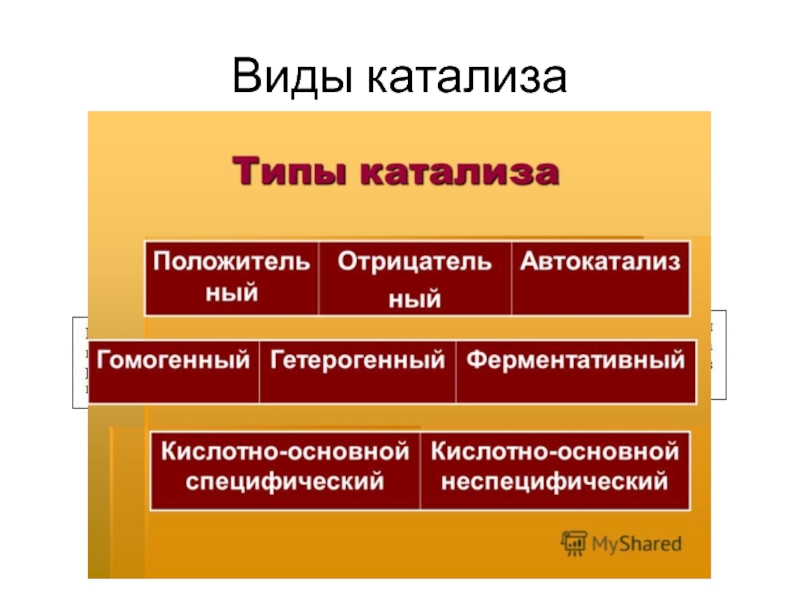
- 7. Виды катализа
- 8. Сложный катализатор PbO CuO Отрыв NO2 групп
- 9. Катализатор на подложке Для получения катализаторов с
- 10. Катализатор на подложке
Слайд 2Что такое катализатор?
Свойства:
Селективность. Катализаторы сами не вызывают химическую реакцию, а только
ускоряют реакцию, которая протекает и без них.
Не влияют на энергетический итог реакции.
В обратимых реакциях катализаторы ускоряют как прямую, так и обратную реакцию, причем в одинаковой степени.
Каталитические яды
Не влияют на энергетический итог реакции.
В обратимых реакциях катализаторы ускоряют как прямую, так и обратную реакцию, причем в одинаковой степени.
Каталитические яды
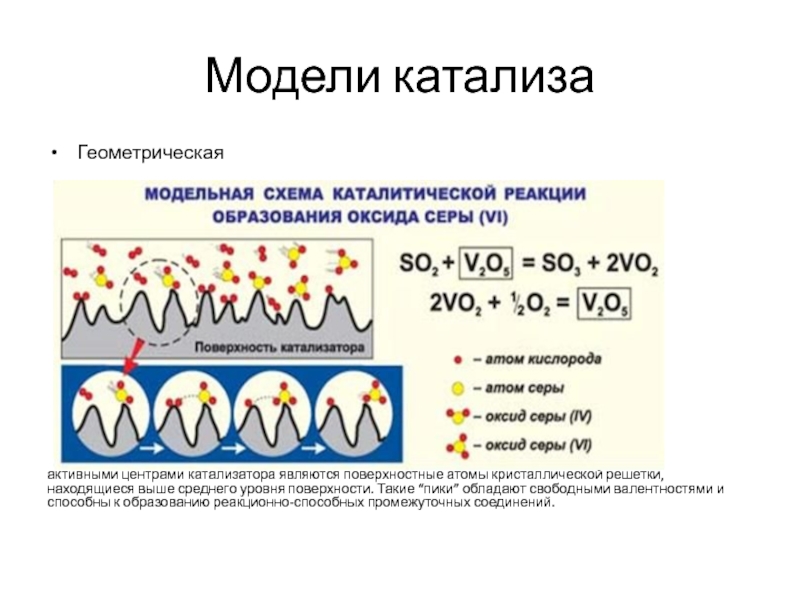
Слайд 3Модели катализа
Геометрическая
активными центрами катализатора являются поверхностные атомы кристаллической решетки, находящиеся выше
среднего уровня поверхности. Такие “пики” обладают свободными валентностями и способны к образованию реакционно-способных промежуточных соединений.
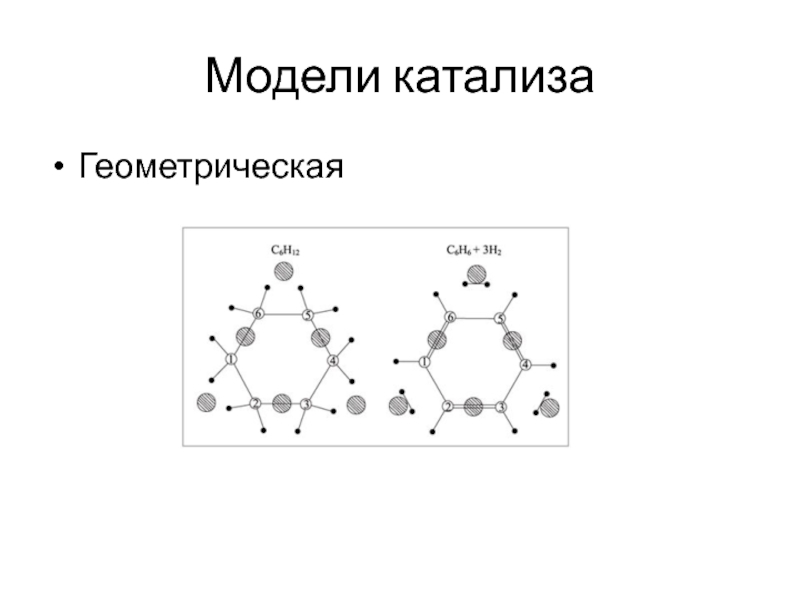
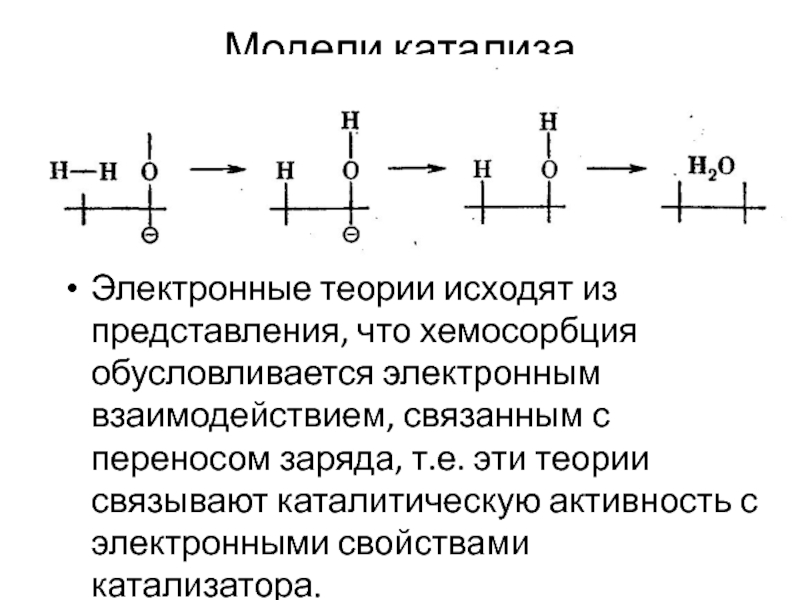
Слайд 5Модели катализа
Электронные теории исходят из представления, что хемосорбция обусловливается электронным взаимодействием,
связанным с переносом заряда, т.е. эти теории связывают каталитическую активность с электронными свойствами катализатора.
Слайд 8Сложный катализатор
PbO
CuO
Отрыв NO2 групп
Окисление углерода и водородосодержащие продукты, восстановление до окиси
азота
Сажа адсорбирует окиси азота
Свинец катализует окисление C
Медь катализует окисление CO
Сажа адсорбирует окиси азота
Свинец катализует окисление C
Медь катализует окисление CO
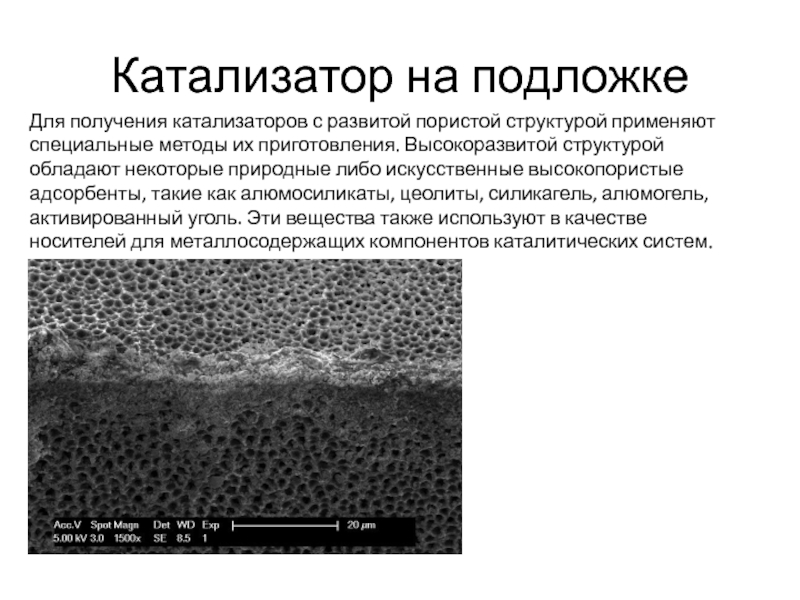
Слайд 9Катализатор на подложке
Для получения катализаторов с развитой пористой структурой применяют специальные
методы их приготовления. Высокоразвитой структурой обладают некоторые природные либо искусственные высокопористые адсорбенты, такие как алюмосиликаты, цеолиты, силикагель, алюмогель, активированный уголь. Эти вещества также используют в качестве носителей для металлосодержащих компонентов каталитических систем.