- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Катализ и катализаторы. (Лекция 10) презентация
Содержание
- 1. Катализ и катализаторы. (Лекция 10)
- 2. 10.1 Катализ и катализаторы 10.2 Кинетика фер-ментативных реак-ций. План
- 3. 10.1 Катализ – это явление изменения скорости реакции под влиянием ве-ществ, называемых катализаторами.
- 4. Катализаторы – это вещества, изменяющие скорость химической
- 5. Небольшие количества катализаторов способ-ны существенно изме-нить скорость взаимо-действия большого ко-личества реагирующих веществ.
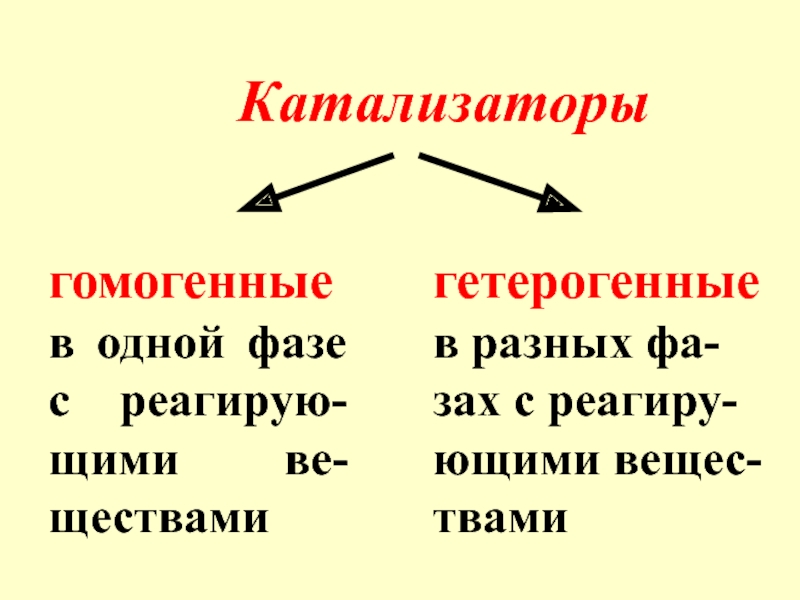
- 6. Катализаторы гомогенные в одной фазе с реагирую-щими
- 7. Пример гетерогенного катализа
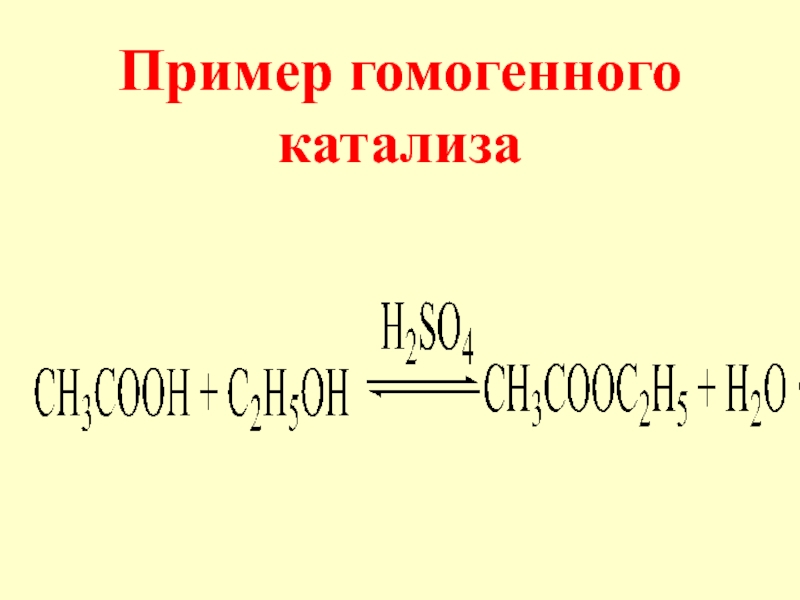
- 8. Пример гомогенного катализа
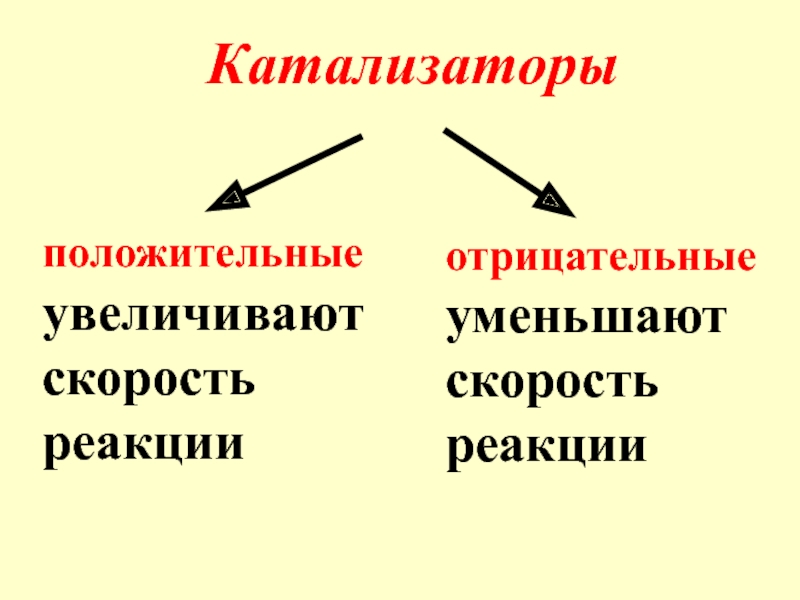
- 9. Катализаторы положительные
- 10. Ингибаторы – вещества, уменьша-ющие скорость реак-ции, но расходую-щиеся при этом сами.
- 11. С точки зрения теории активного комплекса механизм
- 12. Без катализатора: А + В ↔
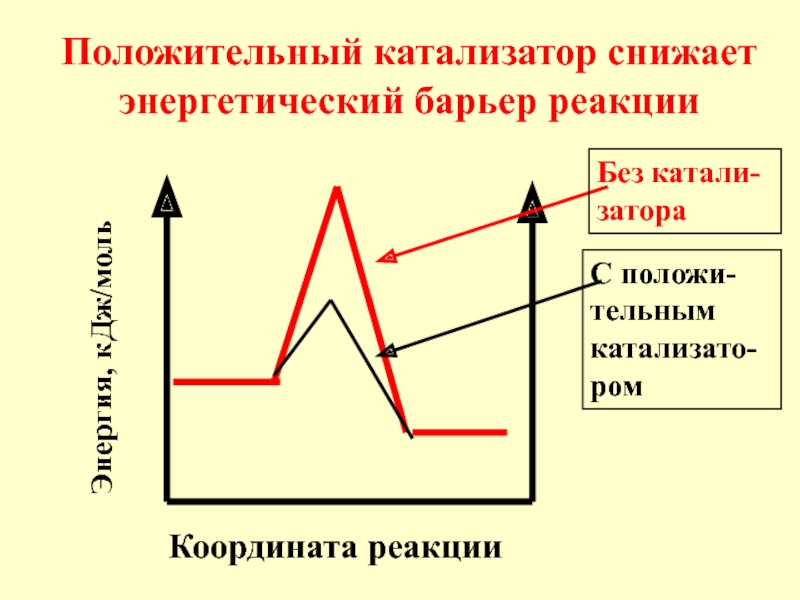
- 13. Координата реакции Положительный катализатор снижает энергетический барьер реакции Энергия, кДж/моль Без катали-затора С положи-тельным катализато-ром
- 14. Под воздействием поло-жительного катализатора в реакционной смеси
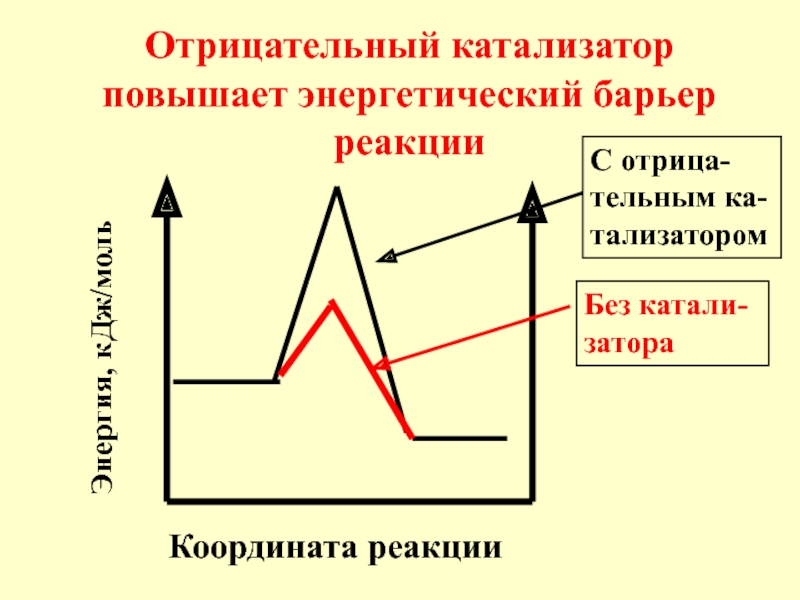
- 15. Координата реакции Отрицательный катализатор повышает энергетический барьер реакции Энергия, кДж/моль Без катали-затора С отрица-тельным ка-тализатором
- 16. Под воздействием отри-цательного катализатора в реакционной смеси
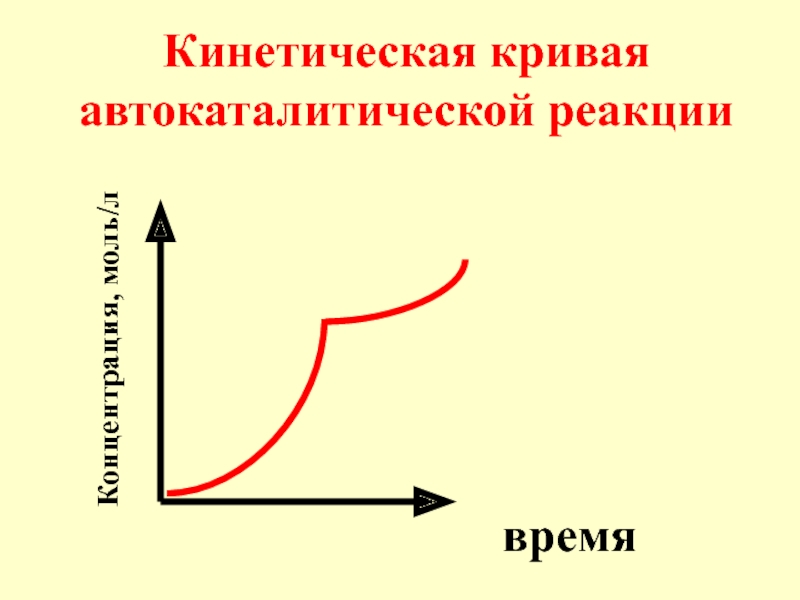
- 18. Частным случаем катализа является автокатализ: ката-лизатором служит один из продуктов реакции.
- 19. Пример автокаталити-ческой реакции: 2 KMnO4
- 20. Кинетическая кривая автокаталитической реакции время Концентрация, моль/л
- 21. Разрушение озоново-го слоя Земли – пример гомогенного катализа, протекаю-щего в атмосфере под воздействием фреонов.
- 22. Фреоны – это фторо-хлороуглеводороды (СF2Cl2), применяемые как
- 23. В атмосфере происходит разложение фреонов под воздействием
- 24. Без катализатора процесс протекает по схеме: O3
- 25. В присутствии катализатора: O3 + Cl →
- 26. Координата реакции Энергия, кДж/моль О3+ О 2О2
- 27. Вещества, усиливаю-щие действие катализа-торов, называются про-моторами, а ослабляю-щие - каталитическими ядами.
- 28. 10.2 Практически все биохимические реакции являются ферментативны-ми.
- 29. Известно около 2000 различных ферментов, ~150 из
- 30. Трипсин и химотрипсин – лечение бронхитов
- 31. Ферменты отличаются от обычных катализаторов: а) более
- 32. Механизм ферментативной реакции можно представить схемой:
- 33. Е –
- 34. Характеристикой пер-вой стадии фермента-тивной реакции явля-ется КМ
- 35. KM KM = 10‾5–10‾3 моль/л
- 36. КМ характеризует ус-тойчивость фермент-субстратного комп-лекса (ES). Чем меньше КМ, тем ус-тойчивее комплекс .
- 37. Кинетическое уравнение: υ = k2 [ES],
- 38. k2 равна числу молекул субстрата, претерпеваю-щих превращения
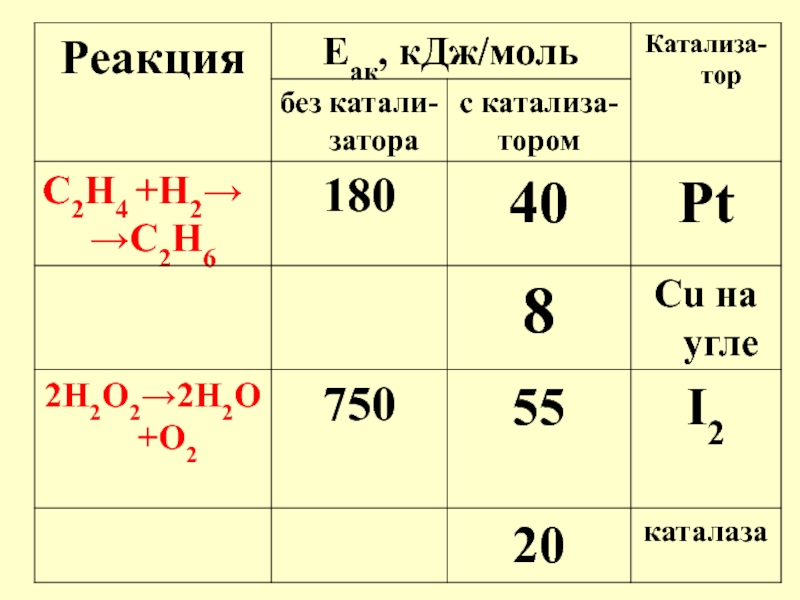
- 39. Для уреазы, ускоряющей гидролиз мочевины: k2 =
- 40. Существенным недостатком уравнения (1) является невоз-можность экспериментального
- 41. υ = [E]общ [S] KM + [S] k2 Уравнение Михаэлиса-Ментен
- 42. Произведение k2[E]общ является величиной постоянной, которую обозначают υmax (мак-симальная скорость).
- 43. Соответственно: υ = υmax [S] KM + [S]
- 44. При низкой концентрации субстрата
- 45. 2) При высокой концент-рации субстрата Км
- 46. Кинетическая кривая ферментативной реакции [S] υ Реакция нулевого порядка Реакция первого порядка
- 47. 3) Если [S] = КМ, то
- 48. [S] υmax 2 υmax KM Графическое определение константы Михаэлиса(KM)
- 49. На активность фермен-тов оказывают влия-ние: а) температура, б) кислотность среды, в) наличие ингибиторов
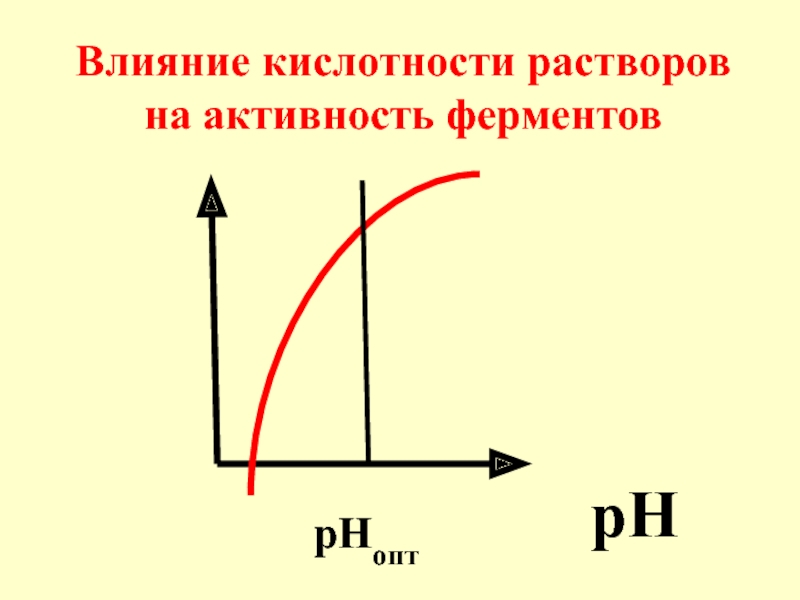
- 50. pH рНопт Влияние кислотности растворов на активность ферментов
- 51. Для большинства ферментов опти-мальные значения рН совпадают с физиологическими значениями (7,3-7,4).
- 52. Однако существуют фер-менты, для нормального функционирования кото-рых
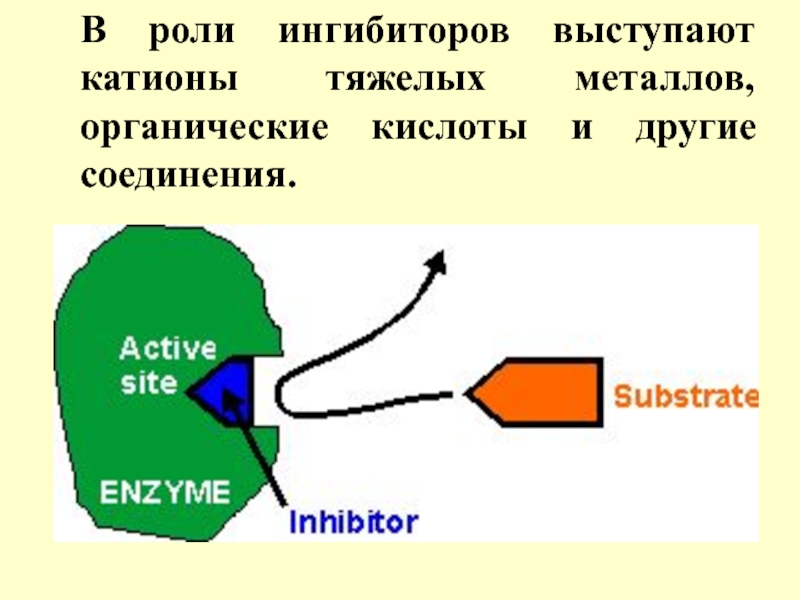
- 53. Ингибиторы ферментов – это вещества, занима-ющие часть
- 54. В роли ингибиторов выступают катионы тяжелых металлов, органические кислоты и другие соединения.
- 55. "Ключ к познанию ферментов лежит в изучении скоростей реакций". Дж.Холдейн
- 56. Благодарим за внимание!!!
Слайд 310.1 Катализ – это явление изменения скорости реакции под влиянием ве-ществ,
Слайд 4Катализаторы – это вещества, изменяющие скорость химической реак-ции, но не изменяющиеся
Слайд 5Небольшие количества катализаторов способ-ны существенно изме-нить скорость взаимо-действия большого ко-личества реагирующих
Слайд 6Катализаторы
гомогенные в одной фазе с реагирую-щими ве-ществами
гетерогенные в разных фа-зах
Слайд 9Катализаторы
положительные
отрицательные
уменьшают скорость реакции
Слайд 11С точки зрения теории активного комплекса механизм действия катализаторов в том,
Слайд 12Без катализатора:
А + В ↔ А...В → АВ
В присутствии катали-затора:
А
Слайд 13Координата реакции
Положительный катализатор снижает энергетический барьер реакции
Энергия, кДж/моль
Без катали-затора
С положи-тельным катализато-ром
Слайд 14Под воздействием поло-жительного катализатора в реакционной смеси возрастает доля актив-ных молекул
Слайд 15Координата реакции
Отрицательный катализатор повышает энергетический барьер реакции
Энергия, кДж/моль
Без катали-затора
С отрица-тельным ка-тализатором
Слайд 16Под воздействием отри-цательного катализатора в реакционной смеси снижается доля актив-ных молекул
Слайд 18Частным случаем катализа является автокатализ: ката-лизатором служит один из продуктов реакции.
Слайд 19Пример автокаталити-ческой реакции:
2 KMnO4 + 5 H2C2O4 +
3 H2SO4
10 CO2 + K2SO4 + 8 H2O
Катализатор: Mn2+
Слайд 21Разрушение озоново-го слоя Земли – пример гомогенного катализа, протекаю-щего в атмосфере
Слайд 22Фреоны – это фторо-хлороуглеводороды (СF2Cl2), применяемые как хладаген-ты. При обычных условиях
Слайд 23В атмосфере происходит разложение фреонов под воздействием ультрафиолето-вого излучения солнца:
CF2Cl2 →
Cl• - катализатор разложения озона
Слайд 25В присутствии катализатора:
O3 + Cl → ClO + O2
ClO + O → Cl + O2 Eак = 0,4 кДж/моль
O3 + O → 2 O2
Cl
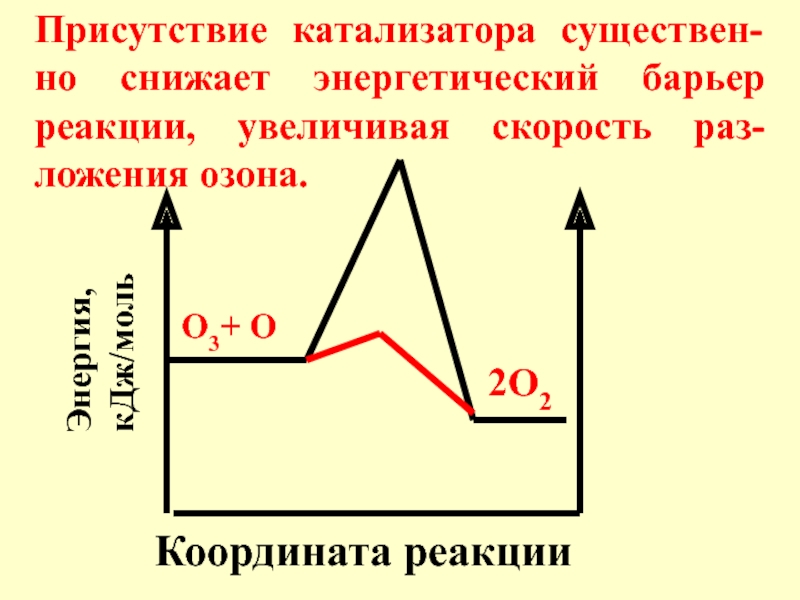
Слайд 26Координата реакции
Энергия, кДж/моль
О3+ О
2О2
Присутствие катализатора существен-но снижает энергетический барьер реакции, увеличивая
Слайд 27Вещества, усиливаю-щие действие катализа-торов, называются про-моторами, а ослабляю-щие - каталитическими ядами.
Слайд 2810.2 Практически все биохимические реакции являются ферментативны-ми.
Ферменты (биокатализато-ры) – это
Слайд 29Известно около 2000 различных ферментов, ~150 из них выделены, причем некоторые
Слайд 30Трипсин и химотрипсин
– лечение бронхитов и пнев-монии;
пепсин – лечение гастрита;
плазмин
панкреатин – лечение подже-лудочной железы.
Слайд 31Ферменты отличаются от обычных катализаторов:
а) более высокой каталитической актив-ностью;
б) высокой специфич-ностью,
Слайд 34Характеристикой пер-вой стадии фермента-тивной реакции явля-ется КМ – константа Михаэлиса. КМ
Слайд 36КМ характеризует ус-тойчивость фермент-субстратного комп-лекса (ES). Чем меньше КМ, тем ус-тойчивее
Слайд 37Кинетическое уравнение:
υ = k2 [ES], (1)
где k2 –
Слайд 38k2 равна числу молекул субстрата, претерпеваю-щих превращения под воздействием одной моле-кулы
1·104 < k2 < 6·106 мин‾1
Слайд 39Для уреазы, ускоряющей гидролиз мочевины:
k2 = 1,85∙106 мин‾1
Для аденозинтрифосфатазы, ускоряющей гидролиз
k2 = 6,24∙106 мин‾1
Для каталазы, ускоряющей разложение Н2О2:
k2 = 5∙106 мин‾1
Слайд 40Существенным недостатком уравнения (1) является невоз-можность экспериментального определения [ES]. Выразив [ES]
Слайд 42Произведение k2[E]общ является величиной постоянной, которую обозначают υmax (мак-симальная скорость).
Слайд 44При низкой концентрации субстрата KM >> [S],
поэтому
υ
υmax
KM
[S]
Кинетическое уравнение реакции 1-го порядка


























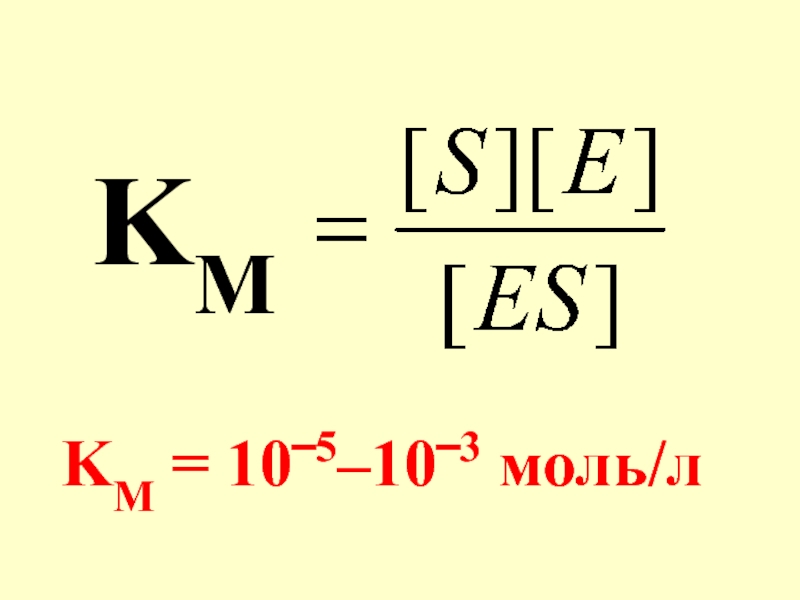

![Кинетическое уравнение:υ = k2 [ES], (1)где k2 – константа скорости, называемая числом оборотов или](/img/tmb/5/432788/fcaa598c2080226efa71b552ffa950d4-800x.jpg)


![Существенным недостатком уравнения (1) является невоз-можность экспериментального определения [ES]. Выразив [ES] через другие величины, получаем](/img/tmb/5/432788/a919cd9362ae3579c505b438823d3da9-800x.jpg)
![υ =[E]общ [S]KM + [S]k2 Уравнение Михаэлиса-Ментен](/img/tmb/5/432788/e49f179f1680f0991428cb6e8554d5c2-800x.jpg)
![Произведение k2[E]общ является величиной постоянной, которую обозначают υmax (мак-симальная скорость).](/img/tmb/5/432788/eeb2e5572da682b25eb038341fbc17a9-800x.jpg)
![Соответственно:υ =υmax [S] KM + [S]](/img/tmb/5/432788/31e2015ee5e7a2f14cc17b785ec2d53f-800x.jpg)
![При низкой концентрации субстрата KM >> [S], поэтомуυ =υmaxKM[S]Кинетическое уравнение реакции 1-го порядка](/img/tmb/5/432788/8afb6f6d38ba676a0e7dfb6a97e20e50-800x.jpg)

![Кинетическая кривая ферментативной реакции[S]υРеакция нулевого порядкаРеакция первого порядка](/img/tmb/5/432788/d28fcb5187a7d6b07e34bff3f3021b0d-800x.jpg)
![3) Если [S] = КМ, тоυ =υmax2что позволяет графически определять Км ,](/img/tmb/5/432788/a644a25f74272f1565cef1df266310db-800x.jpg)
![[S]υmax2υmaxKMГрафическое определение константы Михаэлиса(KM)](/img/tmb/5/432788/29a0eb173b6b72a67a8fa1ae4b471be9-800x.jpg)