- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Каталитические превращения углеводородов и других компонентов нефти презентация
Содержание
- 1. Каталитические превращения углеводородов и других компонентов нефти
- 2. КАТАЛИТИЧЕСКИЙ КРЕКИНГ РИФОРМИНГ ГИДРОКРЕКИНГ
- 3. Катализаторы бывают жидкие и твердые Твердые катализаторы
- 4. Стадии гетерогенно-каталитических реакций над твердыми
- 5. Скорость реакции определяется скоростью наиболее медленной
- 6. 2 Пример Лимитирующая стадия -
- 7. Продолжительность пребывания молекулы на поверхности кат. выражается:
- 8. Молекула перемещается с одного адсорбционного центра
- 9. КАТАЛИТИЧЕСКИЙ КРЕКИНГ Густавсон (Россия) AlBr3,
- 10. Алюмосиликатные катализаторы ( аморфные и кристаллические) Менее
- 11. Условия крекинга на Ал-сил кат: Паровая
- 12. Строение алюмосиликатнах катализаторов Это трехмерная
- 13. Промышленный синтез
- 14. nAl2O3 X mSiO2 Примечание: Al2O3 и
- 15. Алюмосиликатные катализаторы содержат воду А) адсорбирована
- 16. На поверхности Алюмосиликатных катализаторов имеется 2 типа
- 17. Протоны гидроксильных групп, сорбированные атомом Al
- 18. Апротонные центры Координационно ненасыщенные атомы
Слайд 2КАТАЛИТИЧЕСКИЙ КРЕКИНГ
РИФОРМИНГ
ГИДРОКРЕКИНГ
РЕАКЦИИ АЛКИЛИРОВАНИЯ
СТУПЕНЧАТАЯ ПОЛИМЕРИЗАЦИЯ
ИЗОМЕРИЗАЦИЯ
Эти превращения протекают в условиях гомогенного
и чаще
Гетеролитический разрыв связи
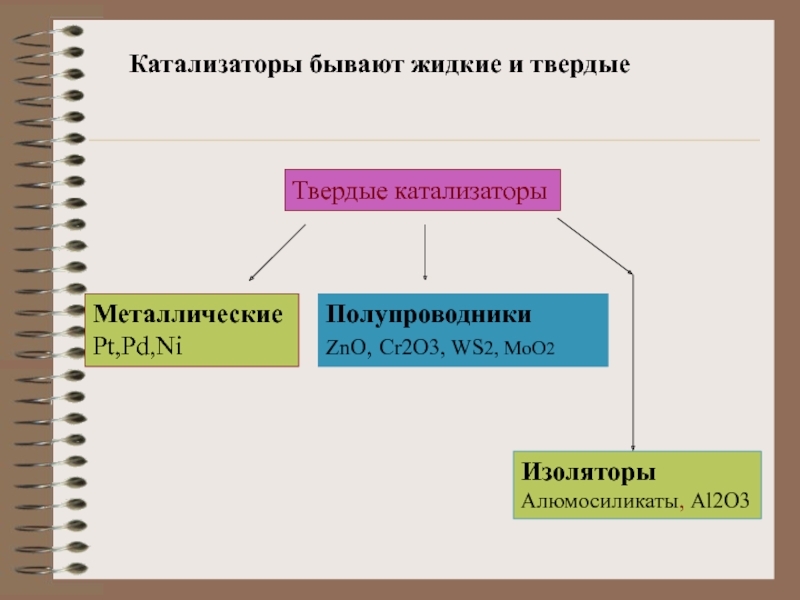
Слайд 3Катализаторы бывают жидкие и твердые
Твердые катализаторы
Металлические
Pt,Pd,Ni
Полупроводники
ZnO, Cr2O3, WS2, MoO2
Изоляторы
Алюмосиликаты, Al2O3
Слайд 4Стадии гетерогенно-каталитических
реакций над твердыми катализаторами
1.Диффузия реагентов к поверхности Cat
2. Активированная
3. Химическое превращение
4. Десорбция продуктов реакции
5. Диффузия продуктов реакции в объем
Слайд 5Скорость реакции определяется скоростью
наиболее медленной (лимитирующей) стадии
1 Пример:
Лимитирующая стадия- диффузия
Процесс
Скорость мало зависит от Т
Процесс описывается ур-ем скорости диффузии
Нужно применять крупнопористые катализаторы
либо сильно измельченные (увеличить поверхность Cat)
Слайд 62 Пример
Лимитирующая стадия - химическая реакция
Процесс находится в кинетической области
Скорость
( скорость хим. Реакции увеличивается
в 2-3 раза при повышении Т на 10оС)
Примечание : при определенном повышении Т реакция
может перейти в диффузную зону
Слайд 7Продолжительность пребывания молекулы на поверхности кат. выражается:
Механизм активированной адсорбции
Молекула удерживается на поверхности валентными связями
τ=τ0e
Q/RT
Q- теплота адсорбции кДж/моль
τ0 минимальное время жизни молекулы на поверхности
(при Q = 0 Т=~)
13 16
10 - 10 c
Слайд 8Молекула перемещается с одного адсорбционного
центра на другой
Время жизни на адсорбционном
τ’=τ’0e
Q’/RT
Q’- величина энергетического барьера для перехода
с одного центра на другой
Примем: τ0 = τ
Найдем отношение времени пребывания мол на
поверхности кат. ко времени жизни на одном адсорбционном центре:
τ/τ`= (Q-Q`)/RT
Если Q = 41 кДж/моль, Q’ = 20.9 кДж/моль, Т = 300К
То τ/τ`= 1000
Слайд 9КАТАЛИТИЧЕСКИЙ КРЕКИНГ
Густавсон (Россия) AlBr3, AlCl3
Создание кат. Крекинга обусловлено Необходимостью
1. снижения Т и Р ( по сравнению с терм.
крекингом)
2. Повышения выхода бензина и улучшения его качества
Недостатки AlCl3
1 Высокий расход кат.
2. Невозможность регенерации кат.
3. Разложение кат. под действием влаги воздуха
(HCl –коррозия аппаратуры)
Слайд 10Алюмосиликатные катализаторы
( аморфные и кристаллические)
Менее активны , чем AlCl3 , но
Достоинства:
1.Высокая механическая прочность
2. Высокая химическая и термическая стабильность
3. Легко активируются выжигом углистых отложений
Слайд 11Условия крекинга на Ал-сил кат:
Паровая фаза, 400-500оС, Р- близко к атмосферному
Сырье:
вакуумные газойли с концом кипения 500оС и выше
(разраб крекинг мазута)
Алюмосиликатные катализаторы
гранулированные вещества с высокой
удельной поверхностью 1000м2/г
C химической точки зрения – слабые кислоты
Слайд 12
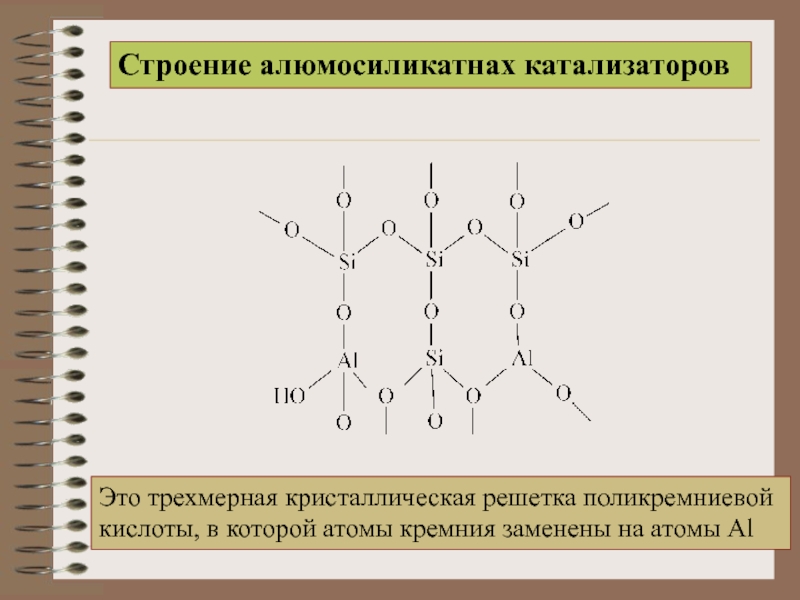
Строение алюмосиликатнах катализаторов
Это трехмерная кристаллическая решетка поликремниевой
кислоты, в которой
Слайд 13
Промышленный синтез
Взаимодействие водных растворов силиката натрия
[Na2SiO3] и сульфата алюминия [Al2(SO4)3]
Образовавшийся силикат алюминия в среде
минерального масла дает гранулы геля.
Гранулы промывают, сушат, прокаливают при 800оС
Слайд 14nAl2O3 X mSiO2
Примечание:
Al2O3 и SiO2 в отдельности не являются катализаторами К.
Механические смеси Al2O3 и SiO2 также неактивны
В настоящее время в нефтеперерабатывающей
промышленности применяют:
Алюмосиликатные цеолитсодержащие
катализаторы крекинга
Содержат до 20% цеолитов на аморфной
алюмосиликатной матрице
Слайд 15Алюмосиликатные катализаторы содержат воду
А) адсорбирована (снижает активность кат.)
Удаляют прокаливанием при 500-600оС
Б)
участвует в схеме катализа
(прокаленный до 1000оС катализатор неактивен)
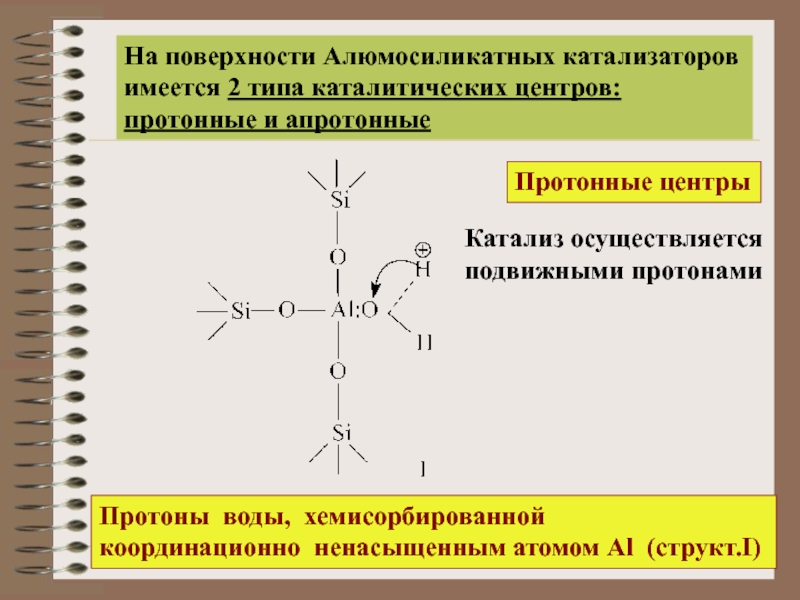
На поверхности Алюмосиликатных катализаторов
имеется 2 типа каталитических центров
Слайд 16На поверхности Алюмосиликатных катализаторов
имеется 2 типа каталитических центров:
протонные и апротонные
Протонные центры
Катализ
подвижными протонами
Протоны воды, хемисорбированной
координационно ненасыщенным атомом Al (структ.I)
Слайд 17
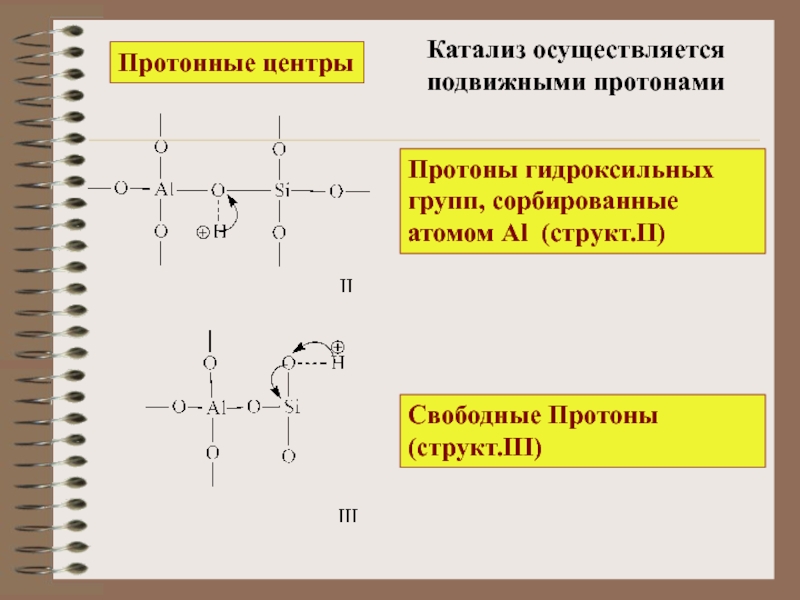
Протоны гидроксильных групп, сорбированные атомом Al (структ.II)
Свободные Протоны (структ.III)
Катализ осуществляется
подвижными
Протонные центры
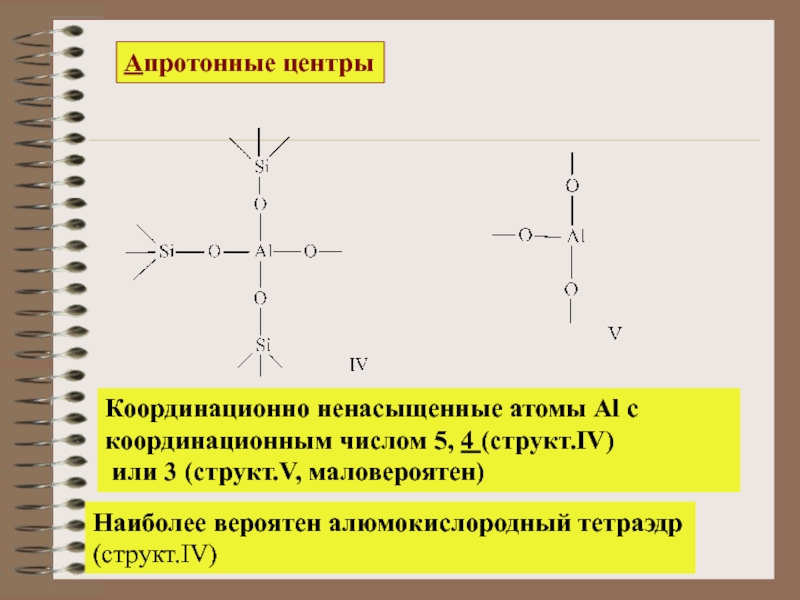
Слайд 18Апротонные центры
Координационно ненасыщенные атомы Al c
координационным числом 5, 4 (структ.IV)
Наиболее вероятен алюмокислородный тетраэдр
(структ.IV)