- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбоновые кислоты презентация
Содержание
- 1. Карбоновые кислоты
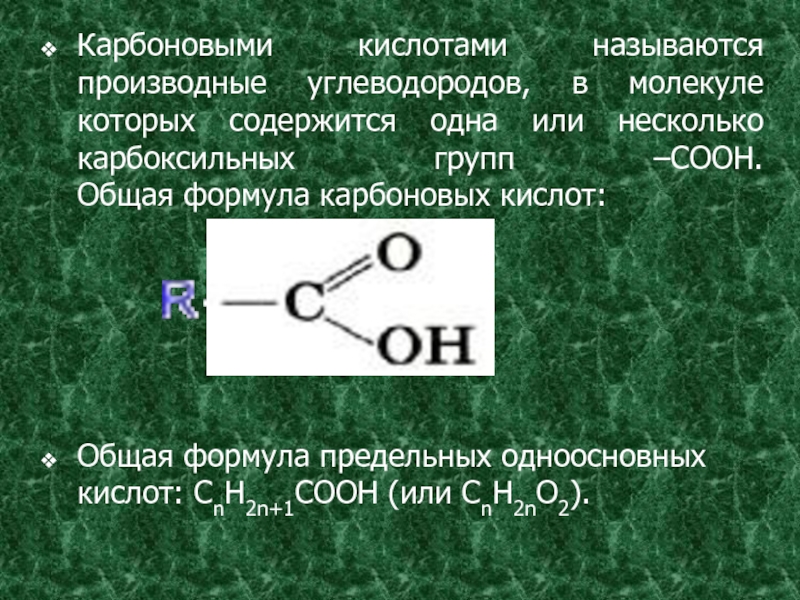
- 2. Карбоновыми кислотами называются производные углеводородов, в молекуле
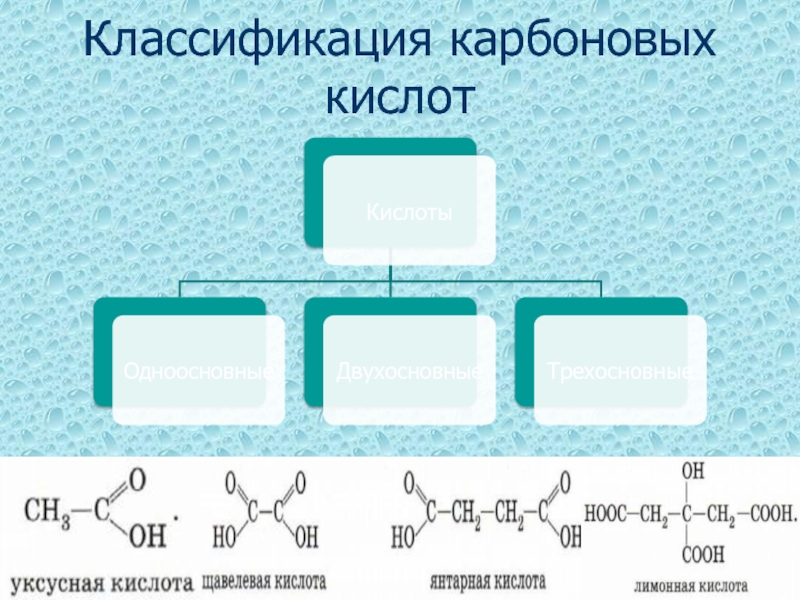
- 3. Классификация карбоновых кислот
- 4. Классификация карбоновых кислот СН2=СН—СООН пропеновая (акриловая) кислота
- 5. Номенклатура
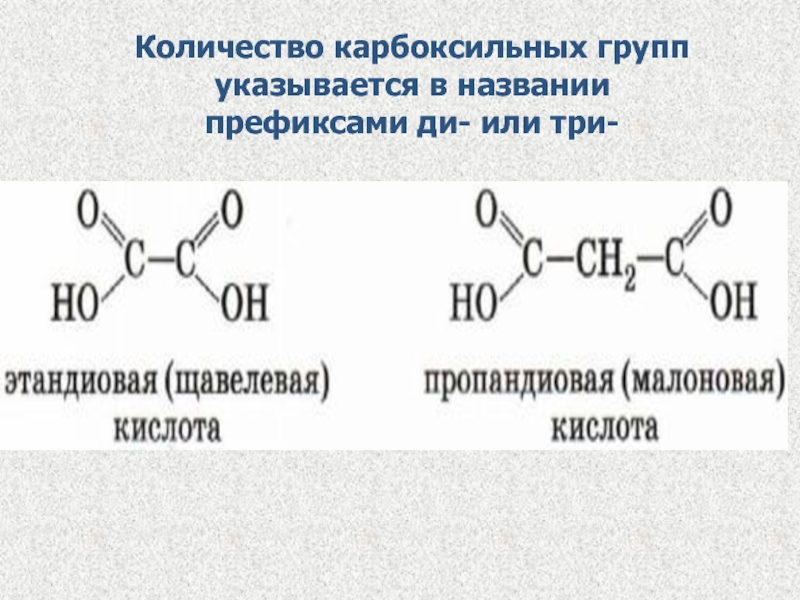
- 6. Количество карбоксильных групп указывается в названии префиксами ди- или три-
- 8. Изомерия Для алифатических кислот - изомеризация
- 9. Получение 1. Окисление альдегидов (кислородом на катализаторе;
- 10. Получение 3. Гидролиз сложных эфиров:
- 11. Физические свойства С1- С3 жидкости с
- 12. Химические свойства 1. Карбоновые кислоты- слабые электролиты,
- 13. 5. Взаимодействие с солями более слабых и
- 14. 7. Взаимодействие с галогенами: При галогенировании карбоновых
- 15. 8. Реакции присоединения по кратной связи характерны для непредельных карбоновых кислот
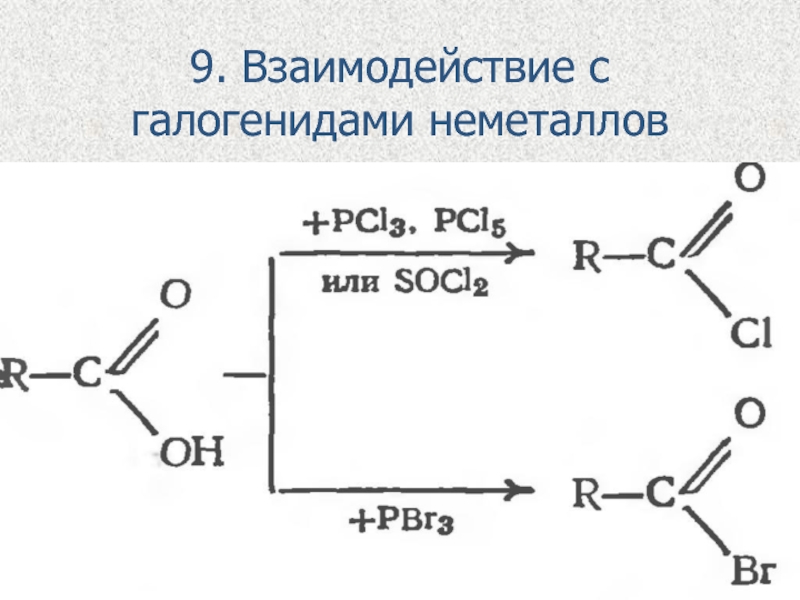
- 16. 9. Взаимодействие с галогенидами неметаллов
- 19. Применение Масляная кислота – для получения
- 20. Пятна ржавчины можно удалить раствором уксусной кислоты.
- 21. Расположите следующие кислоты: уксусную, пропионовую, хлоруксусную, дихлоруксусную
- 22. Образец предельной одноосновной органической кислоты массой 3,7
- 23. Соли карбоновых кислот широко используются в
Слайд 1Карбоновые кислоты
Понятие
Классификация
Номенклатура
Изомерия
Получение
Физические свойства
Химические свойства
Применение
Слайд 2Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или
несколько карбоксильных групп –COOH.
Общая формула карбоновых кислот:
Общая формула предельных одноосновных кислот: СnH2n+1COOH (или СnH2nO2).
Общая формула предельных одноосновных кислот: СnH2n+1COOH (или СnH2nO2).
Слайд 8Изомерия
Для алифатических кислот - изомеризация углеводородного радикала.
Для ароматических - изомерия
положения заместителя при бензольном кольце.
Межклассовая изомерия со сложными эфирами (например, CH3-COOH и HCOO-CH3).
Межклассовая изомерия со сложными эфирами (например, CH3-COOH и HCOO-CH3).
Слайд 9Получение
1. Окисление альдегидов (кислородом на катализаторе; KMnO4; K2Cr2O7):
2. Каталитическое окисление алканов:
2CH4 + 3O2 → 2H–COOH + 2H2O
Слайд 10Получение
3. Гидролиз сложных эфиров:
4. Гидролиз нитрилов:
5. Ароматические
кислоты синтезируют окислением гомологов бензола: в качестве окислителя можно использовать растворы KMnO4 или K2Cr2O7 в кислой среде:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Слайд 11Физические свойства
С1- С3 жидкости с характерным резким запахом
С4- С9
вязкие маслянистые жидкости с неприятным запахом
С С10 твердые нерастворимые вещества
Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей и существуют в основном в виде димеров .
С ростом относительной молекулярной массы температура кипения предельных одноосновных кислот увеличивается
С С10 твердые нерастворимые вещества
Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей и существуют в основном в виде димеров .
С ростом относительной молекулярной массы температура кипения предельных одноосновных кислот увеличивается
Слайд 12Химические свойства
1. Карбоновые кислоты- слабые электролиты, в водном растворе диссоциируют:
R–COOH R–COO- + H+
2. Взаимодействие с металлами:
2СH3COOH + Mg → (CH3COO)2Mg + H2
3. Взаимодействие с основными оксидами: 2СH3COOH + СaO → (CH3COO)2Ca + H2O
4. Взаимодействие с основаниями:
H–COOH + NaOH → H–COONa + H2O
2. Взаимодействие с металлами:
2СH3COOH + Mg → (CH3COO)2Mg + H2
3. Взаимодействие с основными оксидами: 2СH3COOH + СaO → (CH3COO)2Ca + H2O
4. Взаимодействие с основаниями:
H–COOH + NaOH → H–COONa + H2O
Слайд 135. Взаимодействие с солями более слабых и летучих кислот:
2СH3CH2COOH +
Na2CO3 → 2CH3CH2COONa + H2O + CO2
6. Взаимодействие со спиртами (этерификация):
CH3COOH+ C2H5OH CH3COOC2H5 + H2O
6. Взаимодействие со спиртами (этерификация):
CH3COOH+ C2H5OH CH3COOC2H5 + H2O
Слайд 147. Взаимодействие с галогенами:
При галогенировании карбоновых кислот, содержащих более одного атома
углерода в углеводородном остатке, возможно образование продуктов с различным положением галогена в молекуле. В присутствии небольших количеств красного фосфора, то она идёт селективно и водород замещается лишь в α-положении (у ближайшего к функциональной группе атома углерода) в молекуле кислоты.
Слайд 19Применение
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота
– применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Слайд 20Пятна ржавчины можно удалить раствором уксусной кислоты. Составьте молекулярные и ионные
уравнения происходящих при этом реакций, учитывая, что ржавчина содержит оксид и гидроксид железа (III) — Fe2O3 и Fe(OH)3. Почему такие пятна не удаляются водой? Почему они исчезают при обработке раствором кислоты?
Слайд 21Расположите следующие кислоты: уксусную, пропионовую, хлоруксусную, дихлоруксусную и трихлоруксусную в порядке
усиления кислотных свойств. Обоснуйте своё мнение.
Слайд 22Образец предельной одноосновной органической кислоты массой 3,7 г нейтрализовали водным раствором
гидрокарбоната натрия. При пропускании выделившегося газа через известковую воду было получено 5 г осадка. Какая кислота была взята? Вычислите объём выделившегося газа.
Ответ: С2Н5СООН; 1,12 л СO2.
Слайд 23
Соли карбоновых кислот широко используются в пищевой промышленности в качестве пищевых
добавок. Они выполняют роль консервантов, стабилизаторов, регуляторов кислотности. Назовите соли, формулы и коды которых представлены ниже.
По составу напитков и продуктов, представленному на этикетках, определите, какие из них содержат перечисленные пищевые добавки.
По составу напитков и продуктов, представленному на этикетках, определите, какие из них содержат перечисленные пищевые добавки.