- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбоновые кислоты презентация
Содержание
- 1. Карбоновые кислоты
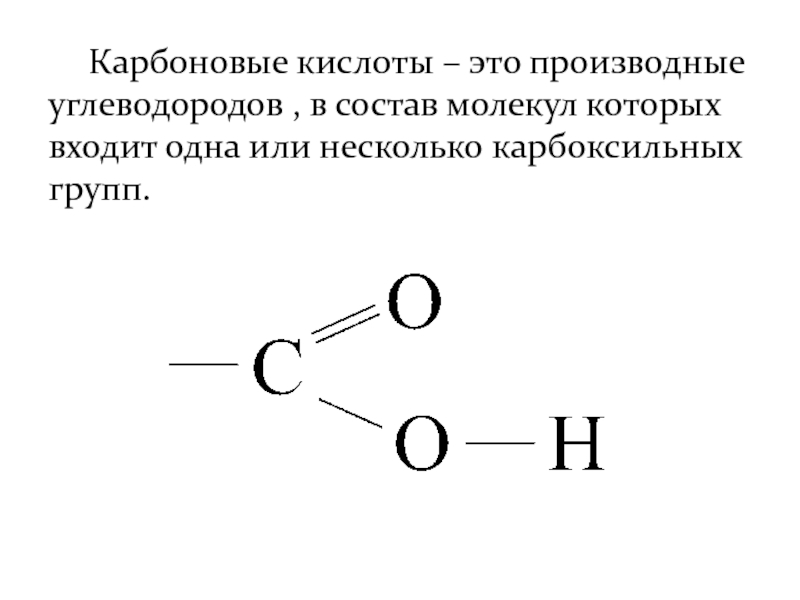
- 2. Карбоновые кислоты – это производные углеводородов ,
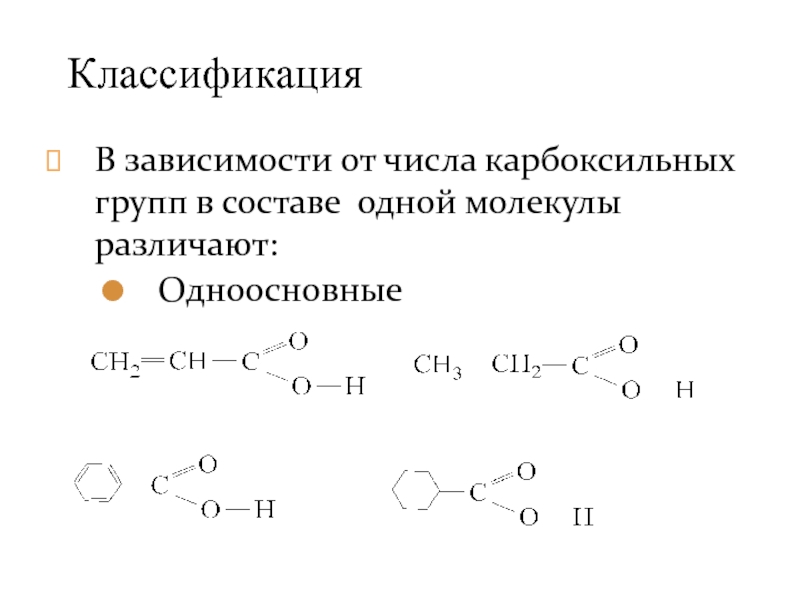
- 3. В зависимости от числа карбоксильных групп в составе одной молекулы различают: Одноосновные Классификация
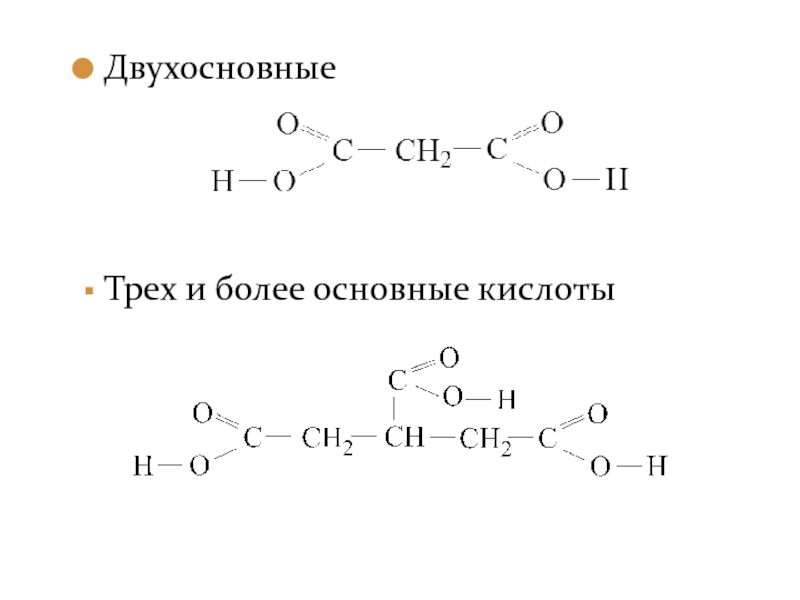
- 4. Двухосновные Трех и более основные кислоты
- 5. НОМЕНКЛАТУРА Систематическая номенклатура предлагает два способа построения
- 6. НОМЕНКЛАТУРА Способ II. Названия карбоновых кислот образуют
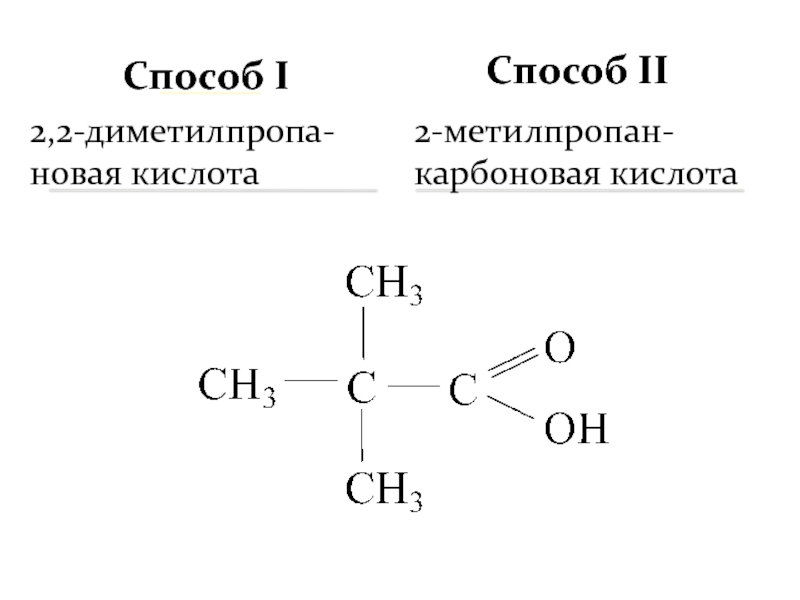
- 7. 2,2-диметилпропа-новая кислота 2-метилпропан-карбоновая кислота Способ II _____
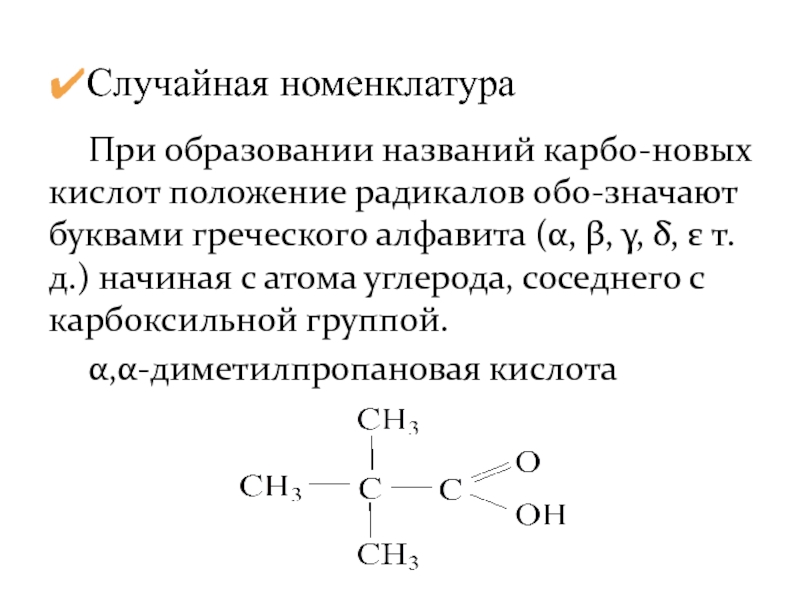
- 8. При образовании названий карбо-новых кислот положение радикалов
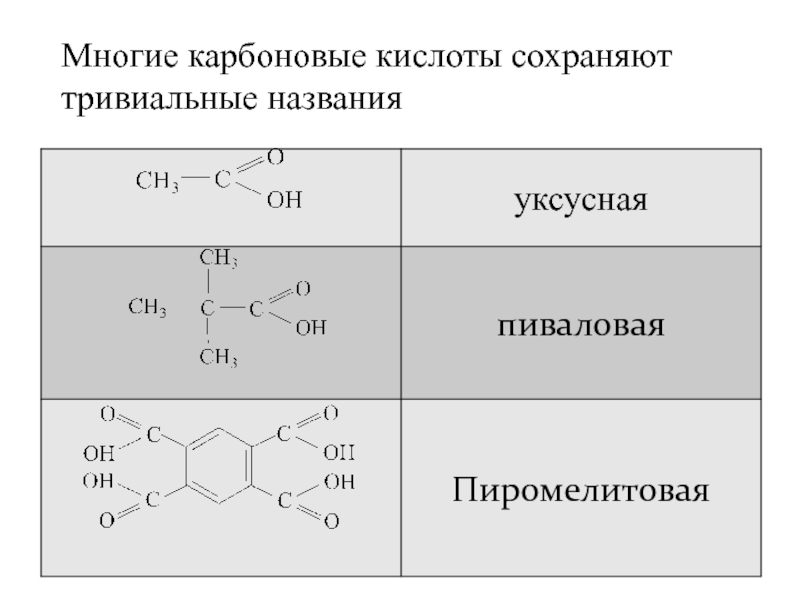
- 9. Многие карбоновые кислоты сохраняют тривиальные названия
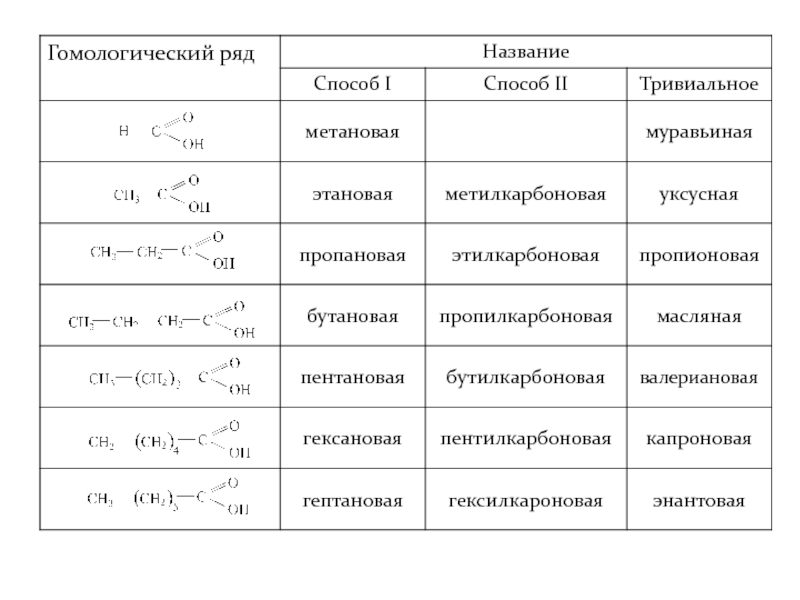
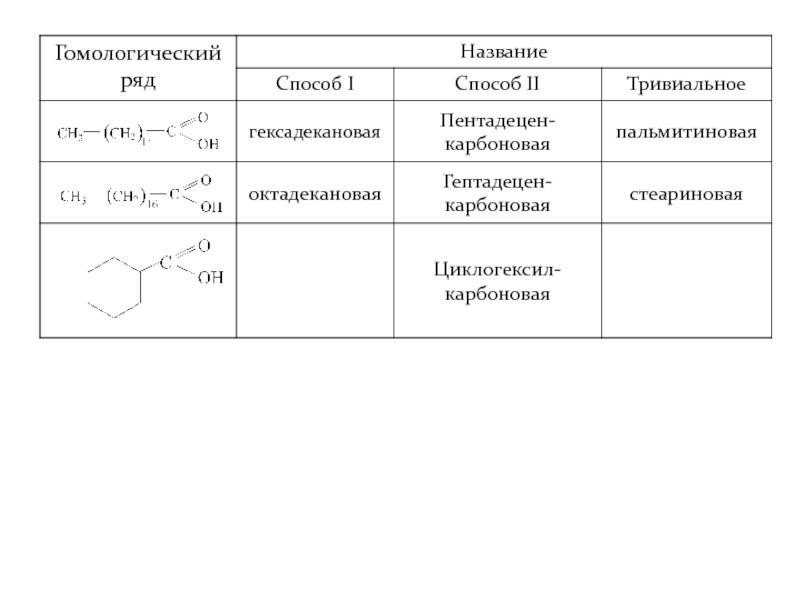
- 10. Одноосновные насыщенные (предельные) карбоновые кислоты
- 13. Изомерия насыщенных карбоновых кислот определяется строением углеводородного радикала (или структурная изомерия) Изомерия
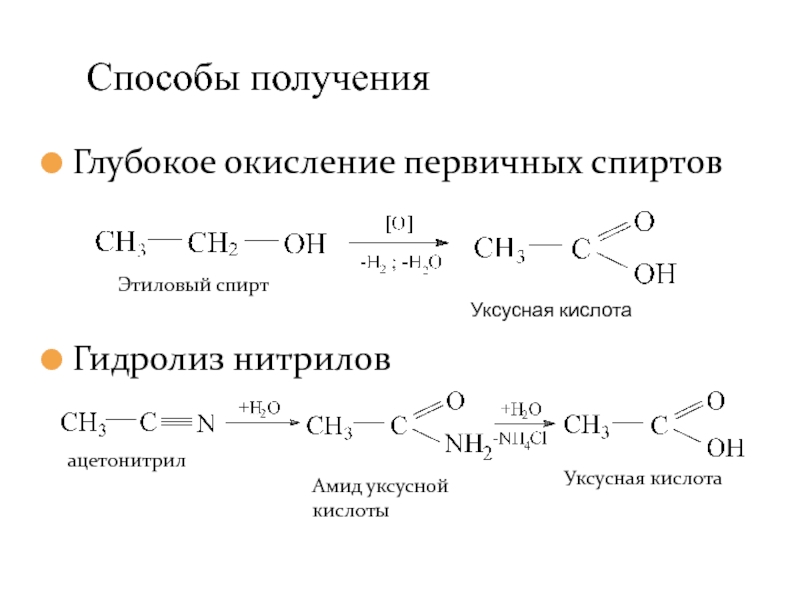
- 14. Глубокое окисление первичных спиртов Гидролиз нитрилов Способы получения
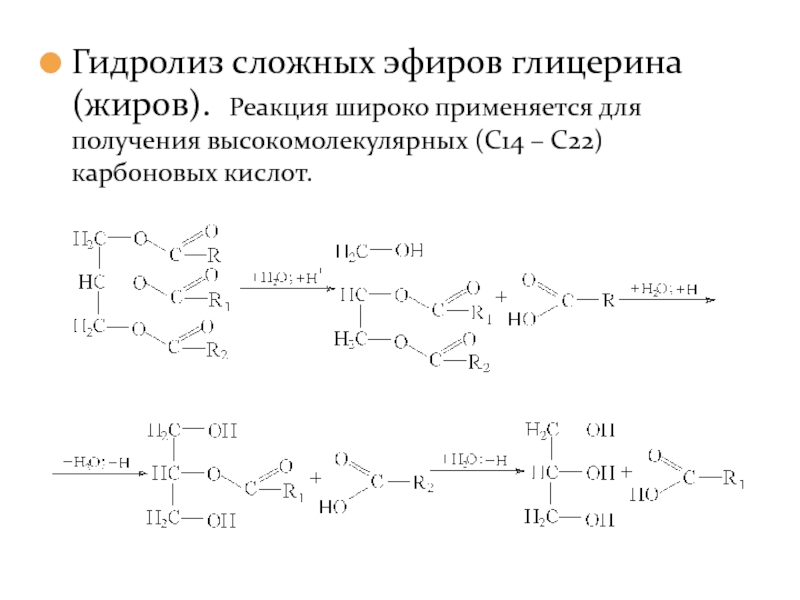
- 15. Гидролиз сложных эфиров глицерина (жиров). Реакция широко
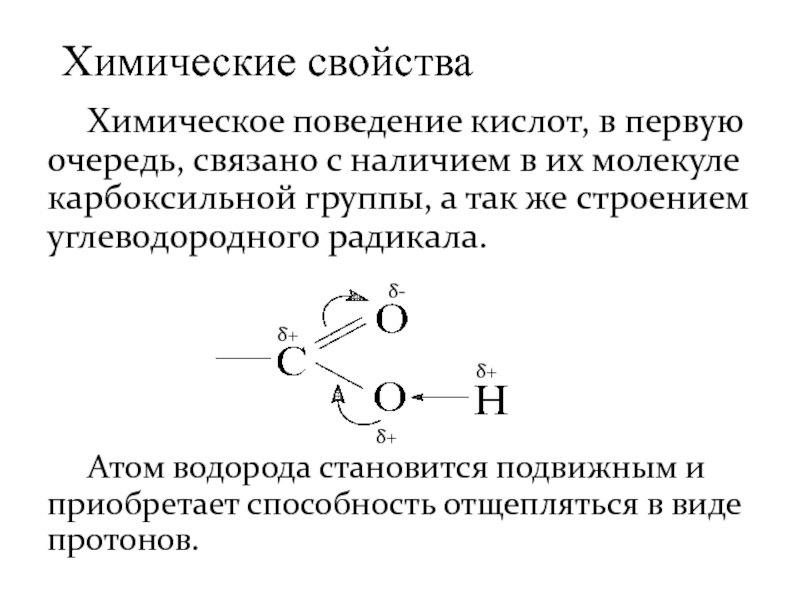
- 16. Химическое поведение кислот, в первую очередь, связано
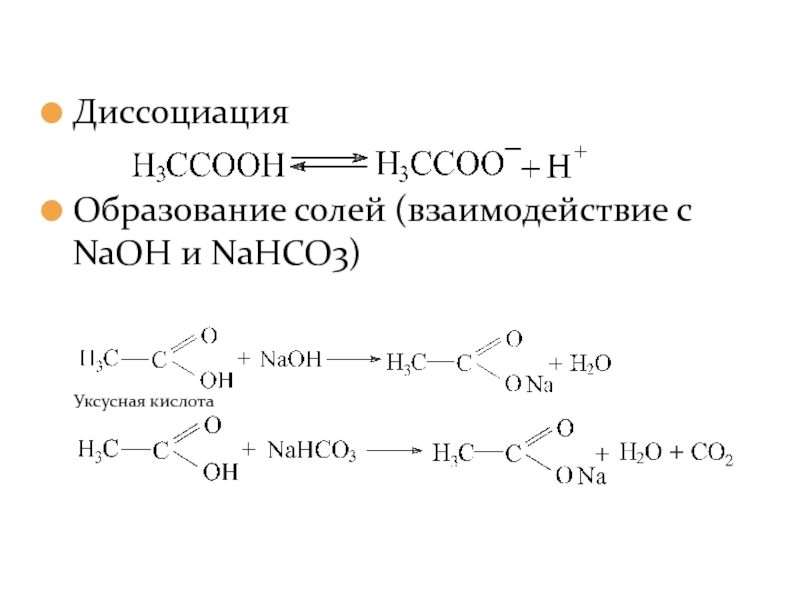
- 17. Диссоциация Образование солей (взаимодействие с NaOH и NaHCO3)
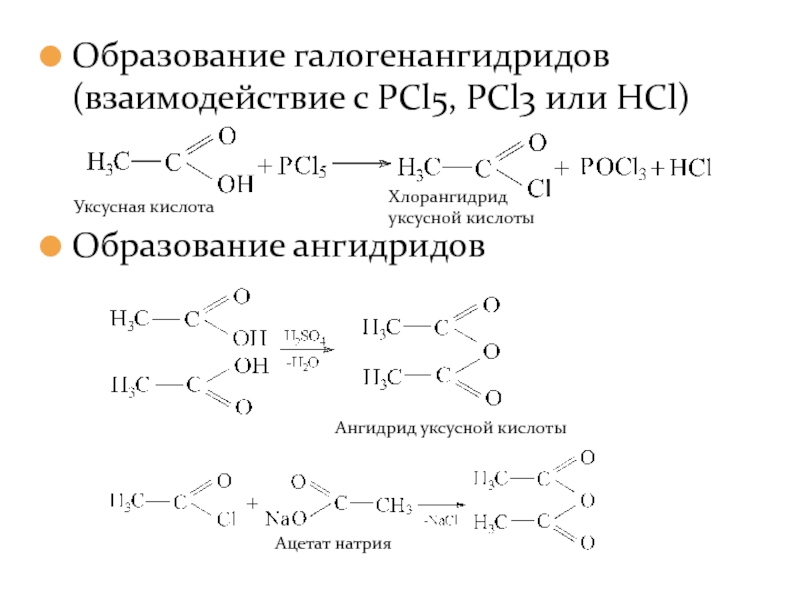
- 18. Образование галогенангидридов (взаимодействие с PCl5, PCl3 или HCl) Образование ангидридов
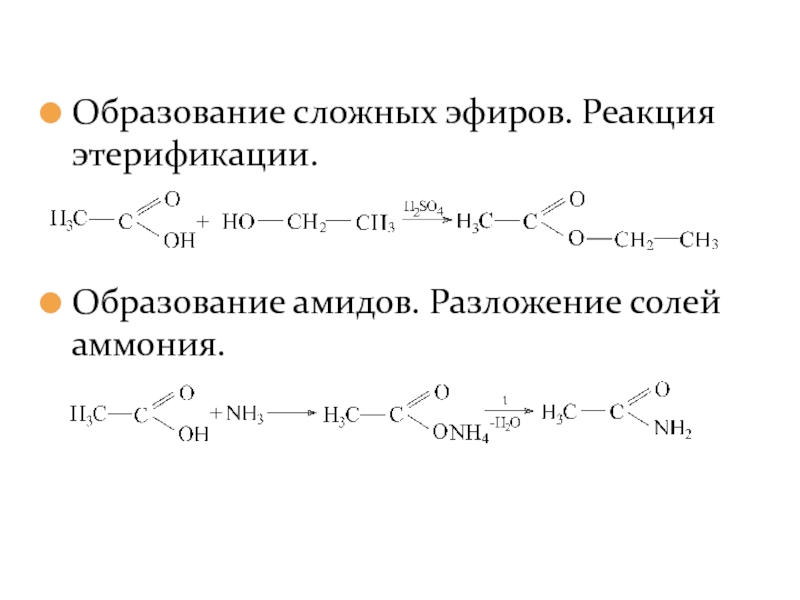
- 19. Образование сложных эфиров. Реакция этерификации. Образование амидов. Разложение солей аммония.
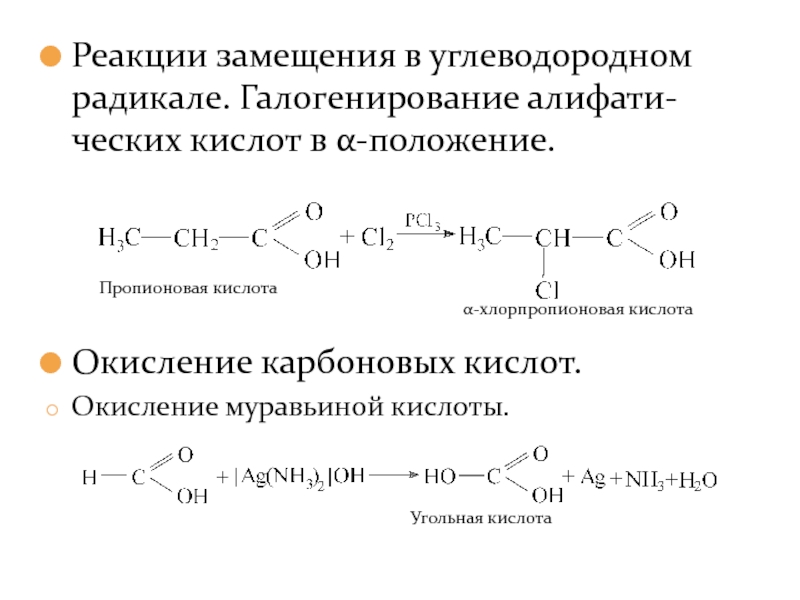
- 20. Реакции замещения в углеводородном радикале. Галогенирование алифати-ческих
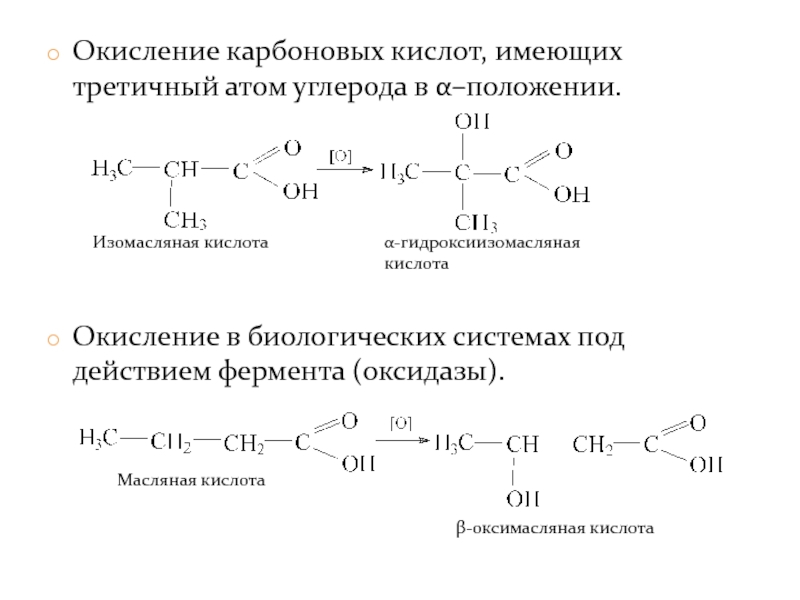
- 21. Окисление карбоновых кислот, имеющих третичный атом углерода
- 22. Одноосновные ненасыщенные (непредельные) карбоновые кислоты
- 24. Изомерия ненасыщенных карбоновых кислот определяется: строением углеводородного
- 25. Из галогенкарбоновых кислот (дегидро-галогенирование). Окисление непредельных альдегидов. Способы получения
- 26. Ненасыщенные одноосновные кислоты вступают во все реакции,
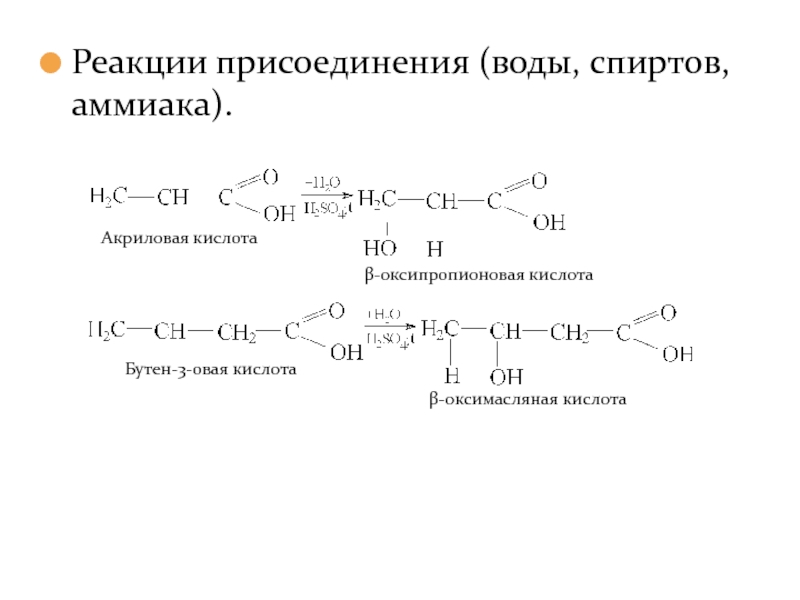
- 27. Реакции присоединения (воды, спиртов, аммиака).
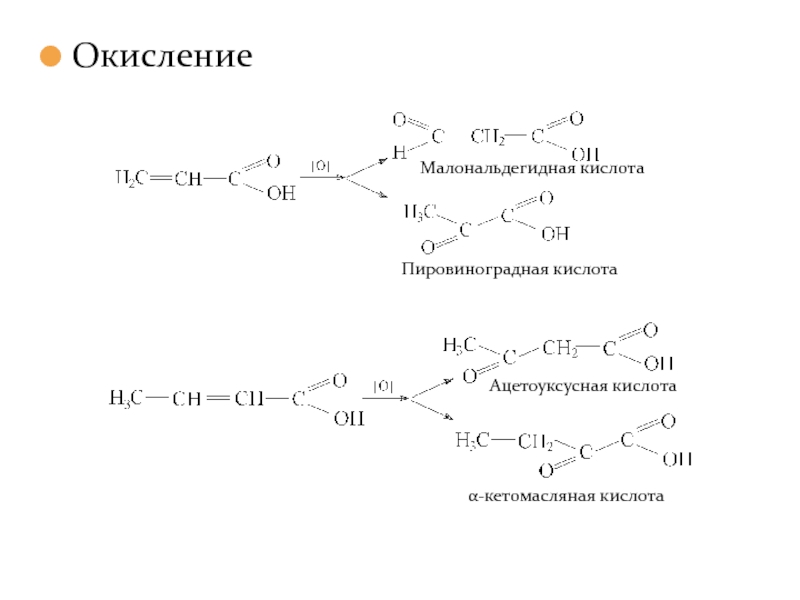
- 28. Окисление
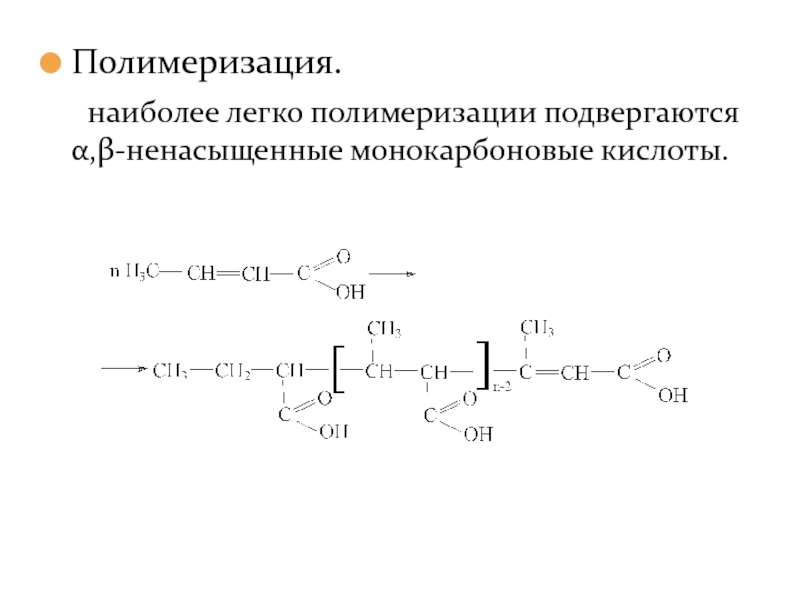
- 29. Полимеризация. наиболее легко полимеризации подвергаются α,β-ненасыщенные монокарбоновые кислоты.
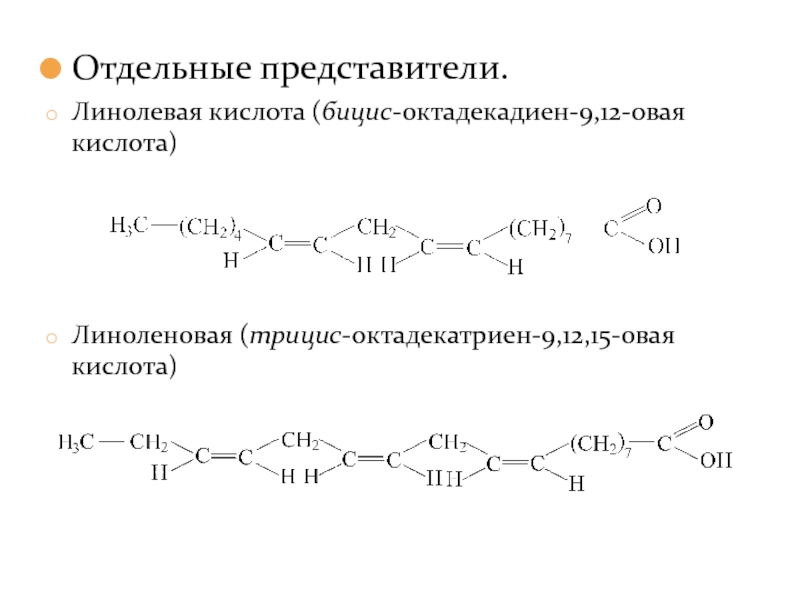
- 30. Отдельные представители. Линолевая кислота (бицис-октадекадиен-9,12-овая кислота) Линоленовая (трицис-октадекатриен-9,12,15-овая кислота)
- 31. Ароматические карбоновые кислоты
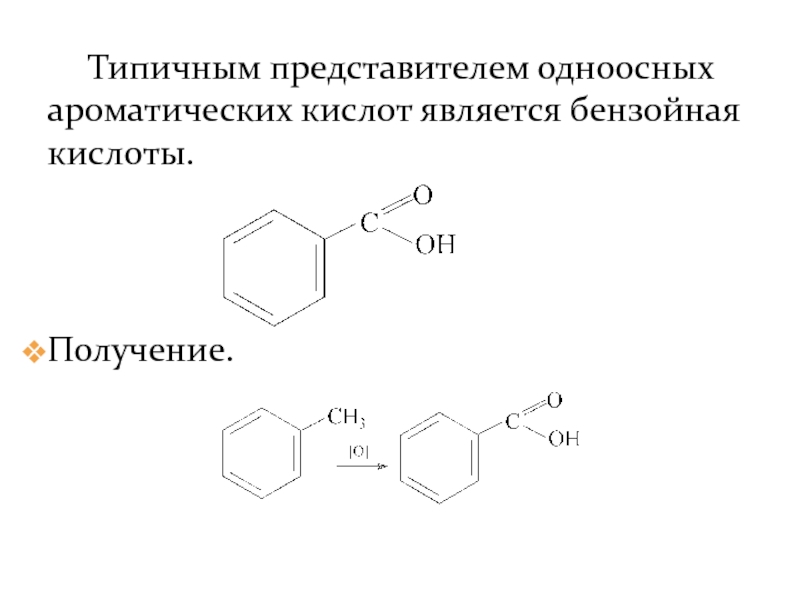
- 32. Типичным представителем одноосных ароматических кислот является бензойная кислоты. Получение.
- 33. Реакции карбоксильной группы. Для аренкарбоновых кислот характерны
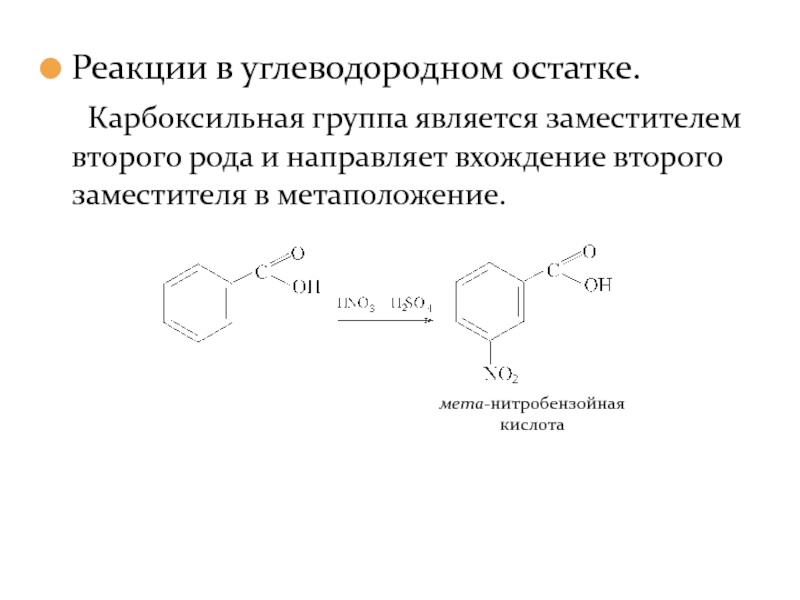
- 34. Реакции в углеводородном остатке. Карбоксильная группа является
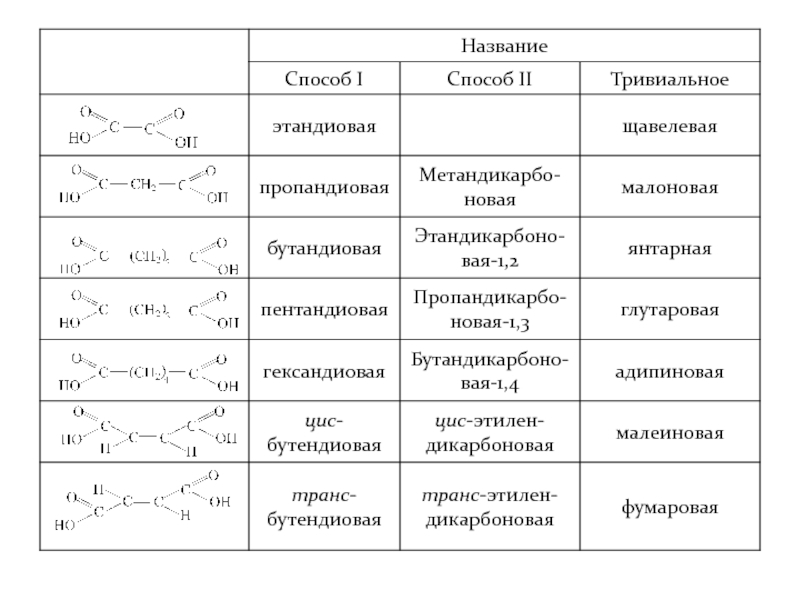
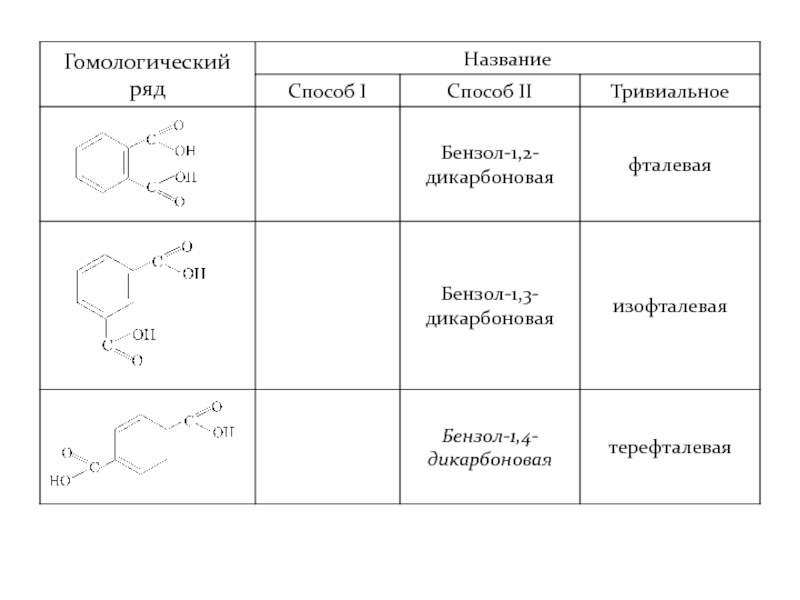
- 35. Двухосновные кислоты
- 38. Структурная изомерия насыщенных али-фатических двухосновных карбоновых кислот.
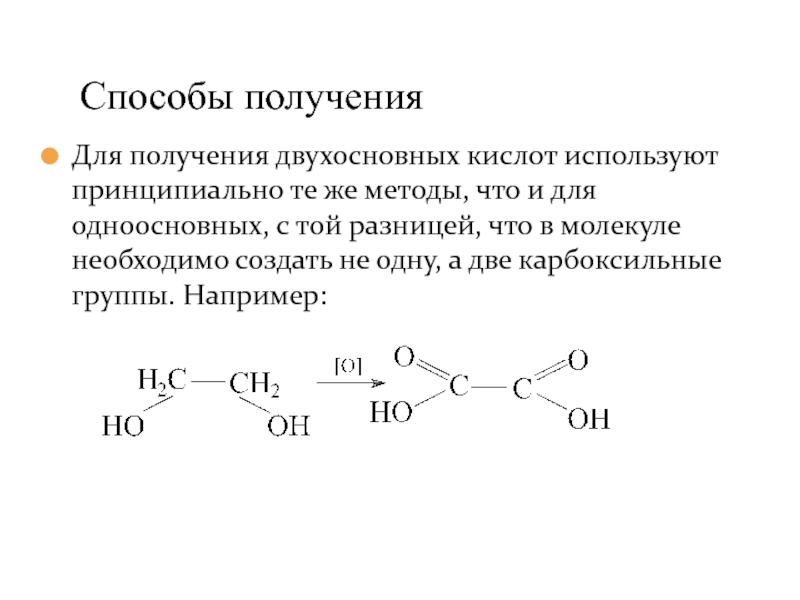
- 39. Для получения двухосновных кислот используют принципиально те
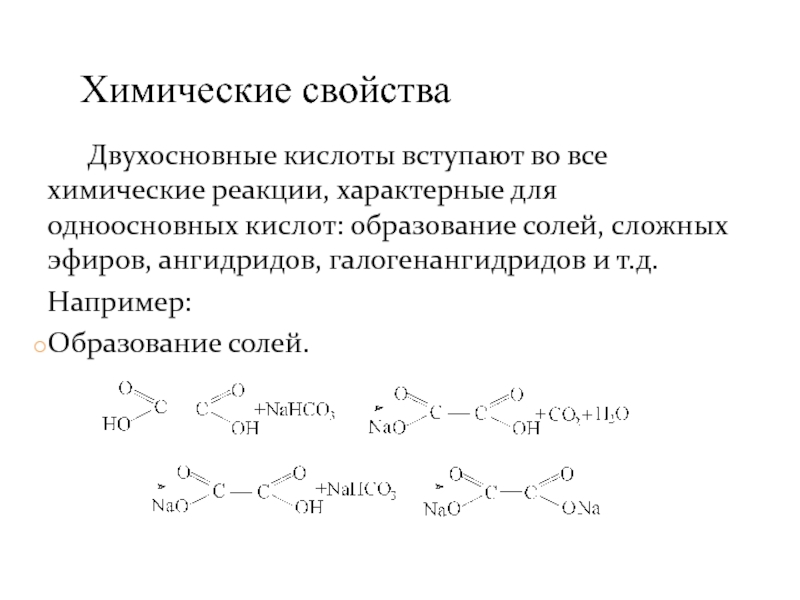
- 40. Двухосновные кислоты вступают во все химические реакции,
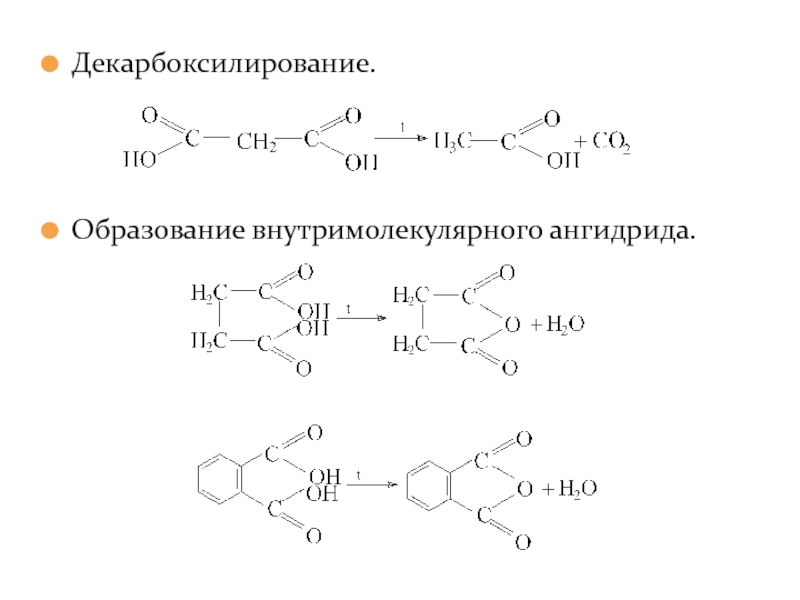
- 41. Декарбоксилирование. Образование внутримолекулярного ангидрида.
Слайд 2 Карбоновые кислоты – это производные углеводородов , в состав молекул которых
Слайд 3В зависимости от числа карбоксильных групп в составе одной молекулы различают:
Одноосновные
Классификация
Слайд 5НОМЕНКЛАТУРА
Систематическая номенклатура предлагает два способа построения названий карбоновых кислот:
Способ I. Названия
Слайд 6НОМЕНКЛАТУРА
Способ II. Названия карбоновых кислот образуют от названия родоначальных углеводородов считая
Слайд 8 При образовании названий карбо-новых кислот положение радикалов обо-значают буквами греческого алфавита
α,α-диметилпропановая кислота
Случайная номенклатура
Слайд 13 Изомерия насыщенных карбоновых кислот определяется строением углеводородного радикала (или структурная изомерия)
Изомерия
Слайд 15Гидролиз сложных эфиров глицерина (жиров). Реакция широко применяется для получения высокомолекулярных
Слайд 16 Химическое поведение кислот, в первую очередь, связано с наличием в их
Атом водорода становится подвижным и приобретает способность отщепляться в виде протонов.
Химические свойства
Слайд 19Образование сложных эфиров. Реакция этерификации.
Образование амидов. Разложение солей аммония.
Слайд 20Реакции замещения в углеводородном радикале. Галогенирование алифати-ческих кислот в α-положение.
Окисление карбоновых
Окисление муравьиной кислоты.
Слайд 21Окисление карбоновых кислот, имеющих третичный атом углерода в α–положении.
Окисление в биологических
Слайд 24 Изомерия ненасыщенных карбоновых кислот определяется:
строением углеводородного радикала (или структурная изомерия)
Положением двойных
Пространственная (геометрическая или цис-транс-)
Изомерия
Слайд 25Из галогенкарбоновых кислот (дегидро-галогенирование).
Окисление непредельных альдегидов.
Способы получения
Слайд 26 Ненасыщенные одноосновные кислоты вступают во все реакции, характерные для кис-лот (образование
α-ненасыщенные кислоты отличаются не-которыми особенностями в химическом поведе-нии. (Например: присоединение галогеноводо-родов и воды протекает против правила Марков-никова.
Химические свойства
Слайд 29Полимеризация.
наиболее легко полимеризации подвергаются α,β-ненасыщенные монокарбоновые кислоты.
Слайд 30Отдельные представители.
Линолевая кислота (бицис-октадекадиен-9,12-овая кислота)
Линоленовая (трицис-октадекатриен-9,12,15-овая кислота)
Слайд 32 Типичным представителем одноосных ароматических кислот является бензойная кислоты.
Получение.
Слайд 33Реакции карбоксильной группы.
Для аренкарбоновых кислот характерны все реакции насыщенных карбоновых кислот
Химические свойства
Слайд 34Реакции в углеводородном остатке.
Карбоксильная группа является заместителем второго рода и направляет
Слайд 38Структурная изомерия насыщенных али-фатических двухосновных карбоновых кислот.
У ненасыщенных кислот имеет место
У ароматических двухосновных кислот изомерия также изомерия положения карбоксильных групп.
Изомерия
Слайд 39Для получения двухосновных кислот используют принципиально те же методы, что и
Способы получения
Слайд 40 Двухосновные кислоты вступают во все химические реакции, характерные для одноосновных кислот:
Например:
Образование солей.
Химические свойства