- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбонильные соединения презентация
Содержание
- 1. Карбонильные соединения
- 2. План Определение Классификации Номенклатура Нахождение в природе
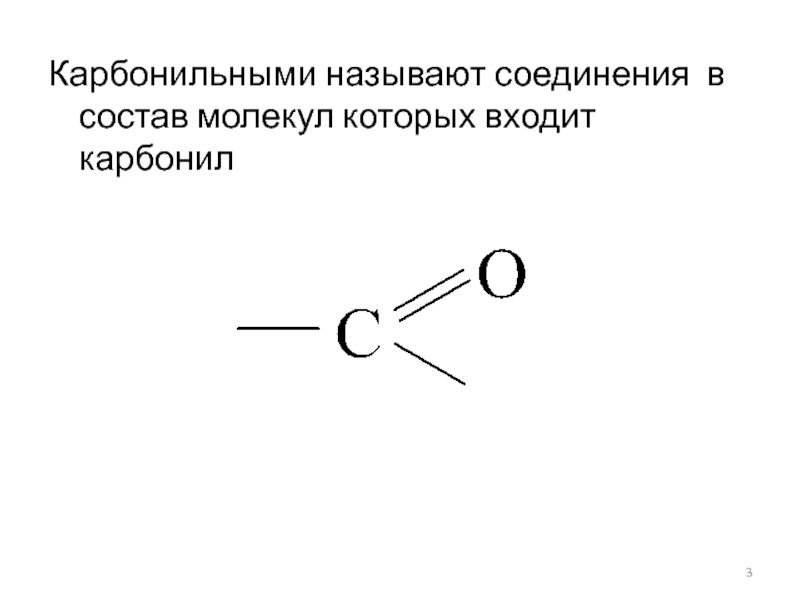
- 3. Карбонильными называют соединения в состав молекул которых входит карбонил
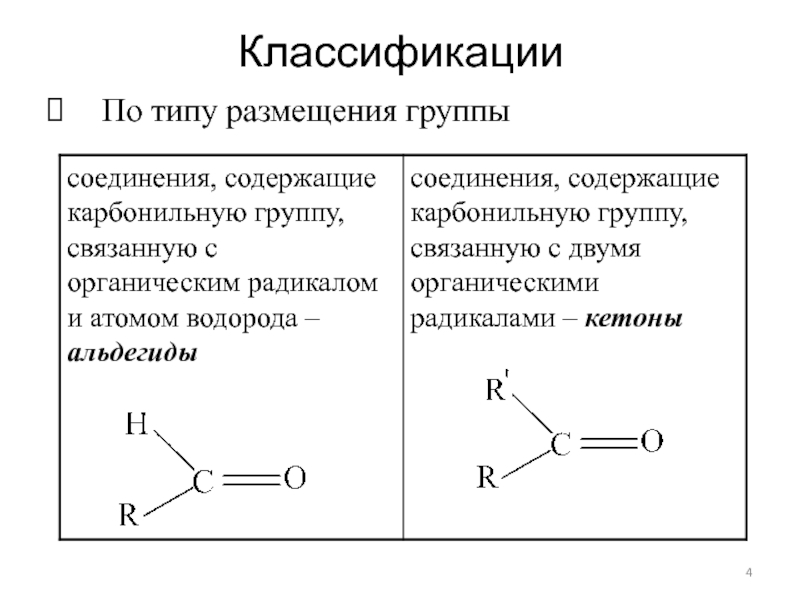
- 4. Классификации По типу размещения группы
- 5. Классификации По количеству карбонильных групп
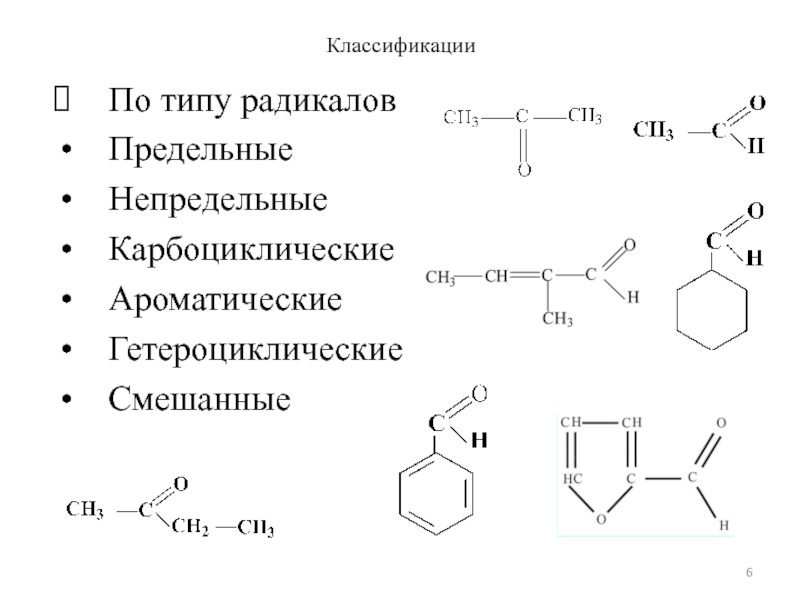
- 6. Классификации По типу радикалов Предельные Непредельные Карбоциклические Ароматические Гетероциклические Смешанные
- 7. Номенклатура Альдегидную группу по систематической номенклатуре обозначают
- 8. Номенклатура. Типичные представители
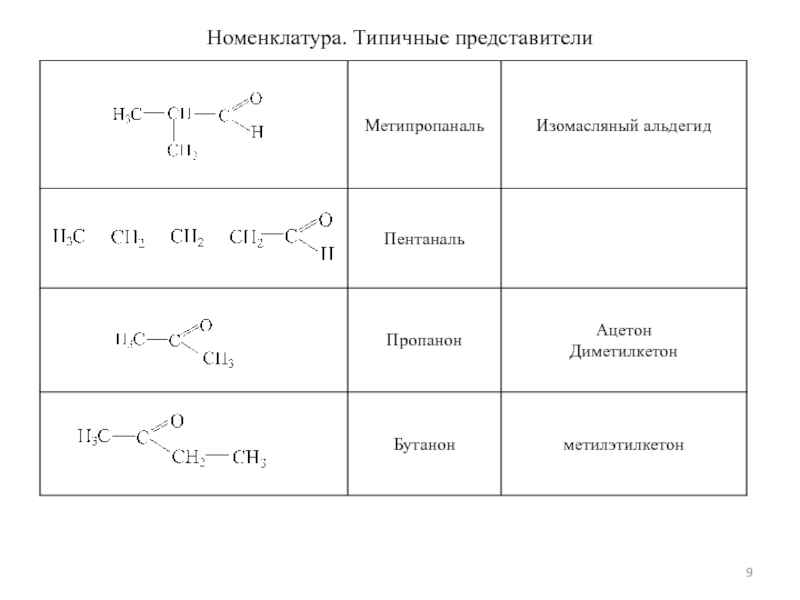
- 9. Номенклатура. Типичные представители
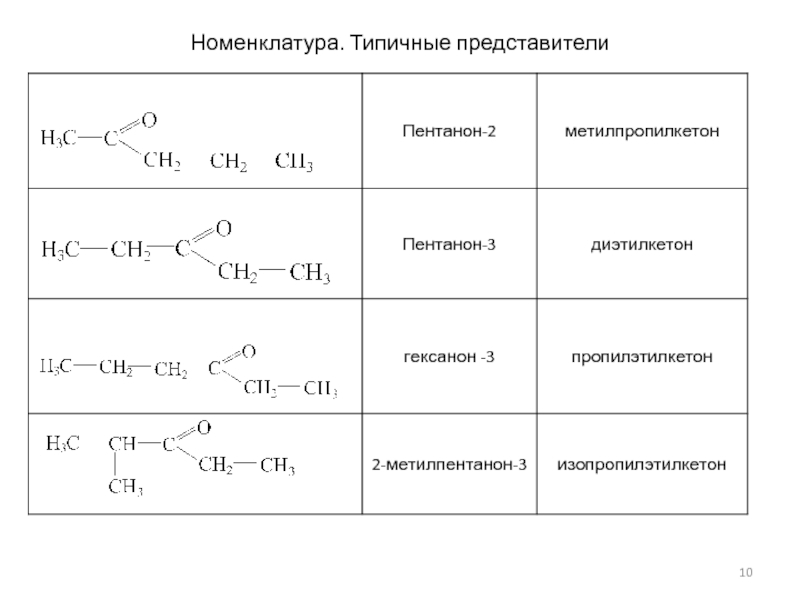
- 10. Номенклатура. Типичные представители
- 11. Номенклатура. Типичные представители
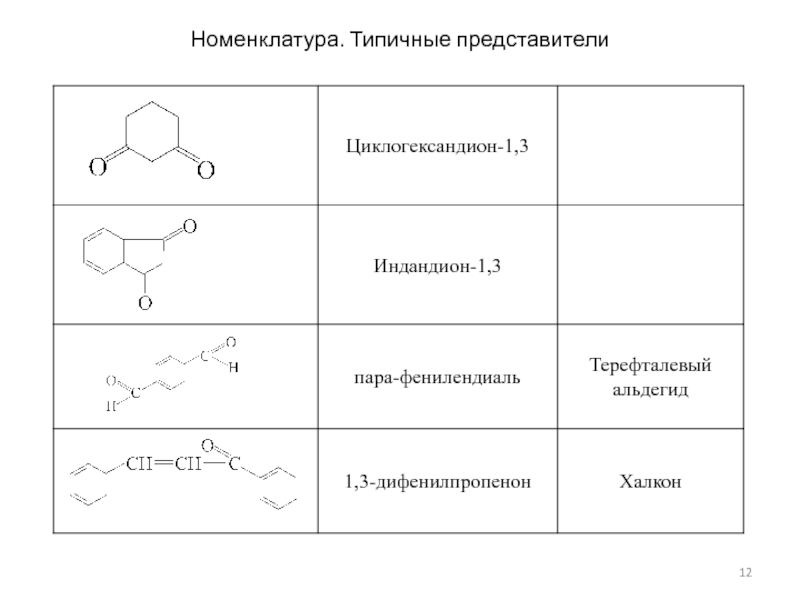
- 12. Номенклатура. Типичные представители
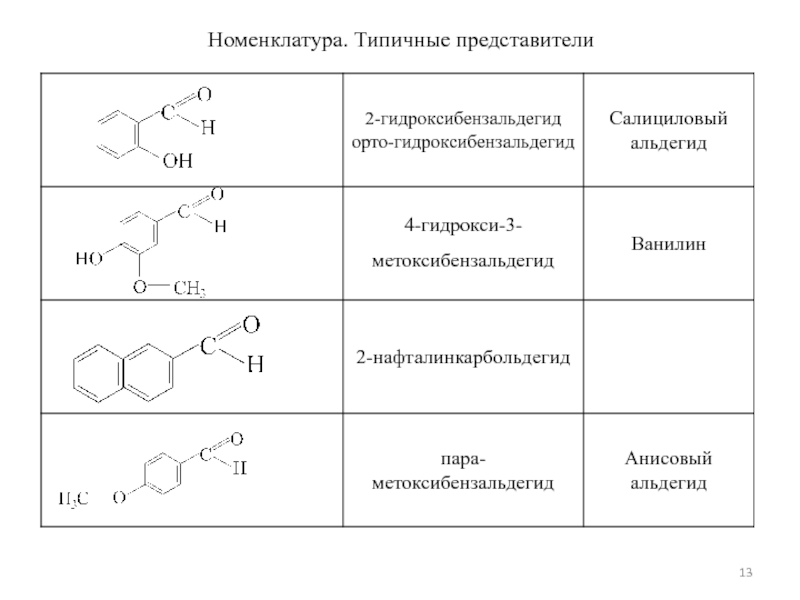
- 13. Номенклатура. Типичные представители
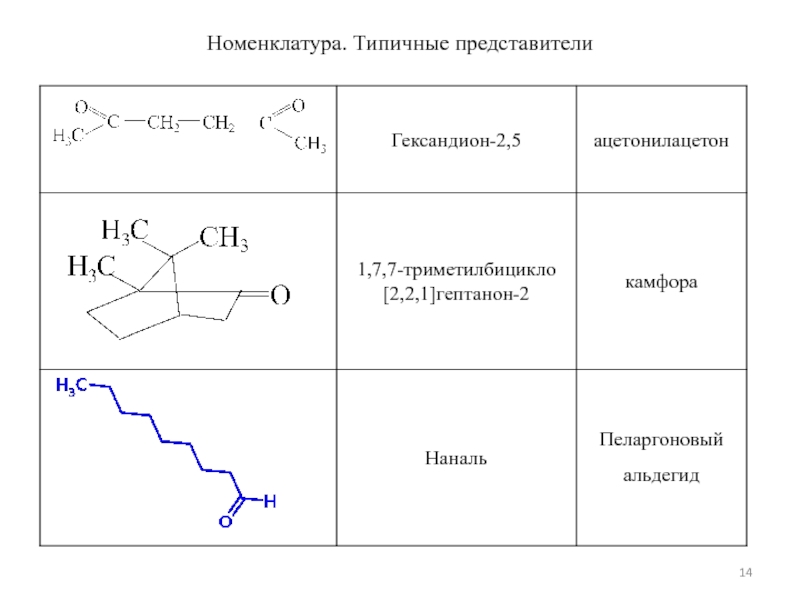
- 14. Номенклатура. Типичные представители
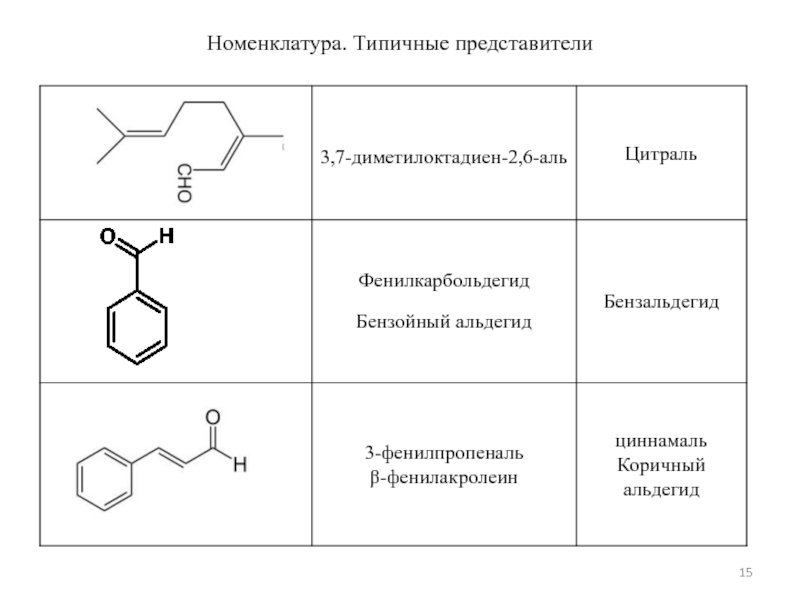
- 15. Номенклатура. Типичные представители
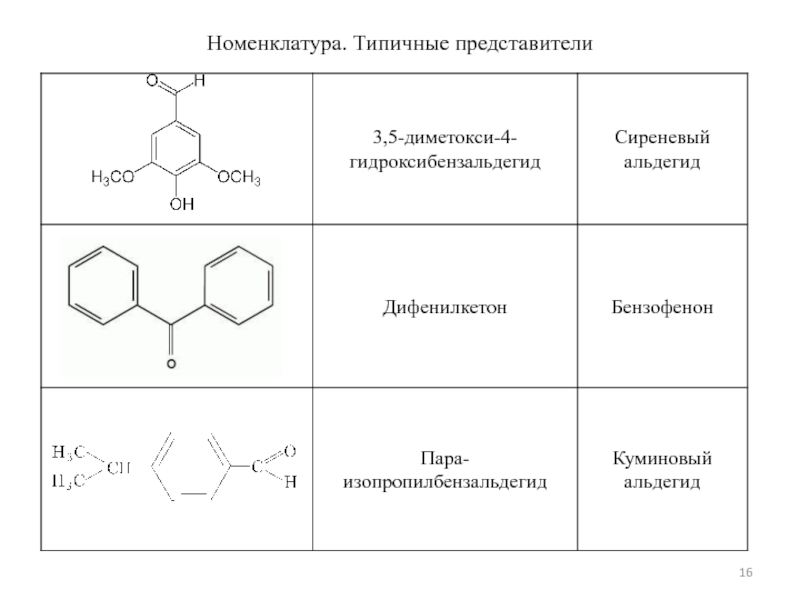
- 16. Номенклатура. Типичные представители
- 17. Нахождение в природе
- 18. Пеларгоновый альдегид С8H17 COH содержится в
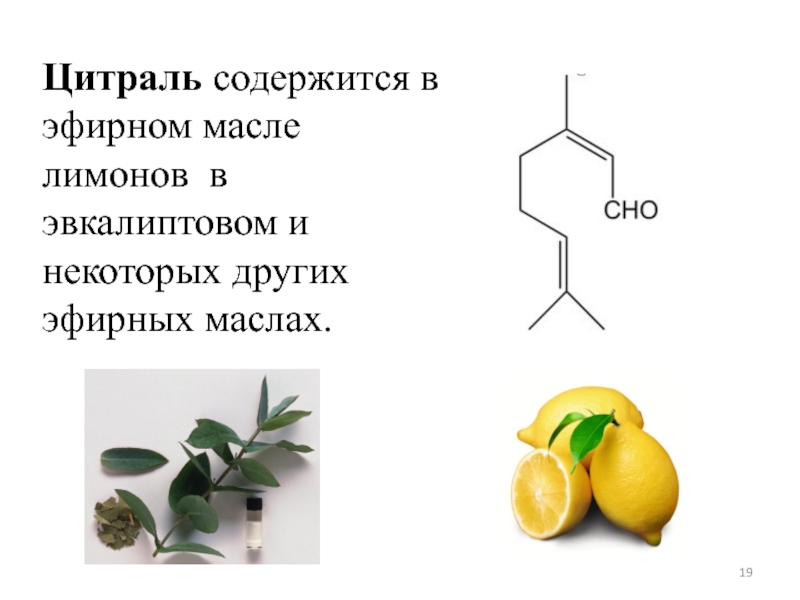
- 19. Цитраль содержится в эфирном масле лимонов в эвкалиптовом и некоторых других эфирных маслах.
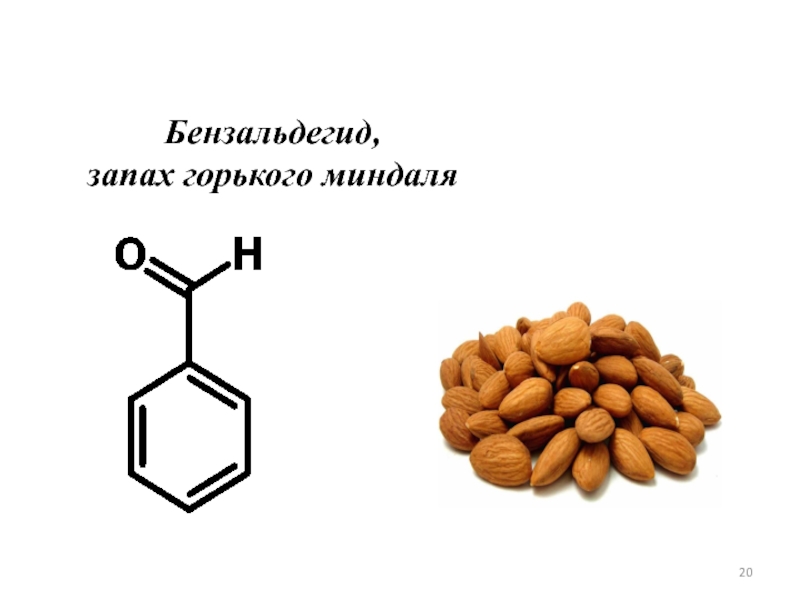
- 20. Бензальдегид, запах горького миндаля
- 21. Коричный альдегид
- 22. Сиреневый и коричный альдегиды
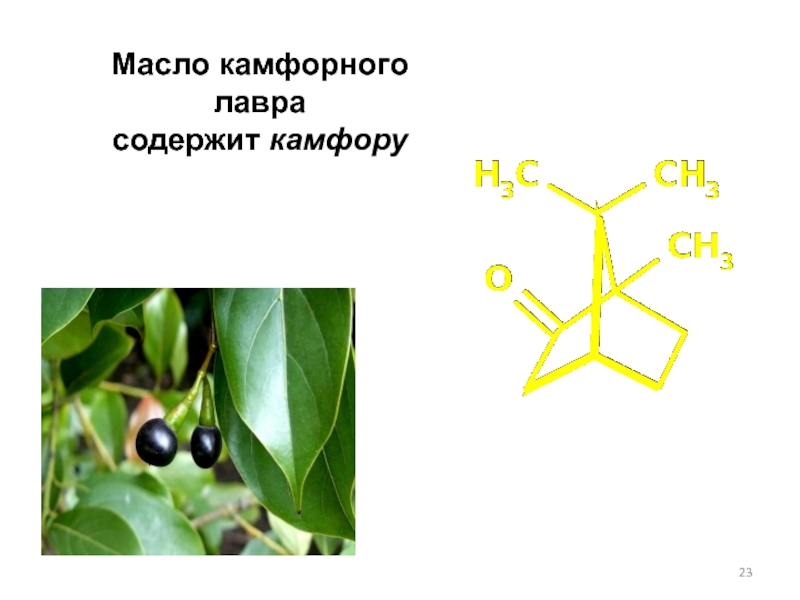
- 23. Масло камфорного лавра содержит камфору
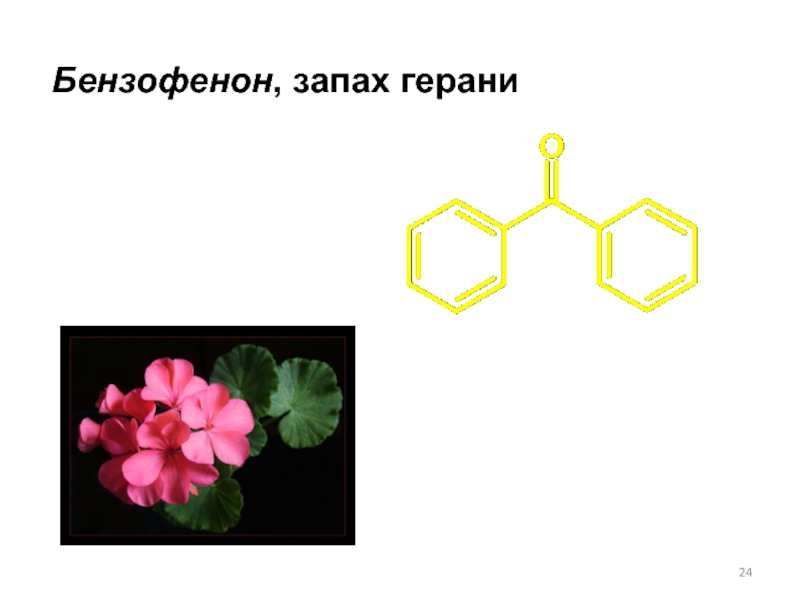
- 24. Бензофенон, запах герани
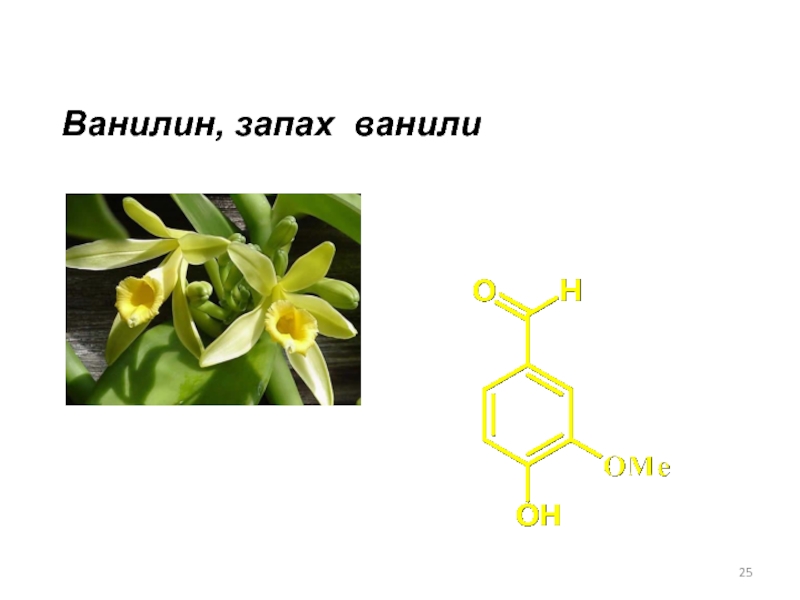
- 25. Ванилин, запах ванили
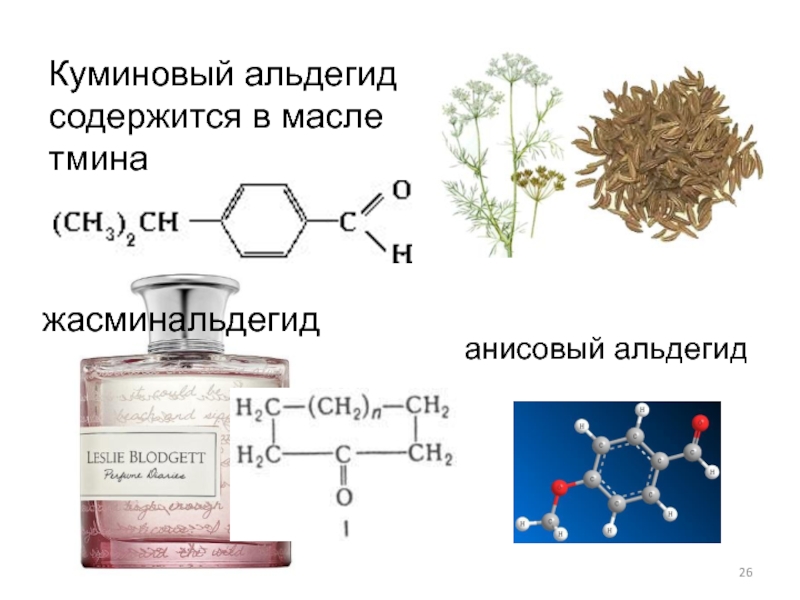
- 26. Куминовый альдегид содержится в масле тмина анисовый альдегид жасминальдегид
- 27. Многие насекомые при нападении врагов используют
- 28. Насыщенные монокарбонильные соединения
- 29. Физические свойства Низшие представители гомологического ряда предельных
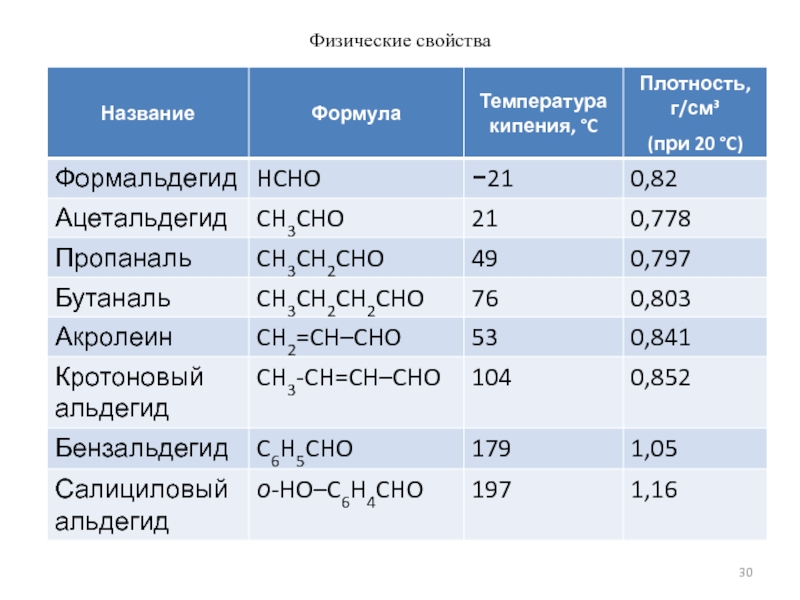
- 30. Физические свойства
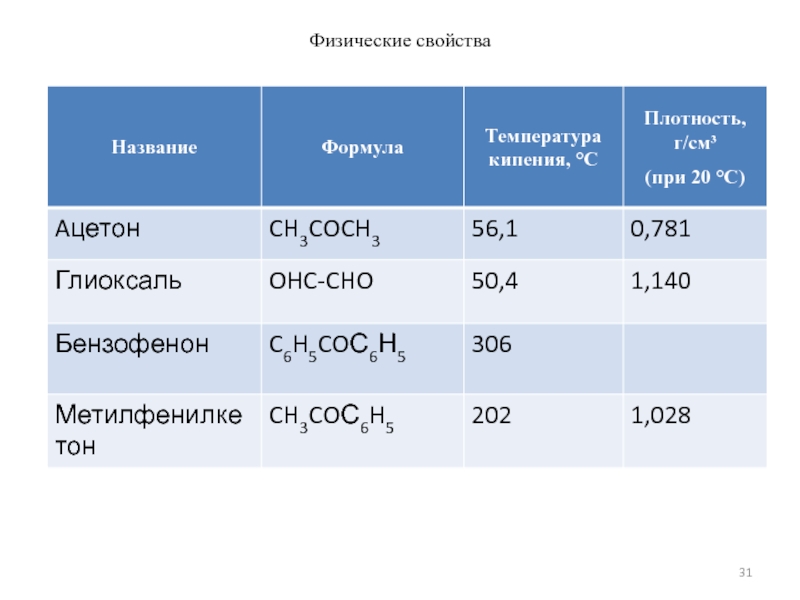
- 31. Физические свойства
- 32. Изомерия Структурная изомерия углеводородных радикалов характерная для
- 33. Способы получения Окисление и дегидрирование спиртов (см.
- 34. Способы получения монокарбонильных соединений Гидролиз геминальных дигалогеналканов
- 35. Химические свойства Альдегиды и кетоны принадлежат к
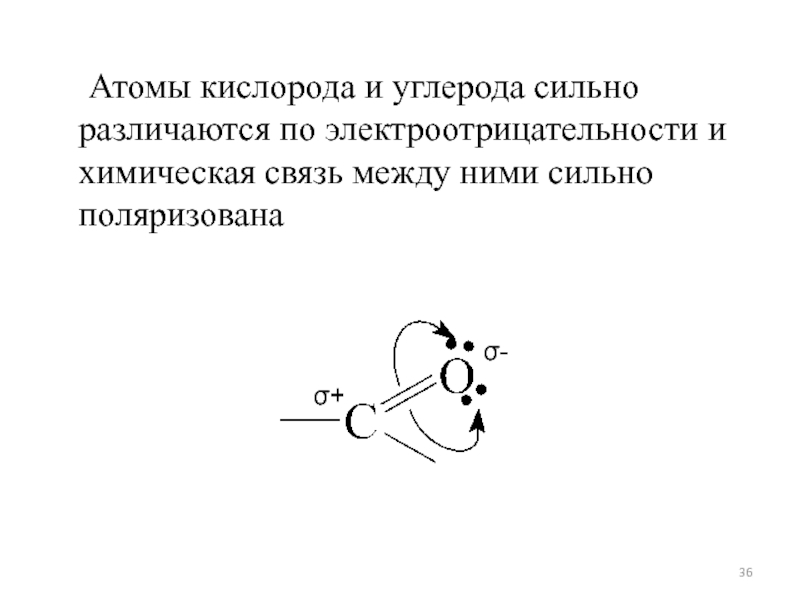
- 36. Атомы кислорода и углерода сильно различаются по электроотрицательности и химическая связь между ними сильно поляризована
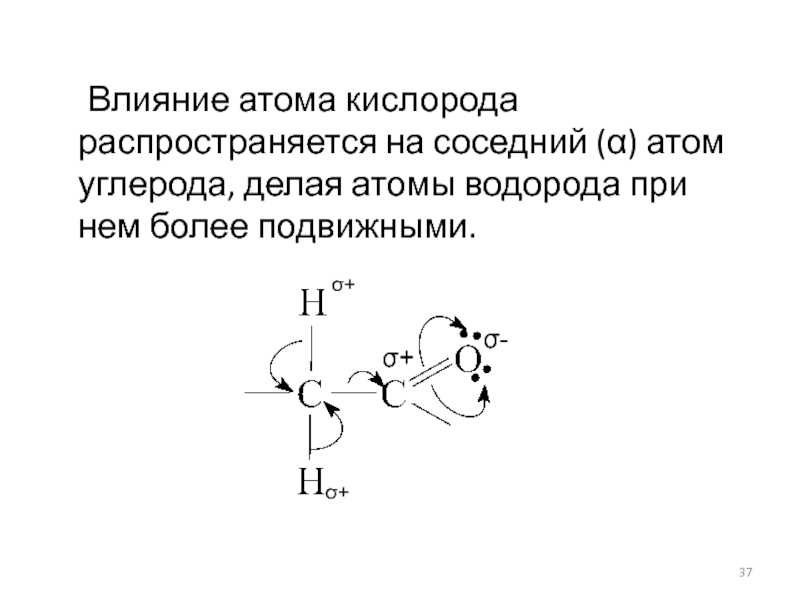
- 37. Влияние атома кислорода распространяется на соседний (α)
- 38. Химические свойства монокарбонильных соединений Все химические свойства
- 39. Химические свойства монокарбонильных соединений Присоединение по двойной
- 40. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 41. Химические свойства монокарбонильных соединений. Присоединение по двойной связи Взаимодействие с синильной кислотой
- 42. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 43. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 44. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 45. Химические свойства монокарбонильных соединений. Реакции замещения Реакции замещения Взаимодействие с гидроксиламином
- 46. Химические свойства монокарбонильных соединений. Реакции замещения Взаимодействие с гидразином и его производными
- 48. Химические свойства монокарбонильных соединений Реакции замещения Взаимодействие с PCl5 и PBr5
- 49. Реакции, связанные с подвижностью атомов водорода в α-положении Взаимодействие с галогенами в присутствии щелочей
- 50. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 51. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 52. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 53. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 54. Химические свойства монокарбонильных соединений. Присоединение по двойной
- 55. Химические свойства монокарбонильных соединений. Присоединение по двойной
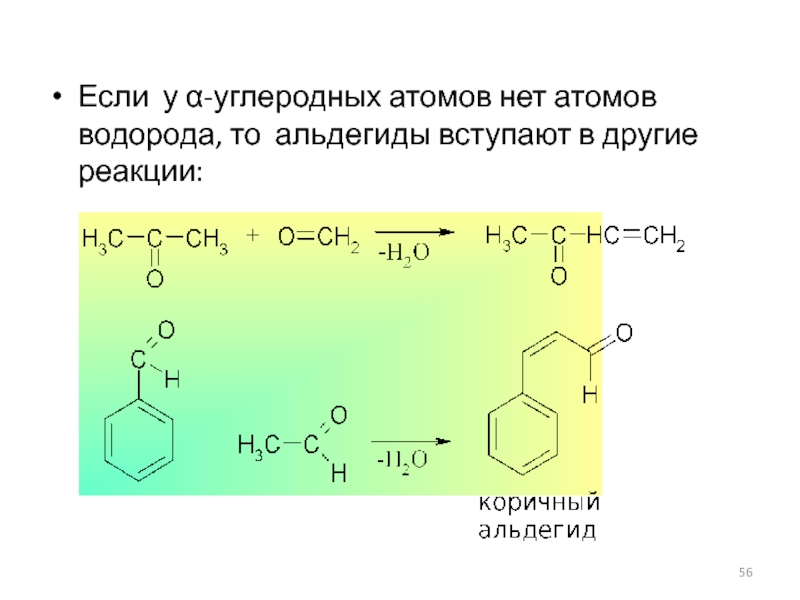
- 56. Если у α-углеродных атомов нет атомов водорода, то альдегиды вступают в другие реакции:
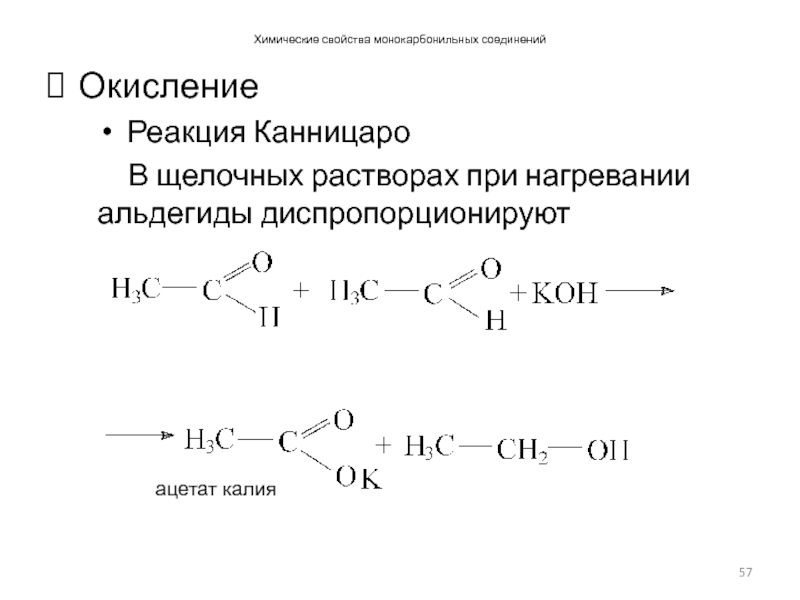
- 57. Химические свойства монокарбонильных соединений Окисление Реакция Канницаро В щелочных растворах при нагревании альдегиды диспропорционируют
- 58. Химические свойства монокарбонильных соединений. Окисление Реакция Тищенко В присутствии алкоголятов алюминия альдегиды диспропорционируют
- 59. Химические свойства монокарбонильных соединений. Окисление Взаимодействия с
- 60. Химические свойства монокарбонильных соединений. Окисление Взаимодействия с
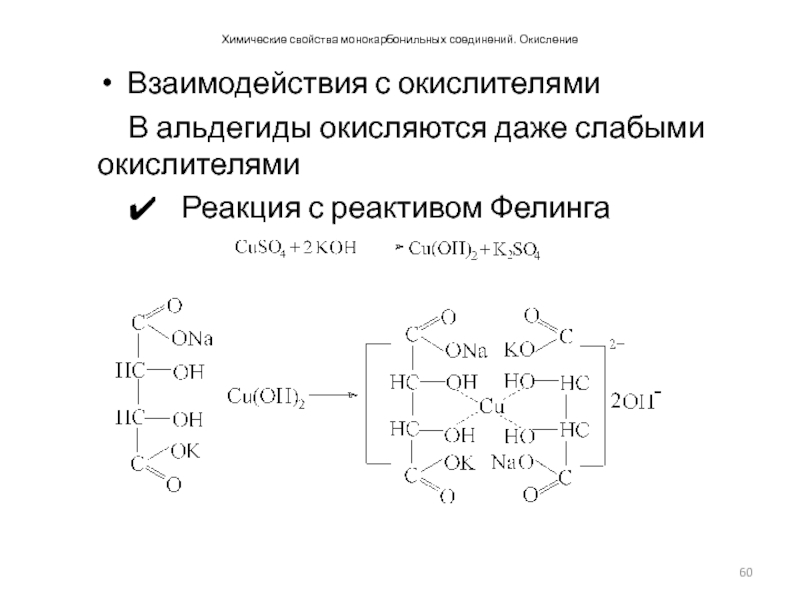
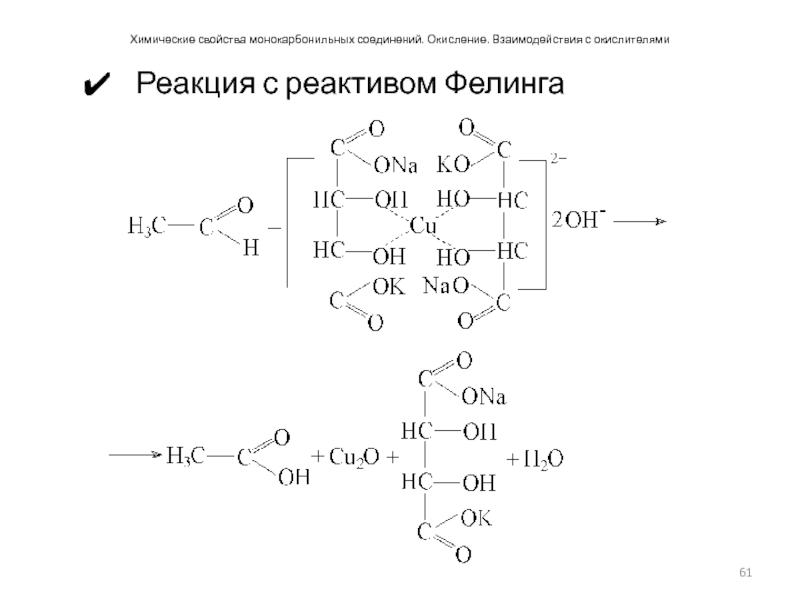
- 61. Химические свойства монокарбонильных соединений. Окисление. Взаимодействия с окислителями Реакция с реактивом Фелинга
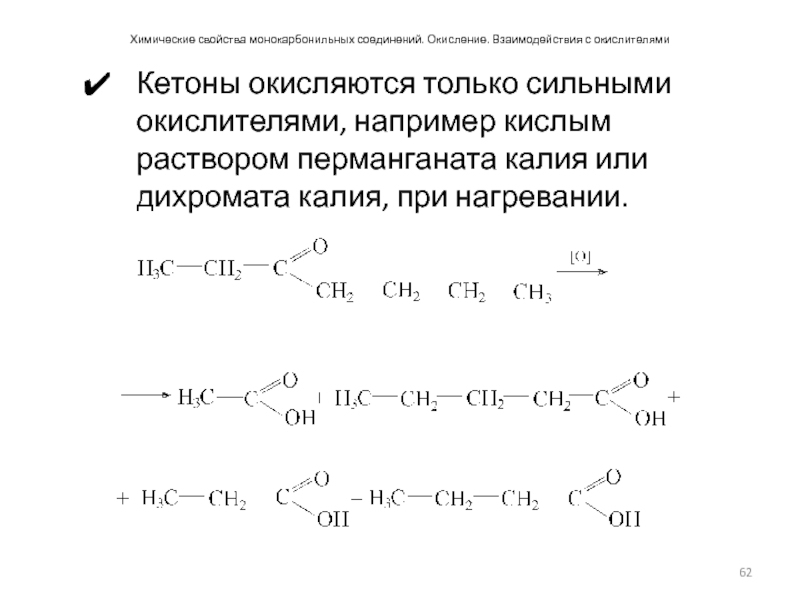
- 62. Химические свойства монокарбонильных соединений. Окисление. Взаимодействия с
- 63. Отдельные представители
- 64. Формальдегид. Метаналь. ( formīca «муравей») — бесцветный газ
- 65. Метаналь применяют для производства фенолоформальдегидных пластмасс и
- 66. Раствор формальдегида в воде называют формалином, его
- 67. Уксусный альдегид (этаналь, ацетальдегид) Бесцветная жидкость
- 68. Акролеин Вследствие своей высокой реакционной способности акролеин
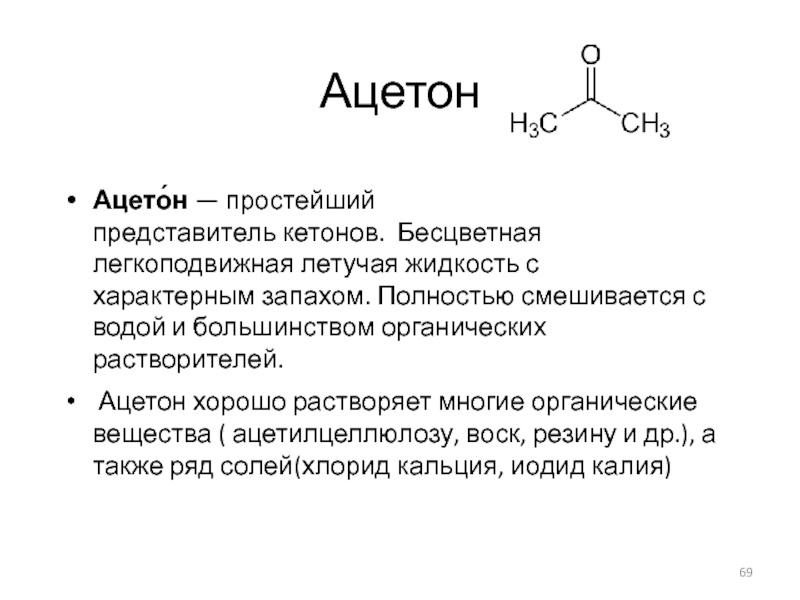
- 69. Ацетон Ацето́н — простейший представитель кетонов. Бесцветная легкоподвижная летучая жидкость с
- 70. В качестве растворителя ацетон используется в производстве красок, лаков
- 71. Опасность для здоровья!!! Кетоны - легковоспламеняющиеся вещества,
- 72. Применение. Основное количество получаемого в промышленности ацетальдегида
- 73. Ненасыщенные карбонильные соединения
- 74. Карбонильные соединения аренов
- 75. Дикарбонильные соединения
Слайд 1Карбонильные соединения
Альдегиды и кетоны
Лектор: Стутко Оксана Валериевна
старший преподаватель кафедры Химии
Слайд 2План
Определение
Классификации
Номенклатура
Нахождение в природе
Насыщенные карбонильные соединения
Изомерия
Способы получения
Физические свойства
Химические свойства
Слайд 6Классификации
По типу радикалов
Предельные
Непредельные
Карбоциклические
Ароматические
Гетероциклические
Смешанные
Слайд 7Номенклатура
Альдегидную группу по систематической номенклатуре обозначают суффиксами –аль и –карбальдегид или
Кетонную группу по систематической номенклатуре обозначают суффиксами –он и –кетон или приставками оксо- и кето-. Некоторые кетоны имеют тривиальные названия.
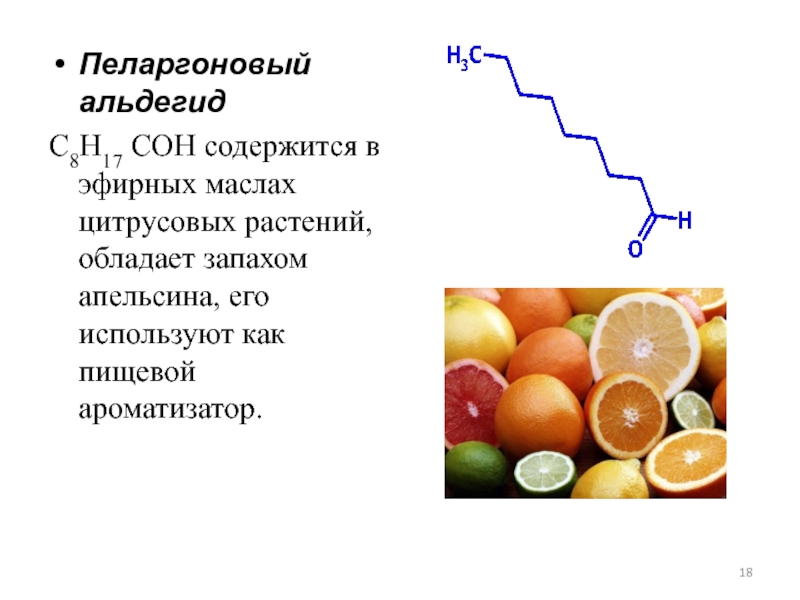
Слайд 18Пеларгоновый альдегид
С8H17 COH содержится в эфирных маслах цитрусовых растений, обладает
Слайд 19Цитраль содержится в эфирном масле лимонов в эвкалиптовом и некоторых других
Слайд 27Многие насекомые при нападении врагов используют
средства химической защиты
Цитраль,
содержится в
Долиходиал,
содержится в организме палочников
Подобные соединения обладают сильным, летучим запахом,
который оказывает раздражающее действие,
а капли попавшие на покровы хищника могут вызывать
раздражение и зуд.
Слайд 29Физические свойства
Низшие представители гомологического ряда предельных альдегидов и кетонов – легкие
С3-С6 запах неприятный
Высшие в воде не растворимы, температуры кипения высокие, запах приятный, применяются в парфюмерии.
Слайд 32Изомерия
Структурная изомерия углеводородных радикалов характерная для всех карбонильных соединений
Изомерия положения функциональной
Слайд 33Способы получения
Окисление и дегидрирование спиртов (см. химические свойства спиртов)
Окисление алкенов (см.
Гидратация алкинов (см. химические свойства алкинов)
Пинаколиновая перегруппировка (см. химические свойства спиртов)
Прямое карбонилироание (оксосинтез) несимметричных алкенов (см. химические свойства алкенов)
Слайд 35Химические свойства
Альдегиды и кетоны принадлежат к наиболее реакционным органическим соединениям, причём
Атомные орбитали атома углерода карбонильной группы sp2-гибридизованы. Следовательно в этой части молекула карбонильного соединения плоская, и можно говорить о двойной химической связи между атомами углерода и кислорода.
Слайд 36 Атомы кислорода и углерода сильно различаются по электроотрицательности и химическая связь
Слайд 37 Влияние атома кислорода распространяется на соседний (α) атом углерода, делая атомы
Слайд 38Химические свойства монокарбонильных соединений
Все химические свойства карбонильных соединений можно разделить на
Присоединение по двойной связи
Реакции замещения
Реакции связанные с подвижностью атомов водорода в α-положении
Окисление
Слайд 39Химические свойства монокарбонильных соединений
Присоединение по двойной связи
Восстановление
протекает в присутствии катализаторов восстановления
Слайд 40Химические свойства монокарбонильных соединений. Присоединение по двойной связи
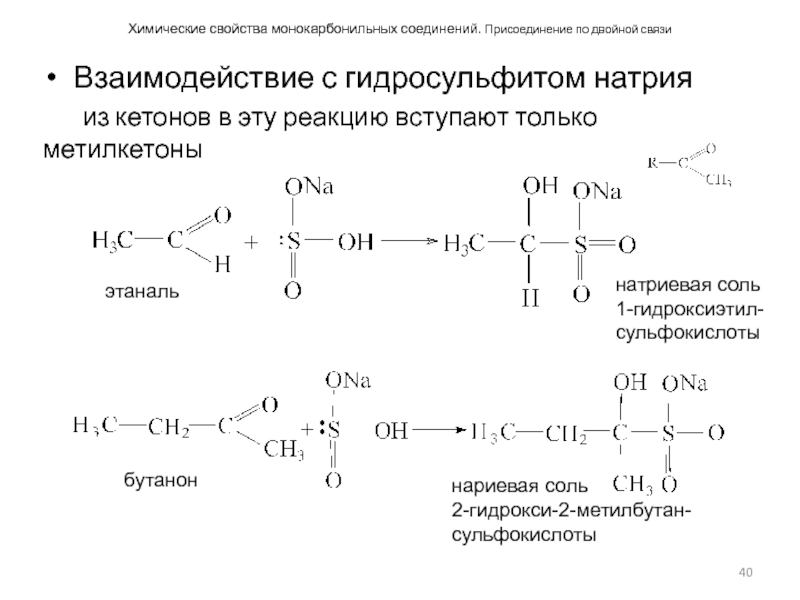
Взаимодействие с гидросульфитом натрия
из
Слайд 41Химические свойства монокарбонильных соединений. Присоединение по двойной связи
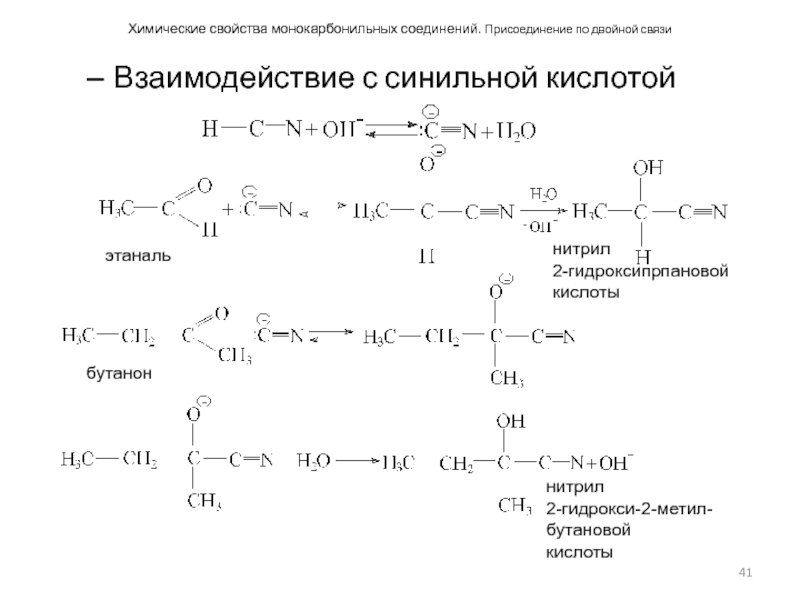
Взаимодействие с синильной кислотой
Слайд 42Химические свойства монокарбонильных соединений. Присоединение по двойной связи
Взаимодействие со спиртами
Реакция идет
В этих реакциях образуются полуацетали, а при избытке спирта образуются ацетали
Слайд 43Химические свойства монокарбонильных соединений. Присоединение по двойной связи
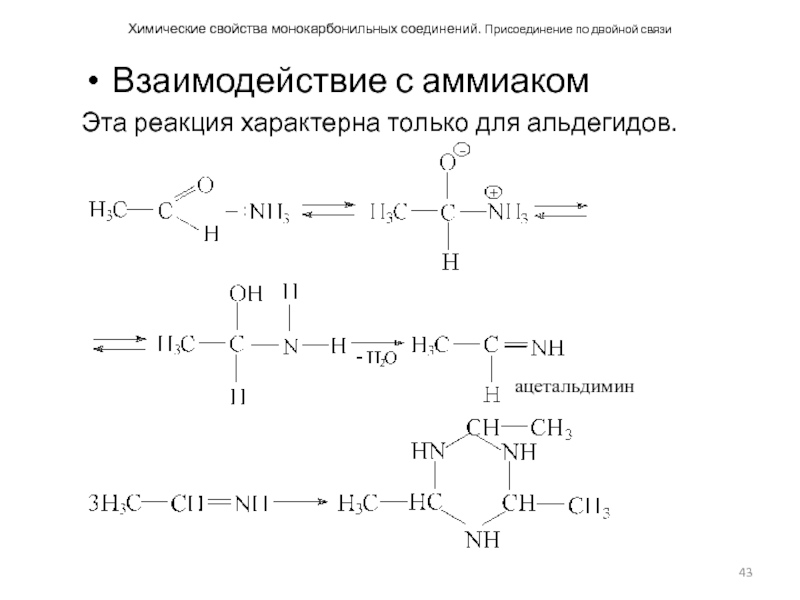
Взаимодействие с аммиаком
Эта реакция
Слайд 44Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Взаимодействие с аммиаком
Особым
Уротропин в пищевой промышленности зарегистрирован как консервант (код E239). Часто применяется в сыроделии, а также для консервации икры.
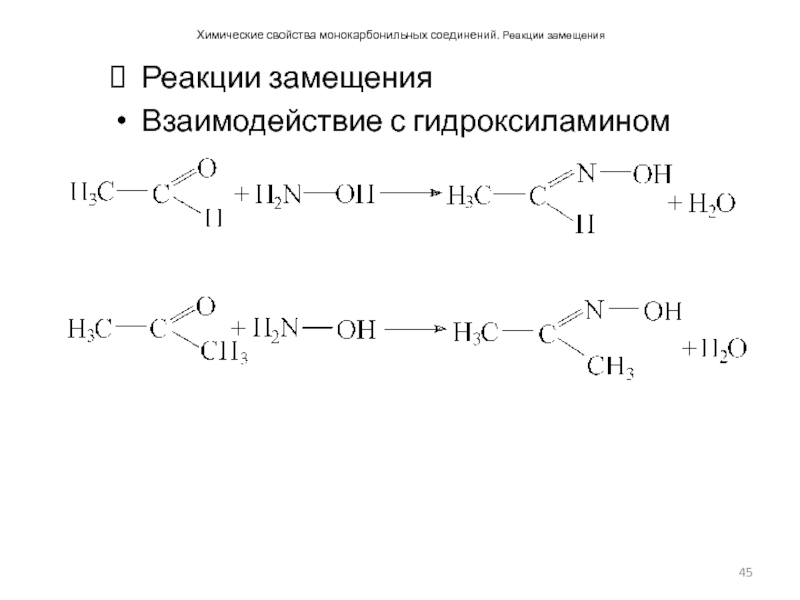
Слайд 45Химические свойства монокарбонильных соединений. Реакции замещения
Реакции замещения
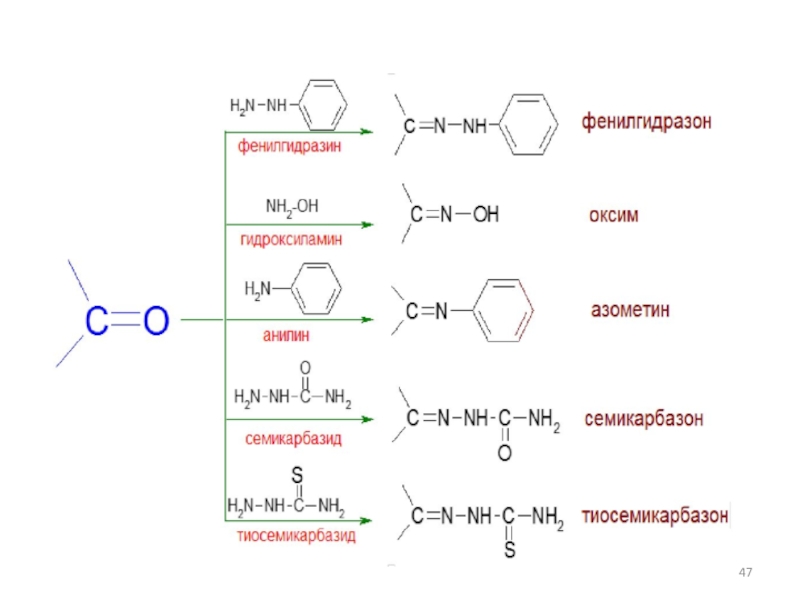
Взаимодействие с гидроксиламином
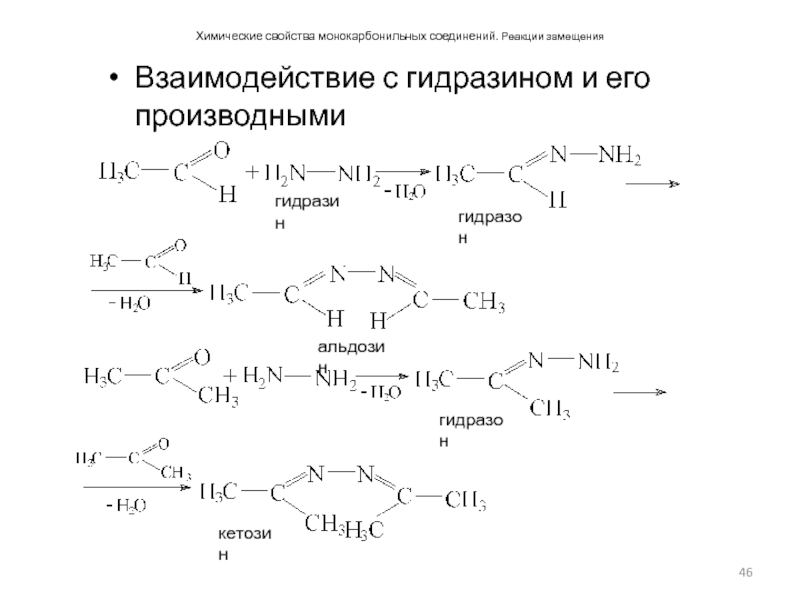
Слайд 46Химические свойства монокарбонильных соединений. Реакции замещения
Взаимодействие с гидразином и его производными
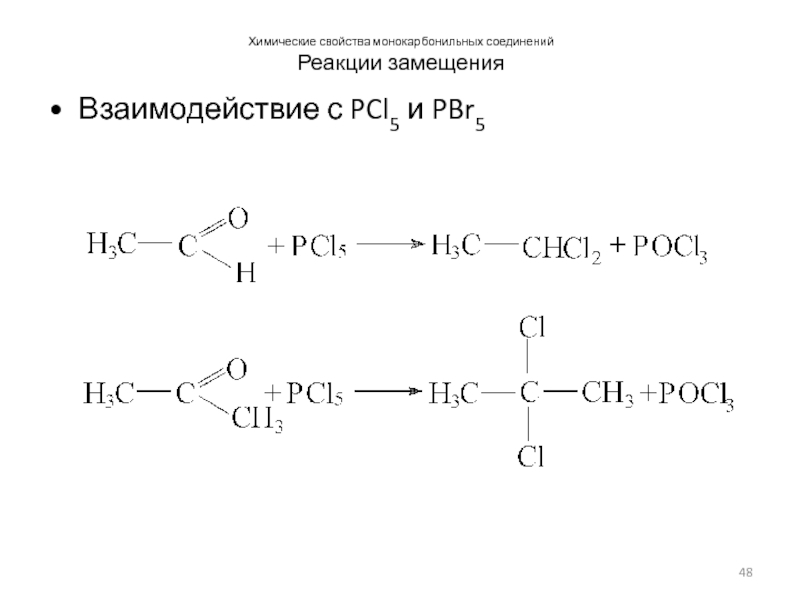
Слайд 48Химические свойства монокарбонильных соединений
Реакции замещения
Взаимодействие с PCl5 и PBr5
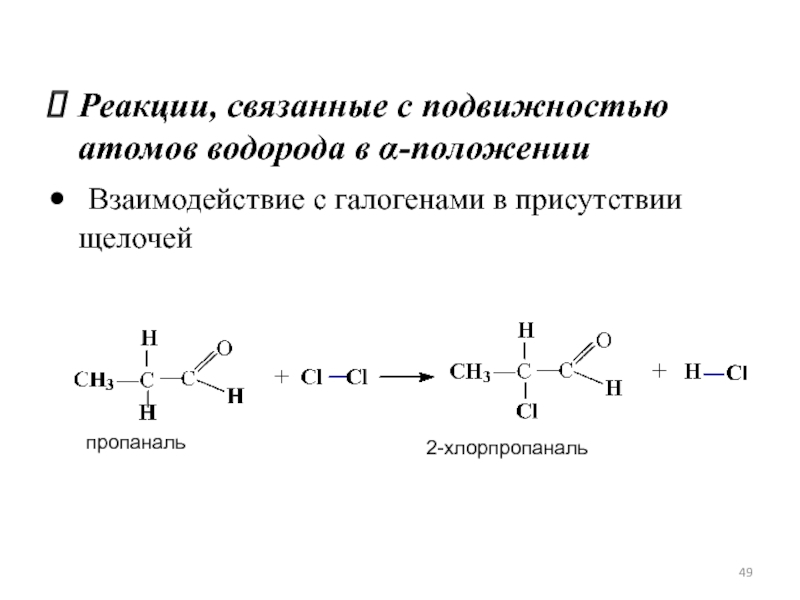
Слайд 49Реакции, связанные с подвижностью атомов водорода в α-положении
Взаимодействие с галогенами в
Слайд 50Химические свойства монокарбонильных соединений. Присоединение по двойной связи
Конденсация (уплотнение)
Альдольная конденсация
Реакция характерна
Слайд 51Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение)
Кротоновая конденсация
Продукты
Слайд 52Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение)
Кротоновая конденсация
Своё
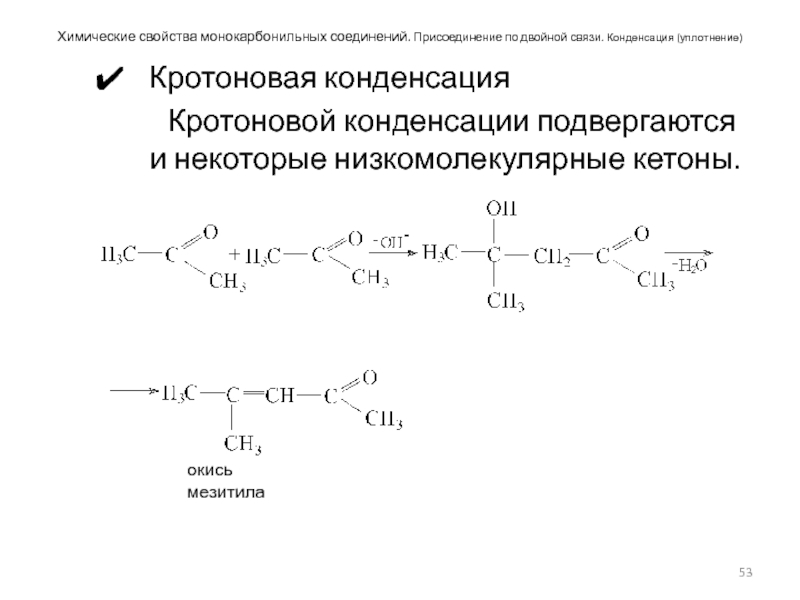
Слайд 53Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение)
Кротоновая конденсация
Кротоновой
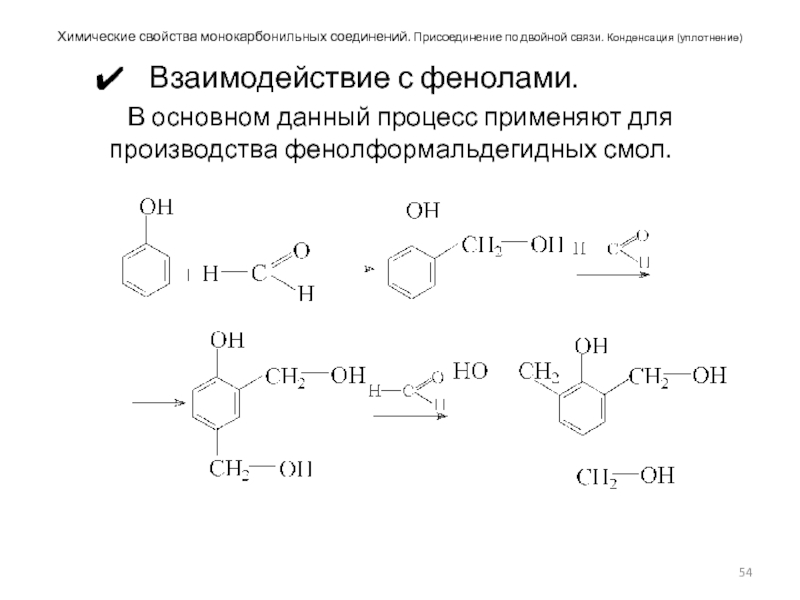
Слайд 54Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение)
Взаимодействие с
В основном данный процесс применяют для производства фенолформальдегидных смол.
Слайд 55Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение) Взаимодействие
При нагревании фенолспирты конденсируются с образованием различных продуктов.
Слайд 57Химические свойства монокарбонильных соединений
Окисление
Реакция Канницаро
В щелочных растворах при нагревании альдегиды диспропорционируют
Слайд 58Химические свойства монокарбонильных соединений. Окисление
Реакция Тищенко
В присутствии алкоголятов алюминия альдегиды диспропорционируют
Слайд 59Химические свойства монокарбонильных соединений. Окисление
Взаимодействия с окислителями
В альдегиды окисляются даже слабыми
Реакция серебряного зеркала
Слайд 60Химические свойства монокарбонильных соединений. Окисление
Взаимодействия с окислителями
В альдегиды окисляются даже слабыми
Реакция с реактивом Фелинга
Слайд 61Химические свойства монокарбонильных соединений. Окисление. Взаимодействия с окислителями
Реакция с реактивом Фелинга
Слайд 62Химические свойства монокарбонильных соединений. Окисление. Взаимодействия с окислителями
Кетоны окисляются только сильными
Слайд 64Формальдегид. Метаналь.
( formīca «муравей») — бесцветный газ с резким запахом, хорошо растворимый
Иррита́нты — группа веществ (слезоточивого или раздражающего действия), вызывающих раздражительные реакции при попадании на слизистые и кожу, и воздействии на дыхательные пути (респираторный эффект).
Слайд 65Метаналь применяют для производства фенолоформальдегидных пластмасс и многих лекарственных препаратов, например
Слайд 66Раствор формальдегида в воде называют формалином, его используют для хранения биопрепаратов,
Слайд 67Уксусный альдегид
(этаналь, ацетальдегид)
Бесцветная жидкость с резким запахом, хорошо растворяется в
Ацетальдегид токсичен при действии на кожу, ирритант и, возможно, канцероген.
Он является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Образуется при термической обработке полимеров и пластиков.
Слайд 68Акролеин
Вследствие своей высокой реакционной способности акролеин является токсичным, сильно раздражающим слизистые
Акролеин является одним из продуктов термического разложения глицерина и жиров-глицеридов, чем объясняется раздражающие слизистые оболочки свойства дыма горелых жиров.
Слайд 69Ацетон
Ацето́н — простейший представитель кетонов. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Полностью смешивается с водой
Ацетон хорошо растворяет многие органические вещества ( ацетилцеллюлозу, воск, резину и др.), а также ряд солей(хлорид кальция, иодид калия)
Слайд 70В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс,
Он также применяется в производстве смазочных масел и изготовлении искусственного шелка и синтетической кожи.
В химической промышленности ацетон является промежуточным химическим соединением при производстве многих химикатов, таких как кетен, уксусный ангидрид, метиловый метакрилат, изофорон, хлороформ, йодоформ и витамин С.
Слайд 71Опасность для здоровья!!!
Кетоны - легковоспламеняющиеся вещества, а наиболее летучие представители этого
Обычно кетоны быстро выводятся из организма, главным образом, вместе с выдыхаемым воздухом. Их метаболизм включает процесс окислительной гидроксилизации, а затем восстановления до вторичного спирта.
Высокие концентрации кетонов при ингаляции обладают наркотическим воздействием. В более низких концентрациях они способны вызвать тошноту, рвоту и раздражение глаз и респираторной системы.