- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кальций туралы презентация
Содержание
- 1. Кальций туралы
- 2. Кальций IV период, II топтың негізгі топшасының
- 3. Табиғатта таралуы сульфаттар CaS04• 2Н20 ғаныш,
- 4. Физикалық қасиеттері Кальций ақ түсті, жеңіл
- 5. Химиялық қасиеттері Кальций белсенді металл болғандықтан көптеген
- 6. Күрделі заттармен Ca + 2НОН =
- 7. Оттекпен оңай әрекеттесіп, қыздырғанда жанады. Металлоидтармен тікелей
- 8. Кальцийдің қосылыстары Кальций оксиді — ақ
- 9. Кальций оксиді — нағыз негіздік оксид. Кальций
- 10. Кальцийдің қоспалары табиғатта кең таралған. Кальций қосылыстарының
- 11. Қолданылуы Калций инертті газды тазартып болат,
- 12. Назарларыңызға рахмет!!! IKAZ.KZ - ашық мәліметтер порталы
Слайд 2Кальций IV период, II топтың негізгі топшасының элементі. Реттік немірі 20,
IKAZ.KZ - ашық мәліметтер порталы
Слайд 3Табиғатта таралуы
сульфаттар CaS04• 2Н20 ғаныш,
карбонаттар - СаС03, доломит СаС03 • 2MgC03;
фосфаттары
IKAZ.KZ - ашық мәліметтер порталы
Слайд 4Физикалық қасиеттері
Кальций ақ түсті, жеңіл (р=1,55 г/см3), сілтілік металдардан қаттырақ зат,
Ат. н. 20; ат. м. 40,08; балқу t 842°С; қайнау t 1495°С тығыздығы 1,55 г/см2. Кальцийді 1808 жылы ағылшын ғалымы Г.Дэви ашқан. Түсі күмістей ақ, жеңіл металл, белгілі изотоптары 14, табиғи изотоптары 6. Негізгі минералдары: кальцит, ангидрит, гипс, флюорит, апатит, т.б.
IKAZ.KZ - ашық мәліметтер порталы
Слайд 5Химиялық қасиеттері
Кальций белсенді металл болғандықтан көптеген реакцияларға түседі.
Жай заттармен
Са + Н2 =
Са + Сl2 = СаСl2 кальций хлориді
2Са + О2 = 2СаО кальций оксиді
6Са + 2N2СаN кальций нитриді
Ca + 2С =СаС2 кальций карбиді
IKAZ.KZ - ашық мәліметтер порталы
Слайд 6Күрделі заттармен
Ca + 2НОН = Са(ОН)2 + Н2↑
Ca + 2HCl=СаСl2 +
Осы реакциялардың барлығында кальций - тотықсыздандырғыш.
IKAZ.KZ - ашық мәліметтер порталы
Слайд 7Оттекпен оңай әрекеттесіп, қыздырғанда жанады. Металлоидтармен тікелей әрекеттеседі. Кальций металын өнеркәсіпте
электролиз әдісімен алу үшін балқыған Калций хлориді (CaCl2) арқылы тұрақты ток жіберіп, катодта таза Калций металын алады;
екінші әдіс Al не Mg ұнтағының әктаспен аралас қоспасын вакумда 1100 – 1200°С-та қыздыру арқылы алады. Калций көмегімен уран, торий, ванадий, хром, цирконий, бериллий, тантал сияқты қиын балқитын, сирек те шашыранды, ілеспе металдарды тотықсыздандырып өндіреді.
IKAZ.KZ - ашық мәліметтер порталы
Слайд 8Кальцийдің қосылыстары
Кальций оксиді — ақ түсті қиын балқитын зат. Техникада оны
СаС03 =t= СаО + СО2↑- 180кДж
IKAZ.KZ - ашық мәліметтер порталы
Слайд 9Кальций оксиді — нағыз негіздік оксид. Кальций сілтілікжер металл болғандықтан, оның
СаО + Н20 = Са(ОН)2 + 70 кДж
Бұл реакция өте қуатты жүреді, су бұрқылдап "қайнап" жатады, тіпті біразы буланады. Нөтижесінде, сөндірілген әк деп аталатын көпсіген кеуек ақ ұнтақ түзіледі. Кальций гидроксиді суда аз ериді. Оның қанық ерітіндісі лабораторияда әк суы деген атпен жиі колданылады.
IKAZ.KZ - ашық мәліметтер порталы
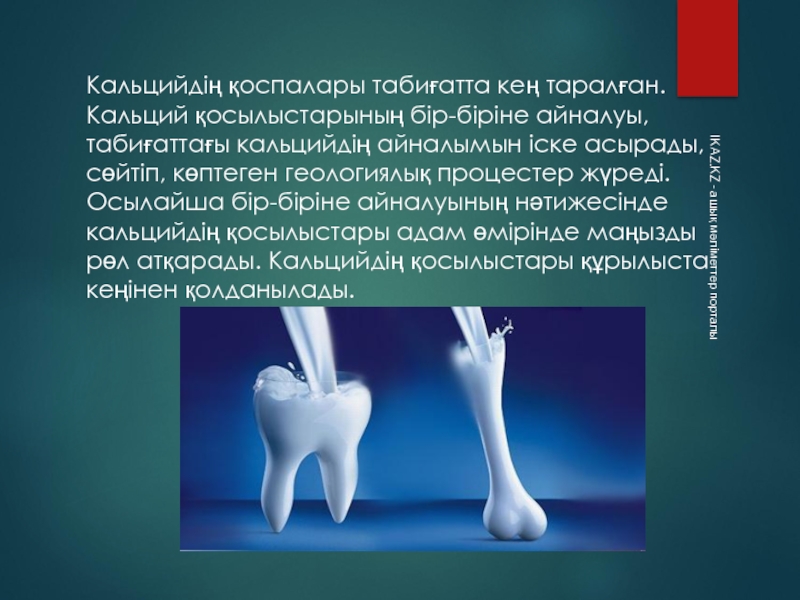
Слайд 10Кальцийдің қоспалары табиғатта кең таралған. Кальций қосылыстарының бір-біріне айналуы, табиғаттағы кальцийдің
IKAZ.KZ - ашық мәліметтер порталы
Слайд 11Қолданылуы
Калций инертті газды тазартып болат, никель, мыс, т.б. металдарды балқыту үшін
IKAZ.KZ - ашық мәліметтер порталы