- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Качественный анализ (часть 1) презентация
Содержание
- 1. Качественный анализ (часть 1)
- 2. Техника безопасности Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 3. Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 4. Что такое качественный анализ? Качественный анализ –
- 5. Аналитическая реакция - это реакция, которая сопровождается
- 6. Реакции ионного обмена BaCl2 + Na2SO4 =
- 8. Катионы Катионы I аналитической группы (Pb2+, Hg22+)
- 9. Катионы OH– OH– NH3 Катионы V аналитической
- 10. Качественная реакция на Pb2+ Pb2+ + 2Cl-
- 11. Качественная реакция на Ba2+ Pb2+ + 2Cl-
- 12. Как распознать Cu2+? Cu2+ + 2NH3·H2O +
- 13. Как распознать Ni2+? Ni2+ + 2NH3·H2O =
- 14. Соединения никеля Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 15. Как распознать Fe3+? Способ 1 К анализируемому
- 16. Как распознать Fe3+? Способ 2 К анализируемому
- 17. Как распознать NH4+? К анализируемому раствору добавить
- 18. Индикаторы Кислая среда H+: водные растворы кислот
- 19. Индикаторы Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
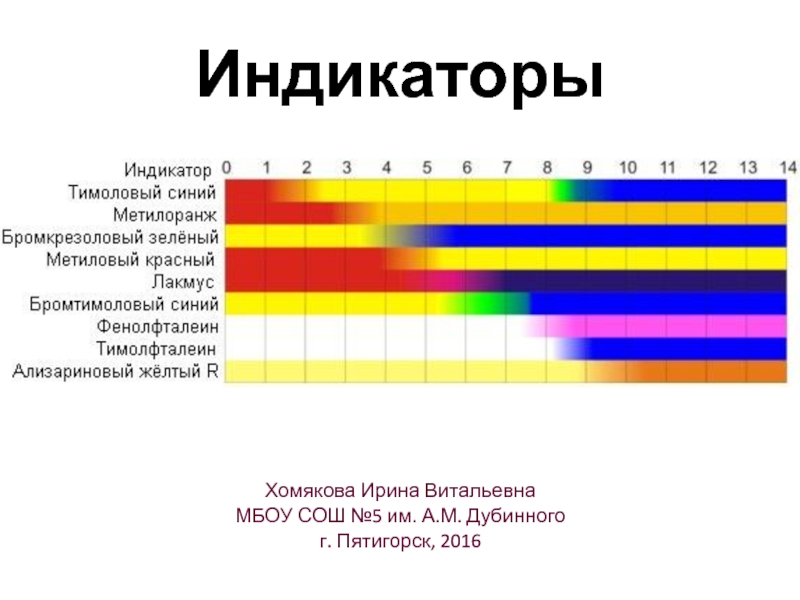
- 20. Метилоранж pH > 7 pH < 7 Фенолфталеин pH > 7
- 21. Кислоты HCl (соляная) H2SO4 (серная)
Слайд 1Качественный анализ
Часть 1
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г.
Слайд 2Техника безопасности
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск,
Слайд 4Что такое качественный анализ?
Качественный анализ – это идентификация (обнаружение) компонентов анализируемых
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 5Аналитическая реакция - это реакция, которая сопровождается каким-либо внешним эффектом (образование
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 6Реакции ионного обмена
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Хомякова Ирина Витальевна
МБОУ
г. Пятигорск, 2016
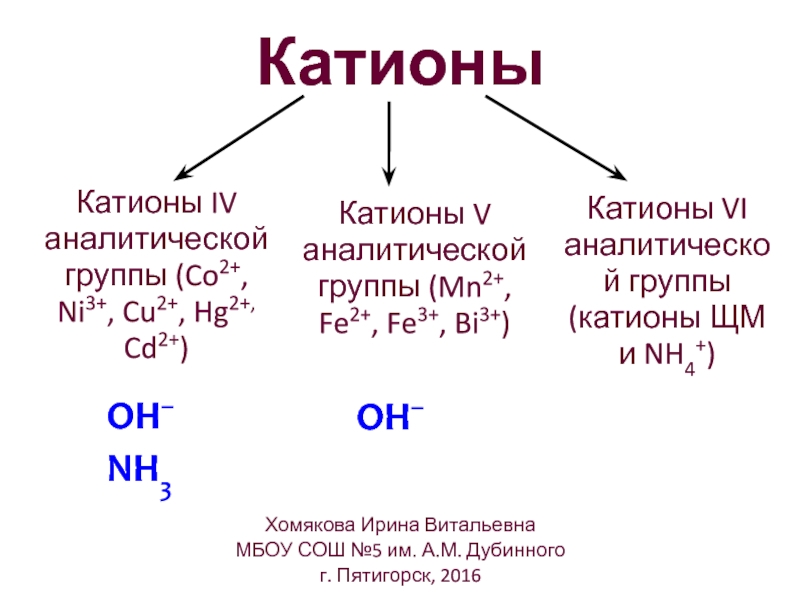
Слайд 8Катионы
Катионы I аналитической группы (Pb2+, Hg22+)
Катионы II аналитической группы (Ca2+, Sr2+,
SO42 –
Hal –
Катионы III аналитической группы (Zn2+, Al3+, Cr3+)
OH–
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 9Катионы
OH–
OH–
NH3
Катионы V аналитической группы (Mn2+, Fe2+, Fe3+, Bi3+)
Катионы VI аналитической группы
Катионы IV аналитической группы (Co2+, Ni3+, Cu2+, Hg2+, Cd2+)
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 10Качественная реакция на Pb2+
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- =
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Pb2+ + 2I– = PbI2↓
К анализируемому раствору добавить р-р NaI или KI
Если выпал золотистый осадок, то в анализируемом растворе был Pb2+
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 11Качественная реакция на Ba2+
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- =
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Ba2+ + SO42– = BaSO4↓
К анализируемому раствору добавить р-р Na2SO4 (K2SO4)
Если выпал белый осадок, то в анализируемом растворе был Ba2+
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 12Как распознать Cu2+?
Cu2+ + 2NH3·H2O + SO42- = Cu2(OH)2SO4↓+ 2NH4+
Cu2(OH)2SO4 +
К анализируемому раствору добавить р-р NaOH или KOH
Если выпал голубой осадок, то к нему добавить водный NH3
Если р-р стал синий, то в нем есть Cu2+
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 13Как распознать Ni2+?
Ni2+ + 2NH3·H2O = Ni(OH)2↓ + 2NH4+
Ni(OH)2 + 6NH3·H2O
К анализируемому раствору добавить избыток NH3 (водн)
Если р-р стал фиолетовый, то в нем есть Ni2+
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 15Как распознать Fe3+?
Способ 1
К анализируемому раствору добавить р-р NaOH или KOH
Если
Fe3+ + 3OH– = Fe(OH)3↓
бурый
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 16Как распознать Fe3+?
Способ 2
К анализируемому раствору добавить р-р KSCN
Если раствор
Fe3+ + 3SCN– = Fe(SCN)3
красный
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 17Как распознать NH4+?
К анализируемому раствору добавить избыток водного раствора NaOH или
Нагреть полученный раствор
Если появился запах аммиака, то в исходном растворе был NH4+
NH4+ + OH– = NH3↑ + H2O
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 18Индикаторы
Кислая среда H+: водные растворы кислот
Щелочная среда ОH–: водные растворы щелочей
Хомякова
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 21Кислоты
HCl (соляная)
H2SO4 (серная)
HNO3 (азотная)
H3PO4 (ортофосфорная)
CH3COOH (уксусная)
Щелочи
NaOH (гидроксид
KOH (гидроксид калия)
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016









![Как распознать Cu2+?Cu2+ + 2NH3·H2O + SO42- = Cu2(OH)2SO4↓+ 2NH4+Cu2(OH)2SO4 + 4NH3·H2O = [Cu(NH3)4]2+ +](/img/tmb/4/341276/e59ade89d6da048abdda157e664fca5a-800x.jpg)
![Как распознать Ni2+?Ni2+ + 2NH3·H2O = Ni(OH)2↓ + 2NH4+Ni(OH)2 + 6NH3·H2O = [Ni(NH3)6]2+ + 2OH-К](/img/tmb/4/341276/bab274d5158ca52a2eb2d6c47e0db1e4-800x.jpg)