- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Качественные реакции на функциональные группы презентация
Содержание
- 1. Качественные реакции на функциональные группы
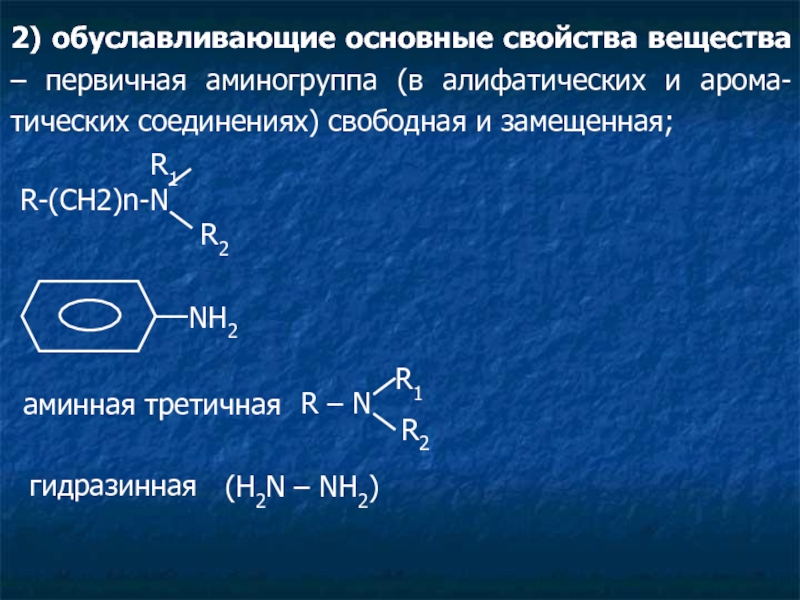
- 2. Функциональная группа – это атом или группа
- 3. Классификация функциональных групп 1) обуславливающие кислые
- 5. 3) не проявляют ни кислые, ни основные
- 6. C2H5OH + CH3COOH
- 7. II. Гидроксильная группа – фенольная. Лекарственные средства,
- 8. III. Карбонильная группа – альдегидная. Лекарственные
- 9. Образование ауринового красителя (раствор формальдегида).
- 10. Реакция с жидкостью Фелинга R–C–H + 2NaOOC–CH–CH–COOК
- 11. IV. Карбоксильная группа Ацетаты 1) CH -
- 12. Бензоаты. Лекарственные
- 13. Салицилаты. Лекарственные средства: салициловая кислота;
- 15. Н2С — СООNa 2 НOС —
- 16. никотиновая кислота N
- 17. V. Простые эфиры (R – O –
- 18. VI сложноэфирная группа COOH
- 19. CH - C = O + H
- 20. VII. Амины ароматические первичные (R – NH2)
- 21. Реакция образования азокрасителя Препарат растворяют в
- 22. VIII. Имидная группа (–NH–) NH2
- 23. VIII Имидная группа. Сульфаниламидные препараты, барбитураты,
- 24. Кислотно-основное титрование в неводных средах Определяют вещества,
- 25. МЕТОД НЕВОДНОГО ТИТРОВАНИЯ Классификация растворителей Амфитропные или
- 26. 3) Протофильные или основные: NH3, H2N-NH2, H2N(CH2)2NH2,
- 27. Преимущество метода кислотно-основного титрования в неводных средах
- 28. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОСНОВАНИЙ И ИХ СОЛЕЙ.
- 29. Реакция нейтрализации сопровождается образо-ванием молекул того растворителя,
- 30. 2 R – N+ – CH3 CH3COO-
- 31. Суммарно: 2 R – N –
- 32. ОПРЕДЕЛЕНИЕ КИСЛОТ. Определение фармакопейных
- 33. HO N N
- 34. O O
Слайд 2 Функциональная группа – это атом или группа атомов неуглеводородного характера, которые
Функциональные группы обуславливают:
свойства веществ;
характер реакций идентификации;
методов количественного определения.
Слайд 3Классификация функциональных групп
1) обуславливающие кислые свойства вещества:
карбоксильная (-СООН);
имидная
енольная [C=C(OH)];
ендиольная (-С = С-);
фенольный гидроксил
ОН
ОН
ОН
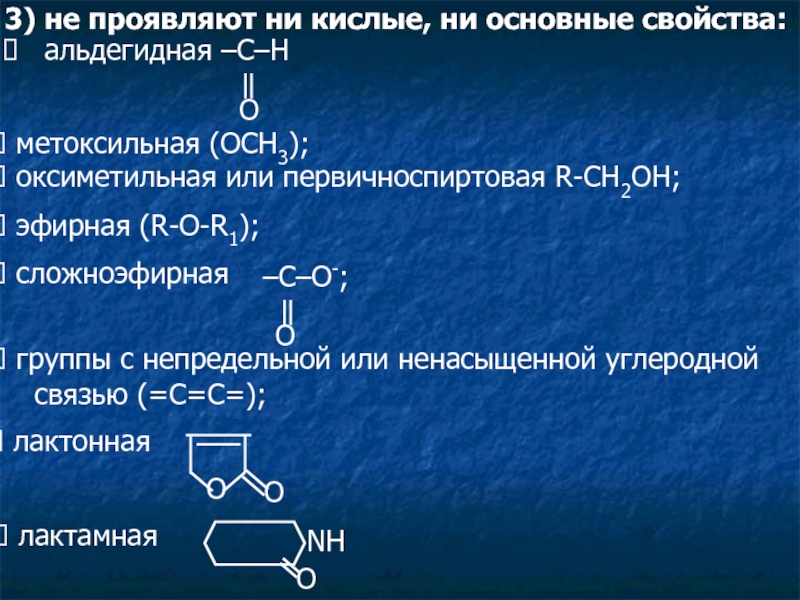
Слайд 53) не проявляют ни кислые, ни основные свойства:
метоксильная (ОСН3);
оксиметильная или первичноспиртовая R-CH2OH;
эфирная (R-O-R1);
сложноэфирная
–C–O-;
группы с непредельной или ненасыщенной углеродной
связью (=С=С=);
лактонная
O
O
лактамная
O
NH
Слайд 6C2H5OH + CH3COOH
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА
ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
I. Гидроксильная группа – спиртовая (одно-атомные спирты).
Образование сложного эфира:
H2SO4 конц.
этилацетат с характерным запахом
Слайд 7II. Гидроксильная группа – фенольная.
Лекарственные средства, содержащие фено-льную группу:
салициловая кислота;
салицилат натрия;
резорцин;
адреналин;
пиридоксин;
морфин.
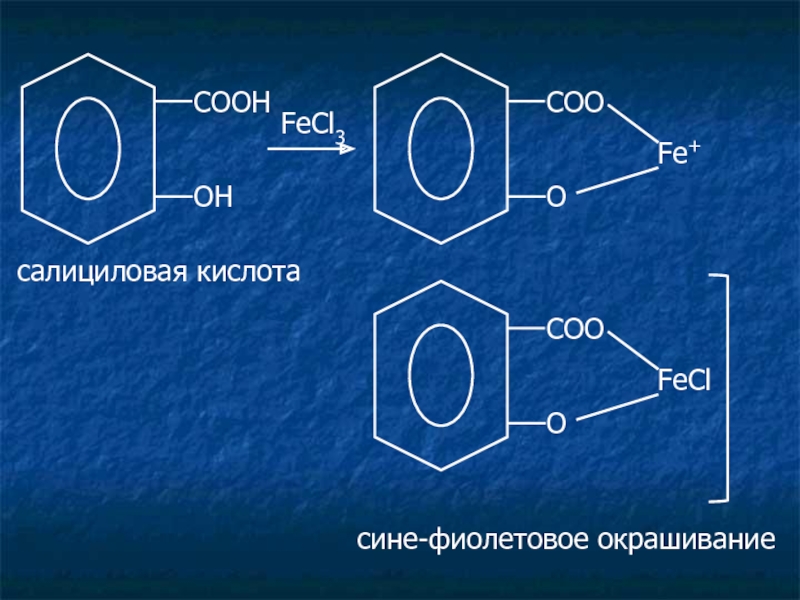
C6H5OH + FeCl3 C6H5OFeCl2 + HCl
Слайд 8III. Карбонильная группа – альдегидная.
Лекарственные средства:
глюкоза;
раствор формальдегида.
Реакция «серебряного зеркала»
AgNO3
2[Ag(NH3)2]OH + R–C–H → 2Ag↓ + R –C– OH + 4NH3↑+ H2O
t
серый осадок
или «зеркало»
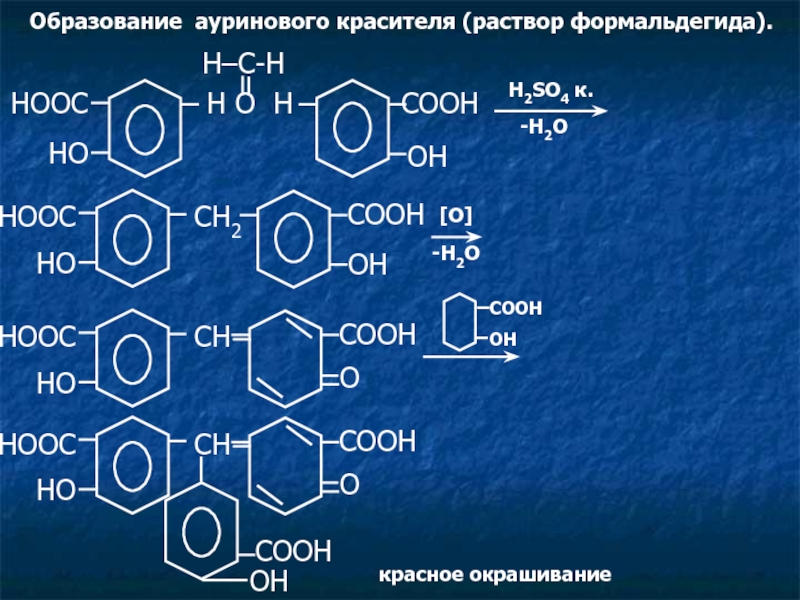
Слайд 9Образование ауринового красителя (раствор формальдегида).
HOOC
HO
O
COOH
OH
COOH
красное окрашивание
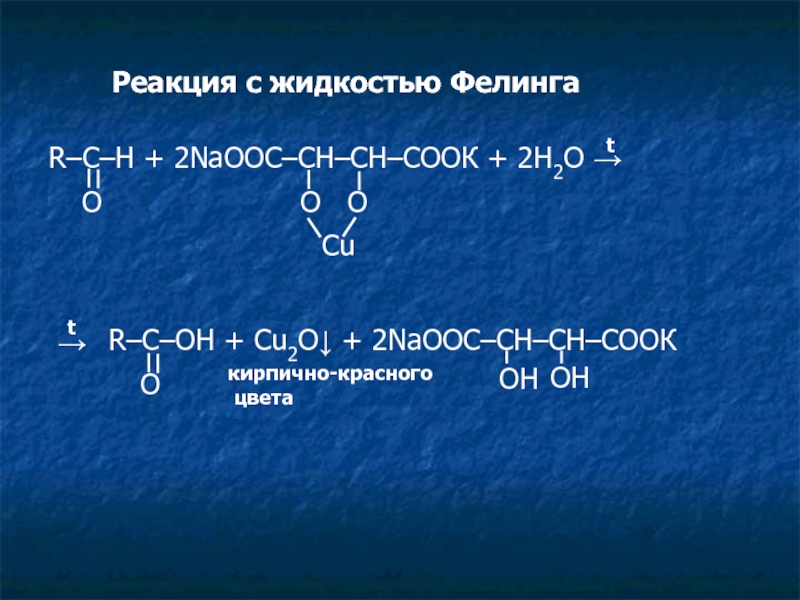
Слайд 10Реакция с жидкостью Фелинга
R–C–H + 2NaOOC–CH–CH–COOК + 2H2O →
O
O O
Cu
t
O
OH
OH
кирпично-красного
R–C–OH + Cu2O↓ + 2NaOOC–CH–CH–COOК
→
t
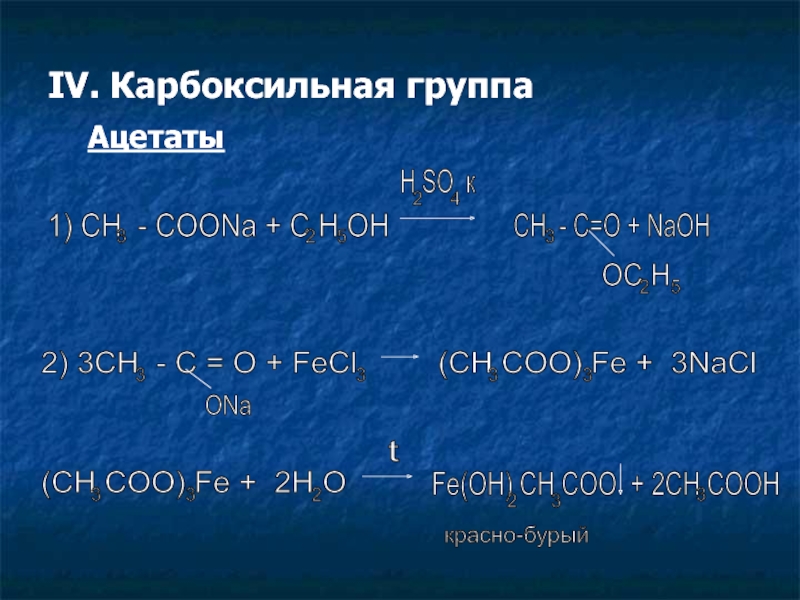
Слайд 11IV. Карбоксильная группа
Ацетаты
1) CH - COONa + C H OH
3
2
5
H SO к
2
4
CH - C=O + NaOH
3
OC H
2
5
2) 3CH - C = O + FeCl
3
ONa
3
(CH COO) Fe + 3NaCl
3
3
(CH COO) Fe + 2H O
3
3
2
t
Fe(OH) CH COO + 2CH COOH
2
3
3
красно-бурый
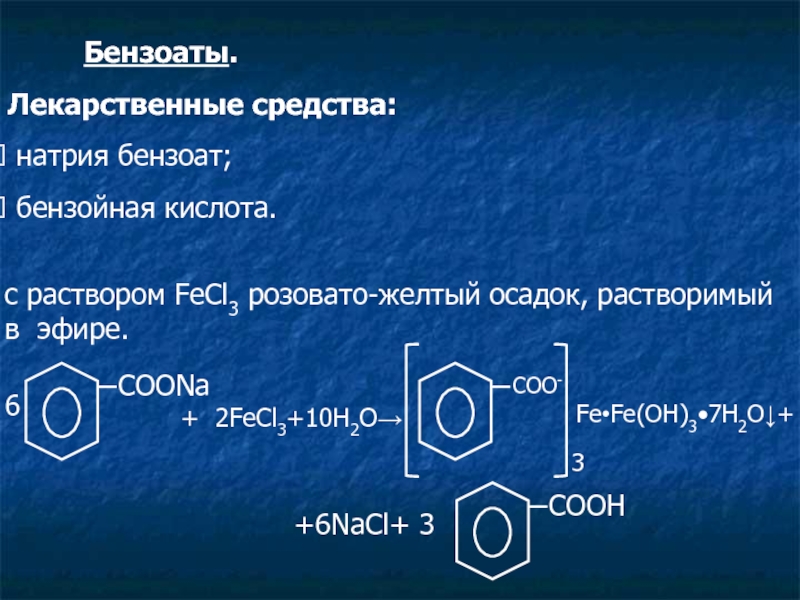
Слайд 12 Бензоаты.
Лекарственные средства:
натрия бензоат;
бензойная кислота.
c
6
COONa
+ 2FeCl3+10H2O→
COO-
3
Fe•Fe(OH)3•7H2O↓+
+6NaCl+ 3
COOH
Слайд 13Салицилаты.
Лекарственные средства:
салициловая кислота;
натрия салицилат.
c раствором FeCl3 появляется сине-фиолетовое или
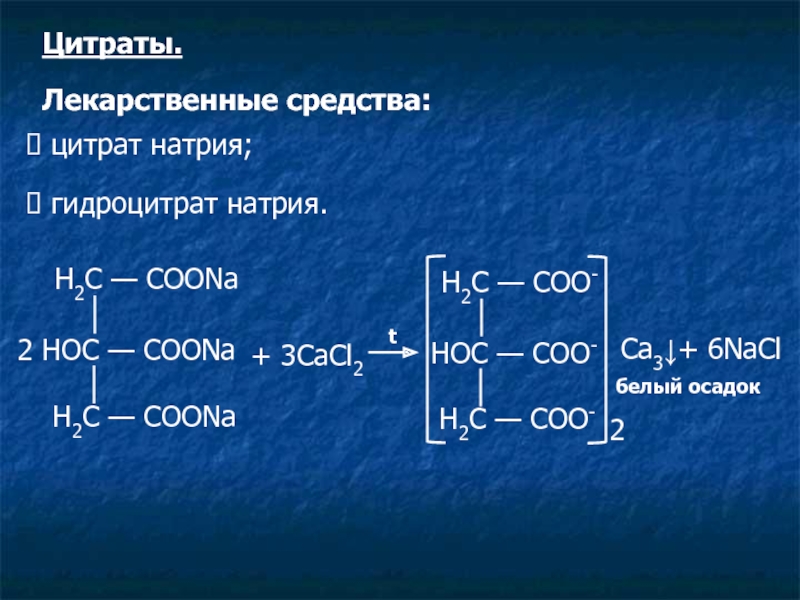
Слайд 15Н2С — СООNa
2 НOС — СООNa
Н2С — СООNa
+
t
Н2С — СОО-
НOС — СОО-
Н2С — СОО-
2
Ca3↓+ 6NaCl
белый осадок
Цитраты.
Лекарственные средства:
цитрат натрия;
гидроцитрат натрия.
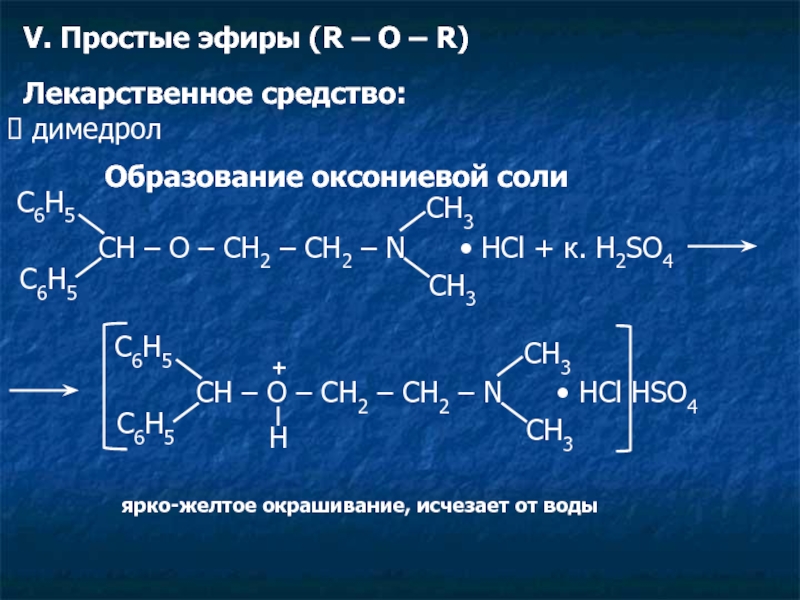
Слайд 17V. Простые эфиры (R – O – R)
Лекарственное средство:
димедрол
Образование оксониевой
CH – O – CH2 – CH2 – N • HСl + к. H2SO4
C6H5
C6H5
CH3
CH3
CH – O – CH2 – CH2 – N • HСl HSO4
C6H5
C6H5
CH3
CH3
+
H
ярко-желтое окрашивание, исчезает от воды
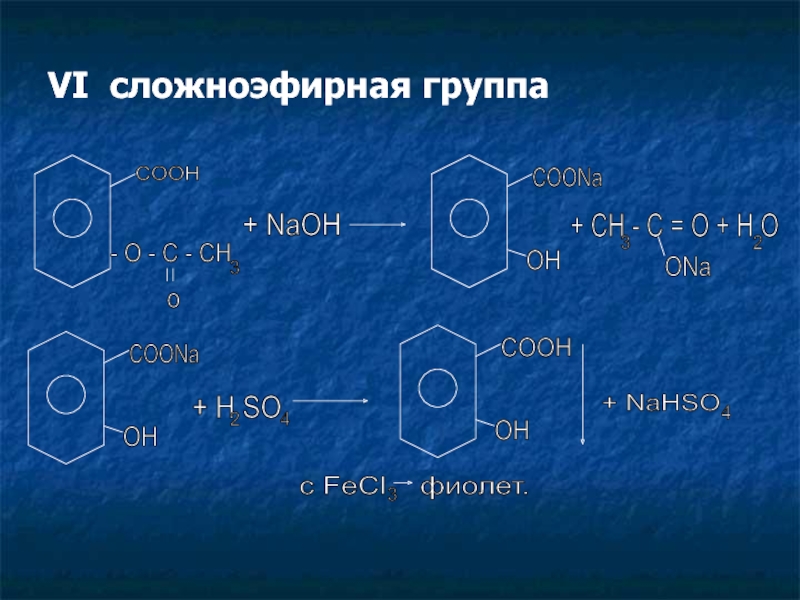
Слайд 18VI сложноэфирная группа
COOH
- O - C - CH
3
o
+ NaOH
COONa
OH
+ CH - C = O + H O
3
ONa
2
COONa
OH
+ H SO
2
4
COOH
OH
+ NaHSO
4
с FeCl фиолет.
3
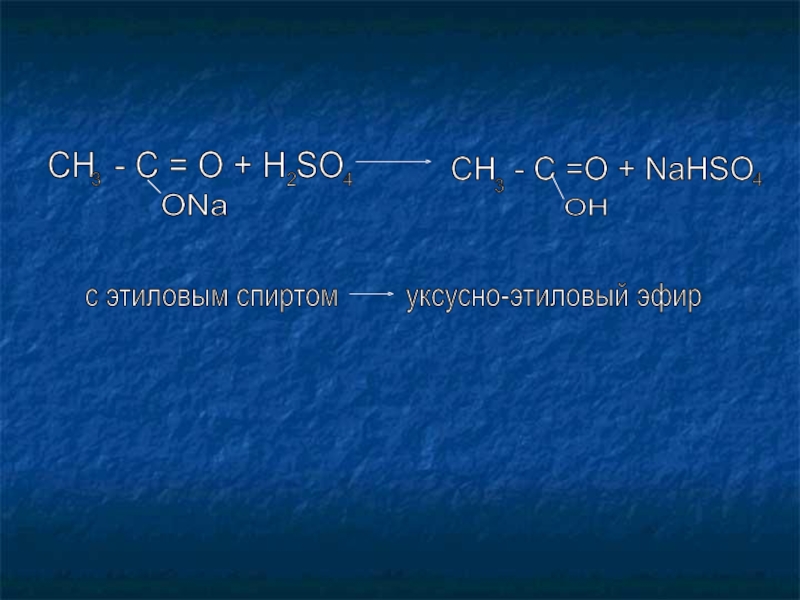
Слайд 19CH - C = O + H SO
3
ONa
2
4
CH - C =O + NaHSO
3
4
OH
с этиловым спиртом уксусно-этиловый эфир
Слайд 20VII. Амины ароматические первичные (R – NH2)
Лекарственные средства:
анестезин;
новокаин;
стрептоцид;
сульфацил натрия;
натрия пара-аминосалицилат.
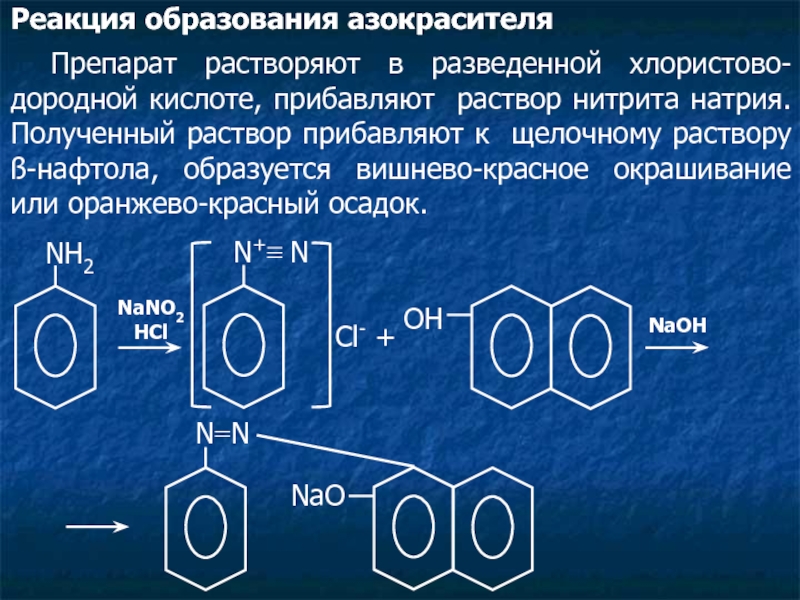
Слайд 21Реакция образования азокрасителя
Препарат растворяют в разведенной хлористово-дородной кислоте, прибавляют раствор нитрита
NH2
NaNO2
HCl
N+≡ N
Cl- +
ОН
NaOH
N=N
NaO
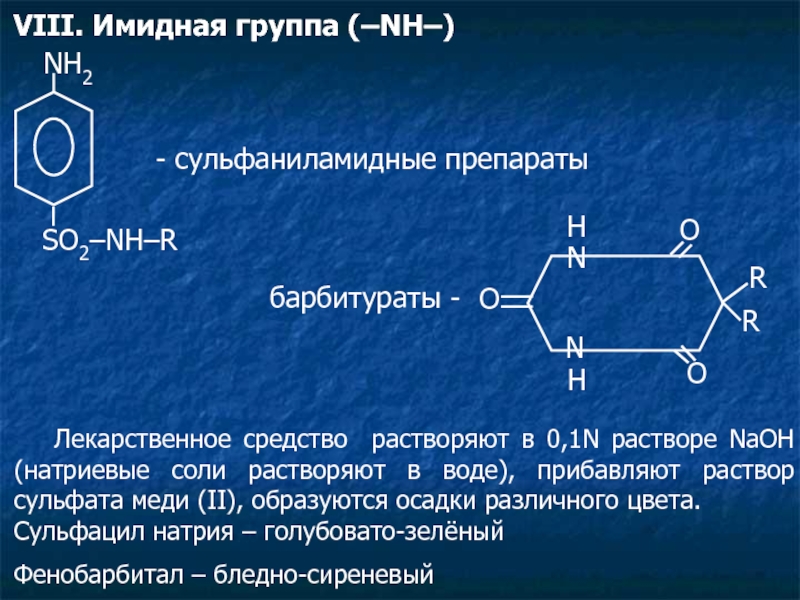
Слайд 22VIII. Имидная группа (–NH–)
NH2
SO2–NH–R
- сульфаниламидные препараты
O
N
N
O
R
R
O
H
H
барбитураты -
Лекарственное средство растворяют в 0,1N растворе NaOH (натриевые соли растворяют в воде), прибавляют раствор сульфата меди (II), образуются осадки различного цвета.
Сульфацил натрия – голубовато-зелёный
Фенобарбитал – бледно-сиреневый
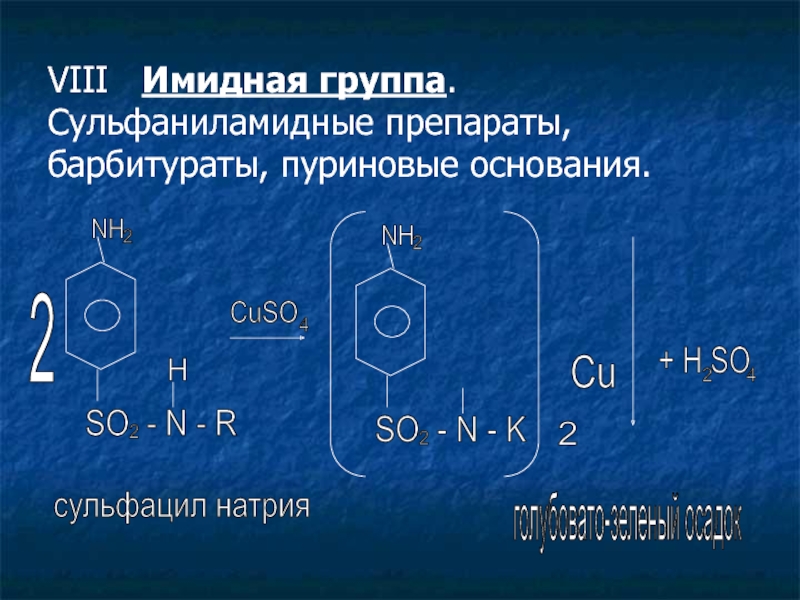
Слайд 23VIII Имидная группа. Сульфаниламидные препараты, барбитураты, пуриновые основания.
2
NH
2
SO - N - R
2
H
CuSO
4
NH
2
SO - N - K
2
2
Cu
+ H SO
2
4
сульфацил натрия
голубовато-зеленый осадок
Слайд 24Кислотно-основное титрование в неводных средах
Определяют вещества, которые в водной среде невозможно
Из-за плохой растворимости
Нечеткий переход окраски индикатора
Из-за нейтрального характера солей
Слайд 25МЕТОД НЕВОДНОГО ТИТРОВАНИЯ
Классификация растворителей
Амфитропные или амфотерные:
H2O, CH3OH, C2H5OH и другие.
Эти
отношению к кислотам и роль кислоты по отношению к
основаниям.
2) Протогенные или кислотные:
HF, H2SO4, HCOOH, CH3COOH и другие вещества
кислотного характера.
Молекулы протогенных растворителей склонны
отдавать свои протоны и превращаться в основания:
HF + C2H5OH → C2H5OH2+ + F-
Слайд 263) Протофильные или основные:
NH3, H2N-NH2, H2N(CH2)2NH2, HCON(CH3)2 и другие вещества основного
Молекулы протофильных растворителей отличаются большим сродством к протону и поэтому легко присое-диняют протоны:
HCON(CH3)2 + CH3COOH ⮀ [HCONH(CH3)2]+ + СН3СОО-
4) Апротонные или апротные:
C2H6, C6H12, CCl4 и другие вещества нейтрального характера, молекулы которых не способны ни отдавать, ни присоединять протоны, т.к. молекулы апротонных растворителей не диссоциированы.
Слайд 27 Преимущество метода кислотно-основного титрования в неводных средах состоит и в том,
Слайд 28ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОСНОВАНИЙ
И ИХ СОЛЕЙ.
HClO4 + CH3COOH →
кислота основание ион ацетония
Ацетат-ионы, обуславливающие в безводной уксусной кислоте щелочность раствора, нейтрализуются ионами ацетония, обуславливающими в том же растворителе кислотность раствора:
CH3COO- + CH3COOH2+ → 2CH3COOH
Слайд 29 Реакция нейтрализации сопровождается образо-ванием молекул того растворителя, в среде которого протекает
1) HClO4 + 2CH3COOH → 2CH3COOH2+ + 2ClO4-
ацетоний
2) 2 R – N – CH3 · HCl + Hg(CH3COO)2
CH3COOH
2 R – N+ – CH3 CH3COO- + HgСl2
Н+
СН3
СН3
ацетат димедрола
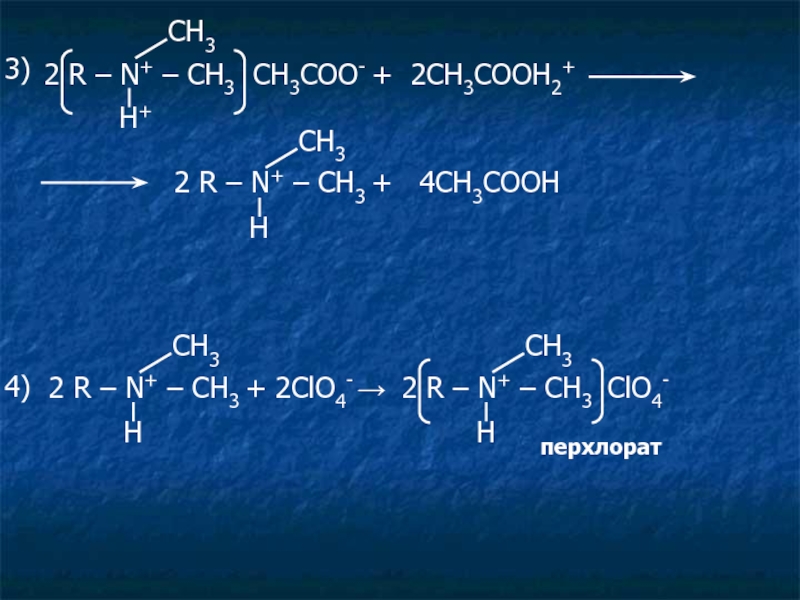
Слайд 302 R – N+ – CH3 CH3COO- + 2CH3COOH2+
Н+
СН3
3)
Н
СН3
2 R
Н
СН3
2 R – N+ – CH3 + 2ClO4- →
4)
Н
СН3
2 R – N+ – CH3 ClO4-
перхлорат
Слайд 31Суммарно:
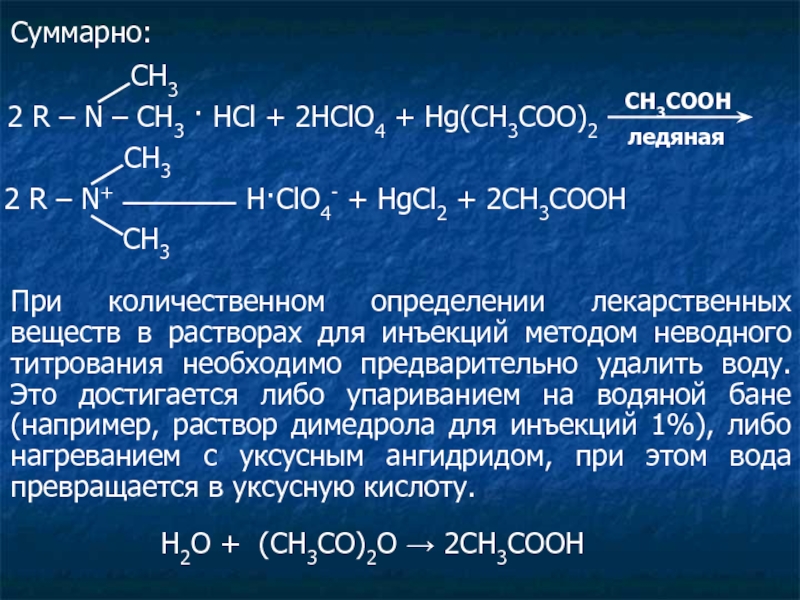
2 R – N – CH3 · HCl + 2HClO4 +
СН3
CH3COOH
ледяная
2 R – N+ H·ClO4- + HgCl2 + 2CH3COOH
СН3
СН3
При количественном определении лекарственных веществ в растворах для инъекций методом неводного титрования необходимо предварительно удалить воду. Это достигается либо упариванием на водяной бане (например, раствор димедрола для инъекций 1%), либо нагреванием с уксусным ангидридом, при этом вода превращается в уксусную кислоту.
Н2О + (СН3СО)2О → 2СН3СООН
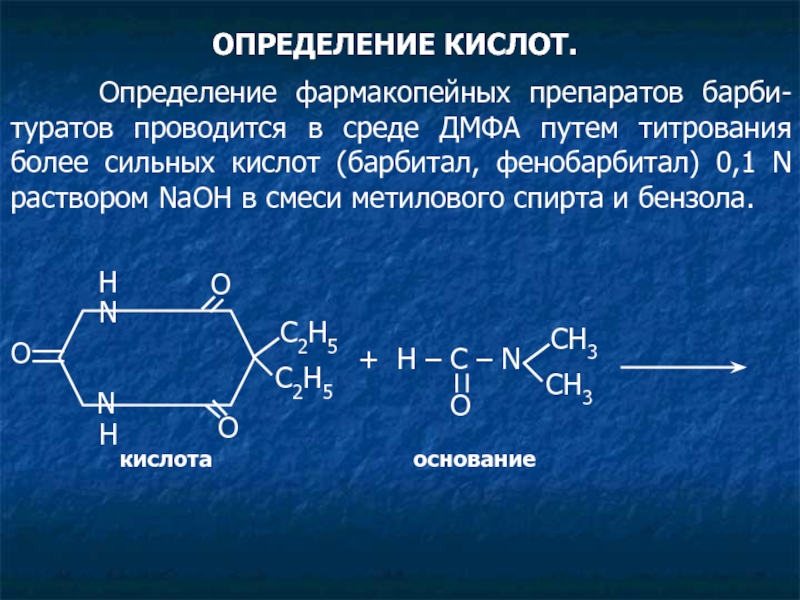
Слайд 32ОПРЕДЕЛЕНИЕ КИСЛОТ.
Определение фармакопейных препаратов барби-туратов проводится в среде
O
N
N
O
С2Н5
O
H
H
С2Н5
+ H – C – N
O
СН3
СН3
кислота основание
Слайд 33
HO
N
N
O
С2Н5
O
H
С2Н5
+ H – C –
O
СН3
СН3
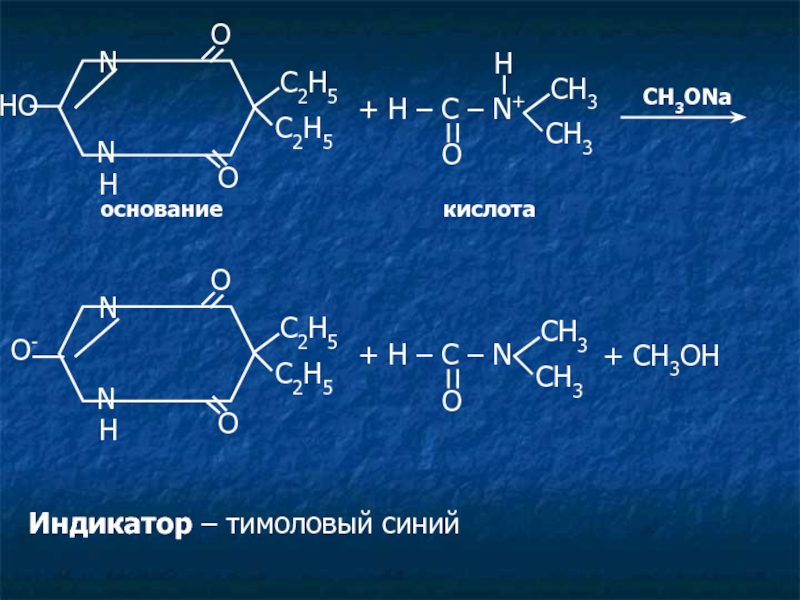
основание кислота
H
CH3ONa
O
Индикатор – тимоловый синий


![Классификация функциональных групп1) обуславливающие кислые свойства вещества: карбоксильная (-СООН); имидная (-NH); енольная [C=C(OH)]; ендиольная (-С](/img/tmb/4/381676/da0b66afcb880d2a328a577587ce07a0-800x.jpg)


![III. Карбонильная группа – альдегидная.Лекарственные средства: глюкоза; раствор формальдегида.Реакция «серебряного зеркала»AgNO3 + 3NH4OH → [Ag(NH3)2]OH +](/img/tmb/4/381676/0394fb5303e71166540898faef51e9d9-800x.jpg)