- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Изотопная геохимия. Изотопы презентация
Содержание
- 1. Изотопная геохимия. Изотопы
- 2. Изотопы (изос - одинаковый, топос - место)
- 3. Нуклиды, атомы с одинаковым числом нейтронов (n0),
- 4. Нуклиды, атомы с одинаковым массовым числом (М),
- 5. В природе известно около 350 изотонов и
- 6. Особенности изотопов Природные изотопы делятся на
- 7. У легких элементов с четным порядковым номером
- 8. Наибольшее число изотопов отмечено у четных элементов
- 9. Радиоактивность Радиоактивность – способность некоторых изотопов самопроизвольно
- 10. Ядра, обладающие свойством самопроизвольно распадаться, называются радиоактивными.
- 11. α-распад - вид радиоактивного распада ядра, в
- 12. β -распад — тип радиоактивного распада, обусловленного слабым
- 13. β+-распад происходит в ядрах с избытком протонов,
- 14. β--распад - ядерный нейтрон распадается на протон
- 15. «К-захват» характерен для ядер с избытком протонов,
- 16. При «К-захвате» образуется изобар, происходит сдвиг на
- 17. γ-излучение - не приводит к изменению ядра,
- 18. Это жесткое излучение, с очень короткими длинами
- 19. Спонтанное деление – деление или раскалывание на
- 21. Радиоактивный распад – явление статистическое. Скорость распада
- 22. За определенный период времени распадается какое-то количество
- 23. Закон радиоактивного распада: 1) N0 =
- 24. – константа распада является специфической для каждого
- 25. Т-период полураспада - это время, за которое
- 26. Период полураспада Т можно вычислить по той
- 27. Основной закон радиоактивного распада: Число распавшихся атомов
- 28. Абсолютная геохронология Зная скорость распада радиоактивного элемента
- 29. Для элементов конца периодической таблицы характерны сложные
- 30. Урановый ряд В результате перехода
- 31. Актино-урановый ряд в результате
- 32. Ториевый ряд В результате
- 33. Характерной особенностью радиоактивных превращений является их необратимость и смена тяжелых атомов более легкими.
- 34. Свинцово-свинцовый метод, или метод обыкновенного (породного) свинца
- 35. Возраст определяется по независимым отношениям 206Pb/204Pb, 207Pb/204Pb,
- 36. Допускается, что изотопный состав руд после отделения
- 37. Метод датирования по породному свинцу был применен
- 38. В основе Sm - Nd модельного метода
- 39. Sm и Nd являются редкоземельными элементами и
- 40. Калий-аргоновый метод. Калий - 3 изотопа (это
- 41. 40К распадается двумя путями: Первый вид «К-захват»:
- 42. Этот метод получил широкое распространение, использовались преимущественно
- 43. Устойчивыми к потере аргона являются амфиболы.
- 44. Рубидий-стронциевый метод Рубидий - 2 изотопа
- 45. В результате β- -распада 87Rb
- 46. При выборе минералов необходимо учитывать, что пути
- 47. Рубидий не дает своих минералов и, являясь
- 48. За время существования Земли прирост радиогенного стронция
- 49. Доля первоначального стронция, захваченного минералом в процессе
- 50. За первичное отношение, характеризующее первоначальный стронций земной
- 51. Рубидий-стронциевый метод применим для датировки возраста магматических
- 52. Отношение 87Sr/86Sr было использовано для решения вопроса
- 53. Радиоуглеродный метод Углерод - 3 изотопа: 126C
- 55. Период полураспада 14С – 5730 лет, что
- 56. В основе всех методов лежат следующие положения:
- 57. известны конечные продукты – стабильные радиогенные изотопы
- 58. известны все ныне существующие и существовавшие радиоактивные
- 59. Изотопный анализ геологических объектов
- 60. Изотопное отношение характеризуется величиной отклонения от стандарта
- 61. Надежность методов изотопной геохимии обусловлена достоверностью знаний
- 62. Фракционирование легких стабильных изотопов вызывается внешними процессами,
- 63. I. Физико-химические процессы Реакции изотопного обмена
- 64. II. Биогенные процессы Биогенные процессы: фотосинтез, жизнедеятельность организмов (в частности, бактерий) и др.
- 65. Стабильные изотопы в геологии Изотопы углерода
- 66. За стандарт принято отношение 13С/12С углерода карбоната
- 67. Избыточная δ13С по отношению к стандарту
- 68. Весовой кларк С в земной коре небольшой
- 69. Однонаправленные химические реакции и равновесные процессы приводят
- 70. Бикарбонатные анионы морской воды обогащены 13С и
- 71. Соотношение изотопов 12С и 13С в карбонатных циклах [Дегенс, 1967]
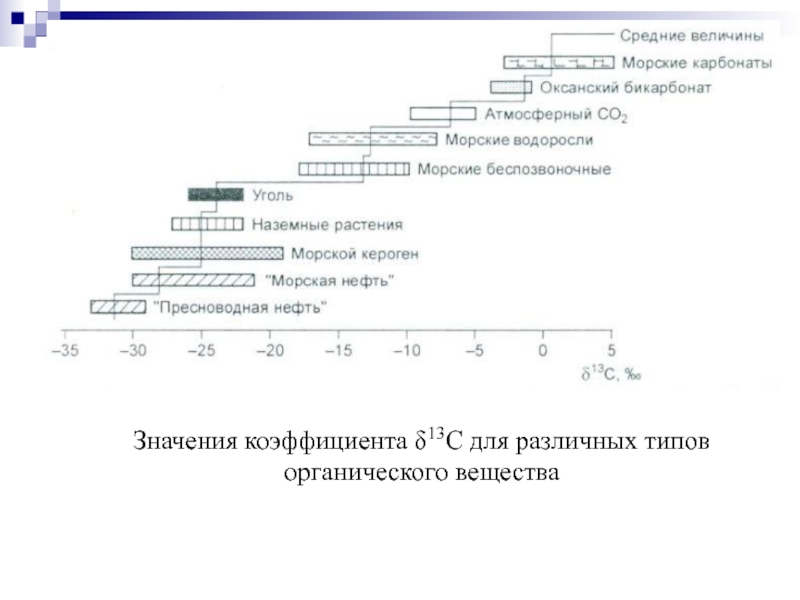
- 72. Значения коэффициента δ13С для различных типов органического вещества
- 73. Распределение изотопов С между земными объектами и метеоритами
- 74. Отмечено, что фракционирование (разделение) изотопов С интенсивнее
- 75. Изотопы серы Сера - это четный
- 76. Прирост тяжелого изотопа серы определяется по формуле
- 77. Эффективное фракционирование серы отмечается при окислительно–восстановительных процессах,
- 78. Сера в природе выступает в нескольких валентных
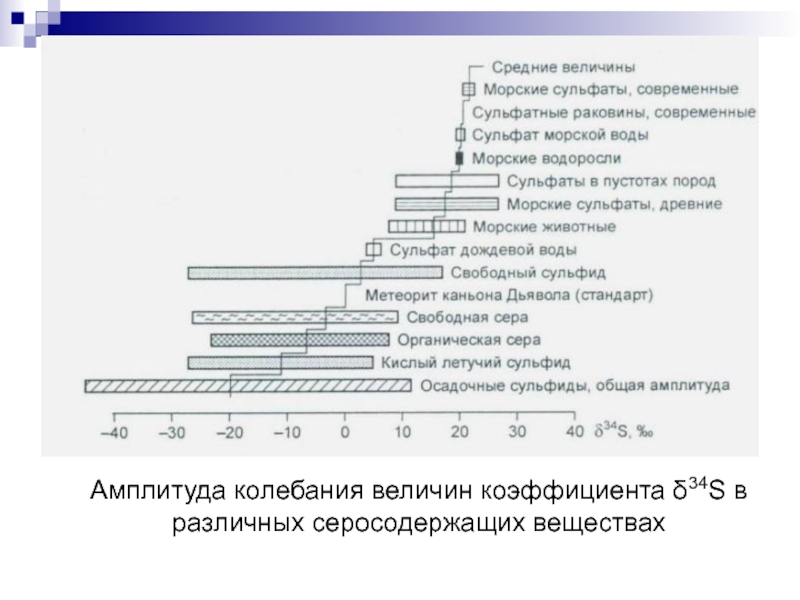
- 79. Амплитуда колебания величин коэффициента δ34S в различных серосодержащих веществах
- 80. Распределение изотопов S между различными объектами (сводная таблица)
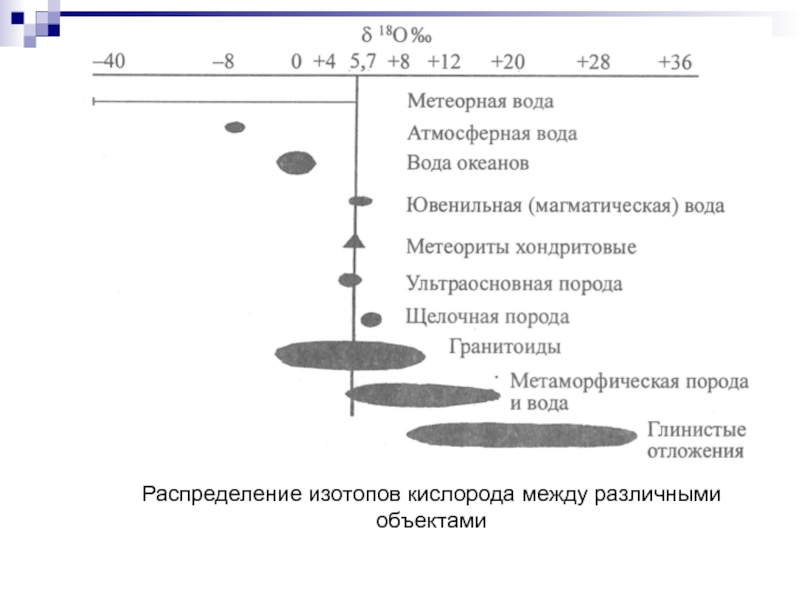
- 81. Изотопы кислорода Кислород - самый распространенный элемент
- 82. На практике пользуются отношением 18O/16O В
- 83. Разделение изотопов кислорода является следствием обменных реакций
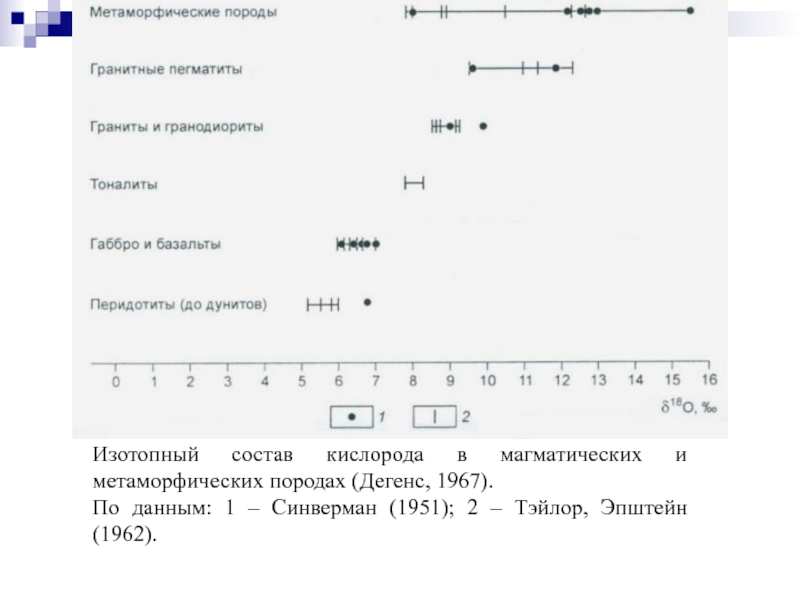
- 84. Изотопный состав кислорода в магматических и метаморфических
- 85. Изменение величины 18O/16O в карбонатах и кремнистых породах с геологическим возрастом [Дегенс, 1967]
- 86. Утяжеление кислорода атмосферы происходило за счет тяжелого
- 87. Распределение изотопов кислорода между различными объектами
Слайд 2Изотопы (изос - одинаковый, топос - место) - нуклиды (виды, разновидности
Изотопы - атомы элемента, имеющие в атомных ядрах одинаковое число протонов (Z), но разные числа нейтронов (N), а следовательно, и разные числа нуклонов (массовое число - М)
Пример: 168O – 188O; 23592U – 23892U.
Слайд 3Нуклиды, атомы с одинаковым числом нейтронов (n0), но разным массовым числом
Пример:
Слайд 4Нуклиды, атомы с одинаковым массовым числом (М), но разным числом протонов
Пример:
Слайд 5В природе известно около 350 изотонов и более 150 изобаров. Более
Способ обнаружения изотопов - непосредственное измерение масс атомов на масс-спектрографе.
Слайд 6Особенности изотопов
Природные изотопы делятся на 2 группы - стабильные и
Четные изотопы преобладают по распространенности над нечетными (12С, 32S, 238U и др.) как в Земле в целом, так и в метеоритах.
Слайд 7У легких элементов с четным порядковым номером или четным числом протонов
Слайд 8Наибольшее число изотопов отмечено у четных элементов середины таблицы (Хе -
Изотопы с массовым числом, кратным 4 - особенно стойкие (гелионы): 168O, 2412Mg, 2814Si, 126С, 4020Са и др. Это, в основном, элементы, cоставляющие основной объем массы верхней части литосферы.
Слайд 9Радиоактивность
Радиоактивность – способность некоторых изотопов самопроизвольно распадаться с испусканием элементарных частиц
Радиоактивность – способность атомных ядер к самопроизвольному превращению в другие ядра с испусканием одной или нескольких заряженных частиц и фотонов
Слайд 10Ядра, обладающие свойством самопроизвольно распадаться, называются радиоактивными. Ядра, не имеющие таких
Радиоактивный распад элементов (изотопов) происходит в результате испускания определенного вида энергии (Е).
Слайд 11α-распад - вид радиоактивного распада ядра, в результате которого происходит испускание
α-распад заключается в способности ядер превращаться в другие, более легкие ядра путем испускания α-частицы – ядра гелия (42He2).
При этом массовое число уменьшается на 4, а атомный номер – на 2.
Слайд 12β -распад — тип радиоактивного распада, обусловленного слабым взаимодействием и изменяющего заряд
Кроме β− и β+ -распадов, к бета-распадам относят также электронный захват, когда ядро захватывает атомный электрон.
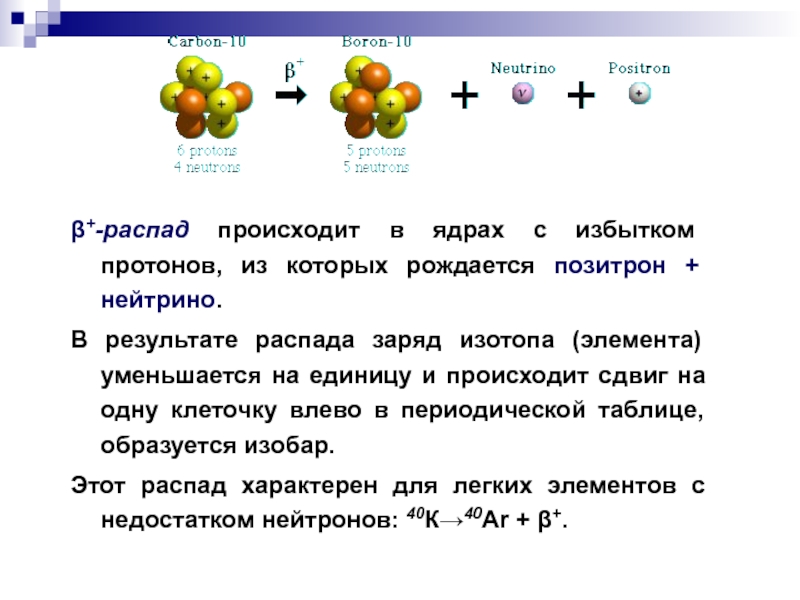
Слайд 13β+-распад происходит в ядрах с избытком протонов, из которых рождается позитрон
В результате распада заряд изотопа (элемента) уменьшается на единицу и происходит сдвиг на одну клеточку влево в периодической таблице, образуется изобар.
Этот распад характерен для легких элементов с недостатком нейтронов: 40К→40Ar + β+.
Слайд 14β--распад - ядерный нейтрон распадается на протон + нейтрино + электрон.
Характерен для ядер с избытком нейтронов.
При этом заряд элемента увеличивается на единицу и происходит сдвиг на одну клеточку вправо в периодической таблице. Образуется изобар: Rb → 8738Sr + e.
Слайд 15«К-захват» характерен для ядер с избытком протонов, которые превращаются в нейтроны
Если захват электрона осуществляется со второй от ядра орбиты, превращение называется L-захватом.
Слайд 16При «К-захвате» образуется изобар, происходит сдвиг на одну клеточку влево в
Пример: 4019К + ē → 4018Ar
Место захваченного электрона занимает другой электрон, на его место скатывается еще электрон, возникает поток электронов, что приводит к рождению рентгеновского мягкого излучения.
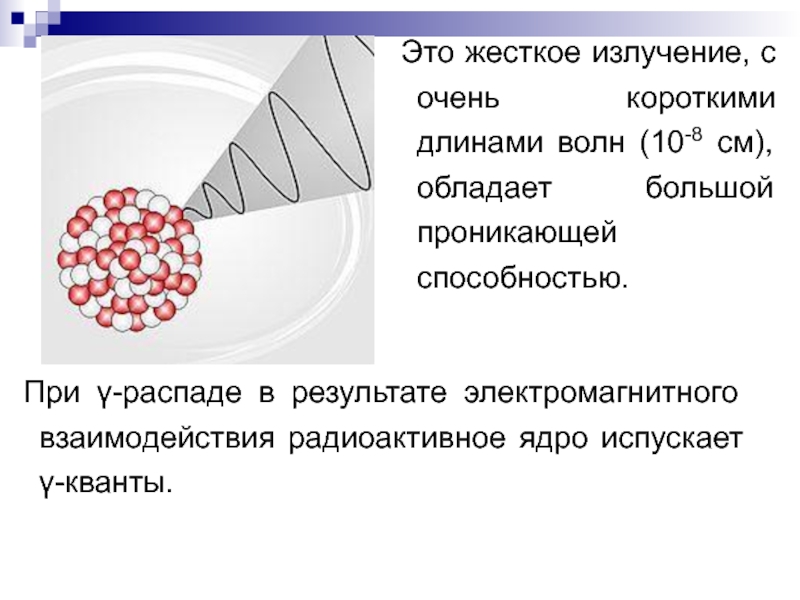
Слайд 17γ-излучение - не приводит к изменению ядра, обусловлено переходом возбужденного (радиоактивного)
Слайд 18Это жесткое излучение, с очень короткими длинами волн (10-8 см), обладает
При γ-распаде в результате электромагнитного взаимодействия радиоактивное ядро испускает γ-кванты.
Слайд 19Спонтанное деление – деление или раскалывание на два сравнимых по массе
Дочерние осколки по массам соответствуют элементам середины таблицы Менделеева. Ядро раскалывается на две части, близкие по массам, и при этом происходит испускание нейтронов β- и γ-излучения, обусловленное энергией воздействующих на ядро квантов.
Слайд 21Радиоактивный распад – явление статистическое. Скорость распада радиоактивных ядер не зависит
Величиной, характеризующей распад конкретного радионуклида, является константа распада λ – вероятность распада ядер в единицу времени.
Радиоактивный распад – явление необратимое.
Слайд 22За определенный период времени распадается какое-то количество радиоактивных ядер и образуются
Слайд 23Закон радиоактивного распада:
1) N0 = Nt*eλt или 2) Nt =
где N0 - первоначальное число атомов (ядер) радиоактивного элемента;
Nt - число атомов по истечении времени t;
е - основание натуральных логарифмов (е = 2,718281);
λ – постоянная радиоактивного распада, показывающая, какая часть атомов (ядер) определенного радиоактивного элемента распадается за единицу времени (год, сутки, часы, минуты, секунды) по отношению к общему первоначальному числу.
Слайд 24– константа распада является специфической для каждого радионуклида.
не зависит
Чем меньше константа распада, тем больше продолжительность жизни радионуклида.
Слайд 25Т-период полураспада - это время, за которое количество атомов радиоактивного элемента
Пример: 238U Т = 4,47*109 лет.
Слайд 26Период полураспада Т можно вычислить по той же формуле радиоактивного распада,
Т 238U – 4,47*109 лет, λ – 1,55125*10-10 лет;
Т235U - 7,04*108 лет, λ U235 - 9,8485*10-10 лет;
Т 232Th - 14,01*109 лет, λ 232Th - 4,9475*10-11 лет
Слайд 27Основной закон радиоактивного распада:
Число распавшихся атомов за единицу времени пропорционально первоначальному
Со временем количество радиоактивных изотопов убывает, но увеличивается число радиогенных конечных стабильных изотопов, появившихся в результате распада.
Слайд 28Абсолютная геохронология
Зная скорость распада радиоактивного элемента (изотопа), соотношение его изотопов (распространенности,
Слайд 29Для элементов конца периодической таблицы характерны сложные серии или ряды распада.
Детально изучены три ряда радиоактивного распада: урановый, актино-урановый и ториевый.
Слайд 30Урановый ряд
В результате перехода в стабильный радиогенный свинец произошла потеря
Слайд 31Актино-урановый ряд
в результате α- и β--распада 235U образовался стабильный радиогенный
Слайд 32Ториевый ряд
В результате α- и β--распада 232Th образовался стабильный радиогенный
Слайд 33Характерной особенностью радиоактивных превращений является их необратимость и смена тяжелых атомов
Слайд 34Свинцово-свинцовый метод, или метод обыкновенного (породного) свинца
Используются отношения радиогенных изотопов свинца
Количество же радиогенных изотопов все время растет, поэтому изотопный состав минералов, содержащих свинец, различен.
Слайд 35Возраст определяется по независимым отношениям 206Pb/204Pb, 207Pb/204Pb, 208Pb/204Pb в свинцовых минералах,
Чем древнее месторождение, тем меньше содержание изотопов 206Рb, 207Рb и 208Рb и соответственно меньше изотопные соотношения 206Pb/204Pb, 207Рb/204Рb и 208Pb/ 204Pb.
Слайд 36Допускается, что изотопный состав руд после отделения его от магмы в
Считается, что U и Th в руде содержатся в ничтожных количествах и не влияют в дальнейшем на изотопный состав свинца.
Такое датирование называется модельным, так как дает лишь приближенную оценку возраста свинцовых месторождений.
Слайд 37Метод датирования по породному свинцу был применен для определения возраста железных
Изохрона возраста Земли была названа геохроной.
На изохроне метеоритов находятся современные океанические осадки.
Pb – Pb модельный метод был применен при датировании источников базальтовых магм.
Слайд 38В основе Sm - Nd модельного метода лежит процесс превращения радиоактивного
147Sm имеет большой период полураспада: 1,06*1011 лет, поэтому накопление радиогенного 143Nd протекает весьма медленно и метод пригоден для исследования древних событий и датирования древних пород, подходит для датирования основных и ультраосновных пород.
Слайд 39Sm и Nd являются редкоземельными элементами и входят в состав основных
Известно, что биотит, апатит и другие минералы имеют тенденцию концентрировать более легкие редкоземельные элементы, а пироксен , амфибол, гранат – более тяжелые.
Слайд 40Калий-аргоновый метод.
Калий - 3 изотопа (это исключение для нечетного элемента), распространенность
Аргон - 3 изотопа (распространенность в %): 3618Ar – 0,307, 3818Ar – 0,061 – первичные изотопы
4018Ar – 99,63 – радиогенный, образующийся в результате сложного радиоактивного распада 40К.
Слайд 4140К распадается двумя путями:
Первый вид «К-захват»:
4019К → 4020Са в результате β-–распада
второй вид распада «К-захват»:
4019К →4018Ar, образуется изобар 40 Аr.
Отношение 40Аr/40К увеличивается с возрастом.
Слайд 42Этот метод получил широкое распространение, использовались преимущественно калиевые полевые шпаты и
Скоро было замечено, что результаты возраста занижены, что связано с потерей аргона минералами, особенно калиевыми полевыми шпатами.
На утечку аргона из полевого шпата и слюды влияет температура. Так, при метаморфизме пород происходит диффузия газов (так как они не связаны химически в минерале) и в этом случае расчеты дают возраст последнего метаморфизма.
Слайд 43Устойчивыми к потере аргона являются амфиболы.
При оценке возраста осадочных пород,
Слайд 44Рубидий-стронциевый метод
Рубидий - 2 изотопа (нечетный элемент), распространенность (в %):
8537Rb – 72,15 – стабильный изотоп;
8737Rb – 27,85 – радиоактивный.
Стронций - 4 изотопа, распространенность (в %):
8438Sr – 0,58,
8638Sr – 9,87,
8838Sr – 82,52
8738Sr – 7,03 – радиогенный продукт распада 87Rb.
количество не меняется
со временем
Слайд 45
В результате β- -распада 87Rb переходит в 87Sr образуется изобар:
Распад
Слайд 46При выборе минералов необходимо учитывать, что пути рубидия и стронция расходятся
Слайд 47Рубидий не дает своих минералов и, являясь полным геохимическим аналогом калия,
Слайд 48За время существования Земли прирост радиогенного стронция (87Sr) составил 7 %.
За
Слайд 49Доля первоначального стронция, захваченного минералом в процессе кристаллизации, оценивается измерением отношения
Зная отношения 87Sr/86Sr и 87Rb/86Sr в минерале, первоначальное отношение 87Sr/86Sr и одну из известных констант распада 87Rb, можно вычислить возраст t.
Слайд 50За первичное отношение, характеризующее первоначальный стронций земной коры, принято отношение 87Sr/86Sr
породы мантийного источника - 0,702 – 0,707;
для современного валового состава Земли - 0,7045;
породы коровых магм – выше 0,707;
изотопное отношение 87Sr/86Sr в известняках, где рубидий отсутствует – от 0,698 до 0,708.
Слайд 51Рубидий-стронциевый метод применим для датировки возраста магматических и метаморфических пород.
Для
Слайд 52Отношение 87Sr/86Sr было использовано для решения вопроса о происхождении карбонатитов.
Rb-Sr-метод
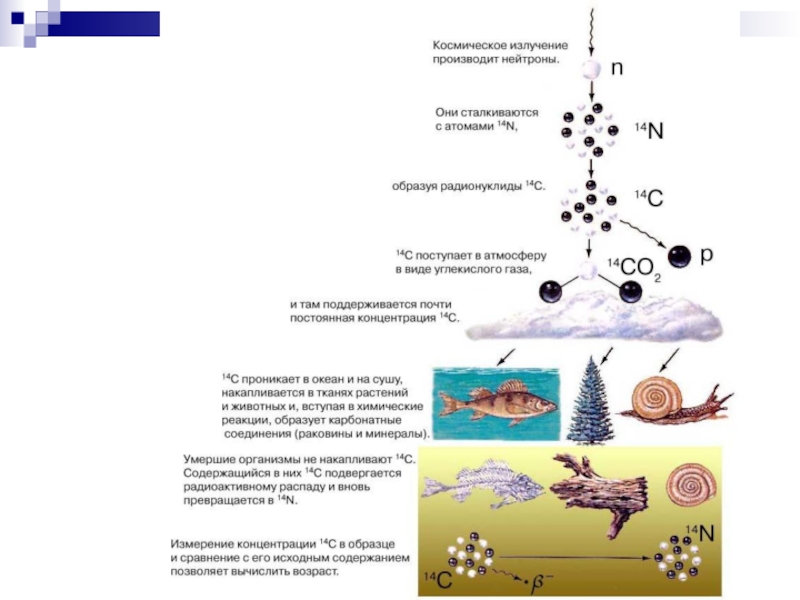
Слайд 53Радиоуглеродный метод
Углерод - 3 изотопа: 126C (98,892 %), 136C (1,11 %) –
14С постоянно возникает в верхних слоях атмосферы под действием космических лучей на стабильный изотоп 14N и снова переходит в 14N при β- -распаде.
Радиоактивный изотоп углерода попадает на Землю и смешивается с другими изотопами углерода в воде, горных породах, растениях, живых организмах и др.
Слайд 55Период полураспада 14С – 5730 лет, что позволяет использовать его только
Слайд 56В основе всех методов лежат следующие положения:
радиоактивный распад протекает с
известны постоянные радиоактивного распада (λ) и полураспада (Т);
точно известен изотопный состав рядов распада;
Слайд 57известны конечные продукты – стабильные радиогенные изотопы – как сложных изотопных
известны виды распада (α, β и др.);
известны изотопные соотношения и распространенность радиоактивных и радиогенных изотопов;
Слайд 58известны все ныне существующие и существовавшие радиоактивные элементы.
В основе всего должны
Слайд 60Изотопное отношение характеризуется величиной отклонения от стандарта (δ), измеряемой в промилле
No – изотопное отношение в образце,
Ns- изотопное отношение в стандарте.
Принято использовать отношение тяжелых изотопов к легким, которое обозначают символом типа δ34S.
Слайд 61Надежность методов изотопной геохимии обусловлена достоверностью знаний о фракционировании изотопов в
Причем важно знать не только тенденции, но и скорости процессов, от которых зависит полнота фракционирования и возможность изменения изотопного отношения в результате наложенных процессов.
Слайд 62Фракционирование легких стабильных изотопов вызывается внешними процессами, зависит от них и
Слайд 63I. Физико-химические процессы
Реакции изотопного обмена при подвижных равновесных процессах
Абсорбция и
Диффузия газов и жидкостей через пористые массы
Слайд 64II. Биогенные процессы
Биогенные процессы: фотосинтез, жизнедеятельность организмов (в частности, бактерий) и
Слайд 65Стабильные изотопы в геологии
Изотопы углерода
Углерод имеет 3 изотопа: 126C, 136C –
14С – радиоактивный.
12С - абсолютно преобладающий (четный, легкий изотоп) - 98,89 %, 13С – 1,11 % и 14С имеет незначительную распространенность.
Соотношение распространенностей 12С/13С в природных объектах варьирует от 88,0 до 94. Однако для сравнения значений изотопного состава пользуются соотношением 13С/12С, т.е. относительным приростом тяжелого изотопа.
Слайд 66За стандарт принято отношение 13С/12С углерода карбоната кальция (белемнит из меловых
Слайд 67
Избыточная δ13С по отношению к стандарту обозначается знаком «+», а дефицитная
(13С/12С)обр – отношение изотопов в образце
(13С/12С)станд - отношение тех же изотопов в стандарте.
Слайд 68Весовой кларк С в земной коре небольшой – 0,35, атомный –
окисленнная форма – СO2, карбонаты, бикарбонаты;
восстановленная – метан, органический углерод и самородная форма – графит, алмаз.
Слайд 69Однонаправленные химические реакции и равновесные процессы приводят к разделению изотопов.
Так,
Слайд 70Бикарбонатные анионы морской воды обогащены 13С и морские осадки, состоящие из
При микробиологическом фракционировании в продуктах жизнедеятельности организмов накапливается легкий изотоп углерода 12С (уголь, торф, нефть, метан).
Слайд 74Отмечено, что фракционирование (разделение) изотопов С интенсивнее протекает при низких температурах,
Слайд 75Изотопы серы
Сера - это четный элемент типа 4q, весовой кларк
Изотопы серы: 32S (95,018 %) абсолютно преобладающий
34S (4,215 %), 33S (0,750 %), 36S (0,017 %).
За стандарт принято отношение 32S/34S = 22,22 и 34S/32S = 0,0450045 в сере троилита из метеорита Каньон Дьявола (Аризона, США).
Слайд 76Прирост тяжелого изотопа серы определяется по формуле
δ34S со знаком «+»
Слайд 77Эффективное фракционирование серы отмечается при окислительно–восстановительных процессах, которые могут проходить как
Наиболее эффективно реакция проходит при температуре 30°С и при рН = 6,3 – 8,6 с участием бактерий.
Слайд 78Сера в природе выступает в нескольких валентных состояниях: S0 – нулевая
Количество изотопа 34S увеличивается в этом ряду вправо и максимальной концентрации достигает в сульфатной сере, где связь серы с кислородом более сильная: сера сильнее связана в окислительных продуктах, чем в восстановительных.
Слайд 81Изотопы кислорода
Кислород - самый распространенный элемент в земной коре.
У кислорода
В низкотемпературных измерениях используется стандарт PDB (белемнит меловых отложений Юж. Каролины). В остальных случаях – стандарт SMOW (средний состав морской воды).
Слайд 82
На практике пользуются отношением 18O/16O
В качестве мантийного стандарта (хондриты, ультраосновные породы)
Слайд 83Разделение изотопов кислорода является следствием обменных реакций изотопного равновесия.
Вариации состава
Подчиненное значение в разделении изотопов кислорода имеют биогенные факторы.
Слайд 84Изотопный состав кислорода в магматических и метаморфических породах (Дегенс, 1967).
По
Слайд 85Изменение величины 18O/16O в карбонатах и кремнистых породах с геологическим возрастом
Слайд 86Утяжеление кислорода атмосферы происходило за счет тяжелого кислорода воды, поступающей из
Изотопный состав кислорода природных вод находится в изотопном равновесии с атмосферной углекислотой (СО2), но не находится в равновесии с кислородом атмосферы.
Тяжелый кислород, поступающий из глубоких слоев Земли, освобождается в гидросфере и атмосфере и накапливается в углекислоте или кремнеземе – скелетах живых организмов, а затем – в осадочных породах.


























![Урановый ряд В результате перехода в стабильный радиогенный свинец произошла потеря 8 α-частиц ([238-206]/4=8), что](/img/tmb/3/295237/dba6dd87f468c760d5a43a0d412dc9a4-800x.jpg)







































![Соотношение изотопов 12С и 13С в карбонатных циклах [Дегенс, 1967]](/img/tmb/3/295237/371974b03f913b164c5a17e214abe50d-800x.jpg)










![Изменение величины 18O/16O в карбонатах и кремнистых породах с геологическим возрастом [Дегенс, 1967]](/img/tmb/3/295237/e0694fbf8ec0e28783fd9919ed73a1ec-800x.jpg)